水素化ジイソブチルアルミニウム
表示
(DIBAL-Hから転送)
| 水素化ジイソブチルアルミニウム | |
|---|---|
| |

| |
Diisobutylaluminium hydride | |
別称 DIBAH; DIBAL; DiBAlH; DIBAL-H; DIBALH | |
| 識別情報 | |
| CAS登録番号 | 1191-15-7 |
| PubChem | 16682954 (モノマー)131737379 (ダイマー) |
| ChemSpider | 10430352 |
| UNII | H2EJ47H11A |
| EC番号 | 214-729-9 |
| |
| |
| 特性 | |
| 化学式 | C8H19Al (モノマー) C16H38Al2 (ダイマー) |
| モル質量 | 142.22 g/mol (モノマー) 284.44 g/mol (ダイマー) |
| 外観 | 無色の液体 |
| 密度 | 0.798 g/cm3 |
| 融点 |
-80 ℃ |
| 沸点 |
116 ~ 118 ℃ (at 1 mmHg) |
| 水への溶解度 | 水と反応する |
| 溶解度 | 炭化水素、テトラヒドロフラン、エーテルに溶ける。 |
| 危険性 | |
| GHSピクトグラム |  
|
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H220, H225, H250, H260, H314 |
| Pフレーズ | P210, P222, P223, P231+232, P233, P240, P241, P242, P243, P260, P264, P280, P301+330+331, P302+334 |
| 主な危険性 | 空気中で発火 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
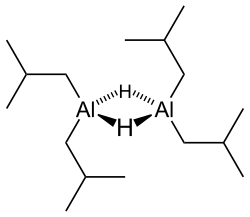
水素化ジイソブチルアルミニウム(すいそかジイソブチルアルミニウム、diisobutylaluminium hydride)は有機合成において汎用される還元剤である。DIBAL, DIBAH, DIBAL-H などと略される。化学式は [(CH3)2CHCH2]2AlH、もしくはイソブチル基を iBu と略記し iBu2AlH と表される。もともとはアルケンを重合させる際の共触媒として開発された化合物である[1]。
特徴
[編集]ケトンやエステルなどのカルボニル化合物の還元に用いられる代表的な還元剤の一つである。同じく還元剤である水素化アルミニウムリチウムと同程度の還元力を持つが、DIBALはルイス酸性を持ち、有機溶媒への溶解性も高いため反応性が異なる。無色液体だが、ほとんどの場合 THF、トルエン、ヘキサン、ジクロロメタンなどの溶液として市販されている。湿気に弱いため、不活性ガス雰囲気下で保存・使用する。
他の多くの有機アルミニウム化合物と同様、二量体として存在する。2個のアルミニウム原子が水素原子で架橋された構造を持つ。
DIBALはトリイソブチルアルミニウム(二量体)を加熱し、ベータ水素脱離を起こすことによって合成できる[2]。
反応性
[編集]- アルデヒド・ケトン - 還元されてアルコールを与える。α,β-不飽和ケトンは選択的に 1,2-還元を受け、アリルアルコール誘導体を与える。
- エステル - 2当量用いればアルコールまで還元できる。低温で1当量だけ用いるとアルデヒドで止めることも可能だが、実際には過剰還元が起こりやすく、残存エステルとアルデヒドの分離も困難なケースが多い。このため、いったんアルコールまで還元した上でアルデヒドに酸化するか、ワインレブアミドを経由するのも有用な方法である。
- ラクトン - ラクトールを与える。エステルの場合と異なり、ほぼ完全にラクトールで止めることができる。
- アセタール - 一方のアルコキシ基が切断され、エーテルを与える。1,2-または1,3-ジオールをアセタールとし、DIBALで処理すると立体障害の小さい方から還元が進行し、立体障害の大きい方にアルキル基が残る。これによりジオールを区別して保護することが可能になる。
- ニトリル - 過剰量のDIBALを作用させるとアミンにまで還元されるが、1当量だけ用いるとアルドイミンの段階で止めることができる。これを酸処理すればアルデヒドが選択的に得られる。
関連項目
[編集]脚注
[編集]- ^ Ziegler, K., Martin, H.; Krupp, F. (1960). "Metallorganische Verbindungen, XXVII Aluminiumtrialkyle und Dialkyl-Aluminiumhydride Aus Aluminiumisobutyl-Verbindungen". Liebigs Ann. 629 (1): 14-19. doi:10.1002/jlac.19606290103.
- ^ Eisch, J. J. Organometallic Syntheses; Academic Press: New York, 1981; Vol. 2. ISBN 0-12-234950-4.



