DAPI
| DAPI | |
|---|---|

| |

| |
2-(4-amidinophenyl)-1H -indole-6-carboxamidine | |
| 識別情報 | |
| CAS登録番号 | 28718-90-3 |
| PubChem | 2954 |
| ChemSpider | 2848 |
| ChEMBL | CHEMBL48217 |
| |
| |
| 特性 | |
| 化学式 | C16H15N5 |
| モル質量 | 277.324 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
DAPI(ダピ、ダーピー、4',6-diamidino-2-phenylindole)は染色に用いられる蛍光色素の一種で、DNAに対して強力に結合する物質である。蛍光顕微鏡観察に広く利用されている。
概要
[編集]DAPIは1977年、当初はトリパノソーマに対する薬剤として合成された。その後、蛍光顕微鏡との組み合わせにより血中のマラリア原虫の検出などに利用されたが、今日では細胞生物学の分野に欠かせない試薬となっている。DAPIは浸透速度は遅いものの細胞膜透過性の色素であり、生きた細胞・固定された細胞の両方に対して使うことができる。生細胞染色が可能なDAPIは観察試料の調製が容易なため、広く普及している蛍光色素である。
色素特性
[編集]
DAPIはDNA二重螺旋の小さい溝、特にAT(アデニン・チミン)に富んだ領域に優先的に結合する。蛍光顕微鏡観察において、DAPIは紫外光(UV)によって励起することができる。二本鎖DNAに結合したDAPIは、励起光の波長 358nm に吸収極大を持ち、放出される蛍光は 461nm が極大である。DAPIの蛍光の波長域は広く[1]、色としては青~水色に見える。なおDAPIはRNAにも結合するが、その場合の蛍光波長は 500nm 前後であり、蛍光強度は小さい[2]。従って、RNA結合由来の蛍光は適切なダイクロイックミラーで除外することができる。また高濃度のDAPIは細胞内のポリリン酸を染色することができ、この場合の蛍光は526nmで黄色に見える[3]。 また、微小管に結合して蛍光強度が増大することから、濁度測定より高感度なチューブリンの重合試験の蛍光指示薬として用いられることがある[4]。
利用
[編集]DAPIが放出する青い蛍光は、観察試料を多重染色する際に便利である。青色の蛍光は、(若干のクロストークはあるものの)GFPが放つ緑色蛍光やテキサスレッドの赤色蛍光、その他のフルオレセイン誘導体やAlexaと波長域が離れており、スペクトル分離や画像撮影後のイメージング処理によって容易に選別が可能である。DNAを含む細胞核の染色以外に、DAPIは培養細胞中のマイコプラズマやウイルスのDNAを染めてこれらを検出する用途に良く用いられる。
DAPIの励起に必要なUVの照射はラジカルの生成を促すため、他の色素を退色させてしまう。これは退色防止剤を併用することである程度抑止でき、顕微鏡下での観察時間を引き延ばすことが可能である。しかし、退色防止剤によっては生きた細胞に悪影響を及ぼす点、さらにUV照射自体が細胞にダメージを与える点などは注意を要する。
DAPIの他にも、ヘキスト染色(Hoechst stain)によってDNAを青色蛍光で可視化することができ、これも生細胞染色・死細胞染色ともに可能となっている。AT選択性もDAPIと同じである。
染色例
[編集]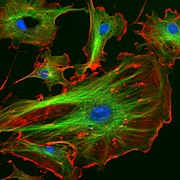
|

|

|
- 左:内皮細胞の蛍光顕微鏡像。青色がDAPI染色した細胞核、緑色が微小管、赤色がファロイジン染色したアクチン繊維。
- 中:ラット膵臓のランゲルハンス島。青色がDAPI染色した細胞核、緑色がβ細胞(抗インスリン抗体染色)、赤色がα細胞(抗グルカゴン抗体染色)。
- 右:ヒトリンパ球の核をDAPIで染めたもの。赤色は13番染色体、緑色は21番染色体(FISH法による)。
毒性
[編集]DAPIは生細胞、固定後細胞の両方を核染色できるが、生細胞の核染色に必要な濃度は、固定後細胞のそれと比較して著しく高い[5]。メーカー作成のMSDSには非毒性と記載されており[6]、大腸菌を用いた実験ではDAPIに変異原性があるとは認められなかった[7]。変異原であるとの記載もあるが、エビデンスは不明である[2]。DAPIは遺伝子の本体であるDNAと結合するため、ある程度低いレベルで変異原として作用するかもしれない。DAPIを扱う作業は慎重に行うとともに、使い捨て手袋の使用が推奨される。
取り扱い及び保存
[編集]科学的、身体的、毒物学的な詳しい特性については、不明な部分が多い。肌、目、呼吸器系との接触を避けること。密閉式の容器などに入れ、冷蔵保存すること。[8]
参考文献
[編集]- ^ Laser Photomedicine and Biomedical Optics at the Oregon Medical Laser Center
- ^ a b Invitrogen, DAPI Nucleic Acid Stain. reviewed 2006-4-24.
- ^ Tijssen, T.P.F. et al. (1982). “Localization of polyphosphates in Saccharomyces fragilis, as revealed by 4',6-diamidino-2-phenylindole fluorescence”. Biochimica et Biophysica Acta 721 (4): 394-398. doi:10.1016/0167-4889(82)90094-5.
- ^ Bonne D et al. (1985). “4',6-Diamidino-2-phenylindole, a fluorescent probe for tubulin and microtubules”. J Biol Chem 260 (5): 2819-25. PMID 3972806.
- ^ Zink D, Sadoni N, Stelzer E. (2003). “Visualizing Chromatin and Chromosomes in Living Cells.”. Methods 29 (1): 42–50. doi:10.1016/S1046-2023(02)00289-X. PMID 12543070.
- ^ [1]
- ^ Ohta T, Tokishita S, Yamagata H. (2001). “Ethidium bromide and SYBR Green I enhance the genotoxicity of UV-irradiation and chemical mutagens in E. coli.”. Mutat Res. 492 (1-2): 91–7. doi:10.1016/S1383-5718(01)00155-3. PMID 11377248.
- ^ TECHNICAL DATA SHEET 315 at Polysciences,Inc.(pdf)
- Chandra P, Mildner B, Dann O, Metz A. (1977). “Influence of 4'-6'-diamidino-2-phenylindole on the secondary structure and template activities of DNA and polydeoxynucleotides”. Mol Cell Biochem 18 (2-3): 81-6.
- Hyman BC, MacInnis AJ (1979). “Rapid Detection of Malaria and Other Bloodstream Parasites by Fluorescence Microscopy with 4'6 Diamidino-2-Phenylindole (DAPI)”. The Journal of Parasitology 65 (3): 421-5.
- Tanious FA et al. (1992). “DAPI (4',6-diamidino-2-phenylindole) binds differently to DNA and RNA: minor-groove binding at AT sites and intercalation at AU sites”. Biochemistry 31 (12): 3103-12. PMID 1372825
関連項目
[編集]外部リンク
[編集]- Polysciences,Inc.(ペンシルベニア州ワーリントン市)
