シャルコー・マリー・トゥース病
シャルコー・マリー・トゥース病(Charcot-Marie-Tooth disease: CMT)は、下腿と足の筋萎縮と感覚障害を特徴とし、進行すると上肢や手にも障害を生じる神経原性筋萎縮である[1]。遺伝性運動性感覚性ニューロパチー(Hereditary Motor and Sensory Neuropathy: HMSN)、腓骨筋萎縮症(peroneal muscular atrophy)とも呼ばれる。遺伝性ニューロパチーの代表疾患である[1][2]。
概念
[編集]シャルコー・マリー・トゥース病では、遺伝子異常により神経が正常に機能するために必要な物質が発現しなくなる。そのため、神経の軸索もしくは髄鞘(ミエリン鞘)に異常が生じ、症状が現れると考えられている。
主に、初期に脱髄型のニューロパチーを示す群(CMT1, CMT3, and CMT4: HMSN type1)と、初期に軸索障害型のニューロパチーを示す群 (CMT2: HMSN type2)とに大別されることが多い。しかし最近の研究によると、髄鞘形成に重要な役割を果たすシュワン細胞と神経細胞との間には密接な相互作用があり、しばしば脱髄・軸索障害の両者とが混在した病理所見を示すものがあることが判明している。
神経の分子構造は、神経細胞・シュワン細胞・線維芽細胞の相互作用により決定されており、特に神経細胞とシュワン細胞は相互にシグナルをやり取りし、神経細胞の生存と分化とに関与している。シャルコー・マリー・トゥース病では、この神経細胞とシュワン細胞間の相互作用が阻害されていることが知られている。
神経細胞と脱髄をおこしたシュワン細胞とが相互作用することにより、軸索の構造や機能にまで異常が生じることはわかっている。しかし、その結果なぜシャルコー・マリー・トゥース病が生じるのかは、未だに不明である。軸索の変性によって、または脱髄に伴う軸索の機能障害のために、筋力低下や感覚障害が生じている可能性はある。
脱髄型ニューロパチーを示す患者では、神経伝導速度(nerve conduction velocity: NCV)の低下が特徴的である[1][2]。対して、軸索障害型ニューロパチーを示す患者では、複合筋活動電位(compound muscle action potential: CMAP)の低下が見られ、神経伝導速度は正常もしくはやや低下する程度である。
シャルコー・マリー・トゥース病は1867年、シャルコー(Jean-Martin Charcot(1825-1893))とその弟子であるマリー(Pierre Marie(1853-1940))およびトゥース(Howard Henry Tooth(1856-1925))によって報告された。
疫学
[編集]シャルコー・マリー・トゥース病(CMT)はすべての人種に認められ、その有病率は欧米では2500人に1人と言われてきた。最近の疫学調査では人口10万人対9.7~82.4人とその頻度は高い[3]。日本の調査では人口10万人対10.8人との報告があるが、実際には有病率はより高いものと推定される[4]。CMTの多くは0~20歳ころまでに発症するが50歳代の発症も比較的多い。車椅子使用患者は約20%で寝たきり患者は1%であった。
分類
[編集]シャルコー・マリー・トゥース病(CMT)は遺伝性ニューロパチーの中で代表的な疾患である。遺伝性運動感覚性ニューロパチー(hereditary motor and sensory neuropathy、HMSN)と呼ばれることもある。遺伝子異常にもとづいた分類がされるようになりHMSNよりもCMTの呼称をもちいることが多くなった。筋炎疾患としては運動神経だけが障害される遺伝性運動性ニューロパチー(hereditary motor neuropathy、HMN)、感覚神経だけ障害される遺伝性感覚性ニューロパチー(hereditary sensory neuropathy、HSN)、また感覚神経に加えて自律神経も障害される遺伝性感覚性自律神経性ニューロパチー(hereditary sensory and autonomic neuropathy、HSAN)もある。
CMTは髄鞘の障害か軸索の障害かの区別、遺伝形式(常染色体優性、常染色体劣性、X染色体性)、遺伝子座および原因遺伝子によって分類される。CMT1Aのように数字の後にアルファベットを並べて分類する。大きな分類では髄鞘の障害が主体で常染色体優性遺伝形式のものをCMT1、髄鞘障害で劣性遺伝形式のものをCMT4、軸索障害で優性遺伝のものをCMT2、劣性遺伝のものをAR-CMT2と呼ぶ。CMT3はデジュリーヌ・ソッタス病のことだが現在はほとんど使われていない。X染色体性遺伝形式のものはCMTXと呼ばれている。遺伝子座や遺伝子異常の違いをアルファベットで表現する。たとえば劣性遺伝性髄鞘障害型で最初に遺伝子座が同定されたものはCMT4Aとなる。
末梢神経障害が脱髄か軸索障害かを決めるのは容易ではない。CMTでは便宜的に上肢の正中神経の運動速度伝導速度(MCV)が38m/sを境に決定される。すなわちCMTの分類に神経伝導速度検査は不可欠である。家系の中でもMCVが38m/sの上下にまたがる場合もあり中間型CMTと呼ばれることもある。
CMTは少なくとも34の原因遺伝子に加え、8以上の遺伝子座が報告されている。原因遺伝子を病態別に分類すると以下の9つに分類できる。
- ミエリン構成蛋白
- ミエリン関連蛋白転写因子
- ミエリン関連蛋白の輸送・代謝・処理
- 末梢神経細胞分化・維持
- ニューロフィラメント・タンパク輸送関連
- ミトコンドリア関連
- DNA修復・転写・核酸合成
- イオンチャネル
- アミノアシルtRNA合成酵素
1~4はミエリン形成に関わる遺伝子であり脱髄型CMTの原因になる。5~9は神経細胞の形成・維持・活動に関連する遺伝子で主に軸索型CMTの原因となる。脱髄型CMTの原因の多くは髄鞘の主な構成蛋白やシュワン細胞で重要なものである。髄鞘の構成蛋白の20%を占めるPMP22の質的な異常も末梢神経障害を引き起こす。またMPZは髄鞘の50%を閉め髄鞘の接着に関与している。GJB1(Gap junction protein beta-1、Cx32)は髄鞘と軸索間の結合をもち栄養物質の交換に関与している。髄鞘形成時に必要な転写因子であるEGR2、SOX10は髄鞘形成に必要な蛋白の転写を誘導する働きがある。この他シュワン細胞ではたらく様々な遺伝子の異常が脱髄型CMTを引き起こす。軸索型CMT、CMT2の原因としては体のエネルギーを生み出すミトコンドリアに関連したもの、軸索の構造を支える神経線維や軸索内の物質輸送に関わるもの、DNAおよびRNA関連及び核膜蛋白など神経細胞をささえる蛋白合成と関わるもの、末梢神経の発生分化に関連するものなどがある。ミトコンドリア関連のMFN2が頻度が高く有名である。もうひとつCMTの特徴として遺伝的多様性というものがある。これは異なる遺伝子の異常によっても同じ症状が出現するということである。
遺伝性ニューロパチーの頻度に関して述べる。最も頻度の高いCMTはCMT1Aと呼ばれる型である。常染色体優性遺伝で欧米のCMT全体の50%、脱髄型の約70%を占める。脱髄型で2番目に多いのはGJB1/Cx32の変異でありX染色体遺伝形式のためCMTXと呼ばれる。その次に多いのがミエリン構成蛋白であるMPZによるものである。CMT2ではMFN2やGJB1によるものが多い。Murphyらの報告[5]によるとCMT患者1607人の遺伝子検査を行い、712例(44.3%)で原因を同定し、PMP22、GJB1、MPZ、MFN2の4つの遺伝子異常が90%異常を占めていた。
CMT Type 1 (CMT1)
[編集]シャルコー・マリー・トゥース病の中で最も頻度が高いタイプである。常染色体優性遺伝。脱髄を伴い、神経伝導速度の顕著な低下が見られる。以下のサブタイプは皆同様な臨床症状を示す。
- CMT type 1A - CMT1A (OMIM 118220)- CMT Type1のサブタイプの中では最も頻度が高い。PMP22遺伝子(17p11.2)の重複によって生じる。神経伝導速度は平均15-20m/s。
- CMT type 1B - CMT1B (OMIM 118200) - プロテイン・ゼロ(protein zero(P0))をコードしているMPZ遺伝子(1q22)の変異により生じる。神経伝導速度は20m/s以下。
- CMT type 1C - CMT1CはLITAF Gene(16p13.1-p12.3)が原因遺伝子である。神経伝導速度は平均15-20m/s。
- CMT type 1D -CMT1DはEGR2 Gene(10q21.1-q22.1)が原因遺伝子である。神経伝導速度は平均15-20m/s。
- CMT type 1E -CMT1EはPMP22遺伝子(17p11.2)の点突然変異によって生じる。
- PMP22/CMT1A(PMP22 duplication)
PMP22は主要なミエリン構成蛋白質のひとつでミエリン蛋白全体の20%を占めるものである。PMP22を含む1.4MBのゲノム重複により通常2コピーのPMP22遺伝子が3コピーになるためにFISH法で遺伝子診断ができる。PMP22をはさんで類似した配列をもつ領域が17番染色体にありこれが染色体の組み換えのときに誤った部位で組み換えが起こり欠失や重複が生じると考えられている。CMTの多くはこの異常で生じている。アスコルビン酸(ビタミンC)の大量投与でPMP22の発現を抑制できCMT1Aモデルマウスで有効という報告があったが臨床試験では効果は認められなかった。ニュートロピン3(NT-3)治験のパイロット試験で臨床効果が得られたという報告もある。予後不良な疾患ではないため遺伝子治療などは試みられていない。PMP22の過剰発現はPI3K-AKT-mTORのシグナル伝達を負に制御し、その結果Ras-Raf-MEK-ERK伝達系のへの抑制が低下する。この2つのシグナル伝達系のバランス異常がシュワン細胞分化障害を誘導する。ニューレグリン-1治療はPI3K-AKT-mTORとRas-Raf-MEK-ERK伝達系のバランス障害を是正する[6]。C22[7][8]などいくつかのモデルマウスが知られている。
- P0蛋白(Myelin Protein Zere、MPZ)遺伝子異常/CMT1B
P0蛋白は分子量28000の糖蛋白であり末梢ミエリンを構成する蛋白の約50%を占める。重層するミエリン膜を互いに固定するボトルのような役割を果たす。脱髄型であるCMT1Bの原因でもあり軸索型CMT2I/Jの原因でもある。脱髄型では早期発症であることが多い。軸索型は発症年齢が高く成人後に発症する。早発型と遅発型で遺伝子変異も異なる。
- CMT1E
CMT1EはPMP22遺伝子の点突然変異で引き起こされるCMT1の稀なタイプである。CMT1全体の1~5%を占めると考えられている。かつてはPMP22の点突然変異によっておこる脱髄性ニューロパチーはCMT1Aと分類されていたが、PMP22の重複と点突然変異で病態が異なることが明らかになり区別されるようになった。PMP22のミスセンス変異でおこり、常染色体優性遺伝の遺伝形式をとることが多い。臨床症状は遺伝性圧脆弱性ニューロパチーのような反復性の運動麻痺など非典型例もあるが多くはCMT1Aより重篤な進行性の筋力低下を示す。デジュリーヌ・ソッタス病のような臨床症状をしめすことがある。TremblerマウスやTrembler-Jマウス[9]がPMP22の変異をもつ[10]本疾患のモデルマウスであり、同様の変異の例も報告されている[11][12][13]。
CMT Type 2 (CMT2)
[編集]常染色体優性遺伝。軸索変性を主体とし、神経伝導速度は正常よりはやや低下するが38m/sを下回らない。
- CMT type 2A - CMT2A (OMIM 118210) -
KIF 1B(廣川信隆らのグループによって発見された)が原因遺伝子である。またミトフシン2(Mitofusin-2)蛋白をコードするMFN2(1p36.2)も原因遺伝子とされる。軸索障害が主体のため、神経伝導速度は低下しない。
- CMT type 2B - CMT2B (OMIM 600882) -
RAB7遺伝子(3q21)を原因遺伝子とする。皮膚に潰瘍をきたす。
- CMT type 2C - CMT2C - (12q23-q24) -構音障害や呼吸筋麻痺をきたす。
- CMT type 2D - CMT2D (OMIM 601472) - GARS遺伝子(7p15)を原因遺伝子とする。下肢よりも上肢に障害が強い(非典型的)。
- CMT type 2E - CMT2E - NEFL遺伝子(8p21)を原因遺伝子とする。
- CMT type 2F - CMT2F (OMIM 606595) - HSPB1遺伝子(7q11-q21)を原因遺伝子とする。
- CMT type 2G - CMT2G - (12q12-13)
- CMT type 2H - CMT2H (OMIM 607731)
- CMT type 2J - CMT2J (OMIM 607736) - (1q22) 聴覚異常を伴う。
- CMT type 2K - CMT2K (OMIM 607831) - (8q13-q21.1)
- CMT type 2L - CMT2L (OMIM 608673) - (12q24)
- CMT2A2型
ミトフシン2遺伝子異常でCMT2A2型はおこる。ミトフシン2はミトコンドリア膜に存在する蛋白質でミトコンドリアと小胞体の結合を司る。ミトフシン2の異常でミトコンドリアの小胞体が結合できなくなるとカルシウムの供給が受けられずミトコンドリアの機能低下がおこる。その結果軸索障害型のニューロパチーとなる。
CMT Type 3 (CMT3)
[編集]デジュリーヌ・ソッタス病(Dejerine-Sottas disease)とも呼ばれる。多くが乳児期に発症する。
- CMT type 3 - CMT3 - 常染色体劣性遺伝。重い筋力低下をきたす。神経伝導速度は10m/s以下と著明に低下。病理学的にはオニオンバルブ(onion bulb)形成が顕著。
CMT Type 4 (CMT4)
[編集]劣性遺伝のCMTである。乳児期に発症する重症型が多いのが特徴である。ペリアキシン遺伝子の異常によるものニューロフィラメントL遺伝子の異常のもの、ダイナミン2遺伝子の異常によるものtRNA合成酵素の異常によるものシュワン細胞の発達に関係する遺伝子(SOX10やEGR2)などが知られている。
X-Linked (CMTX)
[編集]X染色体に原因のあるCMTXは5種類知られている。そのうち最も多いのがCMTX1でありコネキシン32という蛋白質をコードするGJB1という遺伝子の異常でおこる。CMTX1では軸索性と脱髄性のいずれの障害もあるが女性では軸索性を示す場合が多いと言われている。コネキシンはシュワン細胞に発現しているがなぜシュワン細胞の障害で軸索性の障害を起こすのかは不明である。
症状
[編集]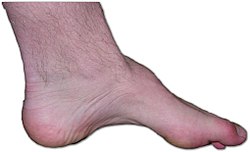
生活歴を聴取すると「子供の頃から走ることやスポーツをすることは苦手だった」、「もともと足が他の人と比べて小さかった」というエピソードが聴取できる場合が多い。まれに出生時や小児期に運動発達の遅れなどで気づかれることもある。こういった例は先天性髄鞘形成不全(cogenital hypomyelinating neuropathy、CHM)といわれやや症状が強い。
シャルコー・マリー・トゥース病は多くの場合、下肢から始まる遠位優位の筋萎縮、筋力低下を初発症状とし[1][2]、左右対称性、長さ依存性(長い神経ほど症状出現が早く、かつ症状が強い)の遺伝性のポリニューロパチーである。その他の特徴として上肢では手内在筋が障害されやすいこと、骨格系の変化、易疲労性などがあげられる。基本的には何年もかけて緩徐に進行するためいつ症状が出現したのかははっきりしないことも多い。
10歳から30歳までに歩きにくさやつまずきやすさ、足の変形などで気づかれ医療機関を受診する場合が多い。歩きにくさは「つまずいてよく転倒する」、「階段が登りにくい」、「スリッパが脱げやすい」[1]など両下肢遠位筋の筋力低下に起因するものである。特に足関節の背屈、挙上を行う前脛骨筋(深腓骨神経支配)の筋力低下や足関節の背屈や外反を行う腓骨筋の筋力低下によってこれらの症状が起こると考えられている。これらの症状は両足にみられ、ほぼ左右対称性である。これ以前に足内在筋の筋萎縮と筋力低下は起こっている。足に始まった症状は徐々に手指に広がる。手指に関する訴えでは「ボタンの留め外しが難しい」、「箸や鉛筆が使いづらい」という訴えから始まることが多い。これは上肢の最遠位である母指球筋や骨間筋など手内在筋の筋萎縮と筋力低下によるものである。回内筋や回外筋の筋力低下により「ベットボトルの蓋を開けにくい」、「ドアノブを回しにくい」といった症状も出現する。上肢筋力低下も基本的に左右差はない。経過が長くなると骨格系の変形を伴うことがある。足の前後長は短縮するが足の甲が高くなる凹足という変形が有名である。内反尖足になることもある。凹足(pes cavus)に足の底屈と内反が伴うと槌状足趾変形(hammer toes)となる[1][2]。
易疲労性のため長時間運動をすると筋痙攣が起こることもある。また筋肉量の減少で手足が冷えやすいと訴える。本態性振戦に類似する振戦を伴うこともある。振戦は30代半ばまでに気がつくことが多く、40%ほどの患者で認められる。まれではあるが網膜や聴神経の障害を合併したり、病気の進行とともに側弯症など脊柱の変形を生じたりする場合もある。
検査
[編集]身体所見
[編集]頻度の多いCMT1Aを念頭に示す。
- 運動系
筋萎縮や筋力低下は遠位筋ほど早期から症状が障害されやすく、症状が強い。したがって筋力低下は足の内在筋からはじまり下腿筋、大腿筋という経過で進行する。筋萎縮は貸遠位部にいくほど強調されるため「逆シャンパンボトル」[1][2]といわれるような特徴的な筋萎縮パターンを取る。上肢も手内在筋の萎縮が目立つ。母指球筋の筋力低下から母指は外反し猿手を呈し、骨間筋萎縮により指と指の間に溝ができる猿手を示す。
- 腱反射
病初期には低下しながらも保たれている場合もある。しかしアキレス腱反射消失し次いで、膝蓋腱反射と最終的には上肢の腱反射も消失する。
- 感覚系
本人は感覚障害の訴えをしないことが多いが、手袋靴下型の感覚障害が認められる。
- 歩行
初期は前頚骨筋の筋力低下のため踵立ちが維持できない。進行すると鶏歩となる[1][2]。
- 末梢神経の肥厚
健常人では末梢神経を外表面から観察することはできないがシャルコー・マリー・トゥース病では末梢神経の肥厚のため約20%の患者で体表から末梢神経を触れることができる。触れることができる神経は大耳介神経、尺骨神経、腓骨神経などであり、それぞれ頸部外側面、尺骨神経溝から数cm近位部、腓骨頭後面で触れることができる。
- 骨格系の変形
前後長の短い足と不釣り合いに高い足甲によって特徴付けられる凹足がもっともよく認められる。偏平足や側弯症も稀ながら認められる。青年期に股関節形成異常が認められることがある。
- 呼吸機能
進行性筋ジストロフィーなどのミオパチーとは異なり、先天性髄鞘形成不全など小児発症例を除けば呼吸器障害が問題となることは稀である。
電気生理学的検査
[編集]シャルコー・マリー・トゥース病の神経伝導速度検査の特徴としては臨床症状と同様であるが左右差がほとんどないこと、下肢の所見が上肢よりも重篤であることが多いなどの特徴がある。左右差があったり、上肢の方が異常が強い場合は慢性炎症性脱髄性多発神経炎など別のニューロパチーも鑑別にあがる。シャルコー・マリー・トゥース病の神経伝導速度検査で最も重要なのは遺伝性脱髄性感覚運動ニューロパチーであるCMT1と軸索感覚性ニューロパチーであるCMT2の鑑別である。便宜上、上肢の正中神経のMCVがCMT1では38m/sに満たず、CMT2では38m/sよりも速いとされている。中には中間型CMTといい家系の中で上肢正中神経のMCVが38m/sの上下にまたがる場合もある。しかしCMT1の多くは医療機関を受診する頃には正中神経のMCVは20~25m/sに低下している。
- PMP22/CMT1A
複数の検査区間で比較的均一な伝導速度の低下を認め、Uniform slowingといわれる。伝導ブロックを示さない。発症前の小児期からNCVの低下があるが症状とNCVは相関せず、CMAP振幅の低下が筋力低下と相関する。
病理検査
[編集]シャルコー・マリー・トゥース病の末梢神経病理は病型によって異なる。PMP22/CMT1Aが最も多く、MPZ/CMT1B、Cx32/CMTXが多くみられるためこれを中心に述べる。シャルコー・マリー・トゥース病の原因遺伝子が次々と同定され、病理学的な観点からすべての遺伝子診断別の特徴を検討することは困難である。
- PMP22/CMT1A
CMT1Aでは神経束が大きくなり皮膚直下で触知できることがしばしばある。神経肥厚の原因はミクロロベルではオニオンバルブ(onion bulb)[1][2]、神経内鞘、神経周膜の浮腫、シュワン細胞の増加などである。オニオンバルブは神経横断像でみられる髄鞘周囲にタマネギ状の層構造である。脱髄とその後の髄鞘再生とが長年にわたり繰り返し起きたことによる病理変化である。CMT1aでは全例でオニオンバルブが認められ、有髄神経の約半数にオニオンバルブが出現する。オニオンバルブは小径有髄線維強くみられる特徴がある。有髄神経線維密度は中等度の低下があり無髄神経線維密度は比較的軽度である。ときほぐし線維では約80%におよぶ有髄線維の脱髄性変化が特徴的である。これら病理変化に一致して神経伝導速度検査では四肢の伝導速度が一様に低下する。
乳児のCMT1Aではオニオンバルブが乏しいことがあり、髄鞘の消失やマクロファージの浸潤、神経束内の浮腫などの急性期脱髄像がみられることもある。オニオンバルブはCMT1Aの中核病理であるが必ずしも特異的ではない。例えば糖尿病性ニューロパチーや慢性炎症性脱髄性多発神経炎でもしばしばオニオンバルブが認められる。しかしこれらの疾患ではオニオンバルブの出現率は有髄神経の10%にも満たない。
- MPZ/CMT1B
MPZ/CMT1Bは一般的には脱髄型のCMTに分類されるが軸索障害型を呈するグループがある。脱髄型の病理所見はCMT1Aと同様であるがオニオンバルブの形成は比較的軽度であり有髄神経密度がより高度に低下している。一方、軸索障害型ではオニオンバルブがほとんどみられず、慢性軸索変性所見である軸索再生像(axonal sprouts)がみられる。ときほぐし線維での軸索障害線維が正常の約4倍に達する。
- Cx32/CMTX
病理学的には脱髄型と軸索障害型が混在した末梢神経障害である。オニオンバルブと軸索再生像(axonal sprouts)が同時にみられるのが特徴的である。有髄神経密度、無髄神経密度ともに比較的保たれており、ときほぐし線維での脱髄神経比は約10%程度、軸索障害線維比はMPZ/CMT1Bとほぼ同等である。
- デジュリーヌ・ソッタス病
デジュリーヌ・ソッタス病(Dejerine-Sottas病)では高度の髄鞘の菲薄化と髄鞘低形成を特徴とする。
- 遺伝性圧脆弱性ニューロパチー
遺伝性圧脆弱性ニューロパチー(hereditary neuropathy with liability to pressure palsy、HNPP)への物理的あるいは機械的な圧迫により限局性の症状を繰り返すという特徴的な臨床症状で知られている。ときほぐし像ではトマキュラ(tomacula)とよばれるミエリンのソーセージ状の肥厚がみられ、横断像ではトマキュラに相当する部分が何層にも肥大化したミエリンとなりゼリー・ロール(jelly rolls)とよばれる。
- 遺伝性運動感覚ニューロパチー2型(HMSN2型)
オニオンバルブの形成が全くみられず軸索再生像が極めて広範に認められる。
- CBT4B
ときほぐし線維でトマキュラが極めて高頻度に認められる。
遺伝子検査
[編集]CMTの原因となる遺伝子は数が多く効率的な遺伝子検査が必要と考えられている。またすべての原因遺伝子が同定されているわけではない。PMP22の重複によるCMT1Aが脱髄型の70%、CMT全体でも50%を占める。そのため脱髄型または病型不明の場合はまずFISH法(in site ハイブリダイゼーション法)でPMP22の重複や欠失を評価する。この検査は三菱化学メディエンス社から提供されている、17番染色体1本あたりに1つのPMP22の遺伝子があるのが正常である。すなわち正常では2コピーある。CMT1Aでは異常な2つのコピーを持つ染色体と正常な1つのコピーをもつ染色体で合計3コピー認められる。2つのコピーは必ず近接して存在する。PMP22の欠失が原因のHNPPもこの検査で遺伝子診断ができる。MLPA法でより高い精度で安価に検出することができるが保険適応となっていない。PMP22の重複が認められない場合はまたは軸索型ではシークエンス解析を行う。脱髄型では比較的頻度の高いGJB1、MPZ、PMP22など、軸索型ではMFN2などのシークエンス解析を行う。その他の遺伝子異常を検査する場合はマイクロアレイ法をベースとしたDNAチップによる診断やDHPLC(deanturing high-performance liquid chromatography)が行われている。choiらはエキソーム解析法により通常のDNA解析法では異常を見いだせなかった25例中3例(32%)で遺伝子異常を検出したと報告している[14]。今後は次世代シークエンサーを用いたエキソーム解析が主流になると考えられる。
診断
[編集]シャルコー・マリー・トゥース病の診断は家族歴と臨床像により行われる。すでに知られている遺伝子異常が遺伝子検査で認められればより確実になる。特徴的な臨床像としては四肢遠位優位の筋力低下、逆シャンパンボトル様下腿筋萎縮、凹足、槌状足趾、手袋靴下型感覚低下などがあげられる。そして神経伝導速度検査で脱髄型、軸索型に分類する。特徴的な症状と電気生理学的な検査、家族歴が得られればシャルコー・マリー・トゥース病の診断は比較的容易である。しかし家族歴がない場合、症状あるいは電気生理検査で左右非対称である場合、上肢の方が下肢よりも症状が強い場合、近位筋優位である場合、経過が早い場合(数ヶ月で悪化など)はその他のニューロパチーの可能性もあり慎重な診断が必要となる。具体的にはCIDPや抗MAG抗体を伴うニューロパチー、POEMS症候群、ビタミンB1欠乏ニューロパチー、アルコール性多発ニューロパチー、アミロイドーシス、脊髄小脳変性症によるニューロパチー(Aprataxin、senataxin、frataxin)、Refsum病、異染性白質ジストロフィー、Krabbe病、Tangier病などが鑑別疾患となる。
遺伝カウンセリング
[編集]シャルコー・マリー・トゥース病の遺伝カウンセリングは2つの問題点がある。ひとつは多くの症例で原因遺伝子が不明になる点である。特に日本人のCMTでは髄鞘型の50%、軸索型の80%は原因不明となり正確な遺伝カウンセリングができない。また同一遺伝子変異を持っていたとしても症状が異なることがある。症状のない家族の遺伝子検査に関しては慎重さが求められる。症状を認めない成人では遺伝カウンセリングを行い承諾を得た後に検査を施行し、症状のない小児では遺伝子解析は行わない。
治療
[編集]- CMT1Aの薬物治療
アスコルビン酸の大量投与はモデルマウスでは有効であったが臨床試験では有効性は証明できなかった。NT-3、クルクミン、プロゲステロン拮抗薬などいくつかの薬剤で効果があるという報告もある。RNA干渉法など核酸医薬も有効な可能性がある。
予後
[編集]一般に発症時期が速いほど神経学的障害が重篤になる傾向がある。緩徐に進行する疾患であり、寿命自体にはあまり影響しないと考えられている。しかし多くの患者で杖などが必要となり社会生活には影響がある。
注意点
[編集]いくつかの麻酔薬や抗がん剤、抗菌薬はCMTの症状を悪化させる可能性があり注意が必要である。
トピックス
[編集]核酸医薬による治療
[編集]シャルコー・マリー・トゥース病は核酸医薬での治療が期待される疾患の一つである。機能獲得型の点突然変異が原因の遺伝性疾患では変異型のmRNAのみのノックダウンが有効な治療戦略となる。siRNAで変異型mRNAを特異的にノックダウンする方法はすでに報告され確立している[15]。生後6日から生後18日に隔日でリコンビナントNRG-1を投与するとシュワン細胞が分化しCMT1Aモデルラットの脱髄が軽快するという先行研究がある[16]。ピリミジン塩基の2'-OHを2'–Fに修飾したsiRNA、すなわちCの代わりに2'-FC、Uの代わりに2'-FUを用いたsiRNAは血漿中で3日間効果が持続するという報告がある[17]。以上の事実から変異型mRNAを特異的にノックダウンできるsiRNAを作成し、生後6日から生後18日の間に3日毎にピリミジン塩基の2'–OHを2'–Fに修飾した変異型mRNAを特異的にノックダウンできるsiRNAをCMT1EのモデルマウスであるTrembler-Jマウスに投与すると脱髄が軽快するかも知れない。韓国のソンギュングァン大学のビョンオク教授は変異型mRNAを特異的にノックダウンできるsiRNAを開発しTrembler-Jマウスに投与した[18]。その結果、ローターロッドによる行動解析、電気生理学的検査、病理形態学のいずれも改善を示した。これはCMT1Eで有効な治療戦略となる。
さらに核酸医薬のリーディングカンパニーであるIONIS社ではヒトのPMP22に対するアンチセンス核酸を開発した。化学修飾したアンチセンス核酸を皮下投与しCMT1Aモデル動物(C22マウスとラット)の行動解析、電気生理学的検査、病理形態学のいずれも改善を示した[19]。
脚注
[編集]- ^ a b c d e f g h i j k イヤーノート 2015: 内科・外科編 J-177 メディック・メディア ISBN 978-4896325102
- ^ a b c d e f g 病気がみえるVol.7 メディックメディア社発行 P330 ISBN 978-4896323580
- ^ J Neurol Neurosurg Psychiatry. 2012 83 572-573. PMID 21984771
- ^ Neuroepidemiology. 2002 21 246-250. PMID 12207153
- ^ J Neurol Neurosurg Psychiatry. 2012 83 706-710. PMID 22577229
- ^ Nat Med. 2014 20 1055-1061 PMID 25150498
- ^ Hum Mol Genet. 1996 May;5(5):563-9. PMID 8733121
- ^ J Neuropathol Exp Neurol. 2011 May;70(5):386-98 PMID 21487305
- ^ J Neuropathol Exp Neurol. 1983 Nov;42(6):688-706. PMID 6313869
- ^ Nature. 1992 Mar 19;356(6366):241-4. PMID 1552943
- ^ Neurology. 1993 May;43(5):1010-5. PMID 8492918
- ^ Neurology. 1995 Sep;45(9):1766-7. PMID 7675244
- ^ Nat Genet. 1992 Dec;2(4):288-91 PMID 1303281
- ^ Hum Mutat. 2012 33 1610-1615. PMID 22730194
- ^ PLoS Genet. 2006 Sep 8;2(9):e140. PMID 16965178
- ^ Nat Med. 2014 Sep;20(9):1055-61. PMID 25150498
- ^ RNA. 2004 May;10(5):766-71. PMID 15100431
- ^ Neurobiol Dis. 2017 Apr;100:99-107. PMID 28108290
- ^ J Clin Invest. 2018 Jan 2;128(1):359-368. PMID 29202483
関連項目
[編集]外部リンク
[編集]参考文献
[編集]- シャルコー・マリー・トゥース病診療マニュアル ISBN 9784765314183
- Peripheral Neuropathy ISBN 9780721694917
- ハリソン内科学 第4版 ISBN 9784895927345
- Mol Neurobiol. 2013 Apr;47(2):673-98 PMID 23224996
