ActA
| Actin assembly-inducing protein | |
|---|---|
 EVH1ドメイン-ActAペプチド複合体 | |
| 識別子 | |
| 略号 | ActA |
| Entrez | 2798121 |
| UniProt | P33379 |
ActA(Actin assembly-inducing protein)とは、リステリア・モノサイトゲネス(Listeria monocytogenes)のゲノムにコードされているタンパク質の一つである。膜貫通領域を含む細菌細胞表面タンパク質である[1] 。哺乳動物の細胞内においてActAは、 Arp2/3複合体およびアクチン単量体と相互作用して、細菌表面上でアクチン重合を誘導し、アクチンロケットを生成する。ActAをコードする遺伝子はactAもしくはprtBである[2]。
L. monocytogenesはヒト体内に経口侵入するとすぐに腸上皮細胞に入り込むが、そこで細胞内の液胞に取り込まれるので液胞から迅速に脱出しなければならない[3][4] 。そこでL. monocytogenesはActAタンパク質を用いて細菌表面上でアクチンの重合を始め、アクチンロケットを作り、運動性のための推進力を生み出す。ActAはこのアクチンベースの運動に必要であり、他の細菌性因子の非存在下でもActAがあれば細菌の運動性を誘導するのに十分であることが示されている[5]。
発見
[編集]ActAは、レシチナーゼ陰性のTn917-lacリステリア突然変異株の分析を通じて発見された。この突然変異株は、アクチンベースの運動性があれば可能な細胞から細胞への拡散ができない表現型であった。野生株と同様に効率的にファゴソームから逃げ出し宿主細胞内で増殖したが、野生株のように細胞表面にアクチンは現れなかった。さらなる分析の結果、Tn917-lacがオペロンの第2遺伝子であるactAに挿入されていたことが示された。このオペロンの第3遺伝子plcBはレシチナーゼをコードする。actA自体、plcB、下流の他の共転写領域のどれがアクチン集合に関与するかどうかを決定するために突然変異株が作成された。actA突然変異体を除く全ての突然変異体はF-アクチンとの関連および細胞-細胞間の拡散に関して野生株と近似していた。actA突然変異体のactAを補完すると、野生株の表現型が回復した[1]。
機能
[編集]
ActAは、宿主細胞中に存在する核形成促進因子(NPF)であるウィスコット・アルドリッチ症候群タンパク質(WASP)の模倣物として作用するタンパク質である。哺乳動物細胞のNPFはアクチン関連タンパク質2および3の複合体(Arp2/3複合体)を集合させて結合し、Arp2/3複合体を活性型コンフォメーションへと誘導する[6]。このコンフォメーション変化によりNPFはアクチンフィラメントの重合を70°の角度で開始し、運動性細胞の最先端に特徴的なY分枝アクチン構造を導く。ActAは細菌の古い極に局在し、細菌細胞膜と細胞壁の両方に分布しており、外へは拡散しないように制御されている。 従って、ActAは細菌表面上に偏極かつ固定されて存在し、アクチン重合の開始はこの領域でのみ起こる[7]。ActAの発現は、哺乳動物の宿主細胞に入った後に限定して誘導される[8]。
アクチンフィラメントの形成は、宿主の細胞質内の細菌を前方へと押す力を発生させる。アクチン重合の連続により細胞質内での運動性と隣接細胞への感染能力が生まれる[9]。
ActAは液胞の破壊においても役割を果たす。 ActA欠失突然変異体は液胞からの脱出能力を欠く。酸性領域のN末端における11アミノ酸区間(32〜42)は、ファゴソームの破壊にとって重要であることが示されている[10]。
構造
[編集]actA遺伝子の一次タンパク質産物は639個のアミノ酸から成り、一本のペプチド鎖(最初の29アミノ酸N末端)とActA鎖(610アミノ酸C末端)を含む。この610アミノ酸が成熟ActAタンパク質となる。ActAは分子量70,349Daの表面タンパク質である[1][2]。
ActAは3つの機能的ドメインに分けられる(図2)[1][11][12]
N末端ドメイン
[編集]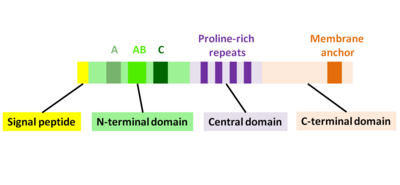
N末端から数えて156アミノ酸残基はN末端ドメインであり、3つの領域から成る[10][13] 。(図2):
- 酸性残基区画である領域A:32-45アミノ酸残基
- アクチン単量体と結合する区画である領域AB:59-102アミノ酸残基
- コフィリン相同配列である領域C:145-156アミノ酸残基
N末端領域はアクチン重合において重要な役割を果たす[14] 。このドメインには、真核生物のWASPファミリーの核形成促進因子(NPF)にも存在するコンセンサス配列エレメントがある[7] 。NPFはArp2/3と同じくアクチン単量体結合領域を含む。ActAのアクチン単量体結合領域は、WASP-Homology-2ドメイン(WH2)やVドメインのような機能的特性を有するが、配列が異なる[15]。NPFではドメインの順序はWH2の次にCドメイン、その次にAドメインであり、ActAとは異なる。
中央ドメイン
[編集]ActAの中心にあるプロリンリッチ領域は、効率的な細菌の運動性を確保するために重要である。FPPPPモチーフかFPPIPモチーフのどちらかを含む4つのプロリンリッチ反復配列がある。これらの領域は、焦点接着やストレスファイバーと関連することが知られている宿主の細胞骨格タンパク質ザイキシン、ビンキュリンおよびpalladinの模倣物となる[16] 。血管拡張因子刺激リン酸化タンパク質(VASP)は、そのEna/VASP homology 1ドメイン(EVH1ドメイン)を介して中央のプロリンリッチ領域に結合し、アクチン単量体結合タンパク質であるプロフィリンを動員し、アクチンフィラメントの反矢じり端で重合を促進する。さらに、VASPはC末端のEVH2ドメインを介してF-アクチンと相互作用し、細菌をアクチン重合体(アクチンロケット)と連結させるようである[17] 。この推測は、ActAが複数のEna/VASPタンパク質と同時に結合でき、ActAとEna/VASPとの間に高い親和性を有するという事実によって支持されている。VASPはin vitroでアクチンのY分枝の頻度を減少させることが示されており、したがって、並列して形成されてアクチンロケットを構成するフィラメントの割合が増加する[18][19]。
C末端ドメイン
[編集]ActAのC末端ドメインは、細菌膜中のタンパク質を固定する疎水性領域を有する。[20][21][22]
そのほかの特記事項として
- アクチン結合領域に配列相同性がない。
- ActAは、宿主NPFとの主な違いとして、RhoファミリーのGTP加水分解酵素などの調節タンパク質と結合する部位を持たず、宿主からの制御を受け付けない。宿主に干渉されないL. monocytogenesのアクチン核形成活性はこの細菌の感染力と病原性にとって有利に働く。
アナログ
[編集]ActAが機能的に模倣しているWASP/N-WASPは真核生物において高度に保存されている。このタンパク質は重要なアクチン-細胞骨格形成装置であり、エンドサイトーシスと細胞運動性などのプロセスにおいて重要である。Rhoファミリーの低分子量GTPアーゼであるCdc42によって活性化されたWASP/N-WASP複合体はArp2/3複合体を活性化し、高速のアクチン重合を導く[23]。
IcsA
[編集]赤痢菌ではIcsAタンパク質がN-WASPを活性化する。活性N-WASP/WASP複合体は、Arp2/3複合体を活性化することによってアクチン重合を導く。ActAタンパク質がArp2/3複合体と直接相互作用して活性化させるのとは対照的である[7]。
RickA
[編集]RickettsiaのRickAタンパク質もWASPと同様の方法でArp2/3複合体を活性化することができる。ActAの場合とは対照的に、アクチンフィラメントは、長くて枝分かれのない束に作られる。Arp2/3複合体は細菌表面付近にのみ局在しているため、Arp2/3複合体に依存しない方法での伸長がより頻繁に利用されていると推測されている[16]。
BimA
[編集]Burkholderia pseudomalleiではBimAがin vitroでアクチン重合を開始する。この細菌の細胞内移動は、Arp2/3複合体とは独立して発動すると考えられている[16]。
脚注
[編集]- ^ a b c d “L. monocytogenes-induced actin assembly requires the actA gene product, a surface protein”. Cell 68 (3): 521–31. (February 1992). doi:10.1016/0092-8674(92)90188-I. PMID 1739966.
- ^ a b Uniprot P33379
- ^ “Bacterial invasion: the paradigms of enteroinvasive pathogens”. Science 304 (5668): 242–8. (April 2004). doi:10.1126/science.1090124. PMID 15073367.
- ^ “Invasion of mammalian cells by Listeria monocytogenes: functional mimicry to subvert cellular functions”. Trends in Cell Biology 13 (1): 23–31. (January 2003). doi:10.1016/S0962-8924(02)00006-5. PMID 12480337.
- ^ Zigmond SH (February 2004). “Formin-induced nucleation of actin filaments”. Current Opinion in Cell Biology 16 (1): 99–105. doi:10.1016/j.ceb.2003.10.019. PMID 15037312.
- ^ “Critical conformational changes in the Arp2/3 complex are induced by nucleotide and nucleation promoting factor”. Molecular Cell 16 (2): 269–79. (October 2004). doi:10.1016/j.molcel.2004.09.018. PMID 15494313.
- ^ a b c “Actin-based motility of intracellular pathogens”. Current Opinion in Microbiology 8 (1): 35–45. (February 2005). doi:10.1016/j.mib.2004.12.013. PMID 15694855.
- ^ Rafelski SM, Theriot JA (February 2006). “Mechanism of polarization of Listeria monocytogenes surface protein ActA”. Molecular Microbiology 59 (4): 1262–79. doi:10.1111/j.1365-2958.2006.05025.x. PMC 1413586. PMID 16430699.
- ^ Goldberg MB (December 2001). “Actin-Based Motility of Intracellular Microbial Pathogens”. Microbiology and Molecular Biology Reviews 65 (4): 595–626. doi:10.1128/MMBR.65.4.595-626.2001. PMC 99042. PMID 11729265.
- ^ a b “Evidence for involvement of ActA in maturation of the Listeria monocytogenes phagosome”. Cell Research 20 (1): 109–12. (January 2010). doi:10.1038/cr.2009.142. PMC 2802179. PMID 20029388.
- ^ “Host-pathogen interactions during entry and actin-based movement of Listeria monocytogenes”. Annual Review of Genetics 31: 113–38. (1997). doi:10.1146/annurev.genet.31.1.113. PMID 9442892.
- ^ Footer, Matthew J.; Lyo, John K.; Theriot, Julie A. (2008-08-29). “Close packing of Listeria monocytogenes ActA, a natively unfolded protein, enhances F-actin assembly without dimerization”. The Journal of Biological Chemistry 283 (35): 23852–23862. doi:10.1074/jbc.M803448200. ISSN 0021-9258. PMC 2527104. PMID 18577520.
- ^ Welch, Matthew D. (2007). “Actin-based motility and cell-to-cell spread of Listeria monocytogenes”. In Goldfine, Howard; Shen, Hao. Listeria monocytogenes: Pathogenesis and host response. New York: Springer. pp. 197–223. ISBN 978-0-387-49373-2
- ^ “Interaction of human Arp2/3 complex and the Listeria monocytogenes ActA protein in actin filament nucleation”. Science 281 (5373): 105–8. (July 1998). doi:10.1126/science.281.5373.105. PMID 9651243.
- ^ “Activation of the Arp2/3 complex by the Listeria acta protein. Acta binds two actin monomers and three subunits of the Arp2/3 complex”. The Journal of Biological Chemistry 276 (5): 3468–75. (February 2001). doi:10.1074/jbc.M006407200. PMID 11029465.
- ^ a b c “Listeria comet tails: the actin-based motility machinery at work”. Trends in Cell Biology 18 (5): 220–7. (May 2008). doi:10.1016/j.tcb.2008.03.001. PMID 18396046.
- ^ Laurent V; Loisel TP; Harbeck B et al. (March 1999). “Role of Proteins of the Ena/VASP Family in Actin-based Motility of Listeria monocytogenes”. The Journal of Cell Biology 144 (6): 1245–58. doi:10.1083/jcb.144.6.1245. PMC 2150578. PMID 10087267.
- ^ “Pivotal role of VASP in Arp2/3 complex–mediated actin nucleation, actin branch-formation, and Listeria monocytogenes motility”. The Journal of Cell Biology 155 (1): 89–100. (October 2001). doi:10.1083/jcb.200106061. PMC 2150787. PMID 11581288.
- ^ Bear JE; Svitkina TM; Krause M et al. (May 2002). “Antagonism between Ena/VASP proteins and actin filament capping regulates fibroblast motility”. Cell 109 (4): 509–21. doi:10.1016/S0092-8674(02)00731-6. PMID 12086607.
- ^ Vazquez-Boland JA; Kocks C; Dramsi S et al. (January 1992). “Nucleotide sequence of the lecithinase operon of Listeria monocytogenes and possible role of lecithinase in cell-to-cell spread”. Infection and Immunity 60 (1): 219–30. PMC 257526. PMID 1309513.
- ^ Domann E; Wehland J; Rohde M et al. (May 1992). “A novel bacterial virulence gene in Listeria monocytogenes required for host cell microfilament interaction with homology to the proline-rich region of vinculin”. The EMBO Journal 11 (5): 1981–90. PMC 556658. PMID 1582425.
- ^ “Polarized distribution of Listeria monocytogenes surface protein ActA at the site of directional actin assembly”. Journal of Cell Science 105 (3): 699–710. (July 1993). PMID 8408297.
- ^ Kurisu S, Takenawa T (2009). “The WASP and WAVE family proteins”. Genome Biology 10 (6): 226. doi:10.1186/gb-2009-10-6-226. PMC 2718491. PMID 19589182.
