AP2アダプタータンパク質複合体
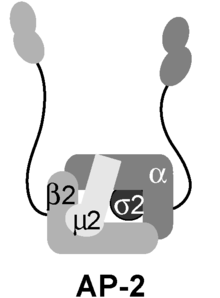
AP2アダプタータンパク質複合体(AP2複合体、英: AP2 adaptor complex)は、クラスリン依存性エンドサイトーシスにおいて、積み荷のインターナリゼーションを行うために細胞膜上で機能する多量体タンパク質である[1]。4つのアダプチンからなる安定な複合体であり、コアドメインと、ポリペプチドリンカーによってコアドメインに連結された2つのappendage domain(付属ドメイン)からなる構造をしている。これらのappendage domainはearドメインとも呼ばれる。コアドメインは膜に結合し、そしてインターナリゼーションの標的となる積み荷とも結合する。2つのearドメイン(αとβ)は、補助タンパク質やクラスリンと結合する。これらの相互作用によって、クラスリン被覆小胞の組み立てとエンドサイトーシスの時空間的調節が行われている。
AP2複合体は、2種類のlarge adaptin(αとβ)、1種類のmedium adaptin(μ)、1種類のsmall adaptin(σ)からなるヘテロ四量体である。
構造
[編集]AP2複合体は、開いたコンフォメーション(活性化状態)と閉じたコンフォメーション(不活性化状態)という、主に2つのコンフォメーションで存在する[2]。活性化状態では、βサブユニット上のクラスリン結合部位や、μサブユニット上の積み荷結合部位は細胞質基質に露出しており[2]、それぞれ相互作用が可能な状態となっている。不活性化状態では、複合体のコンフォメーション変化によってどちらの部位も覆い隠され、その主要機能が阻害された状態となる[3]。αサブユニットとβサブユニットはAP2複合体のポリペプチド配列の約60%を占めており、14個のHEATリピートからなるジグザグ型のαヘリカル構造を形成している[2][4]。

機能
[編集]エンドサイトーシスが必要な際には、AP2複合体は他のAP2複合体とともに活性化状態で凝集し、クラスリン格子の組み立てを促進する[4]。こうしたAP2凝集体はβサブユニット上の結合部位を介して個々のクラスリンタンパク質と相互作用し、小胞の被覆となるかご状構造が形成されるよう、これらを適切な配向で配置する[4]。
調節
[編集]AP2複合体活性の調節は、主に2つ(3つまたは4つの可能性もある)の異なるコンフォメーションへの再編成によって行われている。「開いた」コンフォメーションは複合体の活性化状態であり、クラスリンや積み荷の結合部位は覆い隠されていない。一方「閉じた」コンフォメーションでは、これらの部位はアクセスできない状態となっている[6]。
活性化
[編集]クラスリンの存在によって積み荷の結合が誘導され、同様に積み荷の存在もクラスリンの結合を誘導するようである[7][8]。ホスファチジルイノシトール-(4,5)-ビスリン酸(PIP2)は、AP2が結合し認識するシグナルとして機能する。PIP2は積み荷を含む小胞に存在し、AP2複合体と相互作用する。閉じた状態のAP2複合体はPIP2結合部位が露出しており、コンフォメーションの調節が可能となっている[9]。そのため、PIP2の結合に始まり、積み荷配列の結合、そして最終的にクラスリンの結合という特定の順序で行われるわずかなコンフォメーション変化によって、完全に開いたコンフォメーションへの移行が行われる[9]。また、Muniscinと呼ばれるタンパク質ファミリーはAP2複合体が結合している膜のくぼみに広く存在し、またその阻害によってAP2複合体を介したエンドサイトーシスが低下することから、AP2複合体の主要なアロステリック活性化因子であると考えられている[10][11]。さらに、AP2複合体はμサブユニットのリン酸化によっても調節され、活性化されることが明らかにされている[12][13]。
不活性化
[編集]不活性化、すなわち「閉じた」コンフォメーションへの変化の機構は、いまだ不明確である。NECAPと呼ばれるタンパク質群はAP2複合体のαサブユニットと相互作用し、この過程に関与していると考えられている[6]。多くのことは明らかにはなっていないが、NECAP1がAP2複合体のコア内部に結合するためには、リン酸化された、開いた状態のAP2複合体が必要である[3]。その作用機序は不明であるが、この相互作用はAP2複合体の脱リン酸化を引き起こし、不活性化をもたらす。
医学的重要性
[編集]AP2複合体は、凝集タンパク質の分解を担うオートファジー経路と密接に関係していることが明らかにされている[14]。AP2複合体はPICALMとともにLC3の受容体として機能する[14]。LC3は一部のオートファジー経路において重要な役割を果たしており[15]、AP2複合体の枯渇または機能不全が家族性アルツハイマー病の発症の前駆病変となっている可能性がある[14]。
出典
[編集]- ^ “Clathrin coat construction in endocytosis”. Current Opinion in Structural Biology 10 (2): 220–228. (April 2000). doi:10.1016/S0959-440X(00)00071-3. PMID 10753805. (
 要購読契約)
要購読契約)
- ^ a b c “Molecular Architecture and Functional Model of the Endocytic AP2 Complex”. Cell 109 (4): 523–535. (2002-05-17). doi:10.1016/S0092-8674(02)00735-3. PMID 12086608.
- ^ a b “NECAPs are negative regulators of the AP2 clathrin adaptor complex”. eLife 7: e32242. (January 2018). doi:10.7554/eLife.32242. PMC 5785209. PMID 29345618.
- ^ a b c “Molecular structure, function, and dynamics of clathrin-mediated membrane traffic”. Cold Spring Harbor Perspectives in Biology 6 (5): a016725. (May 2014). doi:10.1101/cshperspect.a016725. PMC 3996469. PMID 24789820.
- ^ “A structural mechanism for phosphorylation-dependent inactivation of the AP2 complex”. eLife 8: e50003. (August 2019). doi:10.7554/eLife.50003. PMC 6739873. PMID 31464684.
- ^ a b “Conformational regulation of AP1 and AP2 clathrin adaptor complexes”. Traffic 20 (10): 741–751. (October 2019). doi:10.1111/tra.12677. PMC 6774827. PMID 31313456.
- ^ “Endocytosis by random initiation and stabilization of clathrin-coated pits”. Cell 118 (5): 591–605. (September 2004). doi:10.1016/j.cell.2004.08.017. PMID 15339664.
- ^ “Regulatory interactions in the recognition of endocytic sorting signals by AP-2 complexes”. The EMBO Journal 16 (9): 2240–2250. (May 1997). doi:10.1093/emboj/16.9.2240. PMC 1169826. PMID 9171339.
- ^ a b “Regulation of clathrin-mediated endocytosis by hierarchical allosteric activation of AP2”. The Journal of Cell Biology 216 (1): 167–179. (January 2017). doi:10.1083/jcb.201608071. PMC 5223608. PMID 28003333.
- ^ “FCHo proteins are nucleators of clathrin-mediated endocytosis”. Science 328 (5983): 1281–1284. (June 2010). doi:10.1126/science.1188462. PMC 2883440. PMID 20448150.
- ^ “The first five seconds in the life of a clathrin-coated pit”. Cell 150 (3): 495–507. (August 2012). doi:10.1016/j.cell.2012.05.047. PMC 3413093. PMID 22863004.
- ^ “AP-1 binding to sorting signals and release from clathrin-coated vesicles is regulated by phosphorylation”. The Journal of Cell Biology 160 (5): 699–708. (March 2003). doi:10.1083/jcb.200211080. PMC 2173368. PMID 12604586.
- ^ “Phosphorylation of the AP2 mu subunit by AAK1 mediates high affinity binding to membrane protein sorting signals”. The Journal of Cell Biology 156 (5): 791–795. (March 2002). doi:10.1083/jcb.200111068. PMC 2173304. PMID 11877457.
- ^ a b c Tian, Yuan; Chang, Jerry C.; Fan, Emily Y.; Flajolet, Marc; Greengard, Paul (2013-10-15). “Adaptor complex AP2/PICALM, through interaction with LC3, targets Alzheimer's APP-CTF for terminal degradation via autophagy”. Proceedings of the National Academy of Sciences of the United States of America 110 (42): 17071–17076. doi:10.1073/pnas.1315110110. ISSN 1091-6490. PMC 3801056. PMID 24067654.
- ^ “Microtubule-Associated Protein 1 Light Chain 3 (LC3) Isoforms in RPE and Retina”. Retinal Degenerative Diseases. Advances in Experimental Medicine and Biology. 1074. (2018). pp. 609–616. doi:10.1007/978-3-319-75402-4_74. ISBN 978-3-319-75401-7. PMID 29721994
