2-ナフトール
| 2-ナフトール | |
|---|---|

| |

| |

| |
Naphthalen-2-ol | |
別称 2-Hydroxynaphthalene; 2-Naphthalenol; beta-Naphthol; Naphth-2-ol | |
| 識別情報 | |
| CAS登録番号 | 135-19-3 |
| PubChem | 8663 |
| ChemSpider | 8341 |
| UNII | P2Z71CIK5H |
| KEGG | C11713 |
| ChEBI | |
| ChEMBL | CHEMBL14126 |
| |
| |
| 特性 | |
| 化学式 | C10H8O |
| モル質量 | 144.17 g mol−1 |
| 外観 | 薄紫色の固体 |
| 密度 | 1.280 g/cm3 |
| 融点 |
121 - 123 °C, 271 K, -68 °F |
| 沸点 |
285 °C, 558 K, 545 °F |
| 水への溶解度 | 0.74 g/L |
| 酸解離定数 pKa | 9.51 |
| 磁化率 | -98.25·10−6 cm3/mol |
| 危険性 | |
| 主な危険性 | 吸入したり、飲み込むと有害である。環境への悪影響を及ぼす。特に水生生物に有害。[1] |
| NFPA 704 | |
| Rフレーズ | R20 R22 R50 |
| Sフレーズ | S24 S25 S61 |
| 引火点 | 161 °C (322 °F)[1] |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
2-ナフトール(en:2-Naphthol)は示性式C10H7OHを有する蛍光性有機化合物である。無色(または黄色)の結晶固体である。ナフタレンの水素を1個、ヒドロキシ基に置換した化合物で、フェノール類に分類される芳香族化合物である。また、そのヒドロキシ基はフェノールよりも反応性が高い。ヒドロキシ基の置換位置が異なる異性体、1-ナフトールが存在する。化学工業ではβ-ナフトールと呼ばれている。異性体はいずれも単純なアルコール、エーテル、クロロホルムに溶けやすい。2-ナフトールは毒物及び劇物取締法に定める劇物に該当する。[2]2-ナフトールは、染料および他の化合物の製造のために広く使用される中間体である。
合成
[編集]2-ナフトールは古くからナフタレンを硫酸中でスルホ化し2-ナフタレンスルホン酸にし(1)、それを溶融した水酸化ナトリウムでスルホ基を切断してナトリウム2-ナフトキシドとし(2)、それを酸で中和させるという合成法で合成されている。[3]
2-ナフトールはクメン法に類似した方法でも製造することができる。[3]
2-ナフトール由来の染料
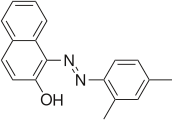
[編集]スーダンの染料は、有機溶剤に溶けやすいという人気の染料である。スーダンの染料のいくつかはジアゾニウム塩と結合した2ナフトールに由来する。[4]スーダン染料I-IVとスーダンレッドGは、アゾカップリングを受けたナフトールで構成されている。
- 2-ナフトール由来の染料の例
反応
[編集]2-ナフトールは、不斉触媒に使用するために普及したC2対称リガンドである1,1'-ビ-2-ナフトールを形成する反応を起こす。
2-ナフトールは、ニューマン-クワートの再配列を介して塩化ジメチルチオカルバモイルとの反応によって2-ナフタレンチオールに変換される。[5]
安全性
[編集]ナフトール(1-及び2-の両方の異性体)は、多環芳香族炭化水素にさらされた家畜およびヒトのバイオマーカーとして使用される。[6]
出典
[編集]- ^ a b Safety data for 2-naphthol
- ^ “毒物及び劇物取締法 第2条: 定義、 別表第2 78”. e-Gov法令検索. 総務省行政管理局 (2019年6月27日). 2020年4月2日閲覧。 “2016年4月1日施行分”
- ^ a b Gerald Booth (2005), "Naphthalene Derivatives", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a17_009。.
- ^ Booth, Gerald (2000). “Dyes, General Survey”. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a09_073. ISBN 978-3527306732
- ^ Melvin S. Newman; Frederick W. Hetzel (1971). “Thiophenols from Phenols: 2-Naphthalenethiol”. Org. Synth. 51: 139. doi:10.15227/orgsyn.051.0139.
- ^ Sreekanth, R.; Prasanthkumar, Kavanal P.; Sunil Paul, M. M.; Aravind, Usha K.; Aravindakumar, C. T. (7 November 2013). “Oxidation Reactions of 1- and 2-Naphthols: An Experimental and Theoretical Study”. The Journal of Physical Chemistry A 117 (44): 11261–11270. doi:10.1021/jp4081355. PMID 24093754.