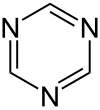
1,3,5-トリアジン
| 1,3,5-トリアジン | |
|---|---|
|
|
別称 sym-Triazine s-Triazine Cyanidine Hydrogen cyanide trimer | |
| 識別情報 | |
| CAS登録番号 | 290-87-9 |
| PubChem | 9262 |
| ChemSpider | 8905 |
| UNII | 8B5F4CM81E |
| EC番号 | 206-028-1 |
| ChEBI | |
| ChEMBL | CHEMBL15698 |
| RTECS番号 | XY2957000 |
| |
| |
| 特性 | |
| 化学式 | C3H3N3 |
| モル質量 | 81.08 g/mol |
| 外観 | 白色結晶固体 |
| 融点 |
81 - 83 °C, 271 K, -36 °F |
| 構造 | |
| 分子の形 | 平面 |
| 双極子モーメント | ゼロ |
| 危険性 | |
| GHSピクトグラム |   
|
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H302, H314, H315, H335, H360 |
| Pフレーズ | P201, P202, P260, P261, P264, P270, P271, P280, P281, P301+312, P301+330+331, P302+352, P303+361+353, P304+340 |
| 主な危険性 | 水と反応しやすい |
| 関連する物質 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
1,3,5-トリアジン (1,3,5-Triazine) または、s-トリアジンは、化学式が(HCN)3の有機化合物である。六員環のヘテロ芳香族環を持ち、トリアジンのいくつかの異性体のうちの1つである。S-トリアジン及びその誘導体には、様々な応用がある。
製法
[編集]対称形の1,3,5-トリアジンは、塩化シアンやシアンイミド等のニトリルの三量体化によって生成される。
ベンゾグアナミン(1フェニル2アミノ置換体)は、ベンゾニトリルとジシアンジアミドから形成される[2]。ピンナーのトリアジン合成では[3]、反応物はアルキルまたはアリルアミジンとホスゲンであり[4][5]、銅カルベノイドによりヒドラジドにN-H基を挿入した後、塩化アンモニウムで処理することによってもトリアジン骨格が得られる[6]。
応用
[編集]有機合成の試薬として、S-トリアジンはシアン化水素と等価に用いられる。シアン化水素が気体であるのに対して固体であるため、トリアジンはより扱いやすい。ガッターマン反応では、芳香族基質にホルミル基を付加させる[7]。
トリアジン誘導体
[編集]トリアジンのN-及びC-置換体は、産業的に用いられる。最も一般的な誘導体は、メラミンとして知られる2,4,6-トリアミノ-1,3,5-トリアジンである。他の重要な誘導体には、シアヌル酸として知られる2,4,6-トリヒドロキシ-1,3,5-トリアジンがある。シアヌル酸クロリドとして知られるトリクロロ-1,3,5-トリアジンは、シマジンやアトラジン等の多くの除草剤の合成原料となる。塩化トリアジンは、セルロース系材料に共有結合する反応染料の重要な基本構造の1つである[8]。

出典
[編集]- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. (2014). p. 147. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4
- ^ Benzoguanamine J. K. Simons and M. R. Saxton Organic Syntheses Coll. Vol. 4, p.78; Vol. 33, p.13 Article
- ^ A. Pinner, Ber. 23, 2919 (1890)
- ^ Name reactions and reagents in organic synthesis, Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro
- ^ Triazines. XIV. The Extension of the Pinner Synthesis of Monohydroxy-s-triazines to the Aliphatic Series. 2,4-Dimethyl-s-triazine1-3 Hansjuergen Schroeder, Christoph Grundmann J. Am. Chem. Soc., 1956, 78 (11), pp 2447–2451 doi:10.1021/ja01592a028
- ^ Shi, B.; Lewis, W.; Campbell, I. B.; Moody, C. J. Org. Lett., 2009, 3686-3688 doi:10.1021/ol901502u
- ^ Roswitha M. Böhme, Qun Dang "1,3,5-Triazine" in Encyclopedia of Reagents for Organic Synthesis 2008 John Wiley & Sons. doi:10.1002/047084289X.rt158.pub2
- ^ Horst Tappe, Walter Helmling, Peter Mischke, Karl Rebsamen, Uwe Reiher, Werner Russ, Ludwig Schläfer and Petra Vermehren "Reactive Dyes"in Ullmann's Encyclopedia of Industrial Chemistry 2000, Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_651
- ^ Aksenov A. V., Aksenova, I. V. "Use of the ring opening reactions of 1,3,5-triazines in organic synthesis" Chemistry of Heterocyclic Cmpds. 45, pp 130-150 (2009). doi:10.1007/s10593-009-0243-5
