齧作用
このページ名「齧作用」は暫定的なものです。(2021年11月) |
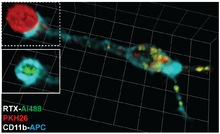
齧作用(げつさよう、Trogocytosis、古代ギリシア語: τρώγω「齧る」より)とは、抗原提示細胞に結合したリンパ球(B細胞、T細胞、NK細胞)が抗原提示細胞から表面分子を取り出し、自分の表面に発現させるプロセスのことである[1]。受け渡しの際にリンパ球と抗原提示細胞の接触面で起こる分子の再編成は、“免疫シナプス”とも呼ばれる。
齧作用の発見まで
[編集]このプロセスの存在が最初に報告されたのは、1970年代後半にいくつかの研究グループが主要組織適合性複合体分子(MHC)などの予期せぬ分子がT細胞に存在することを報告した時であった。抗原提示細胞から、孤立した分子ではなく細胞膜の断片がT細胞に捕捉されるという考えは、緑色蛍光タンパク質(GFP)と融合したMHC分子が細胞内に捕捉されることから示唆されたものである[2]。さらに抗原提示細胞の細胞膜に組み込まれた蛍光プローブやMHC以外の分子が抗原と共にT細胞に捕捉されることで、膜断片がこの転送プロセスに関与していることが示された[3][4]。
齧作用を起こす細胞種
[編集]齧作用は、T細胞、B細胞、NK細胞において、in vivoおよびin vitroで最初に報告されている。T細胞やB細胞では、T細胞のT細胞受容体(TCR)やB細胞のB細胞受容体(BCR)が抗原提示細胞で認識された抗原と相互作用することで、齧作用が引き起こされる。またリンパ球と同様に、PMN(多形核白血球、顆粒球)でも齧作用が起こり、抗体依存性細胞傷害(ADCC)の活性化に繋がる。
試験管内でADCCを開始するためにはPMNが標的細胞に接着し、抗体でオプソニン化された腫瘍細胞と密着結合を形成する必要があることが示された。このような細胞の集積は、エフェクターと標的細胞間の相互の膜脂質の交換に先行しオプソニン化抗体がない場合には起こらない[5]。齧作用は単球や樹状細胞でも起こる。免疫系以外では精子と卵母細胞の間で同様の膜断片の移動が記録されており、このプロセスは配偶子の融合に寄与すると考えられている[6]。
最近ではCNSに常駐するミクログリアなどのマクロファージが、出生後の発達過程で神経軸索の小さな部分を部分的に除去できることから、この用語が使われるようになった[7]。
齧作用の機序
[編集]齧作用は、提示細胞からリンパ球への細胞膜断片の移動を伴う。齧作用はT細胞やB細胞の抗原受容体、NK細胞のキラー抑制およびキラー活性化受容体、Fc受容体やクラスA変性LDL受容体を含むさまざまな受容体のシグナル伝達によって特異的に引き起こされる。齧作用は抗原提示細胞から分泌されるエクソソームのような小胞の捕獲を伴わないと考えられている。むしろ、免疫学的シナプスの形成や変形に必要な物理的な力によってT細胞が引き裂く細胞膜ナノチューブや細胞膜断片によって抗原提示細胞からリンパ球に分子が移動する可能性がある。
受け渡しに関与する2つの細胞のタイプに応じて、齧作用は一方向性または双方向性になる。齧作用によって移送されるタンパク質は多く、ほとんどの場合細胞膜に挿入された、あるいは細胞膜に密接に関連したタンパク質[注 5]を含んでいる。例えばヒトのリンパ球は、一般的なリンパ球の機能に不可欠なGタンパク質であり、ヒトの癌にも顕著に関与している核膜内タンパク質H-Rasを、走査した細胞から獲得することが最近示された[8]。H-Rasの獲得は細胞との接触に依存しており、細胞との結合体を形成する際に生じる。さらにNK細胞やTリンパ球が癌化したH-RasG12Vを獲得すると、導入されたリンパ球に重要な生物学的機能をもたらす。導入されたH-RasG12VはERKリン酸化を誘導し、インターフェロン-γと腫瘍壊死因子αの分泌を増加させ、リンパ球の増殖を促進し、NK細胞による標的細胞の殺傷を増大させた。
生理学的影響
[編集]齧作用は、2つの方法で生理学的な影響を及ぼす可能性がある。即ち「受領者」細胞が、通常は発現していない分子を獲得して利用する場合と、「贈与者」細胞が、細胞パートナーとの相互作用を変化させるような分子を剥奪される場合である。獲得した分子、例えば細胞外または細胞内の構成要素を持つ調節分子は、リンパ球の活性を変化させ、適切な損傷組織への移動など、いくつかのリンパ球の機能を司る場合がある。脂質は非常にエネルギーの高い成分であるので、このような細胞膜の断片は増殖能力にも貢献する可能性を持つ。齧作用は、非常に原始的な生物が他の細胞を食べるために最初に現れたのかもしれない。齧作用で確認された生物学的機能のほとんどは、リンパ球や樹状細胞で報告されている。これらの機能に関する主な発見は以下の通りである。
- 抗原ペプチド-MHC複合体を捕捉した細胞傷害性Tリンパ球(CTL)は、この抗原に特異的なCTLに殺される(「兄弟殺し」と呼ばれるプロセス)。
- 抗原ペプチド-MHC複合体を捕捉したヘルパーTリンパ球は、その不活性化につながる負のフィードバック制御に関与する[9]。
- 齧作用によってT細胞から抗原ペプチド-MHC複合体を剥ぎ取られた樹状細胞は、高親和性T細胞の応答の親和性成熟に貢献する[10]。
- T細胞による樹状細胞上の共刺激分子の下向き制御が、T細胞応答の制御に繋がる[11]。
- 齧作用による樹状細胞間の抗原の移動は、未感作T細胞を犠牲にして記憶T細胞の再活性化を促進する[12]。
- 齧作用による樹状細胞間の抗原移動は移植片拒絶に寄与する[13]。
齧作用の血清療法への応用
[編集]治療用抗体は、癌の治療に使用することができる。例えば、慢性リンパ性白血病の治療に用いられる治療用抗体であるリツキシマブは、腫瘍細胞が発現するCD20分子を認識し、腫瘍細胞を排除する効果がある[14]。しかし、この抗体を使いすぎると、単球が齧作用によってリツキシマブ-CD20複合体を腫瘍細胞の表面から取り除くことがある。この効果は、抗原変調による腫瘍細胞の逃避に繋がる。治療用抗体の投与量を減らすことで、齧作用の程度が抑えられ、治療効果が向上する可能性がある[15]。
エプラツズマブ(CD22 Mab)は、齧作用を利用して、CD22やその他のB細胞タンパク質をB細胞からエフェクター細胞へと転送する[16]。
免疫監視ツールとしての齧作用にもとづくアッセイ
[編集]TRAPアッセイ(TRogocytosis Analysis Protocol)では、抗原提示細胞の細胞膜から分子(この場合は蛍光プローブ)を引き抜く能力にもとづいて、特定の抗原を認識するT細胞およびB細胞を識別、特徴付け、純正化することができる[17]。このアッセイにはフローサイトメーターなどの機器が必要であるが、非常に安価で、簡単に実行でき、短時間(3時間以内に実行可能)で、あらゆるT細胞やB細胞の集団に適用可能である。TRAPアッセイは、ウイルス感染[18]、癌[19]、自己免疫疾患[20]、ワクチン[21]に対するT細胞応答の検出に成功している。
関連項目
[編集]齧作用のプロセスは、食作用や傍細胞貪食とは異なるが、類似していると考えられている。
脚注
[編集]注釈
[編集]出典
[編集]- ^ Joly, Etienne; Hudrisier, Denis (September 2003). “What is trogocytosis and what is its purpose?”. Nature Immunology 4 (9): 815. doi:10.1038/ni0903-815. PMID 12942076.
- ^ Huang, J.; Yang, Y; Sepulveda, H; Shi, W; Hwang, I; Peterson, PA; Jackson, MR; Sprent, J et al. (29 October 1999). “TCR-Mediated Internalization of Peptide-MHC Complexes Acquired by T Cells”. Science 286 (5441): 952–954. doi:10.1126/science.286.5441.952. PMID 10542149.
- ^ Patel, Dhaval M.; Arnold, Paula Y.; White, Gregory A.; Nardella, John P.; Mannie, Mark D. (15 November 1999). “Class II MHC/Peptide Complexes Are Released from APC and Are Acquired by T Cell Responders During Specific Antigen Recognition”. The Journal of Immunology 163 (10): 5201–5210. PMID 10553040.
- ^ Hudrisier, Denis; Riond, Joelle; Mazarguil, Honoré; Gairin, Jean Edouard; Joly, Etienne (15 March 2001). “Cutting Edge: CTLs Rapidly Capture Membrane Fragments from Target Cells in a TCR Signaling-Dependent Manner”. The Journal of Immunology 166 (6): 3645–3649. doi:10.4049/jimmunol.166.6.3645. PMID 11238601.
- ^ Horner, Heike; Frank, Carola; Dechant, Claudia; Repp, Roland; Glennie, Martin; Herrmann, Martin; Stockmeyer, Bernhard (1 July 2007). “Intimate Cell Conjugate Formation and Exchange of Membrane Lipids Precede Apoptosis Induction in Target Cells during Antibody-Dependent, Granulocyte-Mediated Cytotoxicity”. The Journal of Immunology 179 (1): 337–345. doi:10.4049/jimmunol.179.1.337. PMID 17579054.
- ^ Barraud‐Lange, Virginie; Naud‐Barriant, Nathalie; Bomsel, Morgane; Wolf, Jean‐Philippe; Ziyyat, Ahmed (15 June 2007). “Transfer of oocyte membrane fragments to fertilizing spermatozoa”. The FASEB Journal 21 (13): 3446–3449. doi:10.1096/fj.06-8035hyp. PMID 17575263.
- ^ Weinhard, Laetitia; di Bartolomei, Giulia; Bolasco, Giulia; Machado, Pedro; Schieber, Nicole L.; Neniskyte, Urte; Exiga, Melanie; Vadisiute, Auguste et al. (26 March 2018). “Microglia remodel synapses by presynaptic trogocytosis and spine head filopodia induction”. Nature Communications 9 (1): 1228. Bibcode: 2018NatCo...9.1228W. doi:10.1038/s41467-018-03566-5. PMC 5964317. PMID 29581545.
- ^ Rechavi, Oded; Goldstein, Itamar; Vernitsky, Helly; Rotblat, Barak; Kloog, Yoel; Kanellopoulos, Jean (21 November 2007). “Intercellular Transfer of Oncogenic H-Ras at the Immunological Synapse”. PLOS ONE 2 (11): e1204. Bibcode: 2007PLoSO...2.1204R. doi:10.1371/journal.pone.0001204. PMC 2065899. PMID 18030338.
- ^ Helft, Julie; Jacquet, Alexandra; Joncker, Nathalie T.; Grandjean, Isabelle; Dorothée, Guillaume; Kissenpfennig, Adrien; Malissen, Bernard; Matzinger, Polly et al. (15 August 2008). “Antigen-specific T-T interactions regulate CD4 T-cell expansion”. Blood 112 (4): 1249–1258. doi:10.1182/blood-2007-09-114389. PMC 2515122. PMID 18539897.
- ^ Kedl, Ross M.; Schaefer, Brian C.; Kappler, John W.; Marrack, Philippa (3 December 2001). “T cells down-modulate peptide-MHC complexes on APCs in vivo”. Nature Immunology 3 (1): 27–32. doi:10.1038/ni742. PMID 11731800.
- ^ Qureshi, Omar S.; Zheng, Yong; Nakamura, Kyoko; Attridge, Kesley; Manzotti, Claire; Schmidt, Emily M.; Baker, Jennifer; Jeffery, Louisa E. et al. (29 April 2011). “Trans-endocytosis of CD80 and CD86: a molecular basis for the cell extrinsic function of CTLA-4”. Science 332 (6029): 600–603. Bibcode: 2011Sci...332..600Q. doi:10.1126/science.1202947. PMC 3198051. PMID 21474713.
- ^ Wakim, Linda M.; Bevan, Michael J. (31 March 2011). “Cross-dressed dendritic cells drive memory CD8+ T-cell activation after viral infection”. Nature 471 (7340): 629–632. Bibcode: 2011Natur.471..629W. doi:10.1038/nature09863. PMC 3423191. PMID 21455179.
- ^ Herrera, Osquel Barroso; Golshayan, Dela; Tibbott, Rebecca; Ochoa, Francisco Salcido; James, Martha J.; Marelli-Berg, Federica M.; Lechler, Robert I. (15 October 2004). “A Novel Pathway of Alloantigen Presentation by Dendritic Cells”. The Journal of Immunology 173 (8): 4828–4837. doi:10.4049/jimmunol.173.8.4828. PMID 15470023.
- ^ Beum, Paul V.; Kennedy, Adam D.; Williams, Michael E.; Lindorfer, Margaret A.; Taylor, Ronald P. (15 February 2006). “The Shaving Reaction: Rituximab/CD20 Complexes Are Removed from Mantle Cell Lymphoma and Chronic Lymphocytic Leukemia Cells by THP-1 Monocytes”. The Journal of Immunology 176 (4): 2600–2609. doi:10.4049/jimmunol.176.4.2600. PMID 16456022.
- ^ Williams, Michael E.; Densmore, John J.; Pawluczkowycz, Andrew W.; Beum, Paul V.; Kennedy, Adam D.; Lindorfer, Margaret A.; Hamil, Susan H.; Eggleton, Jane C. et al. (15 November 2006). “Thrice-Weekly Low-Dose Rituximab Decreases CD20 Loss via Shaving and Promotes Enhanced Targeting in Chronic Lymphocytic Leukemia”. The Journal of Immunology 177 (10): 7435–7443. doi:10.4049/jimmunol.177.10.7435. PMID 17082663.
- ^ “Epratuzumab”. Immunomedics. 2021年11月27日閲覧。
- ^ Daubeuf, Sandrine; Puaux, Anne-Laure; Joly, Etienne; Hudrisier, Denis (29 December 2006). “A simple trogocytosis-based method to detect, quantify, characterize and purify antigen-specific live lymphocytes by flow cytometry, via their capture of membrane fragments from antigen-presenting cells”. Nature Protocols 1 (6): 2536–2542. doi:10.1038/nprot.2006.400. PMID 17406507.
- ^ Beadling, Carol; Slifka, Mark K (1 October 2006). “Quantifying viable virus-specific T cells without a priori knowledge of fine epitope specificity”. Nature Medicine 12 (10): 1208–1212. doi:10.1038/nm1413. PMID 17013384.
- ^ Machlenkin, Arthur; Uzana, Ronny; Frankenburg, Shoshana; Eisenberg, Galit; Eisenbach, Lea; Pitcovski, Jacob; Gorodetsky, Raphael; Nissan, Aviram et al. (15 March 2008). “Capture of Tumor Cell Membranes by Trogocytosis Facilitates Detection and Isolation of Tumor-Specific Functional CTLs”. Cancer Research 68 (6): 2006–2013. doi:10.1158/0008-5472.CAN-07-3119. PMID 18339883.
- ^ Bahbouhi, Bouchaib; Pettré, Ségolène; Berthelot, Laureline; Garcia, Alexandra; Elong Ngono, Annie; Degauque, Nicolas; Michel, Laure; Wiertlewski, Sandrine et al. (June 2010). “T cell recognition of self-antigen presenting cells by protein transfer assay reveals a high frequency of anti-myelin T cells in multiple sclerosis”. Brain 133 (6): 1622–1636. doi:10.1093/brain/awq074. PMID 20435630.
- ^ Daubeuf, Sandrine; Préville, Xavier; Momot, Marie; Misseri, Yolande; Joly, Etienne; Hudrisier, Denis (September 2009). “Improving administration regimens of CyaA-based vaccines using TRAP assays to detect antigen-specific CD8+ T cells directly ex vivo”. Vaccine 27 (41): 5565–5573. doi:10.1016/j.vaccine.2009.07.035. PMID 19647811.
