赤血球形成
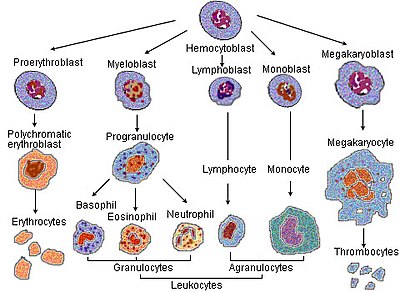
赤血球形成(せっけっきゅうけいせい、英語:erythropoiesis [注釈 1]、エリスロポエシス)は、赤血球(英: Red blood cell, or erythrocyte)を作り出す過程であり、血球芽細胞(多能性造血幹細胞とも)から成熟した赤血球へと成長する過程である[2]。
循環血液中の酸素が減少すると、腎臓が感知して刺激を受けエリスロポエチンというホルモンを分泌する[3]。このホルモンは、赤血球前駆細胞の増殖と分化を刺激し、造血組織における赤血球形成の亢進を活性化し、最終的に赤血球(erythrocytes、エリスロサイト)を形成する[3]。出生後の鳥類や哺乳類(ヒトを含む)では、通常これは、赤色骨髄(赤色髄とも)内で起こる[3]。初期の胎児では、赤血球形成は卵黄嚢の中胚葉細胞で行われる。3カ月目~4ヶ月目までに、赤血球形成は肝臓に移動する[4]。7ヶ月後には骨髄で赤血球形成が行われる。身体活動が活発になると赤血球形成が活発になる[5]。しかし、特定の疾患を持つヒトや一部の動物では、骨髄以外の脾臓や肝臓でも赤血球形成が起こる。これは髄外造血と呼ばれる。
ヒトは5歳頃までは、基本的にすべての骨の骨髄で赤血球を生成する。脛骨と大腿骨は、25歳頃までに重要な造血部位ではなくなる。椎骨、胸骨、骨盤と肋骨、および頭蓋骨は、生涯を通じて赤血球を生産し続ける。20歳までは、すべての骨(長骨とすべての扁平骨)の赤色骨髄から赤血球が作られる。20歳を過ぎると、赤血球は、椎骨、胸骨、肋骨、肩甲骨、腸骨などの膜性骨から生成される。20歳を過ぎると、長骨の骨幹は脂肪の沈着により黄色骨髄(黄色髄とも)となり赤血球形成の機能を失う。
赤血球の分化
[編集]赤血球が成熟する過程で、細胞は一連の「分化(differentiations)」を経る。次のような成熟段階はすべて骨髄内で起こる。
- 多能性造血幹細胞である血球芽細胞は、
- 骨髄系(共通)前駆細胞または多能性幹細胞となり、さらに
- 単能性幹細胞、そして
- 前正赤芽球(一般的には前赤芽球または原始赤芽球とも呼ばれる)になる。
- これは好塩基性または初期の正染性赤芽球(一般的には赤芽球とも呼ばれる)となり、次に
- 多染性または中期の正染性赤芽球、そして
- 正染性または後期の正染性赤芽球となる。この段階で細胞から核が排出され
- 網赤血球となる。
最終段階の後、この細胞は骨髄から放出されるため、新しく循環する赤血球には約1%の網赤血球が含まれる。1~2日後、これらは最終的にエリスロサイト、すなわち成熟した赤血球になる。
これらの段階は、細胞をライト染色で染色して光学顕微鏡で観察したときの特定の外観に対応し、さらにその他の生化学的な変化に対応している。
成熟の過程で、好塩基性前正赤芽球は、大きな核と900 fL(フェムトリットル)の体積の細胞から、95 fLの体積の除核された円盤状へ変化する。網赤血球の段階までに、細胞はその核を排出しているが、まだヘモグロビンを産生する能力をもっている。
赤血球の成熟には、ビタミンB12(コバラミン)とビタミンB9(葉酸)が不可欠である。どちらかが欠如すると、赤血球形成の過程で成熟不全が起こり、臨床的には網赤血球が異常に少ない状態である網状赤血球減少症として現れる。
赤血球形成期の赤血球に見られる特徴
[編集]それらの細胞が成熟するにつれて、多くの特徴も変化する。赤血球前駆細胞の全体的なサイズが縮小し、細胞質と核の比率(C:N)が増加する。核の直径が縮小してクロマチンが凝縮し、染色反応が赤紫色から濃青色へと進行する正染性赤芽球の最終核段階は、核が排出される前の状態である。細胞質の色は、前赤芽球や好塩基性赤芽球の段階では青色であるが、細胞が成長するにつれてヘモグロビンの発現が増加する結果、ピンクがかった赤色に変化する。最初は核は大きく、オープンクロマチンを含んでいる。しかし、赤血球が成熟するにつれて核の大きさは縮小し、最終的にはクロマチン物質の凝縮によって消滅する[6]。
赤血球形成の調節
[編集]エリスロポエチンが関与するフィードバックループは、赤血球形成の過程を調節するのに役立つ。そのため、非疾患状態では、赤血球の生成と赤血球の破壊が等しくなり、赤血球数は組織の酸素レベルを適切に維持するのに十分で、スラッジ、血栓症、または脳卒中を引き起こすほど高くはならない。エリスロポエチンは、低酸素レベルになると腎臓や肝臓で産生される。さらに、エリスロポエチンは循環する赤血球に結合しており、循環している赤血球数が少ないと結合していないエリスロポエチンが比較的高レベルになって、骨髄での産生を促進する。
また、最近の研究では、ペプチドホルモンであるヘプシジンがヘモグロビン産生の調節に関与し、赤血球形成に影響を与える可能性も示している。肝臓はヘプシジンを産生する。ヘプシジンは、消化管での鉄の吸収と細網内皮組織からの鉄の放出を制御する。鉄が赤血球のヘモグロビンのヘム基に組み込まれるためには、骨髄のマクロファージから鉄が放出される必要がある。細胞が形成中に従うコロニー形成単位がある。これらの細胞は、顆粒球・単球コロニー形成単位を含め、コミット細胞と呼ばれる。
ヘプシジンの分泌は、エリスロポエチンに反応して赤芽球から産生される別のホルモンであるエリスロフェロンによって抑制され、2014年に同定された[7][8]。これにより、エリスロポエチンによる赤血球形成と、ヘモグロビン合成に必要な鉄の動員とを結びつけていると考えられる。
マウス細胞でエリスロポエチン受容体やJAK2の機能が失われると、赤血球形成に障害が生じるため、胚での赤血球の産生や成長が妨げられる。全身的なフィードバック抑制がない場合(たとえばサイトカインシグナル伝達タンパク質のサプレッサーの減少または欠如)、マウスモデルで示されているように巨人症が起こる可能性がある[9][10]。
ストレス赤血球形成
[編集]急性貧血では、定常的な赤血球形成に加えて、おそらく別の反応を刺激し、新しい赤血球が急速に形成される。これはラットで研究されており、BMP4依存性ストレス赤血球生成経路の活性化を通じて肝臓で起こる[11]。
参照項目
[編集]脚注
[編集]注釈
[編集]- ^ ギリシャ語で「赤」を意味する「erythro」と「作る」を意味する「poiesis」からなる
注釈
[編集]- ^ Le, Tao; Bhushan, Vikas; Vasan, Neil (2010). First Aid for the USMLE Step 1: 2010 20th Anniversary Edition. USA: The McGraw-Hill Companies, Inc.. pp. 123. ISBN 978-0-07-163340-6
- ^ Pelley, John W. (2007-01-01). “Amino Acid and Heme Metabolism”. Elsevier's Integrated Biochemistry. pp. 97–105. doi:10.1016/B978-0-323-03410-4.50018-3. ISBN 9780323034104. "Erythropoiesis
Heme synthesis is coordinated with globin synthesis during erythropoiesis and as such does not occur in the mature erythrocyte. Erythropoiesis is the development of mature red blood cells from erythropoietic stem cells. The first cell that is morphologically recognizable in the red cell pathway is the proerythroblast. In the basophilic erythroblast, the nucleus becomes somewhat smaller, exhibiting a coarser appearance, and the cytoplasm becomes more basophilic owing to the presence of ribosomes. As the cell begins to produce hemoglobin, the cytoplasm attracts both basic and eosin stains and is called a polychromatophilic erythroblast. As maturation continues, the orthochromatophilic erythroblast extrudes its nucleus and the cell enters the circulation as a reticulocyte. As reticulocytes lose their polyribosomes, they become mature red blood cells." - ^ a b c Sherwood, L, Klansman, H, Yancey, P: Animal Physiology, Brooks/Cole, Cengage Learning, 2005.
- ^ Palis J, Segel GB (June 1998). “Developmental biology of erythropoiesis”. Blood Rev. 12 (2): 106–14. doi:10.1016/S0268-960X(98)90022-4. PMID 9661799.
- ^ Le, Tao; Bhushan, Vikas; Vasan, Neil (2010). First Aid for the USMLE Step 1: 2010 20th Anniversary Edition. USA: The McGraw-Hill Companies, Inc.. pp. 124. ISBN 978-0-07-163340-6
- ^ Textbook of Physiology by Dr. A. K. Jain reprint 2006-2007 3rd edition.
- ^ Koury, M.J. (2015年1月13日). “Erythroferrone: A Missing Link in Iron Regulation”. The Hematologist. American Society of Hematology. 26 August 2015閲覧。
- ^ Kautz L, Jung G, Valore EV, Rivella S, Nemeth E, Ganz T (Jul 2014). “Identification of erythroferrone as an erythroid regulator of iron metabolism”. Nature Genetics 46 (7): 678–84. doi:10.1038/ng.2996. PMC 4104984. PMID 24880340.
- ^ Nicolas G, Bennoun M, Porteu A, Mativet S, Beaumont C, Grandchamp B, Sirito M, Sawadogo M, Kahn A, Vaulont S (April 2002). “Severe iron deficiency anemia in transgenic mice expressing liver hepcidin”. Proc. Natl. Acad. Sci. U.S.A. 99 (7): 4596–601. Bibcode: 2002PNAS...99.4596N. doi:10.1073/pnas.072632499. PMC 123693. PMID 11930010.
- ^ Michael Föller; Stephan M. Huber; Florian Lang (August 2008). “Erythrocyte programmed cell death.”. IUBMB Life 60 (10): 661–668. doi:10.1002/iub.106. PMID 18720418.[リンク切れ]
- ^ Paulson, Robert F.; Shi, Lei; Wu, Dai-Chen (May 2011). “Stress erythropoiesis: new signals and new stress progenitor cells”. Current Opinion in Hematology 18 (3): 139–145. doi:10.1097/MOH.0b013e32834521c8. ISSN 1065-6251. PMC 3099455. PMID 21372709.
