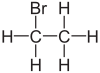
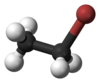
ブロモエタン
表示
(臭化エチルから転送)
| ブロモエタン | |
|---|---|
| |
|

|
| 識別情報 | |
| CAS登録番号 | 74-96-4 |
| PubChem | 6332 |
| ChemSpider | 6092 |
| UNII | LI8384T9PH |
| EC番号 | 200-825-8 |
| 国連/北米番号 | 1891 |
| KEGG | C19354 |
| MeSH | bromoethane |
| ChEBI | |
| ChEMBL | CHEMBL156378 |
| RTECS番号 | KH6475000 |
| バイルシュタイン | 1209224 |
| |
| 特性 | |
| 化学式 | C2H5Br |
| モル質量 | 108.97 g mol−1 |
| 外観 | 無色の液体 |
| 匂い | エーテルのような |
| 密度 | 1.46 g mL−1 |
| 融点 |
−120 ~ −116 °C |
| 沸点 |
38.0 ~ 38.8 °C |
| 水への溶解度 | 1.067 g/100 mL (0 °C) 0.914 g/100 mL (20 °C) 0.896 g/100 mL (30 °C) |
| 溶解度 | エタノール、ジエチルエーテル、クロロホルム、その他有機溶媒と混和 |
| log POW | 1.809 |
| 蒸気圧 | 51.97 kPa (at 20 °C) |
| kH | 1.3 μmol Pa−1 kg−1 |
| 磁化率 | -54.70·10−6 cm3/mol |
| 屈折率 (nD) | 1.4225 |
| 粘度 | 402 Pa.s (at 20 °C) |
| 熱化学 | |
| 標準生成熱 ΔfH |
−97.6–93.4 kJ mol−1 |
| 標準定圧モル比熱, Cp |
105.8 J K−1 mol−1 |
| 危険性 | |
| GHSピクトグラム |   
|
| GHSシグナルワード | DANGER |
| Hフレーズ | H225, H302, H332, H351 |
| Pフレーズ | P210, P281 |
| NFPA 704 | |
| 引火点 | −23 °C (−9 °F; 250 K) |
| 発火点 | 511 °C (952 °F; 784 K) |
| 爆発限界 | 6.75–11.25% |
| 許容曝露限界 | TWA 200 ppm (890 mg/m3)[2] |
| 最低致死濃度 LCLo | 3500 ppm (マウス) 24,000 ppm (モルモット, 30分) 7000 ppm (モルモット, >4.5時間)[3] |
| 半数致死量 LD50 | 1.35 g kg−1 (経口, ラット) |
| 半数致死濃度 LC50 | 26,980 ppm (ラット, 1時間) 16,230 ppm (マウス, 1時間) 4681 ppm (ラット) 2723 ppm (マウス)[3] |
| 関連する物質 | |
| 関連するアルカン | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ブロモエタンはハロゲン化炭化水素系の有機化合物である。臭化エチルとも呼ばれ、EtBrと略されることがある。
合成
[編集]炭化水素の臭素化として最も一般的な方法を用いて合成されている。通常では、エチレンに臭化水素を付加させる方法が取られることが多い。
- C
2H
4 + HBr → CH
3CH
2Br
安価な化合物であるため、研究室レベルで合成することはほとんどない。研究室レベルでは、三臭化リンや臭化チオニルをエタノールと反応させると得られる。エタノールと臭化水素を反応させても得られるが、副生成物としてジエチルエーテルも発生させてしまう。
利用
[編集]有機合成化学においては、ブロモエタンはC2H5+シントンとして用いられるが、実際にカチオンになっているわけではない。様々な反応に用いられ、例えばカルボン酸塩からのエチルエステル合成[4]や擬似カルバニオンによるエチル化[5]、チオ尿素のエチルイソチオウロニウム化[6]、アミン類のエチル化によるエチルアミン合成[7]などが知られている。
室温では液体であるが、非常に揮発性が高い。長年、強塩基として用いられてきたグリニャール試薬の調製などに使われてきた安価な試薬である。グリニャール試薬の調製例を以下に示す[8][9][10]。
- CH
3CH
2Br + Mg → CH
3CH
2MgBr - RC≡CH + CH
3CH
2MgBr → RC≡CMgBr + C
2H
6
このような利用法は、利便性などの点から有機リチウム化合物類が用いられるようになってきている。
安全性
[編集]一般的にハロゲン系炭化水素は健康に悪影響がある可能性があると考えられている。塩化物よりも臭化物の方がアルキル化剤としては優れていることもあり、暴露は最小限に留めるべきである。日本では毒物及び劇物取締法により劇物に指定されている[11]。
出典
[編集]- ^ “bromoethane - Compound Summary”. PubChem Compound. USA: National Center for Biotechnology Information (26 March 2005). 15 June 2012閲覧。
- ^ a b c NIOSH Pocket Guide to Chemical Hazards 0265
- ^ a b “Ethyl bromide”. 生活や健康に直接的な危険性がある. アメリカ国立労働安全衛生研究所(NIOSH). 2024年11月17日閲覧。
- ^ Petit, Y.; Larchevêque, M. Organic Syntheses, Coll. Vol. 10, p.401, 2004 (Vol. 75, p.37, 1998). (オンライン版)
- ^ Makosza, M.; Jonczyk, A. Organic Syntheses, Coll. Vol. 6, p.897, 1988 (Vol. 55, p.91, 1976). (オンライン版)
- ^ E. Brand, E.; Brand, F. C. Organic Syntheses, Coll. Vol. 3, p.440, 1955 (Vol. 22, p.59, 1942). (オンライン版)
- ^ Brasen, W. R; Hauser, C. R. Organic Syntheses, Coll. Vol. 4, p.582, 1963 (Vol. 34, p.58, 1954). (オンライン版)
- ^ Taniguchi, H.; Mathai, I. M.; Miller, S. I. Organic Syntheses, Coll. Vol. 6, p.925, 1988 (Vol. 50, p.97, 1970). (オンライン版)
- ^ A. J. Quillinan, A. J.; Scheinmann, F. Organic Syntheses, Coll. Vol. 6, p.595, 1988 (Vol. 58, p.1, 1978). (オンライン版)
- ^ Newman, M. S.; Stalick, W. M. Organic Syntheses, Coll. Vol. 6, p.564, 1988 (Vol. 57, p.65, 1977). (オンライン版)
- ^ 日本国 国立環境研究所 WebKis-Plus ブロモエタン

