凝固・線溶系
凝固系(血液凝固因子)とは出血を止めるために生体が血液を凝固させる一連の分子の作用系であり、そうして固まった血栓を溶かして分解するのが線溶系(線維素溶解系)である。多くの病態においてこの二つは密接に関係しているため、本稿では二つをまとめて述べる。
前駆的な止血の機序
[編集]血管因子
[編集]末梢の血管が収縮したり、周囲へ漏れた血液が血管を圧迫することで出血を止める。前者の反応には血小板から放出されるセロトニンやトロンボキサンA2が関わっている。またプロスタグランジンE2が局所の神経を敏感にして痛み信号を中枢神経系に送り、患部への注意を喚起する。中枢神経系は生体外の状況を勘案し、末梢の瑣末な損傷を放置してでもその状況から「闘争か逃走か」をすることが肝要と判断すればノルアドレナリンを分泌してさらに末梢血管を収縮させると同時に、エンドルフィンで痛み信号を遮断して外的状況を「闘争か逃走か」によって打開することを選ぶ。
血小板因子
[編集]- 傷害を受けた組織の細胞はフォン・ウィルブランド因子を分泌する。
- フォン・ウィルブランド因子は血小板表面に結合する。
- 損傷部位のコラーゲンとトロンビンが血小板を活性化し、ホスホリパーゼCが活性化される。
- ホスホリパーゼCはホスファチジルイノシトール二リン酸(PIP2)を分解してイノシトールトリスリン酸(IP3)とする、IP3はセカンドメッセンジャーとして小胞体からCa++の遊離を促す、
- 血小板は損傷部位に凝集する、またトロンボキサンA2、第V因子、アデノシン二リン酸(ADP)を放出し、周囲の血小板を活性化する。
血漿の凝固系
[編集]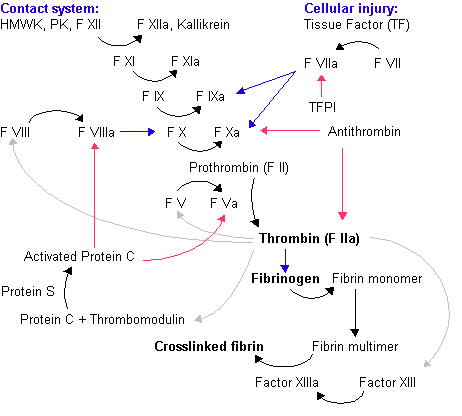
開始期
[編集]外因性経路
[編集]- 細胞が傷害を受けると、組織因子が第VIIa因子(第VII因子が活性化したもの)と結合する
- 第VIIa因子は第IX因子を活性化して第IXa因子とする。
- 第IXa因子は第X因子を活性化して第Xa因子とする。
内因性経路
[編集]- 血液が負に帯電した固体(例えば、岩石や砂)に触れると、プレカリクレインと高分子量キニノゲンが第XII因子を活性化し、第XIIa因子とする。
- 第XIIa因子は第XI因子を活性化して第XIa因子とする。
- 第XIa因子は第IX因子を活性化して第IXa因子とする。
増幅期
[編集]- トロンビンは第XI因子を活性化して第XIa因子とする。第XIa因子は第IX因子を活性化して第IXa因子とする。
- また、トロンビン自体も第V因子と第VIII因子を活性化させてそれぞれ第Va因子、第VIIIa因子とする。
- さらにトロンビンは血小板を活性化して、第XIa因子[要出典]、第Va因子、第VIIIa因子を血小板表面に結合させる。
伝播期
[編集]- 血小板表面に結合した第VIIIa因子と第IXa因子は第X因子を活性化して血小板表面に結合させる。
- 血小板表面に結合した第Xa因子と第Va因子はプロトロンビンを次々とトロンビンに変化させる。
- 大量のトロンビンが血漿中のフィブリノーゲンを分解してフィブリンモノマーにする。フィブリンモノマーは第XIII因子によって架橋されてフィブリンポリマーとなり、他の血球を巻き込んで血餅(血栓)となる。
各々の凝固因子
[編集]個々の凝固因子には通常の自然科学の慣例(発見者が名を付ける)ではなく発見順のローマ数字が使われている。これは、次々に新しい因子が発見され、しかも後になってそれは同じ因子の別の形態だと言うことが判明したためである。後者の理由により、いくつかの欠番がある。ただし、最初の4つはローマ数字による呼び方は余り使われない。
- フィブリノーゲン・フィブリン(第I因子)
- プロトロンビン・トロンビン(第II因子)
- 組織因子(第III因子、トロンボプラスチン)
- カルシウムイオン(第IV因子)
- 第V因子(プロアクセレリン):第1染色体長腕(1q23)にマップされたF5遺伝子によってコードされる分子量33000のタンパク質で、肝臓で発現し血流に放出される。第506残基がアルギニンからグルタミンへと変異した多型を(その多型が多いオランダの街の名前から)第V因子ライデン変異(Factor V Leiden)と言い、静脈血栓塞栓症の増加がみられる。黒人・黄色人種ではまれである。また、この遺伝子は常染色体劣性遺伝のため欠損症はまれである。
- 第VI因子は欠番である(第Va因子の旧名)。
- 第VII因子(プロコンペルチン)
- 第VIII因子:X染色体長腕末端(Xq28)にマップされたF8遺伝子[1]によりコードされる分子量約3万のタンパク質。血漿中では、フォン・ウィルブランド因子と複合体を形成して存在する。この欠損により血友病Aを罹患する。
- 第IX因子(クリスマス因子):X染色体長腕末端近く(第VIII因子に隣接するXq27領域)にマップされたF9遺伝子[2]によりコードされる分子量約55000〜60000の糖タンパク質。この欠損により血友病Bを罹患する。
- 上図のように、第VIII因子または第IX因子を介する反応以外はそれをバイパスする反応経路があるが、第VIII因子および第IX因子にはない。それゆえ血友病AおよびBは先天性の凝固障害でも特に重篤な物となる。またX染色体上にマップされており、染色体の末端にも近いことから、他の凝固障害に比べて罹患率が高く、新規に発生する突然変異も無視できない頻度で存在する。
- 第X因子(スチュアート・ブラウアー因子)第13染色体長腕末端近く(第VII因子に隣接する13q34領域)にマップされたF10遺伝子[3]によりコードされる分子量約35000の糖タンパク質で、主に肝でビタミンK依存的に合成され血流に放出される。
- 第XI因子(血漿トロンボプラスチン前駆物質)第4染色体長腕末端近く(4q35領域)にマップされたF11遺伝子[4]によりコードされる80kDaのタンパク質で,S-S結合した二量体を形成し、さらに高分子量キニノゲンと1:1で結合している。
- 第XII因子(ハーゲマン因子)
- 第XIII因子:フィブリンの安定化。
- プレカリクレイン
- 高分子キニノゲン(Fitzgerald因子)
検査所見
[編集]| 状態 | プロトロンビン時間 | 活性化部分トロンボプラスチン時間 | 出血時間 | 血小板数 |
|---|---|---|---|---|
| ビタミンK欠乏 or ワルファリン | 延長 | 変化なし または やや延長 | 変化なし | 変化なし |
| 播種性血管内凝固症候群 | 延長 | 延長 | 延長 | 減少 |
| ヴォン・ヴィレブランド病 | 変化なし | 延長 or 変化なし | 延長 | 変化なし |
| 血友病 | 変化なし | 延長 | 変化なし | 変化なし |
| アスピリン | 変化なし | 変化なし | 延長 | 変化なし |
| 血小板減少症 | 変化なし | 変化なし | 延長 | 減少 |
| 急性肝不全 | 延長 | 変化なし | 変化なし | 変化なし |
| 末期肝不全 | 延長 | 延長 | 延長 | 減少 |
| 尿毒症 | 変化なし | 変化なし | 延長 | 変化なし |
| 無フィブリノーゲン血症 | 延長 | 延長 | 延長 | 変化なし |
| 第V因子欠乏 | 延長 | 延長 | 変化なし | 変化なし |
| 第X因子欠乏 | 延長 | 延長 | 変化なし | 変化なし |
| 血小板無力症 | 変化なし | 変化なし | 延長 | 変化なし |
| ベルナール・スリエ症候群 | 変化なし | 変化なし | 延長 | 減少 または 変化なし |
| 第XII因子欠乏 | 変化なし | 延長 | 変化なし | 変化なし |
| 遺伝性血管浮腫 | 変化なし | 短縮 | 変化なし | 変化なし |
凝固阻止物質
[編集]- アンチトロンビンIII(AT3):分子量65000のタンパク質で、肝および血管内皮細胞で発現して血流中に放出される。第Xa因子やトロンビンの作用を阻害する。アロステリック部位へのヘパリンの結合により活性が1000倍にもなる。[1][2]
- ヘパリン:多糖類であり、アンチトロンビンIIIを活性化させる。また低分子量ヘパリンはフォン・ウィルブランド因子の活性をも低下させ、血小板との反応を抑制する。
- プロテインC:トロンビンにより分解され活性化プロテインC(Activated Protein C; APC)となり、補酵素であるプロテインSと結合する。活性型第V因子や活性型第VIII因子に結合し抑制する。
- プロテインS:活性型プロテインC(APC)の補酵素であり、APCと結合し抗凝固作用を示す。
- エチレンジアミン四酢酸(EDTA)・クエン酸は血漿中の遊離Ca++イオンをキレート化することでトロンビンの形成を阻止する。両者とも採血した血液の凝固を阻止するために使用される。クエン酸は体内成分でもあり、体内では速やかに代謝されて凝固活性が問題にならない濃度になるため、体外循環回路内や輸血用保存血液の凝固阻止にも使用される。一方、EDTAはヒトの体の成分ではなく、体内では代謝されず二価金属イオンをキレートしたまま尿中へ排泄されるため、抗凝固作用を利用した後人体へ戻されることはない。
- アスピリンはヒトの体の成分ではなく、シクロオキシゲナーゼを阻害し、血小板のアラキドン酸からプロスタグランジン、トロンボキサンA2の生合成を阻害することにより抗血小板作用を発揮する医薬品である。採血した血液に直接加えても、凝固を阻止しない。[3]
- ワルファリンはヒトの体の成分ではなく血栓形成を抑制する目的で使用される医薬品である。内服すると、肝で血液凝固因子が生合成される際にCa結合部位であるγ-カルボキシグルタミン酸の生成を阻害して血液凝固因子の機能を損なうことにより、血液凝固を阻害する。採血した血液に加えても凝固を阻止しない。[4]
- エドキサバンはヒトの体の成分ではなく血栓形成を抑制する目的で使用される医薬品である。内服すると、第Xa因子を競合的かつ選択的に阻害し、血液凝固を抑制する。[5]
線溶系
[編集]
凝固した血餅は生体にとっては異物であり、組織の修復とともに除去されねばならない。このために存在するのが線溶系である。
- 血漿中のプラスミノゲンが組織型プラスミノゲン活性化因子(t-PA)もしくはウロキナーゼ(u-PA)によって活性化され、プラスミンになる。
- プラスミンは凝固したフィブリンを分解し、D-ダイマーその他の分解産物に変化させる。
線溶阻止物質
[編集]- プラスミノゲン活性化阻止物質
- α1-アンチトリプシン:第14染色体長腕末端(14q32)にマップされたSERPINA1遺伝子によりコードされる分子量約51000の糖タンパク質で、活性化されたプラスミンの作用を阻害する。この欠損によりCOPD(慢性閉塞性肺疾患)を発病する確率が上がることが知られているが、機序は不明である。
- α2-アンチプラスミン:第17染色体短腕末端(17p13)にマップされたSERPINF1とSERPINF2遺伝子によりコードされる分子量59000の糖タンパクで、肝で合成され血流に放出される。血漿電気泳動ではα2グロブリンに属し、線溶阻止に果たす役割は上記のα1アンチトリプシンよりも大きい。
- トロンビン活性化性線溶阻止物質
線溶系の異常
[編集]そもそも侵襲を受けていない血管壁でも血栓の形成と線溶は絶えず繰り返されており、このバランスが崩れると様々な疾患を引き起こす。
多発外傷では組織因子が血液内に流入して凝固系を発動し、また敗血症によるエンドトキシンなどは炎症性メディエイターの誘導を介して血管内皮細胞の抗血小板作用を減弱させるため、身体各部で血栓が形成されて凝固因子が消費され、ついには凝固因子の枯渇に至る。同時に血栓による循環不全を解消すべく線溶系が亢進する結果、止血ができなくなる。これが播種性血管内凝固症候群(DIC)である。DICの治療にはヘパリンを用いるが、AT3が枯渇している場合は効果がないのでAT3も同時に投与する。また凝固因子と線溶系の因子の多く(第II、VII、IX、XI、XIII因子、プラスミン)はセリンプロテアーゼが進化した物であるから、セリンプロテアーゼ阻害薬であるメシル酸ナファモスタットやメシル酸ガベキサートを投与する。
参考文献
[編集]Ferguson JJ. et al. "Safe use of platelet GP IIb/IIIa inhibitors." Eur Heart J. 19 Suppl D:D40-51.;1998 Apr Entrez PubMed
