「自然リンパ球」の版間の差分
Smilesworth (会話 | 投稿記録) リンクの追加など |
m 解消済み仮リンクケモカイン受容体を内部リンクに置き換えます (今回のBot作業のうち20.8%が完了しました) |
||
| (9人の利用者による、間の34版が非表示) | |||
| 1行目: | 1行目: | ||
'''自然リンパ球'''('''Innate lymphoid cells''',''' '''ILC) とは共通のリンパ系前駆細胞(CLP)に由来する自然免疫系細胞である。病原性の組織損傷に反応してシグナル分子を分泌し、自然免疫細胞と獲得免疫細胞の両方を制御している。ILCは主に組織内に存在する細胞で、リンパ系組織(免疫関連組織)と非リンパ系組織の両方に存在し、まれに末梢血にも存在する。特に粘膜表面に多く局在し、粘膜の免疫と恒常性の維持に重要な役割を果たしている。リンパ球系に属する自然免疫細胞であるが、抗体特異的な応答はせず、B細胞、および[[T細胞受容体]]を持たない(RAG遺伝子がないため)<ref name=":0">{{Cite journal|last=Walker|first=Jennifer A.|last2=Barlow|first2=Jillian L.|last3=McKenzie|first3=Andrew N. J.|date=2013-02|title=Innate lymphoid cells — how did we miss them?|url=http://www.nature.com/articles/nri3349|journal=Nature Reviews Immunology|volume=13|issue=2|pages=75–87|language=en|doi=10.1038/nri3349|issn=1474-1733|PMID=23292121}}</ref>。通常のリンパ系の形態を持たず、通常の骨髄系細胞や樹状細胞に見られる表現型マーカーを持つ<ref>{{Cite journal|last=Spits|first=Hergen|last2=Cupedo|first2=Tom|date=2012-04-23|title=Innate Lymphoid Cells: Emerging Insights in Development, Lineage Relationships, and Function|url=https://www.annualreviews.org/doi/10.1146/annurev-immunol-020711-075053|journal=Annual Review of Immunology|volume=30|issue=1|pages=647–675|language=en|doi=10.1146/annurev-immunol-020711-075053|issn=0732-0582|PMID=22224763}}</ref>。 |
|||
{{翻訳中途|1=[https://en-two.iwiki.icu/w/index.php?title=Innate_lymphoid_cell&oldid=685250272 英語版 "Innate Lymphoid Cells" 19:36 11 Oct 2015]|date=2015年10月27日 (火) 08:20 (UTC)}} |
|||
ILCは、発生経路、表現型、産生されるシグナル分子の違いから、2013年には1、2、3の3つのグループに分けられていたが<ref>{{Cite journal|last=Spits|first=Hergen|last2=Artis|first2=David|last3=Colonna|first3=Marco|last4=Diefenbach|first4=Andreas|last5=Di Santo|first5=James P.|last6=Eberl|first6=Gerard|last7=Koyasu|first7=Shigeo|last8=Locksley|first8=Richard M.|last9=McKenzie|first9=Andrew N. J.|date=2013-02|title=Innate lymphoid cells — a proposal for uniform nomenclature|url=http://www.nature.com/articles/nri3365|journal=Nature Reviews Immunology|volume=13|issue=2|pages=145–149|language=en|doi=10.1038/nri3365|issn=1474-1733}} </ref>、さらなる調査の結果、[[ナチュラルキラー細胞|NK細胞]]、ILC1、ILC2、ILC3、LTi(Lymphoid tissue inducer、リンパ組織誘導細胞)細胞の5つのグループに分類されている。 |
|||
'''自然リンパ球 (Innate lymphoid cells, '''ILCs) とはリンパ球系に属する自然免疫細胞であるが、抗体特異的な応答はせず、B細胞、および[[T細胞受容体]]を持たない.<ref name=":0">Walker, Jennifer A.; Jillian L. Barlow; Andrew N. J. McKenzie (February 2013).</ref> この細胞群は様々な生理的機能を持っており、あるものはヘルパーT細胞類似である一方、細胞傷害性の[[ナチュラルキラー細胞]](NK細胞)も含む。従って、これらは免疫系において[[恒常性]]維持や[[炎症]]反応に重要な役割を持っており、異常な場合には[[アレルギー]]や[[自己免疫疾患]]のような免疫疾患を引き起こす<ref name=":0">Walker, Jennifer A.; Jillian L. Barlow; Andrew N. J. McKenzie (February 2013).</ref>。 |
|||
この細胞群はさまざまな生理的機能を持っており、組織の[[恒常性]]維持、形態形成、[[炎症]]反応、[[代謝]]、修復、再生など、複数の生理機能に関与している。ILCの役割の多くは[[T細胞]]と類似しており、ILCは獲得免疫系のT細胞と同等の役割を持つ自然免疫系細胞であると考えられる<ref name="PandaColonna2019">{{cite journal|year=2019|title=Innate Lymphoid Cells in Mucosal Immunity|journal=Frontiers in Immunology|volume=10|pages=861|doi=10.3389/fimmu.2019.00861|pmid=31134050|pmc=6515929|vauthors=Panda SK, Colonna M|doi-access=free}}</ref>。 ILCの調節不全は、[[アレルギー]]、[[気管支喘息]]、[[自己免疫疾患]]のような免疫疾患を引き起こす<ref name=":0" />。 |
|||
== 分類 == |
== 分類 == |
||
ILCの分化は、[[サイトカイン]]、[[Notchシグナリング|ノッチリガンド]]、[[概日リズム]]など、周囲の微小環境因子の存在によってスイッチが入る転写因子の存在に応じて開始される。成熟するとILCはサイトカインを放出する。ILCの分類はこれらに基づき、異なるILCサブタイプの発生と機能に関連する転写因子とサイトカインの種類の違いに着目している<ref name="KloseKiss2013">{{cite journal|date=February 2013|title=A T-bet gradient controls the fate and function of CCR6-RORγt+ innate lymphoid cells|journal=Nature|volume=494|issue=7436|pages=261–5|bibcode=2013Natur.494..261K|doi=10.1038/nature11813|pmid=23334414|vauthors=Klose CS, Kiss EA, Schwierzeck V, Ebert K, Hoyler T, d'Hargues Y, Göppert N, Croxford AL, Waisman A, Tanriver Y, Diefenbach A|s2cid=4390857|display-authors=6}}</ref>。これらのうち、NK細胞、NH細胞、LTi細胞はそれぞれ、獲得免疫系のTh1細胞、Th2細胞、Th17細胞に対応したサイトカインを放出する<ref>{{Cite journal|author=小安重夫、鈴木志乃/フォトンクリエイト|month=11|year=2013|title=新しい免疫細胞:ナチュラルヘルパー細胞とは|url=https://www.riken.jp/medialibrary/riken/pr/publications/news/2013/rn201311.pdf|journal=RIKEN NEWS|volume=389|page=4-7}}</ref>。 |
|||
自然リンパ球は産生する[[サイトカイン]]、およびその発生と機能を制御する[[転写因子]]により分類される。いずれの系列においても、新しく発見された細胞の分類には最終分化した細胞であるか、分化途中のものであるかを決定することが重要である<ref name="lanier73">Lanier, Lewis L. (25 January 2013).</ref> 。 |
|||
{| class="wikitable" style="text-align:left;" |
|||
|+ILCの分類 |
|||
! style="font-weight:bold;" |刺激因子 |
|||
! style="font-weight:bold;" |刺激シグナル |
|||
! style="font-weight:bold;" |細胞種 |
|||
! style="font-weight:bold;" |放出サイトカイン |
|||
! style="font-weight:bold;" |免疫学的機能 |
|||
|- |
|||
|[[腫瘍]] |
|||
細胞内微生物(ウイルス、細菌、寄生虫) |
|||
|[[インターロイキン-12|IL-12]] |
|||
{{仮リンク|インターロイキン-15|en|Interleukin 15|label=IL-15}}, |
|||
[[インターロイキン-1β|IL-1β]] |
|||
既存の自然リンパ球を3つのグループに分けることが提案されている<ref>Spits, H. et al. </ref>。 |
|||
|[[ファイル:Cell-1.png|代替文=Graphic of an ILC1/NK cell|サムネイル|50x50ピクセル]] |
|||
|[[インターフェロンγ|IFN-γ]] |
|||
[[グランザイム]], |
|||
[[パーフォリン]] |
|||
|1型免疫([[マクロファージ]]活性化、[[細胞毒性|細胞傷害性]]、[[酸素ラジカル]]) |
|||
|- |
|||
|大きな細胞外分子(寄生虫、アレルゲン) |
|||
|{{仮リンク|インターロイキン-25|en|Interleukin 25|label=IL-25}} |
|||
{{仮リンク|インターロイキン-33|en|Interleukin 33|label=IL-33}}, |
|||
{{仮リンク|胸腺間質性リンパ球新生因子|en|Thymic stromal lymphopoietin|label=TSLP}} |
|||
|[[ファイル:ILC_Cell_3.png|代替文=Graphic of an ILC2 cell|サムネイル|50x50ピクセル]] |
|||
|[[インターロイキン-4|IL-4]], [[インターロイキン-5|IL-5]], {{仮リンク|インターロイキン-9|en|Interleukin 9|label=IL-9}}, {{仮リンク|インターロイキン-13|en|Interleukin 13|label=IL-13}} |
|||
[[アンフィレグリン|AREG]] |
|||
|2型免疫([[粘液]]産生、マクロファージ活性化、[[細胞外マトリックス]]・組織修復、[[血管拡張薬|血管拡張]]、[[体温調節]]) |
|||
|- |
|||
|細胞外微生物(細菌、真菌) |
|||
|[[インターロイキン-1β|IL-1β]] |
|||
[[インターロイキン-23|IL-23]] |
|||
|[[ファイル:ILC_Cell_1.png|代替文=Graphic of an ILC3 cell|サムネイル|50x50ピクセル]] |
|||
|[[インターロイキン-22|IL-22]], [[インターロイキン-17|IL-17]] |
|||
[[GM-CSF]], |
|||
{{仮リンク|リンホトキシン|en|Lymphotoxin}} |
|||
|3型免疫([[食作用]]、[[抗微生物ペプチド|抗菌ペプチド]]、[[上皮細胞]]生存) |
|||
|- |
|||
|間葉系組織細胞([[レチノイン酸]]、{{仮リンク|CXCL13|en|CXCL13}}、{{仮リンク|RANKL|en|RANKL}}) |
|||
|[[インターロイキン-1β|IL-1β]] |
|||
[[インターロイキン-23|IL-23]], |
|||
[[インターロイキン-6|IL-6]] |
|||
|[[ファイル:ILC_Cell_4.png|代替文=Graphic of an LTi cell|サムネイル|50x50ピクセル]] |
|||
|{{仮リンク|RANK|en|RANK}}, [[TNF]], {{仮リンク|リンホトキシン|en|Lymphotoxin}} |
|||
[[インターロイキン-17|IL-17]], [[インターロイキン-22|IL-22]] |
|||
|[[二次リンパ組織]]形成 |
|||
|} |
|||
=== グループ1 === |
=== グループ1 === |
||
グループ1に属するILCは[[インターフェロン]] |
グループ1に属するILCは'''NK細胞'''([[ナチュラルキラー細胞]])および'''ILC1'''であり、[[インターフェロンγ]](IFN-γ)および[[腫瘍壊死因子]](TNF)に代表される1型サイトカイン群を産生する。NK細胞系統とILC1系統は、発生経路の早い段階で分岐し、転写因子への依存性、細胞毒性、常駐マーカーの発現などの違いによって区別される。 |
||
* '''ILC1'''は弱い細胞傷害性を持つ細胞で、ILC3に類似しており、それらから誘導されうる。 |
|||
NK細胞は、血流中を循環し、ウイルスに感染した細胞や腫瘍細胞を殺傷する[[細胞傷害性]]細胞である。ILC1は、細胞毒性を持たない、あるいは弱い細胞障害性を持つ組織内常在細胞で、ウイルスや特定の細菌の感染を防御する機能を持つ。 |
|||
ILC1とNK細胞には共通の特徴と非共通の特徴がある。どちらの細胞もIFN-γを主なサイトカインとして産生し、そのために転写因子{{仮リンク|Tボックス転写因子|en|TBX21|label=T-bet}}を必要とする<ref name="VivierArtis2018">{{cite journal|date=August 2018|title=Innate Lymphoid Cells: 10 Years On|journal=Cell|volume=174|issue=5|pages=1054–1066|doi=10.1016/j.cell.2018.07.017|pmid=30142344|vauthors=Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, Koyasu S, Locksley RM, McKenzie AN, Mebius RE, Powrie F, Spits H|display-authors=6|doi-access=free}}</ref>。またどちらも、感染や損傷後の組織でサイトカイン{{仮リンク|インターロイキン-15|en|Interleukin 15|label=IL-15}}や[[インターロイキン-12|IL-12]]が上昇した場合にもIFN-γを産生し、刺激を受けるとIFN-γと同時に[[TGF-β|TGFβ1]]を分泌する。これにより、腸の上皮や細胞外マトリックスのリモデリングが促進される<ref>{{Cite journal|last1=Jowett|first1=Geraldine M.|last2=Norman|first2=Michael D. A.|last3=Yu|first3=Tracy T. L.|last4=Rosell Arévalo|first4=Patricia|last5=Hoogland|first5=Dominique|last6=Lust|first6=Suzette T.|last7=Read|first7=Emily|last8=Hamrud|first8=Eva|last9=Walters|first9=Nick J.|date=2020-09-07|title=ILC1 drive intestinal epithelial and matrix remodelling|journal=Nature Materials|volume=20|issue=2|pages=250–259|language=en|doi=10.1038/s41563-020-0783-8|issn=1476-4660|pmid=32895507|pmc=7611574|last10=Niazi|first10=Umar|last11=Chung|first11=Matthew Wai Heng|s2cid=221521946}}</ref>。[[インターロイキン-18|IL-18]]の共刺激でもIFN-γレベルが有意に上昇する<ref name="DaussyFaure2014">{{cite journal|date=March 2014|title=T-bet and Eomes instruct the development of two distinct natural killer cell lineages in the liver and in the bone marrow|journal=The Journal of Experimental Medicine|volume=211|issue=3|pages=563–77|doi=10.1084/jem.20131560|pmid=24516120|pmc=3949572|vauthors=Daussy C, Faure F, Mayol K, Viel S, Gasteiger G, Charrier E, Bienvenu J, Henry T, Debien E, Hasan UA, Marvel J, Yoh K, Takahashi S, Prinz I, de Bernard S, Buffat L, Walzer T|display-authors=6|doi-access=free}}</ref>。IFN-γの放出は、マクロファージやその他の単核[[食細胞]]を刺激し、細胞内感染を根絶するための抗菌作用を誘発する。また、両方の細胞タイプによって生成される[[酸素ラジカル]]も、感染症の根絶を助ける。ILC1とNK細胞は、その分子の発現に応じて、[[TNF-α]]を産生し、炎症反応にさらに貢献することもできる。 |
|||
NK細胞とILC1では、転写因子への依存性に違いがある。どちらの細胞タイプも発生にT-betを使用するが、NK細胞はT-betを欠損した宿主にも存在する一方、ILC1はT-betの存在に完全に依存していることが判っている<ref name="VivierArtis2018" />。逆に、NK細胞の発生は転写因子{{仮リンク|Tボックス脳タンパク質2|en|Eomesodermin|label=Eomes}}の存在に完全に依存しているが、ILC1はEomesの存在とは無関係に発生することができる<ref name="VivierArtis2018" />。つまり、Eomesは一般的にNK細胞のマーカーとして使用することができ、成熟したNK細胞はT-bet<sup>+</sup> Eomes<sup>+</sup>であり、ILC1はT-bet<sup>+</sup> Eomes<sup>-</sup>であることを示唆している<ref name="SimonettaPradier2016">{{cite journal|year=2016|title=T-bet and Eomesodermin in NK Cell Development, Maturation, and Function|journal=Frontiers in Immunology|volume=7|pages=241|doi=10.3389/fimmu.2016.00241|pmid=27379101|pmc=4913100|vauthors=Simonetta F, Pradier A, Roosnek E|doi-access=free}}</ref>。 |
|||
ILC1とNK細胞には共通の表現型マーカーが存在する。ILC1とNK細胞は、マウスの{{仮リンク|KLRB1|en|KLRB1|label=NK1.1}}、ヒトとマウスの{{仮リンク|NCR2|en|NCR2|label=NKp44}}や{{仮リンク|NCR1|en|NCR1|label=NKp46}}などのNK細胞受容体(NCR)などの表現型マーカーが共通している<ref name="LuciVieira2019">{{cite journal|year=2019|title=Natural Killer Cells and Type 1 Innate Lymphoid Cells Are New Actors in Non-alcoholic Fatty Liver Disease|journal=Frontiers in Immunology|volume=10|pages=1192|doi=10.3389/fimmu.2019.01192|pmid=31191550|pmc=6546848|vauthors=Luci C, Vieira E, Perchet T, Gual P, Golub R|doi-access=free}}</ref><ref name="VivierArtis2018" />。一方で、ヒトのILC1には{{仮リンク|インターロイキン-7受容体α|en|Interleukin-7 receptor-α|label=CD127}}が発現しているが、これは全てのNK細胞に存在する訳ではないなどの違いもある。さらに、ヒトのNK細胞のマーカーである{{仮リンク|KLRF1|uk|KLRF1|label=NKp80}}はILC1には発現していない。マウスでは、CD200RがNK細胞とILC1を区別することが示されている<ref name="WeizmanAdams20172">{{cite journal|date=November 2017|title=ILC1 Confer Early Host Protection at Initial Sites of Viral Infection|journal=Cell|volume=171|issue=4|pages=795–808.e12|doi=10.1016/j.cell.2017.09.052|pmid=29056343|pmc=5687850|vauthors=Weizman OE, Adams NM, Schuster IS, Krishna C, Pritykin Y, Lau C, Degli-Esposti MA, Leslie CS, Sun JC, O'Sullivan TE|display-authors=6|doi-access=free}}</ref>。特定の組織で、あるいは特定の感染症や炎症の後に、一部のNK/ILC1細胞にこれらの特徴的なマーカーが発現していないことから、ILC1とNK細胞の系統の関係はまだ曖昧である。これは組織特異的機能説を支持するものである<ref name="LuciVieira2019" />。例えば、CD127はILC1の大部分で発現しているが、NK細胞の基本的特徴であるEomesを発現する能力も持っている唾液腺常在ILC1からは欠失している<ref name="CortezFuchs2014">{{cite journal|date=May 2014|title=Cutting edge: Salivary gland NK cells develop independently of Nfil3 in steady-state|journal=Journal of Immunology|volume=192|issue=10|pages=4487–91|doi=10.4049/jimmunol.1303469|pmid=24740507|vauthors=Cortez VS, Fuchs A, Cella M, Gilfillan S, Colonna M|doi-access=free}}</ref>。 |
|||
[[グランザイム]]や[[パーフォリン]]を産生することから、NK細胞は獲得免疫系である[[細胞傷害性T細胞|細胞傷害性CD8<sup>+</sup>T細胞]]に対応する自然免疫系の機能であると考えられているが、ILC1は細胞傷害活性を伴わずIFN-γを単独で産生することから、[[ヘルパーT細胞]]に対応する自然免疫系機能と考えられている<ref name="Colonna2018">{{cite journal|date=June 2018|title=Innate Lymphoid Cells: Diversity, Plasticity, and Unique Functions in Immunity|journal=Immunity|volume=48|issue=6|pages=1104–1117|doi=10.1016/j.immuni.2018.05.013|pmid=29924976|pmc=6344351|vauthors=Colonna M|doi-access=free}}</ref>。 |
|||
=== グループ2 === |
=== グループ2 === |
||
'''ILC2'''には、[[ナチュラルヘルパー細胞]]<ref>{{Cite journal|last=Moro|first=Kazuyo|last2=Yamada|first2=Taketo|last3=Tanabe|first3=Masanobu|last4=Takeuchi|first4=Tsutomu|last5=Ikawa|first5=Tomokatsu|last6=Kawamoto|first6=Hiroshi|last7=Furusawa|first7=Jun-Ichi|last8=Ohtani|first8=Masashi|last9=Fujii|first9=Hideki|date=2010-01-28|title=Innate production of T(H)2 cytokines by adipose tissue-associated c-Kit(+)Sca-1(+) lymphoid cells|url=https://pubmed.ncbi.nlm.nih.gov/20023630/|journal=Nature|volume=463|issue=7280|pages=540–544|doi=10.1038/nature08636|issn=1476-4687|pmid=20023630}}</ref>(NH細胞)、nuocytes<ref>{{Cite journal|last=Neill|first=Daniel R.|last2=Wong|first2=See Heng|last3=Bellosi|first3=Agustin|last4=Flynn|first4=Robin J.|last5=Daly|first5=Maria|last6=Langford|first6=Theresa K. A.|last7=Bucks|first7=Christine|last8=Kane|first8=Colleen M.|last9=Fallon|first9=Padraic G.|date=2010-04|title=Nuocytes represent a new innate effector leukocyte that mediates type-2 immunity|url=http://www.nature.com/articles/nature08900|journal=Nature|volume=464|issue=7293|pages=1367–1370|language=en|doi=10.1038/nature08900|issn=0028-0836|pmid=20200518|pmc=2862165}}</ref>、自然2型ヘルパー細胞(Ih2細胞)<ref>{{Cite journal|last=Price|first=A. E.|last2=Liang|first2=H.-E.|last3=Sullivan|first3=B. M.|last4=Reinhardt|first4=R. L.|last5=Eisley|first5=C. J.|last6=Erle|first6=D. J.|last7=Locksley|first7=R. M.|date=2010-06-22|title=Systemically dispersed innate IL-13-expressing cells in type 2 immunity|url=http://www.pnas.org/cgi/doi/10.1073/pnas.1003988107|journal=Proceedings of the National Academy of Sciences|volume=107|issue=25|pages=11489–11494|language=en|doi=10.1073/pnas.1003988107|issn=0027-8424|pmid=20534524|pmc=2895098}}</ref>が含まれる。{{仮リンク|インターロイキン-25|en|Interleukin 25|label=IL-25}}、{{仮リンク|胸腺間質性リンパ球新生因子|en|Thymic stromal lymphopoietin|label=TSLP}}、{{仮リンク|インターロイキン-33|en|Interleukin 33|label=IL-33}}に反応して、グループ2に属する[[IL-4]]、[[IL-5]]、{{仮リンク|インターロイキン-9|en|Interleukin 9|label=IL-9}}、{{仮リンク|インターロイキン-13|en|Interleukin 13|label=IL-13}}、[[アンフィレグリン]]のような2型サイトカイン群を産生する<ref name="VivierArtis20182">{{cite journal|date=August 2018|title=Innate Lymphoid Cells: 10 Years On|journal=Cell|volume=174|issue=5|pages=1054–1066|doi=10.1016/j.cell.2018.07.017|pmid=30142344|vauthors=Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, Koyasu S, Locksley RM, McKenzie AN, Mebius RE, Powrie F, Spits H|display-authors=6|doi-access=free}}</ref><ref name="VivierArtis20183">{{cite journal|date=August 2018|title=Innate Lymphoid Cells: 10 Years On|journal=Cell|volume=174|issue=5|pages=1054–1066|doi=10.1016/j.cell.2018.07.017|pmid=30142344|vauthors=Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, Koyasu S, Locksley RM, McKenzie AN, Mebius RE, Powrie F, Spits H|display-authors=6|doi-access=free}}</ref>。 |
|||
グループ2に属する[[IL-4]]、[[IL-5]]、IL-9、IL-13のような2型サイトカイン群を産生する。 |
|||
ILC2は、組織に常駐し、[[寄生虫]]に対する2型サイトカイン応答に決定的な役割を果たす。また、[[アレルギー性疾患|アレルギー性]]の[[喘息|肺炎症]]への関与が示唆されている。ILC2は、皮膚<ref>{{cite journal|date=January 2013|title=TSLP elicits IL-33-independent innate lymphoid cell responses to promote skin inflammation|journal=Science Translational Medicine|volume=5|issue=170|pages=170ra16|doi=10.1126/scitranslmed.3005374|pmid=23363980|pmc=3637661|vauthors=Kim BS, Siracusa MC, Saenz SA, Noti M, Monticelli LA, Sonnenberg GF, Hepworth MR, Van Voorhees AS, Comeau MR, Artis D|display-authors=6}}</ref><ref>{{cite journal|date=June 2013|title=Cutaneous immunosurveillance and regulation of inflammation by group 2 innate lymphoid cells|journal=Nature Immunology|volume=14|issue=6|pages=564–73|doi=10.1038/ni.2584|pmid=23603794|pmc=4282745|vauthors=Roediger B, Kyle R, Yip KH, Sumaria N, Guy TV, Kim BS, Mitchell AJ, Tay SS, Jain R, Forbes-Blom E, Chen X, Tong PL, Bolton HA, Artis D, Paul WE, Fazekas de St Groth B, Grimbaldeston MA, Le Gros G, Weninger W|display-authors=6}}</ref>、肺、肝臓、腸などの組織に多く存在する<ref name="VivierArtis20182" /><ref>{{cite journal|date=April 2010|title=Nuocytes represent a new innate effector leukocyte that mediates type-2 immunity|journal=Nature|volume=464|issue=7293|pages=1367–70|bibcode=2010Natur.464.1367N|doi=10.1038/nature08900|pmid=20200518|pmc=2862165|vauthors=Neill DR, Wong SH, Bellosi A, Flynn RJ, Daly M, Langford TK, Bucks C, Kane CM, Fallon PG, Pannell R, Jolin HE, McKenzie AN|display-authors=6}}</ref>。ILC2は特徴的な[[表面マーカー]]および[[ケモカイン受容体]]を発現しており、リンパ球の特定臓器への分配に関わる。ヒトでは、ILC2は[[DP2受容体|CRTH2]]、{{仮リンク|KLRG1|en|KLRG1}}、{{仮リンク|ソマトスタチン受容体2|en|Somatostatin receptor 2|label=SST2}}、{{仮リンク|KLRB1|en|KLRB1|label=CD161}}、{{仮リンク|IL2RA|en|IL2RA|label=CD25}}を発現している<ref name="PandaColonna20192">{{cite journal|year=2019|title=Innate Lymphoid Cells in Mucosal Immunity|journal=Frontiers in Immunology|volume=10|pages=861|doi=10.3389/fimmu.2019.00861|pmid=31134050|pmc=6515929|vauthors=Panda SK, Colonna M|doi-access=free}}</ref>。マウスでは、ILC2は[[CD44]]を発現しているが、CD161は発現していない<ref name="PandaColonna20192" />。ILC2の発生時、[[転写因子]]({{仮リンク|RORα|en|RAR-related orphan receptor alpha}}、および{{仮リンク|GATA3|en|GATA3}}) の活性化に[[インターロイキン-7|IL-7]]が必要である。GATA3はILC2の発生と機能維持に必要とされる。ILC2は肺におけるTh2抗原への応答に必須であるが、全身性のTh2抗原応答には必要ではない<ref>Gold, Matthew J; Antignano, Frann; et al.</ref>。 |
|||
'''ILC2''' (ナチュラルヘルパー細胞、nuocytes, 自然2型ヘルパー細胞などとも呼ばれる<ref>Neill, Daniel R; See Heng Wong, Agustin Bellosi, Robin J Flynn, Maria Daly, Theresa K A Langford, Christine Bucks, Colleen M Kane, Padraic G Fallon, Richard Pannell, Helen E Jolin, Andrew N J McKenzie (2010-04-29).</ref> ) は[[寄生虫]]に対する2型サイトカイン応答に決定的な役割を示す。また、アレルギー性の肺炎症への関与が示唆されている。ILC2は特徴的な表面マーカーおよびケモカイン受容体を持っており、リンパ球の特定臓器への分配に関わる。発生時、これらの細胞に必要である転写因子(RORα、およびGATA3) の活性化に IL-7 が必要である。ILC2は肺におけるTh2抗原への応答に必須であるが、全身性のTh2抗原応答には必要ではない<ref>Gold, Matthew J; Antignano, Frann; et al.</ref>。 |
|||
ILC2は、IL-33やIL-25に対する反応性に応じて、自然型ILC2(nILC2)と炎症型ILC2(iILC2)という亜集団に分類される<ref name="PandaColonna2019" />。nILC2は、自然な免疫状態の組織でIL-33に反応するもので、iILC2はIL-25や寄生虫に反応するものである<ref name="PandaColonna2019" />。nILC2は、{{仮リンク|CD90|en|CD90|label=Thy1}}と{{仮リンク|IL1RL1|en|IL1RL1|label=ST2}}を高発現し、{{仮リンク|KLRG1|en|KLRG1}}は低発現である<ref name="PandaColonna2019" />。iILC2は、KLRG1を多く発現し、Thy1とST2は少ない<ref name="PandaColonna2019" />。これらの亜集団に加えて、ILC210細胞と呼ばれる別の集団は、[[インターロイキン-10|IL-10]]を産生する能力を特徴としている<ref name="PandaColonna2019" />。 |
|||
=== グループ3 === |
=== グループ3 === |
||
グループ3に属する |
グループ3に属する'''ILC3'''は[[インターロイキン-17|IL-17]]Aまたは[[IL-22]]を産生する能力により特徴付けられる。ILC3はNK細胞マーカーを発現しているにもかかわらず、NK細胞とは大きく異なり、転写因子{{仮リンク|RORγ|en|RAR-related orphan receptor gamma|label=RORγt}}を必要とし、細胞傷害性因子を分泌せず、IFN-γやTNFを産生しない。 |
||
* '''ILC3 '''はIL-22を産生し、NKp46 (an NK cell activating receptor) を発現するリンパ球集団である。にも関わらず、ILC3はNK細胞と異なり、転写因子RORγを必要とし、細胞傷害性因子を持たず (perforin, granzymes and death receptors)、IFNγおよびTNFを産生しない。主として粘膜組織に見られ、特に[[消化器]]に見られる。 |
|||
ILC3は細胞外の細菌や真菌に対する自然免疫反応に関与している。ILC3は、[[腸内細菌]]の恒常性と[[Th17細胞]]の応答の制御に重要な役割を果たしている<ref name="MjösbergBernink2012">{{cite journal|date=October 2012|title=The transcription factor GATA3 is essential for the function of human type 2 innate lymphoid cells|journal=Immunity|volume=37|issue=4|pages=649–59|doi=10.1016/j.immuni.2012.08.015|pmid=23063330|vauthors=Mjösberg J, Bernink J, Golebski K, Karrich JJ, Peters CP, Blom B, te Velde AA, Fokkens WJ, van Drunen CM, Spits H|display-authors=6|doi-access=free}}</ref>。ヒト成人のILC3は、主に腸の[[粘膜固有層]]と扁桃腺に存在する他、[[脾臓]]、[[子宮内膜]]、{{仮リンク|脱落膜|en|Decidua}}、[[皮膚]]にも存在する<ref name="JuelkeRomagnani2016">{{cite journal|date=February 2016|title=Differentiation of human innate lymphoid cells (ILCs)|journal=Current Opinion in Immunology|volume=38|pages=75–85|doi=10.1016/j.coi.2015.11.005|pmid=26707651|vauthors=Juelke K, Romagnani C}}</ref>。 |
|||
* '''リンパ組織誘導細胞 (LTi細胞)'''は[[リンパ系]]の発生に必要な分子群を発現するILCの一群である。これらは、胚発生中のリンパ系の発生に必須であり、出産後もリンパ系の構造維持に必要である。さらに、T細胞の免疫記憶の維持にも関わっている<ref>Withers, David R; Fabrina M Gaspal, Emma C Mackley, Clare L Marriott, Ewan A Ross, Guillaume E Desanti, Natalie A Roberts, Andrea J White, Adriana Flores-Langarica, Fiona M McConnell, Graham Anderson, Peter J L Lane (2012-09-01).</ref>。 |
|||
ILC3は、その発生と機能が転写因子RORγtに依存しており<ref name="BuonocoreAhern2010">{{cite journal|date=April 2010|title=Innate lymphoid cells drive interleukin-23-dependent innate intestinal pathology|journal=Nature|volume=464|issue=7293|pages=1371–5|bibcode=2010Natur.464.1371B|doi=10.1038/nature08949|pmid=20393462|pmc=3796764|vauthors=Buonocore S, Ahern PP, Uhlig HH, Ivanov II, Littman DR, Maloy KJ, Powrie F}}</ref>、[[インターロイキン-1β|IL-1β]]やIL-23などの病原性シグナルに応答してRORγtを発現する<ref name="GaffenJain2014">{{cite journal|date=September 2014|title=The IL-23-IL-17 immune axis: from mechanisms to therapeutic testing|journal=Nature Reviews. Immunology|volume=14|issue=9|pages=585–600|doi=10.1038/nri3707|pmid=25145755|pmc=4281037|vauthors=Gaffen SL, Jain R, Garg AV, Cua DJ}}</ref>。 IL-22はILC3が産生する主要なサイトカインであり、腸の恒常性維持に基本的な役割を果たしている。さらにILC3は、環境刺激に応じて、IL-17、IL-22、IFN-γ、[[GM-CSF]]など、他のさまざまなサイトカインを産生する<ref name="PantaziPowell2019">{{cite journal|year=2019|title=Group 3 ILCs: Peacekeepers or Troublemakers? What's Your Gut Telling You?!|journal=Frontiers in Immunology|volume=10|pages=676|doi=10.3389/fimmu.2019.00676|pmid=31024537|pmc=6460375|vauthors=Pantazi E, Powell N|doi-access=free}}</ref>。 |
|||
ILC3にはNCR<sup>-</sup>とNCR<sup>+</sup>の2つのサブセットがある。マウスのILC3のNCR<ref group="注" name="a">Natural Cytotoxicity triggering Receptor</ref>はNKp46であるのに対し、ヒトのILC3のNCRはNKp44である<ref name="PantaziPowell2019" />。 NKp44<sup>+</sup> ILC3はIL-22の独占的供給源として扁桃腺や腸に非常に多く存在する<ref name="PantaziPowell2019" />。ILC3の中には、NKp30やCD56などの他のNK細胞マーカーを発現するものもある<ref name="CupedoCrellin2008">{{cite journal|date=January 2009|title=Human fetal lymphoid tissue-inducer cells are interleukin 17-producing precursors to RORC+ CD127+ natural killer-like cells|journal=Nature Immunology|volume=10|issue=1|pages=66–74|doi=10.1038/ni.1668|pmid=19029905|vauthors=Cupedo T, Crellin NK, Papazian N, Rombouts EJ, Weijer K, Grogan JL, Fibbe WE, Cornelissen JJ, Spits H|s2cid=22864899|display-authors=6}}</ref>。NCR<sup>-</sup> ILC3は主にIL-17AとIL-17Fを産生し、特定の状況下ではIL-22も産生する<ref name="TakatoriKanno2009">{{cite journal|date=January 2009|title=Lymphoid tissue inducer-like cells are an innate source of IL-17 and IL-22|journal=The Journal of Experimental Medicine|volume=206|issue=1|pages=35–41|doi=10.1084/jem.20072713|pmid=19114665|pmc=2626689|vauthors=Takatori H, Kanno Y, Watford WT, Tato CM, Weiss G, Ivanov II, Littman DR, O'Shea JJ|display-authors=6|doi-access=free}}</ref>。NCR<sup>-</sup> ILC3はT-betの発現量が増加するとNCR<sup>+</sup>に分化できる<ref name="KloseKiss20132">{{cite journal|date=February 2013|title=A T-bet gradient controls the fate and function of CCR6-RORγt+ innate lymphoid cells|journal=Nature|volume=494|issue=7436|pages=261–5|bibcode=2013Natur.494..261K|doi=10.1038/nature11813|pmid=23334414|vauthors=Klose CS, Kiss EA, Schwierzeck V, Ebert K, Hoyler T, d'Hargues Y, Göppert N, Croxford AL, Waisman A, Tanriver Y, Diefenbach A|s2cid=4390857|display-authors=6}}</ref>。 |
|||
=== リンパ組織誘導細胞 === |
|||
'''リンパ組織誘導細胞'''('''LTi細胞''')は[[リンパ系]]の発生に必要な分子群を発現するILCの一群である。これらは、胚発生中のリンパ系の発生に必須であり、出生後もリンパ系の構造維持に必要である。さらに、T細胞の免疫記憶の維持にも関わっている<ref>Withers, David R; Fabrina M Gaspal, Emma C Mackley, Clare L Marriott, Ewan A Ross, Guillaume E Desanti, Natalie A Roberts, Andrea J White, Adriana Flores-Langarica, Fiona M McConnell, Graham Anderson, Peter J L Lane (2012-09-01).</ref>。 |
|||
LTi細胞は、そのユニークな発生経路から別の系統と考えられているが、多くの類似した特徴を持つことから、ILC3グループの一部と考えられることが多い。ILC3と同様に、LTi細胞はRORγtに依存している。LTi細胞は、[[腫瘍壊死因子|TNFファミリー]]の一員である{{仮リンク|リンホトキシン|en|Lymphotoxin}}の作用により、リンパ組織の発達を促進し、二次[[リンパ節]]や[[パイエル板]]の形成に関与している<ref name="VivierArtis2018" />。LTi細胞は、胚期と成体期の両方における免疫系の発達で重要な役割を果たしており、そのためLTi細胞は胚期の早い段階で臓器や組織に存在している<ref name="VivierArtis2018" />。LTi細胞は、一次リンパ組織と二次リンパ組織の組織化、および成体のリンパ組織において、獲得免疫反応を制御し、二次リンパ組織の構造を維持するという極めて重要な役割を担っている<ref name="Mebius 493–504">{{cite journal|date=October 1997|title=Developing lymph nodes collect CD4+CD3- LTbeta+ cells that can differentiate to APC, NK cells, and follicular cells but not T or B cells|journal=Immunity|volume=7|issue=4|pages=493–504|doi=10.1016/S1074-7613(00)80371-4|pmid=9354470|vauthors=Mebius RE, Rennert P, Weissman IL|doi-access=free}}</ref>。 |
|||
その産生は、[[レチノイン酸]]、{{仮リンク|CXCL13|en|CXCL13}}、{{仮リンク|RANKL|en|RANKL}}、サイトカイン[[インターロイキン-1β|IL-1β]]、[[インターロイキン-23|IL-23]]、[[インターロイキン-6|IL-6]]によって刺激される<ref name="Strober2010">{{cite journal|date=November 2010|title=The LTi cell, an immunologic chameleon|journal=Immunity|volume=33|issue=5|pages=650–2|doi=10.1016/j.immuni.2010.11.016|pmid=21094460|pmc=3426921|vauthors=Strober W}}</ref>。[[c-Kit]]、{{仮リンク|ケモカイン受容体6|en|C-C chemokine receptor type 6|label=CCR6}}、{{仮リンク|IL2RA|en|IL2RA|label=CD25}}、{{仮リンク|インターロイキン-7受容体α|en|Interleukin-7 receptor-α|label=CD127}}、{{仮リンク|CD90|en|CD90}}を発現するが、NCRは発現しない<ref name="VivierArtis2018" />。{{仮リンク|OX40リガンド|en|OX40 ligand|label=OX40L}}の発現は、成体マウスおよびヒトにおけるLTi細胞のもう一つの優れたマーカーである<ref name="Withers2011">{{cite journal|date=May 2011|title=Lymphoid tissue inducer cells|journal=Current Biology|volume=21|issue=10|pages=R381-2|doi=10.1016/j.cub.2011.03.022|pmid=21601793|vauthors=Withers DR|doi-access=free}}</ref>。LTi細胞は、CD4<sup>+</sup>/<sup>-</sup>のいずれかになる。ILC3と同様に、LTi細胞は、活性化されるとほとんどが、[[インターロイキン-17|IL-17]]A、IL-17F、[[インターロイキン-22|IL-22]]を産生する<ref name="TakatoriKanno2009" />。これは、{{仮リンク|RANK|en|RANK}}、[[腫瘍壊死因子|TNF]]、IL-17、IL-22によって媒介される。 |
|||
LTi細胞は、胚の胸腺上皮細胞の発達を促すことで、リンホトキシン[[:en:Integrin alpha 4|α4]][[:en:Integrin beta 7|β7]]とRANKLのシグナルを介して{{仮リンク|自己免疫調節遺伝子|en|Autoimmune regulator}}(''AIRE'' )の発現を誘導する<ref name="Withers2011" />。 LTi細胞はまた、新しく形成されたリンパ節内で、CD4<sup>+</sup>T細胞にシグナルを送るTNFファミリーのOX40Lと{{仮リンク|CD153|en|CD153|label=CD30L}}を介して[[メモリーT細胞|記憶CD4<sup>+</sup>T細胞]]の生存を可能にし、したがって記憶免疫応答を可能にする<ref name="Withers2011" />。この役割は、自己免疫を予防したり、ワクチン接種後の記憶反応を高めたりするために利用できる<ref name="Withers2011" />。 |
|||
==発生== |
==発生== |
||
{{See also|細胞性免疫#細胞の発達}} |
|||
リンパ球性共通前駆細胞 (CLP) は与えられるシグナルに応じて[[T細胞]]、[[B細胞]]、そしてILCを含む様々な細胞に分化することが出来る。NK細胞を除き、すべてのILCは生存のためにIL-7シグナルが必要である。[[リプレッサー]]ID2はB細胞、およびT細胞分化に拮抗し、ID2依存性前駆体へと分化させる。この前駆体はさらに系統特異的な転写因子により分化する。ILCの異なるグループは共通の前駆細胞を持つことが明らかとなっている |
|||
{{仮リンク|リンパ球系共通前駆細胞|en|Lymphopoiesis#The old model: lymphoid vs myeloid}}(CLP)は与えられるシグナルに応じて[[T細胞]]、[[B細胞]]、そしてILCを含むさまざまな細胞に分化することができる。NK細胞を除き、すべてのILCは生存のためにIL-7シグナルが必要である。[[リプレッサー|転写抑制因子]]である{{仮リンク|ID2 (タンパク質)|en|ID2|label=ID2}}はB細胞およびT細胞分化に拮抗し、ID2依存性前駆体へと[[細胞分化|分化]]させる<ref name="Walker_2013">{{cite journal|date=February 2013|title=Innate lymphoid cells--how did we miss them?|url=https://www.semanticscholar.org/paper/2d040624b1636970743dec273b9fb4eab27799ac|journal=Nature Reviews. Immunology|volume=13|issue=2|pages=75–87|doi=10.1038/nri3349|pmid=23292121|vauthors=Walker JA, Barlow JL, McKenzie AN|s2cid=14580303}}</ref>。この前駆体はさらに系統特異的な転写因子により分化する<ref name="Walker_2013" />。ILCの異なるグループは共通の前駆細胞を持つ<ref>{{Cite journal|doi=10.1038/nri3349|issn=1474-1733|volume=13|issue=2|pages=75–87|last=Walker|first=Jennifer A.|author2=Jillian L. Barlow |author3=Andrew N. J. McKenzie|title=Innate lymphoid cells — how did we miss them?|journal=Nature Reviews Immunology|accessdate=2013-08-03|date= February 2013|url = http://www.nature.com/nri/journal/v13/n2/abs/nri3349.html}}</ref>。ILCは、{{仮リンク|組換え活性化遺伝子|en|Recombination-activating gene}}(RAG)に依存せず、サイトカイン受容体{{仮リンク|共通ガンマ鎖|en|Common gamma chain}}と[[ヤヌスキナーゼ|JAK3キナーゼ]]経路を介した[[サイトカイン]]シグナルに依存して発生する<ref name="EberlColonna2015">{{cite journal|date=May 2015|title=Innate lymphoid cells. Innate lymphoid cells: a new paradigm in immunology|journal=Science|volume=348|issue=6237|pages=aaa6566|doi=10.1126/science.aaa6566|pmid=25999512|pmc=5658207|vauthors=Eberl G, Colonna M, Di Santo JP, McKenzie AN|doi-access=free}}</ref>。 |
|||
<ref>{{Cite journal|doi=10.1038/nri3349|issn=1474-1733|volume=13|issue=2|pages=75–87|last=Walker|first=Jennifer A.|author2=Jillian L. Barlow |author3=Andrew N. J. McKenzie|title=Innate lymphoid cells — how did we miss them?|journal=Nature Reviews Immunology|accessdate=2013-08-03|date= February 2013|url = http://www.nature.com/nri/journal/v13/n2/abs/nri3349.html}}</ref>。 |
|||
この共通前駆細胞への初めの分化に [[Notchシグナリング]]が必要である可能性が示唆されているが、ILCの発生は完全には明らかになっていない |
|||
<ref>{{cite journal|last=Leavy|first=Olive|title=Innate-like lymphocytes: Will the real ILC1 please stand up?|journal=Nature Reviews Immunology|date=25 January 2013|volume=13|issue=2|pages=67–67|doi=10.1038/nri3397}}</ref>。 |
|||
ILC3はILC1の前駆体である可能性がある |
|||
<ref>{{cite journal|last=Spits|first=Hergen|author2=Cupedo, Tom|title=Innate Lymphoid Cells: Emerging Insights in Development, Lineage Relationships, and Function|journal=Annual Review of Immunology|date=23 April 2012|volume=30|issue=1|pages=647–675|doi=10.1146/annurev-immunol-020711-075053}}</ref>。 |
|||
== |
=== 発生初期 === |
||
[[ファイル:ILC_development_2_PNG.png|代替文= A flow diagram of the different development pathways for the 5 subsets of ILC cell, starting from the common lymphoid progenitor, including the different transcription factors they each require for development|サムネイル|400x400ピクセル|主にマウスの分化経路を元にしたILCの発生の模式図<ref name="VivierArtis2018" />。]] |
|||
ILCは、CLPから派生した[[自然リンパ球共通前駆細胞]](CILP)に由来する。CILPは、T細胞やB細胞を含む多くの異なるリンパ系細胞に分化する能力を持つ<ref name="VivierArtis2018" />。CILPはその後、[[ナチュラルキラー前駆細胞]](NKP)や、より最近報告された[[ヘルパー様自然リンパ球共通前駆細胞]](CHILP)に分化することができる<ref name="VivierArtis2018" />。CHILPは、その後、[[リンパ組織誘導前駆細胞]](LTiP)や[[自然リンパ球共通前駆細胞]](ILCP)に分化する。微小環境に存在する因子は、[[Notchシグナリング|ノッチリガンド]]、[[サイトカイン]]、[[概日リズム]]、[[転写因子]]の発現などであり、CLPがどのILCサブタイプに分化するかを決定する{{citation needed|date=August 2020}}。 |
|||
=== 自然リンパ球共通前駆細胞(ILCP) === |
|||
CLPからCILP、そしてILCへと成長する過程では、転写因子{{仮リンク|ID2 (タンパク質)|en|ID2|label=ID2}}が、リンパ系細胞のT細胞やB細胞への分化を抑制する役割を担っている<ref name="EberlColonna2015" />。ID2は、B細胞やT細胞の発生に重要な{{仮リンク|E-box|en|E-box}}転写因子([[2A自己切断ペプチド|E2A]]、E2-2、{{仮リンク|TCF12|en|TCF12|label=HEB}})の活性を低下させることで、その役割を果たしている<ref name="EberlColonna2015" />。当初より、CLPがILCサブセットのいずれかに分化するためにはID2が必要であると考えられており、実際、CLPの発生過程でID2をノックアウトすると、ID2の存在に依存しないNK前駆細胞を除くすべてのILCサブセットの発生が阻害されることが明らかにされた<ref name="KloseFlach2014">{{cite journal|date=April 2014|title=Differentiation of type 1 ILCs from a common progenitor to all helper-like innate lymphoid cell lineages|journal=Cell|volume=157|issue=2|pages=340–356|doi=10.1016/j.cell.2014.03.030|pmid=24725403|vauthors=Klose CS, Flach M, Möhle L, Rogell L, Hoyler T, Ebert K, Fabiunke C, Pfeifer D, Sexl V, Fonseca-Pereira D, Domingues RG, Veiga-Fernandes H, Arnold SJ, Busslinger M, Dunay IR, Tanriver Y, Diefenbach A|display-authors=6|doi-access=free}}</ref>。この事実により、ID2の存在に完全に依存し、主要なILCマーカーを発現する、他系統マーカー陰性(Lin<sup>-</sup><ref group="注">CD3CD4CD8CD19CD11bCD11cFcεR1NK1.1Gr1<sup>−</sup></ref>)の細胞群(真の前駆細胞の要件)が同定され、その表現型は、Lin<sup>-</sup>ID2<sup>+</sup>IL7Ra<sup>+</sup>CD25<sup>-</sup>α4β7<sup>+</sup>であり、これは現在、ヘルパー様自然リンパ球共通前駆細胞CHILPとして知られている<ref name="KloseFlach2014" />。これらの細胞は、ヘルパーT細胞の分化に類似していることから、「ヘルパー様」と名付けられた。 |
|||
=== 転写因子依存性 === |
|||
分化の各ステージは、さまざまな転写因子の発現に依存している。{{仮リンク|NFIL3|en|NFIL3}}、[[HNF1A|TCF-1]]、[[ETS1]]、{{仮リンク|GATA3|en|GATA3}}、{{仮リンク|前骨髄細胞性白血病亜鉛指タンパク質|en|Zinc finger and BTB domain-containing protein 16|label=PLZF}}、T-bet、Eomes、{{仮リンク|RUNX3|en|RUNX3}}、RORα、Bcl11b、Gfi1、RORγt、[[芳香族炭化水素受容体|AhR]]などである<ref name="VivierArtis2018" />。これらの転写因子が協調して発現することにより、リンパ球サブセットの分化に重要な標的遺伝子が活性化されたり、抑制されたりする<ref name="EberlColonna2015" />。特に、サイトカインによって発現が制御されるNfil3は、転写因子Id2、RORγt、Eomes、{{仮リンク|Tox (タンパク質)|en|TOX|label=Tox}}を介してILCの分化を制御している<ref name="XuDomingues2015">{{cite journal|date=March 2015|title=NFIL3 orchestrates the emergence of common helper innate lymphoid cell precursors|journal=Cell Reports|volume=10|issue=12|pages=2043–54|doi=10.1016/j.celrep.2015.02.057|pmid=25801035|vauthors=Xu W, Domingues RG, Fonseca-Pereira D, Ferreira M, Ribeiro H, Lopez-Lastra S, Motomura Y, Moreira-Santos L, Bihl F, Braud V, Kee B, Brady H, Coles MC, Vosshenrich C, Kubo M, Di Santo JP, Veiga-Fernandes H|display-authors=6|doi-access=free}}</ref>。これにより、組織シグナルがILC系統への分化決定に重要な役割を果たしていることが証明された。 |
|||
=== 起源と移行 === |
|||
研究によると、ILCの主な発生場所は、胎児では[[肝臓]]、成人では[[骨髄]]であり、ここでCLP、NKP、CHILPが発見されている<ref name="EberlColonna2015" />。その後、細胞は、[[細胞接着分子]]や[[ケモカイン]]によってコード化された指定の組織に到達するまで、血液中に出て循環する<ref name="EberlColonna2015" />。しかし、ILCの成熟は、ナイーブ[[ヘルパーT細胞]]の成熟と同様に、一次リンパ組織の外で行われる可能性があることも明らかになっている。 |
|||
NK前駆細胞やILC3前駆細胞はヒトの扁桃腺で発見されており、胎児のILCPはマウスの腸内でパイエル板に集積している<ref name="BandoLiang2014">{{cite journal|date=February 2015|title=Identification and distribution of developing innate lymphoid cells in the fetal mouse intestine|journal=Nature Immunology|volume=16|issue=2|pages=153–60|doi=10.1038/ni.3057|pmid=25501629|pmc=4297560|vauthors=Bando JK, Liang HE, Locksley RM}}</ref><ref name="LeeCella2011">{{cite journal|date=November 2011|title=AHR drives the development of gut ILC22 cells and postnatal lymphoid tissues via pathways dependent on and independent of Notch|journal=Nature Immunology|volume=13|issue=2|pages=144–51|doi=10.1038/ni.2187|pmid=22101730|pmc=3468413|vauthors=Lee JS, Cella M, McDonald KG, Garlanda C, Kennedy GD, Nukaya M, Mantovani A, Kopan R, Bradfield CA, Newberry RD, Colonna M|display-authors=6}}</ref>。レチノイン酸は、神経細胞、樹状細胞、[[間質細胞]]など多くの細胞から産生されるが、ILC2よりもILC3の分化に有利であり、ILC3の完全な成熟に必要である<ref name="EberlColonna2015" />。また、食物の[[異化 (生物学)|異化]]後に産生されるリガンドを介して発現するAhRは、腸内ILC3の機能と発現の維持に必要である<ref name="BandoLiang2014" />。 |
|||
== 機能 == |
|||
ILCは、あらゆる臓器、特に粘膜表面で病原体に対する免疫反応を担っている<ref name="Colonna20182">{{cite journal|date=June 2018|title=Innate Lymphoid Cells: Diversity, Plasticity, and Unique Functions in Immunity|journal=Immunity|volume=48|issue=6|pages=1104–1117|doi=10.1016/j.immuni.2018.05.013|pmid=29924976|pmc=6344351|vauthors=Colonna M|doi-access=free}}</ref>。ILCは、免疫調節サイトカインを迅速に分泌する能力を持ち、自然免疫反応の鍵を握っているが、他の免疫細胞との相互作用によって獲得免疫反応の形成にも関与している。ILCが存在する組織の微小環境は、多様なILCプロファイルの発現を決定し、微調整することで、複数のエフェクター機能におけるILCの相互作用を促進する。 |
|||
ILCが組織内の要所々々に配置され深く根付いていることで、恒常性が維持され、その結果、健全な組織機能を維持することができる。しかし、ILCはさまざまな粘膜部位で有害となる役割も果たしている<ref name="KotasLocksley2018">{{cite journal|date=June 2018|title=Why Innate Lymphoid Cells?|journal=Immunity|volume=48|issue=6|pages=1081–1090|doi=10.1016/j.immuni.2018.06.002|pmid=29924974|pmc=6145487|vauthors=Kotas ME, Locksley RM|doi-access=free}}</ref>。 |
|||
ILCの機能はその組織内での局在部位と関連しているため、ILCの局在や移動に関与するシグナルを明らかにすることは、疾患の治療に向けた新たな道筋を見出す上で重要である<ref name="PantaziPowell20192">{{cite journal|year=2019|title=Group 3 ILCs: Peacekeepers or Troublemakers? What's Your Gut Telling You?!|journal=Frontiers in Immunology|volume=10|pages=676|doi=10.3389/fimmu.2019.00676|pmid=31024537|pmc=6460375|vauthors=Pantazi E, Powell N|doi-access=free}}</ref>。 |
|||
=== 寄生虫感染と組織修復 === |
|||
2型免疫、つまりILC2細胞の基本的な特性は、[[蠕虫]]のような消化不能の大型生物への対処である<ref name="LöserSmith2019">{{cite journal|year=2019|title=Innate Lymphoid Cells in Helminth Infections-Obligatory or Accessory?|journal=Frontiers in Immunology|volume=10|pages=620|doi=10.3389/fimmu.2019.00620|pmid=31024526|pmc=6467944|vauthors=Löser S, Smith KA, Maizels RM|doi-access=free}}</ref>。腸内では、蠕虫の感染に反応して、上皮細胞が[[インターロイキン-25|IL-25]]を大量に分泌し、ILC2細胞を活性化する。ILC2は[[インターロイキン-13|IL-13]]を産生し、[[Notchシグナリング|Notchシグナル]]伝達経路を介して、さらに上皮細胞の分化を促す。この指示により、蠕虫の寄生体やその他の大きな病原体を排出できるように組織が再構築される。 |
|||
また、IL-13はT細胞を活性化し、寄生虫を追い出すためのさらなる生理的反応を誘発する<ref name="Palm_2012">{{cite journal|date=April 2012|title=Allergic host defences|journal=Nature|volume=484|issue=7395|pages=465–72|bibcode=2012Natur.484..465P|doi=10.1038/nature11047|pmid=22538607|pmc=3596087|vauthors=Palm NW, Rosenstein RK, Medzhitov R}}</ref>。[[T細胞]]は[[杯細胞]]の粘液分泌を促し、[[平滑筋]]を収縮させ、[[肥満細胞]]や[[好酸球]]を呼び寄せるシグナルを分泌し、[[B細胞]]の増殖を促す<ref name="Palm_2012" />。 |
|||
感染すると、蠕虫の移動に伴い、組織の損傷が拡大する。ILC2は、上皮成長因子受容体に対する[[アンフィレグリン|AREG]]などのリガンドを産生し、組織修復のための上皮細胞の分化を促進することで、感染後の組織損傷を修復する重要な役割を担っている<ref name="VivierArtis20184">{{cite journal|date=August 2018|title=Innate Lymphoid Cells: 10 Years On|journal=Cell|volume=174|issue=5|pages=1054–1066|doi=10.1016/j.cell.2018.07.017|pmid=30142344|vauthors=Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, Koyasu S, Locksley RM, McKenzie AN, Mebius RE, Powrie F, Spits H|display-authors=6|doi-access=free}}</ref>。これにより、上皮のバリア機能を高め、病原体の侵入を遅らせる機能が期待できる<ref name="Palm_2012" />。 |
|||
[[ファイル:ILCs_in_tissue_repair_3_PNG.png|代替文=A flow chart with images of the group 1, 2, and 3 ILC cells, and their individual roles in tissue repair and regeneration.|中央|サムネイル|450x450ピクセル|ILCサブタイプの違いと、大型寄生虫感染による組織損傷後の修復・再生などへの関与<ref name="VivierArtis20184" />。]] |
|||
複数の組織内微小環境において、ILCは間質細胞のような非造血性細胞との関係が深い。肺では、ILC2は間質細胞に特異的に局在し、間質細胞は[[インターロイキン-33|IL-33]]や{{仮リンク|胸腺間質性リンパ球新生因子|en|Thymic stromal lymphopoietin|label=TSLP}}を放出し、ILC2の維持に寄与している。定常状態でも、蠕虫が腸から侵入し血液を介して肺に移動した後の感染への反応でも、ILC2の機能は維持される<ref name="DahlgrenJones2019">{{cite journal|date=March 2019|title=Adventitial Stromal Cells Define Group 2 Innate Lymphoid Cell Tissue Niches|journal=Immunity|volume=50|issue=3|pages=707–722.e6|doi=10.1016/j.immuni.2019.02.002|pmid=30824323|pmc=6553479|vauthors=Dahlgren MW, Jones SW, Cautivo KM, Dubinin A, Ortiz-Carpena JF, Farhat S, Yu KS, Lee K, Wang C, Molofsky AV, Tward AD, Krummel MF, Peng T, Molofsky AB|display-authors=6|doi-access=free}}</ref>。 |
|||
肺のILC2は、血液中の好酸球を呼び込めるように、血管の近くに位置している。また、病原体が溜まる可能性のある気道内にも位置している。これは、[[カルシトニン遺伝子関連ペプチド]]の放出を通じてILC2を活性化する{{仮リンク|神経内分泌細胞|en|Neuroendocrine cell}}と密接に接触していることを意味する<ref name="SuiWiesner2018">{{cite journal|date=June 2018|title=Pulmonary neuroendocrine cells amplify allergic asthma responses|journal=Science|volume=360|issue=6393|pages=eaan8546|doi=10.1126/science.aan8546|pmid=29599193|pmc=6387886|vauthors=Sui P, Wiesner DL, Xu J, Zhang Y, Lee J, Van Dyken S, Lashua A, Yu C, Klein BS, Locksley RM, Deutsch G, Sun X|display-authors=6|doi-access=free}}</ref>。また、[[神経|神経回路]]を介してILCの機能が制御されていることも確認されている。 |
|||
加えて、ILC1とILC3は病原体の感染に反応して、酸素ラジカルや致死的なダメージを与える酵素を放出し、その結果宿主組織にダメージを与える。組織の修復反応は、ILC3とILC1が組織から微生物や破片を除去した後、2型免疫反応によって調整される。 |
|||
=== 腸粘膜 === |
|||
腸のILCは、食物、微生物、内因性代謝物に晒されている。ILCの小腸への帰還は、α4β7[[インテグリン]]と受容体であるCCR9によって行われる。ILC2は骨髄でCCR9を発現しているので直接腸に帰還できるが、ILC1やILC3にCCR9を発現させるにはレチノイン酸が必要である。 |
|||
ILCは、腸内のバリアーの維持を促進し、さまざまな細菌やウイルスの感染から保護する。ILC3は、成人と胎児の両方の腸に最も多く存在するサブセットである<ref name="BerninkPeters2013">{{cite journal|date=March 2013|title=Human type 1 innate lymphoid cells accumulate in inflamed mucosal tissues|journal=Nature Immunology|volume=14|issue=3|pages=221–9|doi=10.1038/ni.2534|pmid=23334791|vauthors=Bernink JH, Peters CP, Munneke M, te Velde AA, Meijer SL, Weijer K, Hreggvidsdottir HS, Heinsbroek SE, Legrand N, Buskens CJ, Bemelman WA, Mjösberg JM, Spits H|s2cid=8614680|display-authors=6}}</ref>。腸内のILCの分布は発生過程で変化し、消化管の各部位に不均等に分布している。このような腸内各部位への偏在は、それぞれ異なるシグナルカスケードに誘導される<ref name="Willinger2019">{{cite journal|year=2019|title=Metabolic Control of Innate Lymphoid Cell Migration|journal=Frontiers in Immunology|volume=10|pages=2010|doi=10.3389/fimmu.2019.02010|pmid=31507605|pmc=6713999|vauthors=Willinger T|doi-access=free}}</ref>。ヒトでは、腸内ILCの約70%がNCR<sup>+</sup><ref group="注" name="a">Natural Cytotoxicity triggering Receptor</ref>、15%がNCR<sup>-</sup>である<ref name="EbboCrinier2017">{{cite journal|date=November 2017|title=Innate lymphoid cells: major players in inflammatory diseases|journal=Nature Reviews. Immunology|volume=17|issue=11|pages=665–678|doi=10.1038/nri.2017.86|pmid=28804130|vauthors=Ebbo M, Crinier A, Vély F, Vivier E|s2cid=2651328}}</ref>。 |
|||
[[ファイル:ILCs_in_the_intestinal_mucosa_12_FINAL.png|代替文=A diagram of the different ILC subsets, present in the intestinal mucosa, and how they all interact with one another, and different effector cells, in order to maintain intestinal homeostasis. Image include the cytokines involved in signalling between the different ILCs, and the intestinal epithelium.|サムネイル|450x450ピクセル|ILCは腸管粘膜で重要な役割を果たしており、関連するサイトカインやエフェクター細胞を介して腸管の恒常性を維持している。]] |
|||
ILC3は[[腸内細菌叢]]と直接相互作用し、微生物叢と宿主との間にネットワークを形成して恒常性を維持している。ILC3はIL-22を分泌し、上皮細胞を刺激して抗菌ペプチドを産生することで、腸内の複数の非有益な細菌のコロニー形成を制限する<ref name="ZhengValdez2008">{{cite journal|date=March 2008|title=Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens|journal=Nature Medicine|volume=14|issue=3|pages=282–9|doi=10.1038/nm1720|pmid=18264109|vauthors=Zheng Y, Valdez PA, Danilenko DM, Hu Y, Sa SM, Gong Q, Abbas AR, Modrusan Z, Ghilardi N, de Sauvage FJ, Ouyang W|s2cid=15742387|display-authors=6}}</ref>。IL-22の分泌は、マクロファージや樹状細胞によるIL-23やIL-1βの産生に起因して誘導され、粘膜層の治癒を促進する<ref name="PandaColonna20193">{{cite journal|year=2019|title=Innate Lymphoid Cells in Mucosal Immunity|journal=Frontiers in Immunology|volume=10|pages=861|doi=10.3389/fimmu.2019.00861|pmid=31134050|pmc=6515929|vauthors=Panda SK, Colonna M|doi-access=free}}</ref>。例えば、IL-22は[[化学療法 (悪性腫瘍)|化学療法]]や[[放射線療法]]後の腸管損傷の修復を促進する。ILC3は、常在菌の内腔への封じ込めを制御し、粘膜固有食細胞への暴露を可能にし、T細胞の活性化に繋がる。ILC3は、[[MHCクラスII分子|MHCクラスII]]受容体を介して抗原を提示することができるが、[[共刺激]]分子を持たないため、T細胞[[アネルギー (免疫学)|アネルギー]](不応答性)の役割を果たし、有益な常在菌に対する耐性を促進する<ref name="EbboCrinier2017" />。したがって、ILC3と腸内T細胞の関係は、恒常性を維持する上で非常に重要である。ILC3が存在しない場合、T細胞の活性化が制御できなくなる可能性があるからだ。さらに、ILC3によるIL-22の産生を微調整する役割を微生物が担っている。例えば、[[回腸]]の{{仮リンク|セグメント細菌|en|Segmented filamentous bacteria}}<ref group="注">分節構造を持つ繊維様の形態の腸内細菌</ref>は、IL-22の産生を調整し、Th17細胞の分化を可能にする<ref name="IvanovMcKenzie2006">{{cite journal|date=September 2006|title=The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells|journal=Cell|volume=126|issue=6|pages=1121–33|doi=10.1016/j.cell.2006.07.035|pmid=16990136|vauthors=Ivanov II, McKenzie BS, Zhou L, Tadokoro CE, Lepelley A, Lafaille JJ, Cua DJ, Littman DR|s2cid=9034013|display-authors=6|doi-access=free}}</ref><ref name="ZhouIvanov2007">{{cite journal|date=September 2007|title=IL-6 programs T(H)-17 cell differentiation by promoting sequential engagement of the IL-21 and IL-23 pathways|journal=Nature Immunology|volume=8|issue=9|pages=967–74|doi=10.1038/ni1488|pmid=17581537|vauthors=Zhou L, Ivanov II, Spolski R, Min R, Shenderov K, Egawa T, Levy DE, Leonard WJ, Littman DR|s2cid=21177884|display-authors=6}}</ref>。 |
|||
ILC3は腸管の恒常性を維持するために{{仮リンク|腸管神経系|en|Enteric nervous system}}と相互作用する。細菌に反応して、粘膜固有層の[[グリア細胞]]が[[神経栄養因子]]を分泌し、その神経栄養因子が神経制御受容体[[RET (タンパク質)|RET]]を介してILC3にIL-22を産生させるからである<ref name="IbizaGarcía-Cassani2016">{{cite journal|date=July 2016|title=Glial-cell-derived neuroregulators control type 3 innate lymphoid cells and gut defence|journal=Nature|volume=535|issue=7612|pages=440–443|bibcode=2016Natur.535..440I|doi=10.1038/nature18644|pmid=27409807|pmc=4962913|vauthors=Ibiza S, García-Cassani B, Ribeiro H, Carvalho T, Almeida L, Marques R, Misic AM, Bartow-McKenney C, Larson DM, Pavan WJ, Eberl G, Grice EA, Veiga-Fernandes H|display-authors=6}}</ref>。また、樹状細胞は病原体によるストレス時にIL-23を産生し、ILC3を活性化してIL-22の産生を可能にする。IL-22が腸内の微生物を制御するメカニズムの一つは、上皮細胞の[[グリコシル化]]パターンを介したものであると考えられている<ref name="GotoObata2014">{{cite journal|date=September 2014|title=Innate lymphoid cells regulate intestinal epithelial cell glycosylation|journal=Science|volume=345|issue=6202|pages=1254009|doi=10.1126/science.1254009|pmid=25214634|pmc=4774895|vauthors=Goto Y, Obata T, Kunisawa J, Sato S, Ivanov II, Lamichhane A, Takeyama N, Kamioka M, Sakamoto M, Matsuki T, Setoyama H, Imaoka A, Uematsu S, Akira S, Domino SE, Kulig P, Becher B, Renauld JC, Sasakawa C, Umesaki Y, Benno Y, Kiyono H|display-authors=6}}</ref>。ILC3によるIL-22とリンホトキシンの発現は、{{仮リンク|フコース転移酵素|en|Fucosyltransferase}}2の発現を制御し、上皮細胞の{{仮リンク|フコース化|en|Fucosylation}}を可能にし、腸内細菌の栄養源となる<ref name="GotoObata2014" />。 |
|||
食事や微生物由来の[[芳香族炭化水素受容体|AhR]]リガンドは、免疫細胞に認識され、腸内のILCの発達やNK細胞の機能を制御する。[[トリプトファン]]代謝物に応答して、AhRシグナルがIL-22の発現を維持し、腸の恒常性を維持する<ref name="VivierArtis20184" />。樹状細胞が産生するレチノイン酸は、RORγtとIL-22を[[アップレギュレート]]することで、ILC1とILC3の腸管帰還受容体の発現を促進し、ILC3の機能を高める<ref name="VivierArtis20184" />。また、マクロファージとILC3sの間には、微生物のシグナル伝達に依存したRORγtによるGM-CSFの産生や、マクロファージによるIL-1βの産生を介した相互作用が存在する<ref name="EbboCrinier2017" />。食事性[[ビタミンA]]が不足すると、ILC3の数が異常に少なくなり、IL-22の産生が低下して感染症に罹りやすくなる。逆に、レチノイン酸は{{仮リンク|インターロイキン-7受容体α|en|Interleukin-7 receptor-α|label=IL-7Rα}}を[[ダウンレギュレート]]することでILC2の増殖を抑制し、ビタミンAを欠乏させるとILC2を介したマウスの蠕虫感染に対する抵抗性が高まることが示されている<ref name="EbboCrinier2017" />。したがって、ILC3は、[[微生物叢]]、腸上皮、神経グリア細胞、その他の免疫細胞の間で、腸の恒常性を維持するための相互作用のネットワークを形成している。 |
|||
LTi細胞は[[パイエル板]]や[[リンパ濾胞]]に存在し、B細胞と相互作用して[[免疫グロブリンA|IgA]]の産生を促進し、宿主と局所微生物群との共生を促進する<ref name="MacphersonYilmaz2018">{{cite journal|date=April 2018|title=IgA Function in Relation to the Intestinal Microbiota|journal=Annual Review of Immunology|volume=36|issue=1|pages=359–381|doi=10.1146/annurev-immunol-042617-053238|pmid=29400985|vauthors=Macpherson AJ, Yilmaz B, Limenitakis JP, Ganal-Vonarburg SC}}</ref>。ILC1とNK細胞はIFN-γを産生し、細胞内の病原体と闘う。[[クロストリジウム・ディフィシル腸炎|''C. dificile''が感染]]すると、ILC1とILC3が協力して感染に対抗する<ref name="AbtLewis2015">{{cite journal|date=July 2015|title=Innate Immune Defenses Mediated by Two ILC Subsets Are Critical for Protection against Acute Clostridium difficile Infection|journal=Cell Host & Microbe|volume=18|issue=1|pages=27–37|doi=10.1016/j.chom.2015.06.011|pmid=26159718|pmc=4537644|vauthors=Abt MC, Lewis BB, Caballero S, Xiong H, Carter RA, Sušac B, Ling L, Leiner I, Pamer EG|display-authors=6|doi-access=free}}</ref>。ILC2は、寄生虫感染時に組織の損傷から守るために、腸内で杯細胞の分化と粘液の産生を誘導する。 |
|||
=== 腫瘍微小環境 === |
|||
自然リンパ系細胞のさまざまなグループは、幾つかの方法で腫瘍形成に影響を与える<ref name="Wagner 326–335">{{Cite journal|last1=Wagner|first1=Marek|last2=Moro|first2=Kazuyo|last3=Koyasu|first3=Shigeo|date=May 2017|title=Plastic Heterogeneity of Innate Lymphoid Cells in Cancer|url=https://linkinghub.elsevier.com/retrieve/pii/S2405803317300638|journal=Trends in Cancer|volume=3|issue=5|pages=326–335|language=en|doi=10.1016/j.trecan.2017.03.008|pmid=28718410}}</ref><ref name="Wagner 415–430">{{Cite journal|last1=Wagner|first1=Marek|last2=Koyasu|first2=Shigeo|date=May 2019|title=Cancer Immunoediting by Innate Lymphoid Cells|url=https://linkinghub.elsevier.com/retrieve/pii/S1471490619300468|journal=Trends in Immunology|volume=40|issue=5|pages=415–430|language=en|doi=10.1016/j.it.2019.03.004|pmid=30992189}}</ref>。 |
|||
[[自然リンパ球#%E3%82%B0%E3%83%AB%E3%83%BC%E3%83%971|ILC1]]は、最も重要な抗腫瘍能力を持つILCの集団であり、NK細胞は腫瘍細胞の表面の欠損したMHCクラスIを認識する能力を持っており<ref>{{cite journal|date=January 2016|title=Cancer Immunosurveillance by Tissue-Resident Innate Lymphoid Cells and Innate-like T Cells|journal=Cell|volume=164|issue=3|pages=365–77|doi=10.1016/j.cell.2016.01.002|pmid=26806130|pmc=4733424|vauthors=Dadi S, Chhangawala S, Whitlock BM, Franklin RA, Luo CT, Oh SA, Toure A, Pritykin Y, Huse M, Leslie CS, Li MO|display-authors=6}}</ref>、MHCクラスI上に外来抗原を提示している腫瘍細胞を認識して殺す細胞傷害性T細胞と補完的に作用する<ref>{{cite journal|date=October 2001|title=Natural killer cells, viruses and cancer|url=https://www.semanticscholar.org/paper/f5b4d5ba5a88ecbf3edb730fe8af42ce3623c37f|journal=Nature Reviews. Immunology|volume=1|issue=1|pages=41–9|doi=10.1038/35095564|pmid=11905813|vauthors=Cerwenka A, Lanier LL|s2cid=205021117}}</ref><ref>{{cite journal|date=April 2001|title=A fresh look at tumor immunosurveillance and immunotherapy|url=https://www.semanticscholar.org/paper/6bba347a54a47fad693fea2edf832617e895a48c|journal=Nature Immunology|volume=2|issue=4|pages=293–9|doi=10.1038/86297|pmid=11276199|vauthors=Smyth MJ, Godfrey DI, Trapani JA|s2cid=24779449}}</ref>。NK細胞は細胞表面に、腫瘍細胞上に過剰に発現したストレス誘導リガンドに特異的なNK細胞活性化受容体を多数発現している。 |
|||
ILC1は、サイトカインであるIFN-γとTNF-αを産生することで腫瘍微小環境に影響を与える。IFN-γとTNF-αは、免疫反応の初期に、[[マクロファージ極性化|M1マクロファージ]]、[[樹状細胞]]、[[細胞傷害性T細胞]]などの他の免疫細胞を極性化<ref group="注">組織微小環境の変化に応じて細胞の性質が可逆的に変化すること。</ref>させ、炎症環境を作り出す<ref>{{cite journal|date=April 2013|title=Intraepithelial type 1 innate lymphoid cells are a unique subset of IL-12- and IL-15-responsive IFN-γ-producing cells|journal=Immunity|volume=38|issue=4|pages=769–81|doi=10.1016/j.immuni.2013.02.010|pmid=23453631|pmc=3634355|vauthors=Fuchs A, Vermi W, Lee JS, Lonardi S, Gilfillan S, Newberry RD, Cella M, Colonna M|display-authors=6}}</ref>。上手くいけば、これらの細胞が集まって来て、腫瘍化した細胞を殺すことができる。しかし場合によっては、IFN-γやTNF-αが{{仮リンク|骨髄由来抑制細胞|en|Myeloid-derived suppressor cell}}などの免疫抑制性の免疫細胞や抗炎症性サイトカインを誘導し、腫瘍細胞が[[腫瘍免疫#腫瘍抗原|逃避]]できるような免疫環境を作ることもある<ref>{{cite journal|date=August 2010|title=Characterization of cytokine-induced myeloid-derived suppressor cells from normal human peripheral blood mononuclear cells|journal=Journal of Immunology|volume=185|issue=4|pages=2273–84|doi=10.4049/jimmunol.1000901|pmid=20644162|pmc=2923483|vauthors=Lechner MG, Liebertz DJ, Epstein AL}}</ref><ref>Heeren, A. Marijne, et al. "High and interrelated rates of PD-L1+ CD14+ antigen-presenting cells and regulatory T cells mark the microenvironment of metastatic lymph nodes from patients with cervical cancer." Cancer immunology research (2014): canimm-0149.</ref><ref name="Wagner 415–430" />。 |
|||
腫瘍監視におけるILC2とILC3の役割は、これらの細胞が存在する組織の微小環境に依存している。 |
|||
[[自然リンパ球#%E3%82%B0%E3%83%AB%E3%83%BC%E3%83%972|ILC2]]は、IL-13、IL-4、[[アンフィレグリン]]などの抗炎症免疫反応を促進するサイトカインを産生し、腫瘍の成長を促進する<ref>{{cite journal|date=September 2015|title=T helper 2 (Th2) cell differentiation, type 2 innate lymphoid cell (ILC2) development and regulation of interleukin-4 (IL-4) and IL-13 production|journal=Cytokine|volume=75|issue=1|pages=14–24|doi=10.1016/j.cyto.2015.05.010|pmid=26044597|pmc=4532589|vauthors=Zhu J}}</ref>。しかし、状況によってはILC2がIL-5を産生し、好酸球の細胞障害性反応を促進することで、抗腫瘍性反応を惹起する場合がある<ref>{{cite journal|date=January 2012|title=Identification of innate IL-5-producing cells and their role in lung eosinophil regulation and antitumor immunity|journal=Journal of Immunology|volume=188|issue=2|pages=703–13|doi=10.4049/jimmunol.1101270|pmid=22174445|vauthors=Ikutani M, Yanagibashi T, Ogasawara M, Tsuneyama K, Yamamoto S, Hattori Y, Kouro T, Itakura A, Nagai Y, Takaki S, Takatsu K|display-authors=6|doi-access=free}}</ref><ref>{{Cite journal|last1=Wagner|first1=Marek|last2=Ealey|first2=Kafi N.|last3=Tetsu|first3=Hiroe|last4=Kiniwa|first4=Tsuyoshi|last5=Motomura|first5=Yasutaka|last6=Moro|first6=Kazuyo|last7=Koyasu|first7=Shigeo|date=February 2020|title=Tumor-Derived Lactic Acid Contributes to the Paucity of Intratumoral ILC2s|journal=Cell Reports|volume=30|issue=8|pages=2743–2757.e5|language=en|doi=10.1016/j.celrep.2020.01.103|pmid=32101749|doi-access=free}}</ref>。 |
|||
[[自然リンパ球#%E3%82%B0%E3%83%AB%E3%83%BC%E3%83%973|ILC3]]もまた、腫瘍の増殖または抗腫瘍の環境に関与しうる。IL-17の産生は血管の透過性を亢進させるので、腫瘍の成長と転移を促進するが、ILC3の表面にあるMHCクラスIIのアップレギュレーションは、CD4<sup>+</sup>T細胞を活性化し、抗腫瘍効果を発揮する<ref name="DucimetièreVermeer2019">{{cite journal|year=2019|title=The Interplay Between Innate Lymphoid Cells and the Tumor Microenvironment|journal=Frontiers in Immunology|volume=10|pages=2895|doi=10.3389/fimmu.2019.02895|pmid=31921156|pmc=6923277|vauthors=Ducimetière L, Vermeer M, Tugues S|doi-access=free}}</ref>。また、ILC3は、肺癌における三次リンパ系構造の形成を促進し、保護的な役割を果たすことが報告されている<ref name="CarregaLoiacono2015">{{cite journal|date=September 2015|title=NCR(+)ILC3 concentrate in human lung cancer and associate with intratumoral lymphoid structures|journal=Nature Communications|volume=6|issue=1|pages=8280|bibcode=2015NatCo...6.8280C|doi=10.1038/ncomms9280|pmid=26395069|vauthors=Carrega P, Loiacono F, Di Carlo E, Scaramuccia A, Mora M, Conte R, Benelli R, Spaggiari GM, Cantoni C, Campana S, Bonaccorsi I, Morandi B, Truini M, Mingari MC, Moretta L, Ferlazzo G|display-authors=6|doi-access=free}}</ref>。 |
|||
=== 肝臓と脂肪組織 === |
|||
[[ファイル:ILCs_and_metabolism_4_PNG.png|代替文=A flow chart displaying the ILC1/2/3 cells, and their individual roles played during metabolism, and how they interact with one another.|サムネイル|420x420px|ILCサブタイプごとの代謝への関わり<ref name="VivierArtis20185">{{cite journal|date=August 2018|title=Innate Lymphoid Cells: 10 Years On|journal=Cell|volume=174|issue=5|pages=1054–1066|doi=10.1016/j.cell.2018.07.017|pmid=30142344|vauthors=Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, Koyasu S, Locksley RM, McKenzie AN, Mebius RE, Powrie F, Spits H|display-authors=6|doi-access=free}}</ref><br />・Macrophage polarisation:微小環境に応じた細胞の可逆的変化<br />・Gut homing:血流中のリンパ球が腸管に集まる現象<br />・MetEnk:メチオニン-[[エンケファリン]]<br />・VAT homeostasis:内臓脂肪組織の恒常性<br />・Beiging:白色脂肪細胞の褐色化(ベージュ脂肪細胞への変化)]]総てのILCサブセットは肝臓に存在し、ウイルスや細菌の感染から組織を守るための免疫反応を制御している<ref name="OchelTiegs2019">{{cite journal|date=April 2019|title=Type 2 Innate Lymphoid Cells in Liver and Gut: From Current Knowledge to Future Perspectives|journal=International Journal of Molecular Sciences|volume=20|issue=8|pages=1896|doi=10.3390/ijms20081896|pmid=30999584|pmc=6514972|vauthors=Ochel A, Tiegs G, Neumann K|doi-access=free}}</ref>。ILC1は肝臓に存在する支配的なILCサブセットである。IFN-γの産生は、[[肝細胞]]の生存を促進する<ref name="NabekuraRiggan2020">{{cite journal|date=January 2020|title=Type 1 Innate Lymphoid Cells Protect Mice from Acute Liver Injury via Interferon-γ Secretion for Upregulating Bcl-xL Expression in Hepatocytes|journal=Immunity|volume=52|issue=1|pages=96–108.e9|doi=10.1016/j.immuni.2019.11.004|pmid=31810881|pmc=8108607|vauthors=Nabekura T, Riggan L, Hildreth AD, O'Sullivan TE, Shibuya A|doi-access=free}}</ref>。ILC1によるIFN-γの産生は、NK細胞受容体{{仮リンク|CD226|en|CD226}}の発現に依存している<ref name="NabekuraRiggan2020" />。ILC1によるIL-12を介したIFN-γの産生は、細胞外の[[アデノシン三リン酸|ATP]]によって促進され、IFN-γは肝細胞の生存促進分子である[[Bcl-2]]、[[Bcl-xL]]をアップレギュレートする<ref name="NabekuraRiggan2020" />。 |
|||
NK細胞は、ウイルス性の[[B型肝炎|B型]]および[[C型肝炎]]、局所性の[[肝線維症]]、[[肝癌]]に対する免疫反応に貢献している。NK細胞は、{{仮リンク|TRAIL|en|TRAIL}}や{{仮リンク|NKG2D|en|NKG2D}}を介して、線維化した肝臓の肝細胞を排除する。 |
|||
ILCは、食事の負荷への対処や、代謝の恒常性の維持に重要な役割を果たしている。[[トリプトファン]]代謝物の産生により、[[芳香族炭化水素受容体|AhR]]転写因子がIL-22の発現を誘導し、ILC3の存在数を維持し、その結果、腸の恒常性が維持されるのである<ref name="VivierArtis2018" />。ビタミンAの代謝物である[[レチノイン酸]]もまた、IL-22の発現をアップレギュレートする。したがって、AhRシグナル伝達経路およびレチノイン酸がないと、[[消化管]]の{{仮リンク|腸粘膜肥厚症菌|en|Citrobacter rodentium}}感染症などの細菌感染に対する免疫力が低下する<ref name="VivierArtis2018" />。レチノイン酸はまた、ILC1やILC3の腸管帰還マーカーの発現を増強する。このように、食事から得られる栄養素は、感染症や炎症に対するILCの免疫反応を変化させるため、バランスのとれた健康的な食事の重要性が強調される。 |
|||
ILC2は、IL-5、IL-4、IL-13の産生を介して、[[脂肪組織]]における2型免疫環境をサポートしている。これにより、脂肪蓄積、インスリン抵抗性、カロリー消費量が調節される<ref name="VivierArtis2018" />。これが調節されないと、1型炎症が持続し、[[肥満]]の原因となる。ILC2は、白色脂肪細胞の褐色化を促進し、その結果、エネルギー消費量が増加する。したがって、組織内のILC2の反応が低下すると、エネルギー恒常性におけるILC2の重要な役割が阻害され、結果としてエネルギー消費量が減少し、脂肪が増加するため、肥満症となる<ref name=":1">{{cite journal|date=March 2015|title=Group 2 innate lymphoid cells promote beiging of white adipose tissue and limit obesity|journal=Nature|volume=519|issue=7542|pages=242–6|language=En|bibcode=2015Natur.519..242B|doi=10.1038/nature14115|pmid=25533952|pmc=4447235|vauthors=Brestoff JR, Kim BS, Saenz SA, Stine RR, Monticelli LA, Sonnenberg GF, Thome JJ, Farber DL, Lutfy K, Seale P, Artis D|display-authors=6}}</ref>。ILC2に加えて、ILC1も脂肪組織のマクロファージの恒常性維持に貢献しており、ヒトの脂肪組織では常在リンパ球数の5-10%を占めている<ref name="LuciVieira2019" />。高脂肪食はILC1の数を増やし、脂肪組織を活性化し、IFN-γやTNF-αの量を増加させる。ILC1はマクロファージの化学誘引物質である[[CCL2]]を産生するため、ILC1-マクロファージ間のシグナル伝達は脂肪組織の重要な調節因子であると考えられる<ref name="LeeKim2016">{{cite journal|date=April 2016|title=Adipose Natural Killer Cells Regulate Adipose Tissue Macrophages to Promote Insulin Resistance in Obesity|journal=Cell Metabolism|volume=23|issue=4|pages=685–98|doi=10.1016/j.cmet.2016.03.002|pmid=27050305|pmc=4833527|vauthors=Lee BC, Kim MS, Pae M, Yamamoto Y, Eberlé D, Shimada T, Kamei N, Park HS, Sasorith S, Woo JR, You J, Mosher W, Brady HJ, Shoelson SE, Lee J|display-authors=6|doi-access=free}}</ref>。この経路は、[[肝疾患]]の患者を治療するためのターゲットになる可能性がある。 |
|||
=== 呼吸器感染症 === |
|||
ILC2は、[[上皮細胞]]や[[杯細胞]]の増殖を促進し、その結果、気道における粘液の産生を促進する。これらの機能は、上皮の完全性の回復と維持に貢献している。ILC2は、AhR、IL-9、IL-13の産生を介して、肺の寄生虫感染に対する防御機能を提供している<ref name="TurnerMorrison2013">{{cite journal|date=December 2013|title=IL-9-mediated survival of type 2 innate lymphoid cells promotes damage control in helminth-induced lung inflammation|journal=The Journal of Experimental Medicine|volume=210|issue=13|pages=2951–65|doi=10.1084/jem.20130071|pmid=24249111|pmc=3865473|vauthors=Turner JE, Morrison PJ, Wilhelm C, Wilson M, Ahlfors H, Renauld JC, Panzer U, Helmby H, Stockinger B|display-authors=6|doi-access=free}}</ref>。これらのILC2は、腸で発生し、寄生虫感染と戦うために肺に移動すると考えられている<ref name="HuangMao2018">{{cite journal|date=January 2018|title=S1P-dependent interorgan trafficking of group 2 innate lymphoid cells supports host defense|journal=Science|volume=359|issue=6371|pages=114–119|bibcode=2018Sci...359..114H|doi=10.1126/science.aam5809|pmid=29302015|pmc=6956613|vauthors=Huang Y, Mao K, Chen X, Sun MA, Kawabe T, Li W, Usher N, Zhu J, Urban JF, Paul WE, Germain RN|display-authors=6|doi-access=free}}</ref>。 |
|||
ILC1とNK細胞は、[[ライノウイルス]]や[[呼吸器合胞体ウイルス]](RSV)などの肺のウイルス感染に反応してIFN-γを分泌する<ref name="PandaColonna2019" />。 |
|||
また、ILC3はIL-17やIL-22を分泌して、[[肺炎レンサ球菌|肺炎連鎖球菌]]感染などの肺感染症にも関与している。ヒトの呼吸器感染症におけるILCの役割を明らかにするには、更なる研究が必要である<ref name="Van MaeleCarnoy2014">{{cite journal|date=August 2014|title=Activation of Type 3 innate lymphoid cells and interleukin 22 secretion in the lungs during Streptococcus pneumoniae infection|journal=The Journal of Infectious Diseases|volume=210|issue=3|pages=493–503|doi=10.1093/infdis/jiu106|pmid=24577508|vauthors=Van Maele L, Carnoy C, Cayet D, Ivanov S, Porte R, Deruy E, Chabalgoity JA, Renauld JC, Eberl G, Benecke AG, Trottein F, Faveeuw C, Sirard JC|display-authors=6|doi-access=free}}</ref>。 |
|||
=== 皮膚修復 === |
|||
[[ファイル:ILCS_in_skin_repair_5_PNG.png|代替文=An image displaying a wound in the skin, and the signalling involved in attracting ILC2s and ILC3s to the site, to aid in the healing process.|サムネイル|320x320px|ILC3とILC2は、傷付いた皮膚に活性化した細胞を誘導することで、治癒プロセスを促進する<ref name="EbboCrinier2017" />。]] |
|||
ILC3とILC2は、表皮のNotch1シグナルを介して、マウスとヒトの両方で創部[[真皮]]に誘導されることが明らかになっている<ref name="EbboCrinier2017" />。ILC3はIL-17Fを分泌し、マクロファージを創傷部位に誘導することで、創傷治癒時の免疫および上皮細胞の反応に役割を果たす。TNFの発現もまた、ILC3の損傷した皮膚表皮への局在を指示することから、創傷治癒に一役買っている<ref name="EbboCrinier2017" />。表皮からIL-33が放出されると、ILC2は重要な表皮成長因子であるアンフィレグリンを大量に分泌し、[[皮膚]]の創傷治癒に貢献する<ref name="EbboCrinier2017" />。 |
|||
== 病理 == |
|||
=== 喘息 === |
|||
[[ファイル:ILCs_in_Asthma_6_PNG_-_FINAL.png|代替文=A flow chart of the different immune cells involved in generating the allergic response to triggers such as allergens in the lungs of asthmatic patients. The diagram displays arrows linking cells together that interact with one another, and is based around the centre ILC2 cell, causing the Th2 response.|サムネイル|375x375ピクセル|喘息患者の肺に存在するILCは、サイトカインを放出して他の免疫細胞に働き掛けてTh2免疫応答を促進することで、この疾患の病態生理に関与している<ref name="EbboCrinier2017" />。<br/>・Mast Cell:肥満細胞<br/>・Dendritic Cell:樹状細胞<br/>・Basophil:好塩基球<br/>・Eosinophil:好酸球]] |
|||
ILC2は、肺の炎症時に病原体としての役割を果たすことが確認されている。肺の上皮細胞は、さまざまな[[アレルゲン]]、[[真菌]]、[[ウイルス]]などに反応して、サイトカインであるIL-33やIL-25、あるいは{{仮リンク|胸腺間質性リンパ球新生因子|en|Thymic stromal lymphopoietin|label=TSLP}}を発現する。これらのサイトカインはILC2を活性化するため、アレルギー性喘息の患者ではILC2の数が増加し、2型のサイトカイン(IL-4/5/13)が放出される<ref name="PandaColonna2019" />。これらはIL-13を分泌し、アレルギー性肺炎を開始し、さらにTh2分化を促進してIL-13の産生を増加させ、その結果、[[アレルギー|アレルギー反応]]を増幅させる<ref name="HalimSteer2014">{{cite journal|date=March 2014|title=Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation|journal=Immunity|volume=40|issue=3|pages=425–35|doi=10.1016/j.immuni.2014.01.011|pmid=24613091|pmc=4210641|vauthors=Halim TY, Steer CA, Mathä L, Gold MJ, Martinez-Gonzalez I, McNagny KM, McKenzie AN, Takei F|display-authors=6|doi-access=free}}</ref>。 |
|||
肺のILC2によるIL-5の産生は、好酸球の動員に繋がり、他の細胞集団は、喘息患者の気道炎症において肺のILC2と相互作用し、ILC2を活性化することが知られている。さらに、ILC2はB細胞の増殖も促進する。ILC2の増加は疾患の重症度と相関していると考えられており、「アレルゲンを経験した」ILC2の一部は、初期の炎症が治まった後も残存し、[[記憶T細胞]]に類似した性質を持つことが確認されている。喘息患者がさまざまなアレルゲンに感作されることが多いのは、この「アレルゲンを経験した」ILC2の存在が理由であると考えられる<ref name="EbboCrinier2017" />。 |
|||
このアレルギー免疫反応は、T細胞やB細胞とは独立しているようで、T細胞やB細胞を欠損したマウスでも、IL-33を用いて喘息様症状に似たアレルギー反応が誘発されることが確認されている<ref>{{cite journal|date=April 2011|title=IL-33 and Airway Inflammation|journal=Allergy, Asthma & Immunology Research|volume=3|issue=2|pages=81–8|doi=10.4168/aair.2011.3.2.81|pmid=21461246|pmc=3062800|vauthors=Oboki K, Nakae S, Matsumoto K, Saito H}}</ref><ref>{{cite journal|date=March 1998|title=Percutaneous sensitization with allergens through barrier-disrupted skin elicits a Th2-dominant cytokine response|journal=European Journal of Immunology|volume=28|issue=3|pages=769–79|doi=10.1002/(SICI)1521-4141(199803)28:03<769::AID-IMMU769>3.0.CO;2-H|pmid=9541570|vauthors=Kondo H, Ichikawa Y, Imokawa G}}</ref>。 |
|||
他のILCが喘息にどのような影響を与えるかは明らかではないが、IL-17を産生するILC3の数と喘息の重症度との間に相関関係があることが研究で示されている。また、マウスでは、NK細胞とILC1がIFN-γの産生によるILC2の増殖を抑制することが示されており、疾患のコントロールに役立つと考えられています。異なるサブセットのバランスが喘息にどのような影響を与えるかを明らかにするには、ヒトの患者を対象としたさらなる研究が必要である<ref name="KimLee2013">{{cite journal|date=January 2014|title=Interleukin-17-producing innate lymphoid cells and the NLRP3 inflammasome facilitate obesity-associated airway hyperreactivity|journal=Nature Medicine|volume=20|issue=1|pages=54–61|doi=10.1038/nm.3423|pmid=24336249|pmc=3912313|vauthors=Kim HY, Lee HJ, Chang YJ, Pichavant M, Shore SA, Fitzgerald KA, Iwakura Y, Israel E, Bolger K, Faul J, DeKruyff RH, Umetsu DT|display-authors=6}}</ref>。 |
|||
=== 自己免疫疾患 === |
|||
NK細胞は、活性化性、抑制性、接着性、サイトカイン性、走化性などに関する[[細胞表面受容体]]を数多く発現している。これら多くの情報を統合することで、NK細胞は[[免疫寛容|自己寛容]]を維持し、自己細胞のストレス信号を認識することができる<ref name="vivier44">{{cite journal|date=January 2011|title=Innate or adaptive immunity? The example of natural killer cells|journal=Science|volume=331|issue=6013|pages=44–9|bibcode=2011Sci...331...44V|doi=10.1126/science.1198687|pmid=21212348|pmc=3089969|vauthors=Vivier E, Raulet DH, Moretta A, Caligiuri MA, Zitvogel L, Lanier LL, Yokoyama WM, Ugolini S|display-authors=6}}</ref>。もし、NK細胞活性化の微妙で動的な調節が自己細胞を攻撃する方に偏ると、[[自己免疫疾患]]の病態が発生する。NK細胞の制御異常は、[[多発性硬化症]]、[[全身性エリテマトーデス]]、[[1型糖尿病]]など多くの自己免疫疾患に関与している<ref>{{cite journal|date=February 2002|title=The role of NK cells in autoimmune disease|journal=Autoimmunity|volume=35|issue=1|pages=1–14|doi=10.1080/08916930290005864|pmid=11908701|vauthors=Baxter AG, Smyth MJ|s2cid=28199633}}</ref>。 |
|||
ILCを標的とすることは、自己免疫疾患の治療法を開発する上で有益であると考えられている。ILCとT細胞は多くの重複した機能を持っているので、それらの活性化サイトカインを標的にした中和化がより良い選択肢であるかも知れない。また、IL-23、IL-1B、IL-6などの上流の活性化因子や、IL-7などの生存因子を標的とすることも、炎症性疾患の治療法の一つとして考えられる<ref name="PantaziPowell2019" />。 |
|||
=== アレルギー性鼻炎 === |
|||
[[ファイル:ILCs_in_allergic_rhinitis_7_PNG.png|代替文=A diagram of the nasal mucosa,an ILC2 cell, and an eosinophil cell, with arrows displaying their interactions with one another, and how these interactions cause allergic rhinitis.|サムネイル|200x200ピクセル|ILCは、アレルギー性鼻炎患者の鼻茸に存在し、正のフィードバックループを形成して炎症を促進し、疾患の病態生理に寄与している<ref name="EbboCrinier2017" />。]] |
|||
ILC2細胞の数は、慢性[[副鼻腔炎|鼻副鼻腔炎]]患者の[[鼻茸]]や、[[気管支喘息#アスピリン喘息|アスピリンで呼吸器疾患]]が悪化した患者など、アレルギー症状を呈する他の組織でも上昇することが判っている<ref name="PandaColonna2019" />。ILC2の存在量は、疾患の重症度と正の相関がある。 |
|||
ILC2は、上皮細胞が産生するTSLPと好酸球が産生するIL-4の存在により活性化される。そしてILC2は、IL-4、IL-5、IL-13を産生し、さらに好酸球を活性化するという[[ポジティブフィードバック|正のフィードバックループ]]で、炎症を促進する。このループを断ち切ることが、鼻炎の治療に繋がる可能性がある。NK細胞は有益な役割を果たしているようで、アレルギー性鼻炎の人には少なくなっている<ref name="ScordamagliaBalsamo2008">{{cite journal|date=February 2008|title=Perturbations of natural killer cell regulatory functions in respiratory allergic diseases|journal=The Journal of Allergy and Clinical Immunology|volume=121|issue=2|pages=479–85|doi=10.1016/j.jaci.2007.09.047|pmid=18061653|vauthors=Scordamaglia F, Balsamo M, Scordamaglia A, Moretta A, Mingari MC, Canonica GW, Moretta L, Vitale M|display-authors=6}}</ref>。 |
|||
=== 炎症性腸疾患(IBD)と腸管癌 === |
|||
[[ファイル:ILCs_in_IBD_8_PNG.png|代替文=A diagram of the gut epithelium, displaying the ILC cells present in the environment, and how they interact with the epithelium and one another, causing inflammation and therefore IBD. The diagram displays the plasticity between ILC1s, into ILC3s, and vice versa, and the plasticity of ILC2s, being able to become ILC1 cells, in the presence of certain cytokines and effector cells.|サムネイル|300x300ピクセル|IBD患者の腸内に存在するILCと、その病態生理に寄与するサイトカインや他の免疫細胞<ref name="EbboCrinier2017" />]] |
|||
IL-17を産生するNCR<sup>-</sup> ILC3は、[[クローン病]]患者の腸内に多く存在することから、[[炎症性腸疾患|IBD]]の[[病態生理学|病態生理]]に寄与しているとの研究結果が出ている<ref name="EbboCrinier2017" />。また、クローン病患者の腸管粘膜に存在するILC1の数は、ILC全体の約10%から40%に増加しており<ref name="EbboCrinier2017" />、ILCの増加は病気の重症度と相関している。腸内のILC3とILC1の可塑性<ref group="注">性質が変化して別種の細胞となる現象。下記参照。</ref>がクローン病の重要な因子であることを示唆する証拠があり、樹状細胞が産生するIL-12にさらされるとILC3がILC1に分化する<ref name="EbboCrinier2017" />。しかし、腸内に存在するIL-23、IL-1B、レチノイン酸は、分化したILC1をILC3に戻すように促すことができる<ref name="EbboCrinier2017" />。また、クローン病患者の腸内にはIFN-γを産生するILC2が存在し、サイトカインなどの特定の環境因子に反応して、ILC2が炎症誘発性の表現型を獲得する能力があることも示唆されている<ref name="EbboCrinier2017" />。 |
|||
IBD患者は、慢性炎症時にILC3がILC1の炎症促進表現型を獲得すると、慢性炎症により[[大腸癌|腸管癌]]になるリスクが上昇する。IBD患者の腸内にはILCが蓄積しているため、ILCが腫瘍化を促進する役割を担っているのではないかと考えられている。これを裏付けるように、腸癌の腫瘍微小環境では、炎症誘発性サイトカインであるIL-23、IL-17、IL-22の量が増加しているという研究結果がある<ref name="LangowskiZhang2006">{{cite journal|date=July 2006|title=IL-23 promotes tumour incidence and growth|journal=Nature|volume=442|issue=7101|pages=461–5|bibcode=2006Natur.442..461L|doi=10.1038/nature04808|pmid=16688182|vauthors=Langowski JL, Zhang X, Wu L, Mattson JD, Chen T, Smith K, Basham B, McClanahan T, Kastelein RA, Oft M|s2cid=4431794|display-authors=6}}</ref><ref name="WuRhee2009">{{cite journal|date=September 2009|title=A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses|journal=Nature Medicine|volume=15|issue=9|pages=1016–22|doi=10.1038/nm.2015|pmid=19701202|pmc=3034219|vauthors=Wu S, Rhee KJ, Albesiano E, Rabizadeh S, Wu X, Yen HR, Huso DL, Brancati FL, Wick E, McAllister F, Housseau F, Pardoll DM, Sears CL|display-authors=6}}</ref><ref name="GrivennikovWang2012">{{cite journal|date=November 2012|title=Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth|journal=Nature|volume=491|issue=7423|pages=254–8|bibcode=2012Natur.491..254G|doi=10.1038/nature11465|pmid=23034650|pmc=3601659|vauthors=Grivennikov SI, Wang K, Mucida D, Stewart CA, Schnabl B, Jauch D, Taniguchi K, Yu GY, Osterreicher CH, Hung KE, Datz C, Feng Y, Fearon ER, Oukka M, Tessarollo L, Coppola V, Yarovinsky F, Cheroutre H, Eckmann L, Trinchieri G, Karin M|display-authors=6}}</ref>。 |
|||
NK細胞は、抗腫瘍効果のあるIFN-γを分泌する。複数の研究で、腸癌患者の腸や末梢血に存在するNK細胞とIFN-γの量が低下していることが示されている<ref name="BieZhang2014">{{cite journal|year=2014|title=Polarization of ILC2s in peripheral blood might contribute to immunosuppressive microenvironment in patients with gastric cancer|journal=Journal of Immunology Research|volume=2014|pages=923135|doi=10.1155/2014/923135|pmid=24741632|pmc=3987940|vauthors=Bie Q, Zhang P, Su Z, Zheng D, Ying X, Wu Y, Yang H, Chen D, Wang S, Xu H|display-authors=6|doi-access=free}}</ref><ref name="LeePark2017">{{cite journal|date=September 2017|title=Natural killer cell activity for IFN-gamma production as a supportive diagnostic marker for gastric cancer|journal=Oncotarget|volume=8|issue=41|pages=70431–70440|doi=10.18632/oncotarget.19712|pmid=29050291|pmc=5642566|vauthors=Lee J, Park KH, Ryu JH, Bae HJ, Choi A, Lee H, Lim J, Han K, Park CH, Jung ES, Oh EJ|display-authors=6|doi-access=free}}</ref>。腸癌の環境におけるこれらの細胞の正確な役割については、更なる研究が必要である。 |
|||
=== 肝癌と肥満 === |
|||
肝臓のILC1は、IFN-γ、TNF-αの産生により慢性B型肝炎の病態に寄与している。([[総胆管|総]])[[胆管]]を裏打ちする上皮の障害は、慢性肝炎に伴って頻繁に観察され、これらの胆管の増殖亢進は肝癌と関連している<ref name="OchelTiegs2019" />。この増殖亢進は、IL-33がILC2細胞を産生誘導することで生成されるIL-13が引き金となっている旨を示唆する証拠がある。また、ILC2は肝線維化の進行を促進し、ひいては肝がんの発生を促進することも明らかになっている<ref name="OchelTiegs2019" />。 |
|||
特定の食物性の栄養素の利用可能性は、脂肪組織に貯蔵されるエネルギーを変化させることによってILCの免疫恒常性に影響を与えうる。脂肪組織は代謝の恒常性を維持しており、現在では完全に免疫担当組織と考えられている。[[栄養失調]]と{{仮リンク|暴飲暴食|en|Gluttony}}は、食事の栄養素の変化を介してILCの反応を調節不全にし、脂肪組織に蓄えられるエネルギーに直接影響を与える<ref name="LuciVieira2019" />。肥満は、消化器微生物叢の変化、脂肪組織から肝臓への遊離[[脂肪酸]]の流出の増加、腸管透過性の亢進と関連している<ref name="LuciVieira2019" />。消化管と肝臓は解剖学的に近接しているため、細菌の代謝物が[[門脈]]を通って運ばれると、ILC1を含む自然免疫細胞に作用して炎症を誘発し、肝臓の炎症状態の発生に重要な役割を果たす。そのため、肥満に伴う炎症は、インスリン抵抗性や代謝異常の形成により、肝疾患の進行に影響を及ぼす可能性がある<ref name="LuciVieira2019" />。脂肪組織の炎症を制御するILC1は、肝臓疾患や[[メタボリック症候群]]の治療対象として期待されている。 |
|||
また、ILC2は、ヒトやマウスの[[脂肪組織|白色脂肪組織]]に存在し、肥満の原因となることが確認されている。脂肪組織の恒常性が乱されると、ILC2の反応が低下し、{{仮リンク|エネルギー恒常性|en|Energy homeostasis}}におけるILC2の重要な役割が阻害されるため、エネルギー消費量が減少し、脂肪が増加する点が肥満の特徴である<ref name=":1" />。 |
|||
=== 皮膚炎 === |
|||
[[アトピー性皮膚炎]]患者の炎症を起こした皮膚では、ILC2の数が健常者よりも高くなっている<ref name="EbboCrinier2017" />。患者の皮膚から採取されたILC2は、IL-25、IL-33、{{仮リンク|胸腺間質性リンパ球新生因子|en|Thymic stromal lymphopoietin|label=TSLP}}、{{仮リンク|プロスタグランジンD2|en|Prostaglandin D2|label=PGD<sub>2</sub>}}受容体の発現量が増加しており、ILC2の活性化に関与していることが示唆された。また、これらの皮膚病変部には[[好塩基球]]や[[肥満細胞]]が存在し、IL-4、PGD<sub>2</sub>を産生し、ILC2をさらに活性化させている。 |
|||
[[ファイル:ILCs_in_psoriasis_10_PNG.png|代替文= A diagram of the skin epidermis, and the ILC3s, and other effector cells (T cells, neutrophils) present in the environment, and their effector cytokines involved in causing psoriasis.|サムネイル|300x300ピクセル|乾癬患者の表皮に存在するILCと、炎症・表皮肥厚の原因に関与するサイトカインや細胞<ref name="EbboCrinier2017" />。]] |
|||
[[ファイル:ILCs_in_atopic_dermatitis_9_PNG_FINAL.png|代替文= A diagram of the skin epidermis, and the ILC2s, and other effector cells (basophils, and mast cells) present in the environment, and their effector cytokines involved in causing atopic dermatitis.|中央|サムネイル|250x250ピクセル|アトピー性皮膚炎の患者の表皮に存在するILCと、その病態生理の原因に関与する細胞やサイトカイン<ref name="EbboCrinier2017" />。]] |
|||
[[乾癬]]も炎症性皮膚疾患の一つであり、表皮が肥厚し、T細胞や樹状細胞が主に存在する皮疹を形成する。T細胞は1型免疫反応を示すが、表皮の肥厚と炎症は、[[Th17細胞]]や[[γδT細胞]]などの他のT細胞がIL-22、IL-17A、IL-17Fを産生することによって起こると考えられている<ref name="EbboCrinier2017" />。しかし、より最近のデータでは、ILC3数が増加してこれらのサイトカインを大量に産生していることが示唆されており、乾癬患者の末梢血ではILC3の数が増加しているという<ref name="EbboCrinier2017" />。 |
|||
== 可塑性 == |
|||
ILCのサブセットへの分類は単純化された枠組みを提供しているが、上記の[[自然リンパ球#分類|分類]]システムにも拘わらず、幾つかの研究では、ILCの発生と表現型の維持は遥かに複雑で、サブセット間で高度な[[表現型の可塑性|可塑性]]があることが示唆されている。幾つかのILCサブセットは、特定のサイトカインの存在下で異なるサブセットに変換する能力があることが確認されている<ref name="Colonna2018" /><ref name="Wagner 326–335" />。これはT細胞にも共通する特徴であり、この可塑性は、免疫系が多種多様な病原体に対する反応を微調整するために不可欠であると考えられている<ref name="Colonna2018" />。ILCの可塑性には、サイトカイン受容体、その転写因子、および転写因子が特定のクロマチン領域にアクセスすることが必要であるが、生体内のどこでサイトカインが産生され、どこで分化が起こるのかはまだ不明である<ref name="VivierArtis2018" />。[[ファイル:ILCs_in_COPD_11_PNG_FINAL.png|代替文= The lung epithelium after being triggered,by cigarette smoke, and the resulting effect this has on the ILCs in the microenvironment, in patients with COPD. This diagram displays the plasticity between the ILC2 and ILC1 cells in the presence of this trigger, and the cytokine IL-1B, causing an increase in the presence of ILC1, increasing the inflammation, and therefore contributing to the pathophysiology of the disease.|サムネイル|400x400ピクセル|COPD患者の肺に存在するILCは、微小環境に応じて異なるILC表現型に変換する能力を有しており、これが炎症を悪化させ、疾患の病態生理に寄与している<ref name="EbboCrinier2017" />。]] |
|||
[[慢性閉塞性肺疾患]](COPD)の患者に存在するILCは、ILCの可塑性の典型的な例である。ヒトやマウスを対象とした研究では、COPDになると肺に存在するILC2がILC1の表現型を獲得し、IFN-γの分泌が増加し、その結果、炎症が引き起こされることが知られている<ref name="BalBernink2016">{{cite journal|date=June 2016|title=IL-1β, IL-4 and IL-12 control the fate of group 2 innate lymphoid cells in human airway inflammation in the lungs|journal=Nature Immunology|volume=17|issue=6|pages=636–45|doi=10.1038/ni.3444|pmid=27111145|vauthors=Bal SM, Bernink JH, Nagasawa M, Groot J, Shikhagaie MM, Golebski K, van Drunen CM, Lutter R, Jonkers RE, Hombrink P, Bruchard M, Villaudy J, Munneke JM, Fokkens W, Erjefält JS, Spits H, Ros XR|s2cid=883747|display-authors=6}}</ref>。タバコの煙などのさまざまな誘因により、IL-12やIL-18が分泌され、ILC2がILC1に分化する。その際、GATA3の発現が低下し、T-betの発現が上昇する<ref name="BalBernink2016" />。そのため、患者の血中ILC1とILC2の比率は高く、ILC1の多さは病気の重症度と相関している<ref name="BalBernink2016" />。 |
|||
[[自然リンパ球#炎症性腸疾患(IBD)と腸管癌|ILC3がILC1様細胞に変化]]する能力は、''in vitro''および''in vivo''で示されている<ref name="CellaOtero2010">{{cite journal|date=June 2010|title=Expansion of human NK-22 cells with IL-7, IL-2, and IL-1beta reveals intrinsic functional plasticity|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=107|issue=24|pages=10961–6|bibcode=2010PNAS..10710961C|doi=10.1073/pnas.1005641107|pmid=20534450|pmc=2890739|vauthors=Cella M, Otero K, Colonna M|doi-access=free}}</ref><ref name="BerninkKrabbendam2015">{{cite journal|date=July 2015|title=Interleukin-12 and -23 Control Plasticity of CD127(+) Group 1 and Group 3 Innate Lymphoid Cells in the Intestinal Lamina Propria|journal=Immunity|volume=43|issue=1|pages=146–60|doi=10.1016/j.immuni.2015.06.019|pmid=26187413|vauthors=Bernink JH, Krabbendam L, Germar K, de Jong E, Gronke K, Kofoed-Nielsen M, Munneke JM, Hazenberg MD, Villaudy J, Buskens CJ, Bemelman WA, Diefenbach A, Blom B, Spits H|display-authors=6|doi-access=free}}</ref><ref name="Wagner 326–335" />。ILC3をIL-2とIL-15で培養すると、T-betとIL-12受容体(IL-12R)β2のアップレギュレーションが起こり、ILC3からILC1への転換が可能となる。また、IL-23はILC1からILC3への変換を促進することが示唆されている<ref name="BerninkKrabbendam2015" />。 |
|||
ILC2にもある程度の可塑性があることを示す証拠が増えて来ており、サイトカインやノッチリガンドなどの特定の環境刺激に曝されるとILC1やILC3に変化する能力が確認されている<ref name="ZhangXu2017">{{cite journal|date=March 2017|title=Cutting Edge: Notch Signaling Promotes the Plasticity of Group-2 Innate Lymphoid Cells|journal=Journal of Immunology|volume=198|issue=5|pages=1798–1803|doi=10.4049/jimmunol.1601421|pmid=28115527|pmc=5321819|vauthors=Zhang K, Xu X, Pasha MA, Siebel CW, Costello A, Haczku A, MacNamara K, Liang T, Zhu J, Bhandoola A, Maillard I, Yang Q|display-authors=6|doi-access=free}}</ref><ref name="Wagner 326–335" />。 |
|||
炎症、慢性疾患、腫瘍の微小環境などの特定の環境下では、活性化されたNK細胞はILC1の共通マーカーである{{仮リンク|インテグリンα1|en|Integrin alpha 1|label=CD49a}}や{{仮リンク|CXCR6|en|CXCR6}}を発現し始め、その可塑性を強める<ref name="GaoSouza-Fonseca-Guimaraes2017">{{cite journal|date=September 2017|title=Tumor immunoevasion by the conversion of effector NK cells into type 1 innate lymphoid cells|journal=Nature Immunology|volume=18|issue=9|pages=1004–1015|doi=10.1038/ni.3800|pmid=28759001|vauthors=Gao Y, Souza-Fonseca-Guimaraes F, Bald T, Ng SS, Young A, Ngiow SF, Rautela J, Straube J, Waddell N, Blake SJ, Yan J, Bartholin L, Lee JS, Vivier E, Takeda K, Messaoudene M, Zitvogel L, Teng MW, Belz GT, Engwerda CR, Huntington ND, Nakamura K, Hölzel M, Smyth MJ|s2cid=30239|display-authors=6}}</ref><ref name="CortezUlland2017">{{cite journal|date=September 2017|title=SMAD4 impedes the conversion of NK cells into ILC1-like cells by curtailing non-canonical TGF-β signaling|journal=Nature Immunology|volume=18|issue=9|pages=995–1003|doi=10.1038/ni.3809|pmid=28759002|pmc=5712491|vauthors=Cortez VS, Ulland TK, Cervantes-Barragan L, Bando JK, Robinette ML, Wang Q, White AJ, Gilfillan S, Cella M, Colonna M|display-authors=6}}</ref>。 |
|||
疾患時のILCの可塑性の程度を明らかにすることは、病原性の原因となりうる他のサブセットへの転換を防止または促進するために有用である<ref name="Wagner 326–335" /><ref>{{Cite journal|last1=Bald|first1=Tobias|last2=Wagner|first2=Marek|last3=Gao|first3=Yulong|last4=Koyasu|first4=Shigeo|last5=Smyth|first5=Mark J.|date=February 2019|title=Hide and seek: Plasticity of innate lymphoid cells in cancer|url=https://linkinghub.elsevier.com/retrieve/pii/S1044532318300769|journal=Seminars in Immunology|volume=41|pages=101273|language=en|doi=10.1016/j.smim.2019.04.001|pmid=30979591}}</ref>。 |
|||
== 自然免疫系と獲得免疫系 == |
|||
歴史的には、[[自然免疫系]]<small>([[:en:Innate immune system|英語版]])</small>と[[獲得免疫|獲得免疫系]]<small>([[:en:Adaptive immune system|英語版]])</small>の区別は、自然免疫系の非特異性と免疫記憶の欠如に焦点を当てていた<ref name="lanier73">{{cite journal|date=February 2013|title=Shades of grey--the blurring view of innate and adaptive immunity|url=https://cloudfront.escholarship.org/dist/prd/content/qt48w3h76m/qt48w3h76m.pdf|journal=Nature Reviews. Immunology|volume=13|issue=2|pages=73–4|doi=10.1038/nri3389|pmid=23469373|vauthors=Lanier LL|s2cid=27204420}}</ref>。しかし、NK細胞や他のILCが獲得免疫反応の活性化や調節に関して機能するという情報が出て来るに連れ、この区別はより明確ではなくなって来た。研究者の中には、自然免疫系の受容体が生殖細胞でコード化されていることと、獲得免疫系の受容体が再構成されていることを対比して定義すべきだという意見もある<ref name="vivier44" />。 |
|||
== 脚注 == |
|||
{{脚注ヘルプ}} |
|||
=== 注釈 === |
|||
{{Notelist2}} |
|||
=== 出典 === |
|||
{{Reflist|2}} |
{{Reflist|2}} |
||
| 37行目: | 251行目: | ||
* [[免疫系]] |
* [[免疫系]] |
||
* [[ナチュラルキラー細胞]] |
* [[ナチュラルキラー細胞]] |
||
== 外部リンク == |
|||
[https://katosei.jsbba.or.jp/view_html.php?aid=328 自然リンパ球(ILC: Innate Lymphoid Cell)の役割] |
|||
{{デフォルトソート:しせんりんはきゆう}} |
{{デフォルトソート:しせんりんはきゆう}} |
||
2024年9月20日 (金) 20:50時点における最新版
自然リンパ球(Innate lymphoid cells, ILC) とは共通のリンパ系前駆細胞(CLP)に由来する自然免疫系細胞である。病原性の組織損傷に反応してシグナル分子を分泌し、自然免疫細胞と獲得免疫細胞の両方を制御している。ILCは主に組織内に存在する細胞で、リンパ系組織(免疫関連組織)と非リンパ系組織の両方に存在し、まれに末梢血にも存在する。特に粘膜表面に多く局在し、粘膜の免疫と恒常性の維持に重要な役割を果たしている。リンパ球系に属する自然免疫細胞であるが、抗体特異的な応答はせず、B細胞、およびT細胞受容体を持たない(RAG遺伝子がないため)[1]。通常のリンパ系の形態を持たず、通常の骨髄系細胞や樹状細胞に見られる表現型マーカーを持つ[2]。
ILCは、発生経路、表現型、産生されるシグナル分子の違いから、2013年には1、2、3の3つのグループに分けられていたが[3]、さらなる調査の結果、NK細胞、ILC1、ILC2、ILC3、LTi(Lymphoid tissue inducer、リンパ組織誘導細胞)細胞の5つのグループに分類されている。
この細胞群はさまざまな生理的機能を持っており、組織の恒常性維持、形態形成、炎症反応、代謝、修復、再生など、複数の生理機能に関与している。ILCの役割の多くはT細胞と類似しており、ILCは獲得免疫系のT細胞と同等の役割を持つ自然免疫系細胞であると考えられる[4]。 ILCの調節不全は、アレルギー、気管支喘息、自己免疫疾患のような免疫疾患を引き起こす[1]。
分類
[編集]ILCの分化は、サイトカイン、ノッチリガンド、概日リズムなど、周囲の微小環境因子の存在によってスイッチが入る転写因子の存在に応じて開始される。成熟するとILCはサイトカインを放出する。ILCの分類はこれらに基づき、異なるILCサブタイプの発生と機能に関連する転写因子とサイトカインの種類の違いに着目している[5]。これらのうち、NK細胞、NH細胞、LTi細胞はそれぞれ、獲得免疫系のTh1細胞、Th2細胞、Th17細胞に対応したサイトカインを放出する[6]。
| 刺激因子 | 刺激シグナル | 細胞種 | 放出サイトカイン | 免疫学的機能 |
|---|---|---|---|---|
| 腫瘍
細胞内微生物(ウイルス、細菌、寄生虫) |
IL-12 |  |
IFN-γ | 1型免疫(マクロファージ活性化、細胞傷害性、酸素ラジカル) |
| 大きな細胞外分子(寄生虫、アレルゲン) | IL-25 |  |
IL-4, IL-5, IL-9, IL-13 | 2型免疫(粘液産生、マクロファージ活性化、細胞外マトリックス・組織修復、血管拡張、体温調節) |
| 細胞外微生物(細菌、真菌) | IL-1β |  |
IL-22, IL-17 | 3型免疫(食作用、抗菌ペプチド、上皮細胞生存) |
| 間葉系組織細胞(レチノイン酸、CXCL13、RANKL) | IL-1β |  |
RANK, TNF, リンホトキシン | 二次リンパ組織形成 |
グループ1
[編集]グループ1に属するILCはNK細胞(ナチュラルキラー細胞)およびILC1であり、インターフェロンγ(IFN-γ)および腫瘍壊死因子(TNF)に代表される1型サイトカイン群を産生する。NK細胞系統とILC1系統は、発生経路の早い段階で分岐し、転写因子への依存性、細胞毒性、常駐マーカーの発現などの違いによって区別される。
NK細胞は、血流中を循環し、ウイルスに感染した細胞や腫瘍細胞を殺傷する細胞傷害性細胞である。ILC1は、細胞毒性を持たない、あるいは弱い細胞障害性を持つ組織内常在細胞で、ウイルスや特定の細菌の感染を防御する機能を持つ。
ILC1とNK細胞には共通の特徴と非共通の特徴がある。どちらの細胞もIFN-γを主なサイトカインとして産生し、そのために転写因子T-betを必要とする[7]。またどちらも、感染や損傷後の組織でサイトカインIL-15やIL-12が上昇した場合にもIFN-γを産生し、刺激を受けるとIFN-γと同時にTGFβ1を分泌する。これにより、腸の上皮や細胞外マトリックスのリモデリングが促進される[8]。IL-18の共刺激でもIFN-γレベルが有意に上昇する[9]。IFN-γの放出は、マクロファージやその他の単核食細胞を刺激し、細胞内感染を根絶するための抗菌作用を誘発する。また、両方の細胞タイプによって生成される酸素ラジカルも、感染症の根絶を助ける。ILC1とNK細胞は、その分子の発現に応じて、TNF-αを産生し、炎症反応にさらに貢献することもできる。
NK細胞とILC1では、転写因子への依存性に違いがある。どちらの細胞タイプも発生にT-betを使用するが、NK細胞はT-betを欠損した宿主にも存在する一方、ILC1はT-betの存在に完全に依存していることが判っている[7]。逆に、NK細胞の発生は転写因子Eomesの存在に完全に依存しているが、ILC1はEomesの存在とは無関係に発生することができる[7]。つまり、Eomesは一般的にNK細胞のマーカーとして使用することができ、成熟したNK細胞はT-bet+ Eomes+であり、ILC1はT-bet+ Eomes-であることを示唆している[10]。
ILC1とNK細胞には共通の表現型マーカーが存在する。ILC1とNK細胞は、マウスのNK1.1、ヒトとマウスのNKp44やNKp46などのNK細胞受容体(NCR)などの表現型マーカーが共通している[11][7]。一方で、ヒトのILC1にはCD127が発現しているが、これは全てのNK細胞に存在する訳ではないなどの違いもある。さらに、ヒトのNK細胞のマーカーであるNKp80はILC1には発現していない。マウスでは、CD200RがNK細胞とILC1を区別することが示されている[12]。特定の組織で、あるいは特定の感染症や炎症の後に、一部のNK/ILC1細胞にこれらの特徴的なマーカーが発現していないことから、ILC1とNK細胞の系統の関係はまだ曖昧である。これは組織特異的機能説を支持するものである[11]。例えば、CD127はILC1の大部分で発現しているが、NK細胞の基本的特徴であるEomesを発現する能力も持っている唾液腺常在ILC1からは欠失している[13]。
グランザイムやパーフォリンを産生することから、NK細胞は獲得免疫系である細胞傷害性CD8+T細胞に対応する自然免疫系の機能であると考えられているが、ILC1は細胞傷害活性を伴わずIFN-γを単独で産生することから、ヘルパーT細胞に対応する自然免疫系機能と考えられている[14]。
グループ2
[編集]ILC2には、ナチュラルヘルパー細胞[15](NH細胞)、nuocytes[16]、自然2型ヘルパー細胞(Ih2細胞)[17]が含まれる。IL-25、TSLP、IL-33に反応して、グループ2に属するIL-4、IL-5、IL-9、IL-13、アンフィレグリンのような2型サイトカイン群を産生する[18][19]。
ILC2は、組織に常駐し、寄生虫に対する2型サイトカイン応答に決定的な役割を果たす。また、アレルギー性の肺炎症への関与が示唆されている。ILC2は、皮膚[20][21]、肺、肝臓、腸などの組織に多く存在する[18][22]。ILC2は特徴的な表面マーカーおよびケモカイン受容体を発現しており、リンパ球の特定臓器への分配に関わる。ヒトでは、ILC2はCRTH2、KLRG1、SST2、CD161、CD25を発現している[23]。マウスでは、ILC2はCD44を発現しているが、CD161は発現していない[23]。ILC2の発生時、転写因子(RORα、およびGATA3) の活性化にIL-7が必要である。GATA3はILC2の発生と機能維持に必要とされる。ILC2は肺におけるTh2抗原への応答に必須であるが、全身性のTh2抗原応答には必要ではない[24]。
ILC2は、IL-33やIL-25に対する反応性に応じて、自然型ILC2(nILC2)と炎症型ILC2(iILC2)という亜集団に分類される[4]。nILC2は、自然な免疫状態の組織でIL-33に反応するもので、iILC2はIL-25や寄生虫に反応するものである[4]。nILC2は、Thy1とST2を高発現し、KLRG1は低発現である[4]。iILC2は、KLRG1を多く発現し、Thy1とST2は少ない[4]。これらの亜集団に加えて、ILC210細胞と呼ばれる別の集団は、IL-10を産生する能力を特徴としている[4]。
グループ3
[編集]グループ3に属するILC3はIL-17AまたはIL-22を産生する能力により特徴付けられる。ILC3はNK細胞マーカーを発現しているにもかかわらず、NK細胞とは大きく異なり、転写因子RORγtを必要とし、細胞傷害性因子を分泌せず、IFN-γやTNFを産生しない。
ILC3は細胞外の細菌や真菌に対する自然免疫反応に関与している。ILC3は、腸内細菌の恒常性とTh17細胞の応答の制御に重要な役割を果たしている[25]。ヒト成人のILC3は、主に腸の粘膜固有層と扁桃腺に存在する他、脾臓、子宮内膜、脱落膜、皮膚にも存在する[26]。
ILC3は、その発生と機能が転写因子RORγtに依存しており[27]、IL-1βやIL-23などの病原性シグナルに応答してRORγtを発現する[28]。 IL-22はILC3が産生する主要なサイトカインであり、腸の恒常性維持に基本的な役割を果たしている。さらにILC3は、環境刺激に応じて、IL-17、IL-22、IFN-γ、GM-CSFなど、他のさまざまなサイトカインを産生する[29]。
ILC3にはNCR-とNCR+の2つのサブセットがある。マウスのILC3のNCR[注 1]はNKp46であるのに対し、ヒトのILC3のNCRはNKp44である[29]。 NKp44+ ILC3はIL-22の独占的供給源として扁桃腺や腸に非常に多く存在する[29]。ILC3の中には、NKp30やCD56などの他のNK細胞マーカーを発現するものもある[30]。NCR- ILC3は主にIL-17AとIL-17Fを産生し、特定の状況下ではIL-22も産生する[31]。NCR- ILC3はT-betの発現量が増加するとNCR+に分化できる[32]。
リンパ組織誘導細胞
[編集]リンパ組織誘導細胞(LTi細胞)はリンパ系の発生に必要な分子群を発現するILCの一群である。これらは、胚発生中のリンパ系の発生に必須であり、出生後もリンパ系の構造維持に必要である。さらに、T細胞の免疫記憶の維持にも関わっている[33]。
LTi細胞は、そのユニークな発生経路から別の系統と考えられているが、多くの類似した特徴を持つことから、ILC3グループの一部と考えられることが多い。ILC3と同様に、LTi細胞はRORγtに依存している。LTi細胞は、TNFファミリーの一員であるリンホトキシンの作用により、リンパ組織の発達を促進し、二次リンパ節やパイエル板の形成に関与している[7]。LTi細胞は、胚期と成体期の両方における免疫系の発達で重要な役割を果たしており、そのためLTi細胞は胚期の早い段階で臓器や組織に存在している[7]。LTi細胞は、一次リンパ組織と二次リンパ組織の組織化、および成体のリンパ組織において、獲得免疫反応を制御し、二次リンパ組織の構造を維持するという極めて重要な役割を担っている[34]。
その産生は、レチノイン酸、CXCL13、RANKL、サイトカインIL-1β、IL-23、IL-6によって刺激される[35]。c-Kit、CCR6、CD25、CD127、CD90を発現するが、NCRは発現しない[7]。OX40Lの発現は、成体マウスおよびヒトにおけるLTi細胞のもう一つの優れたマーカーである[36]。LTi細胞は、CD4+/-のいずれかになる。ILC3と同様に、LTi細胞は、活性化されるとほとんどが、IL-17A、IL-17F、IL-22を産生する[31]。これは、RANK、TNF、IL-17、IL-22によって媒介される。
LTi細胞は、胚の胸腺上皮細胞の発達を促すことで、リンホトキシンα4β7とRANKLのシグナルを介して自己免疫調節遺伝子(AIRE )の発現を誘導する[36]。 LTi細胞はまた、新しく形成されたリンパ節内で、CD4+T細胞にシグナルを送るTNFファミリーのOX40LとCD30Lを介して記憶CD4+T細胞の生存を可能にし、したがって記憶免疫応答を可能にする[36]。この役割は、自己免疫を予防したり、ワクチン接種後の記憶反応を高めたりするために利用できる[36]。
発生
[編集]リンパ球系共通前駆細胞(CLP)は与えられるシグナルに応じてT細胞、B細胞、そしてILCを含むさまざまな細胞に分化することができる。NK細胞を除き、すべてのILCは生存のためにIL-7シグナルが必要である。転写抑制因子であるID2はB細胞およびT細胞分化に拮抗し、ID2依存性前駆体へと分化させる[37]。この前駆体はさらに系統特異的な転写因子により分化する[37]。ILCの異なるグループは共通の前駆細胞を持つ[38]。ILCは、組換え活性化遺伝子(RAG)に依存せず、サイトカイン受容体共通ガンマ鎖とJAK3キナーゼ経路を介したサイトカインシグナルに依存して発生する[39]。
発生初期
[編集]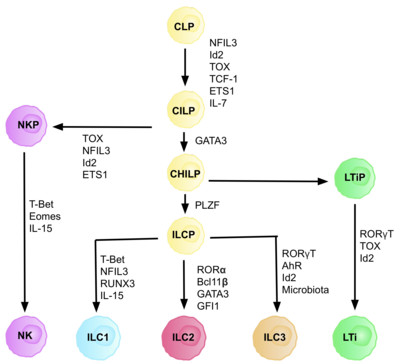
ILCは、CLPから派生した自然リンパ球共通前駆細胞(CILP)に由来する。CILPは、T細胞やB細胞を含む多くの異なるリンパ系細胞に分化する能力を持つ[7]。CILPはその後、ナチュラルキラー前駆細胞(NKP)や、より最近報告されたヘルパー様自然リンパ球共通前駆細胞(CHILP)に分化することができる[7]。CHILPは、その後、リンパ組織誘導前駆細胞(LTiP)や自然リンパ球共通前駆細胞(ILCP)に分化する。微小環境に存在する因子は、ノッチリガンド、サイトカイン、概日リズム、転写因子の発現などであり、CLPがどのILCサブタイプに分化するかを決定する[要出典]。
自然リンパ球共通前駆細胞(ILCP)
[編集]CLPからCILP、そしてILCへと成長する過程では、転写因子ID2が、リンパ系細胞のT細胞やB細胞への分化を抑制する役割を担っている[39]。ID2は、B細胞やT細胞の発生に重要なE-box転写因子(E2A、E2-2、HEB)の活性を低下させることで、その役割を果たしている[39]。当初より、CLPがILCサブセットのいずれかに分化するためにはID2が必要であると考えられており、実際、CLPの発生過程でID2をノックアウトすると、ID2の存在に依存しないNK前駆細胞を除くすべてのILCサブセットの発生が阻害されることが明らかにされた[40]。この事実により、ID2の存在に完全に依存し、主要なILCマーカーを発現する、他系統マーカー陰性(Lin-[注 2])の細胞群(真の前駆細胞の要件)が同定され、その表現型は、Lin-ID2+IL7Ra+CD25-α4β7+であり、これは現在、ヘルパー様自然リンパ球共通前駆細胞CHILPとして知られている[40]。これらの細胞は、ヘルパーT細胞の分化に類似していることから、「ヘルパー様」と名付けられた。
転写因子依存性
[編集]分化の各ステージは、さまざまな転写因子の発現に依存している。NFIL3、TCF-1、ETS1、GATA3、PLZF、T-bet、Eomes、RUNX3、RORα、Bcl11b、Gfi1、RORγt、AhRなどである[7]。これらの転写因子が協調して発現することにより、リンパ球サブセットの分化に重要な標的遺伝子が活性化されたり、抑制されたりする[39]。特に、サイトカインによって発現が制御されるNfil3は、転写因子Id2、RORγt、Eomes、Toxを介してILCの分化を制御している[41]。これにより、組織シグナルがILC系統への分化決定に重要な役割を果たしていることが証明された。
起源と移行
[編集]研究によると、ILCの主な発生場所は、胎児では肝臓、成人では骨髄であり、ここでCLP、NKP、CHILPが発見されている[39]。その後、細胞は、細胞接着分子やケモカインによってコード化された指定の組織に到達するまで、血液中に出て循環する[39]。しかし、ILCの成熟は、ナイーブヘルパーT細胞の成熟と同様に、一次リンパ組織の外で行われる可能性があることも明らかになっている。
NK前駆細胞やILC3前駆細胞はヒトの扁桃腺で発見されており、胎児のILCPはマウスの腸内でパイエル板に集積している[42][43]。レチノイン酸は、神経細胞、樹状細胞、間質細胞など多くの細胞から産生されるが、ILC2よりもILC3の分化に有利であり、ILC3の完全な成熟に必要である[39]。また、食物の異化後に産生されるリガンドを介して発現するAhRは、腸内ILC3の機能と発現の維持に必要である[42]。
機能
[編集]ILCは、あらゆる臓器、特に粘膜表面で病原体に対する免疫反応を担っている[44]。ILCは、免疫調節サイトカインを迅速に分泌する能力を持ち、自然免疫反応の鍵を握っているが、他の免疫細胞との相互作用によって獲得免疫反応の形成にも関与している。ILCが存在する組織の微小環境は、多様なILCプロファイルの発現を決定し、微調整することで、複数のエフェクター機能におけるILCの相互作用を促進する。
ILCが組織内の要所々々に配置され深く根付いていることで、恒常性が維持され、その結果、健全な組織機能を維持することができる。しかし、ILCはさまざまな粘膜部位で有害となる役割も果たしている[45]。
ILCの機能はその組織内での局在部位と関連しているため、ILCの局在や移動に関与するシグナルを明らかにすることは、疾患の治療に向けた新たな道筋を見出す上で重要である[46]。
寄生虫感染と組織修復
[編集]2型免疫、つまりILC2細胞の基本的な特性は、蠕虫のような消化不能の大型生物への対処である[47]。腸内では、蠕虫の感染に反応して、上皮細胞がIL-25を大量に分泌し、ILC2細胞を活性化する。ILC2はIL-13を産生し、Notchシグナル伝達経路を介して、さらに上皮細胞の分化を促す。この指示により、蠕虫の寄生体やその他の大きな病原体を排出できるように組織が再構築される。
また、IL-13はT細胞を活性化し、寄生虫を追い出すためのさらなる生理的反応を誘発する[48]。T細胞は杯細胞の粘液分泌を促し、平滑筋を収縮させ、肥満細胞や好酸球を呼び寄せるシグナルを分泌し、B細胞の増殖を促す[48]。
感染すると、蠕虫の移動に伴い、組織の損傷が拡大する。ILC2は、上皮成長因子受容体に対するAREGなどのリガンドを産生し、組織修復のための上皮細胞の分化を促進することで、感染後の組織損傷を修復する重要な役割を担っている[49]。これにより、上皮のバリア機能を高め、病原体の侵入を遅らせる機能が期待できる[48]。

複数の組織内微小環境において、ILCは間質細胞のような非造血性細胞との関係が深い。肺では、ILC2は間質細胞に特異的に局在し、間質細胞はIL-33やTSLPを放出し、ILC2の維持に寄与している。定常状態でも、蠕虫が腸から侵入し血液を介して肺に移動した後の感染への反応でも、ILC2の機能は維持される[50]。
肺のILC2は、血液中の好酸球を呼び込めるように、血管の近くに位置している。また、病原体が溜まる可能性のある気道内にも位置している。これは、カルシトニン遺伝子関連ペプチドの放出を通じてILC2を活性化する神経内分泌細胞と密接に接触していることを意味する[51]。また、神経回路を介してILCの機能が制御されていることも確認されている。
加えて、ILC1とILC3は病原体の感染に反応して、酸素ラジカルや致死的なダメージを与える酵素を放出し、その結果宿主組織にダメージを与える。組織の修復反応は、ILC3とILC1が組織から微生物や破片を除去した後、2型免疫反応によって調整される。
腸粘膜
[編集]腸のILCは、食物、微生物、内因性代謝物に晒されている。ILCの小腸への帰還は、α4β7インテグリンと受容体であるCCR9によって行われる。ILC2は骨髄でCCR9を発現しているので直接腸に帰還できるが、ILC1やILC3にCCR9を発現させるにはレチノイン酸が必要である。
ILCは、腸内のバリアーの維持を促進し、さまざまな細菌やウイルスの感染から保護する。ILC3は、成人と胎児の両方の腸に最も多く存在するサブセットである[52]。腸内のILCの分布は発生過程で変化し、消化管の各部位に不均等に分布している。このような腸内各部位への偏在は、それぞれ異なるシグナルカスケードに誘導される[53]。ヒトでは、腸内ILCの約70%がNCR+[注 1]、15%がNCR-である[54]。

ILC3は腸内細菌叢と直接相互作用し、微生物叢と宿主との間にネットワークを形成して恒常性を維持している。ILC3はIL-22を分泌し、上皮細胞を刺激して抗菌ペプチドを産生することで、腸内の複数の非有益な細菌のコロニー形成を制限する[55]。IL-22の分泌は、マクロファージや樹状細胞によるIL-23やIL-1βの産生に起因して誘導され、粘膜層の治癒を促進する[56]。例えば、IL-22は化学療法や放射線療法後の腸管損傷の修復を促進する。ILC3は、常在菌の内腔への封じ込めを制御し、粘膜固有食細胞への暴露を可能にし、T細胞の活性化に繋がる。ILC3は、MHCクラスII受容体を介して抗原を提示することができるが、共刺激分子を持たないため、T細胞アネルギー(不応答性)の役割を果たし、有益な常在菌に対する耐性を促進する[54]。したがって、ILC3と腸内T細胞の関係は、恒常性を維持する上で非常に重要である。ILC3が存在しない場合、T細胞の活性化が制御できなくなる可能性があるからだ。さらに、ILC3によるIL-22の産生を微調整する役割を微生物が担っている。例えば、回腸のセグメント細菌[注 3]は、IL-22の産生を調整し、Th17細胞の分化を可能にする[57][58]。
ILC3は腸管の恒常性を維持するために腸管神経系と相互作用する。細菌に反応して、粘膜固有層のグリア細胞が神経栄養因子を分泌し、その神経栄養因子が神経制御受容体RETを介してILC3にIL-22を産生させるからである[59]。また、樹状細胞は病原体によるストレス時にIL-23を産生し、ILC3を活性化してIL-22の産生を可能にする。IL-22が腸内の微生物を制御するメカニズムの一つは、上皮細胞のグリコシル化パターンを介したものであると考えられている[60]。ILC3によるIL-22とリンホトキシンの発現は、フコース転移酵素2の発現を制御し、上皮細胞のフコース化を可能にし、腸内細菌の栄養源となる[60]。
食事や微生物由来のAhRリガンドは、免疫細胞に認識され、腸内のILCの発達やNK細胞の機能を制御する。トリプトファン代謝物に応答して、AhRシグナルがIL-22の発現を維持し、腸の恒常性を維持する[49]。樹状細胞が産生するレチノイン酸は、RORγtとIL-22をアップレギュレートすることで、ILC1とILC3の腸管帰還受容体の発現を促進し、ILC3の機能を高める[49]。また、マクロファージとILC3sの間には、微生物のシグナル伝達に依存したRORγtによるGM-CSFの産生や、マクロファージによるIL-1βの産生を介した相互作用が存在する[54]。食事性ビタミンAが不足すると、ILC3の数が異常に少なくなり、IL-22の産生が低下して感染症に罹りやすくなる。逆に、レチノイン酸はIL-7RαをダウンレギュレートすることでILC2の増殖を抑制し、ビタミンAを欠乏させるとILC2を介したマウスの蠕虫感染に対する抵抗性が高まることが示されている[54]。したがって、ILC3は、微生物叢、腸上皮、神経グリア細胞、その他の免疫細胞の間で、腸の恒常性を維持するための相互作用のネットワークを形成している。
LTi細胞はパイエル板やリンパ濾胞に存在し、B細胞と相互作用してIgAの産生を促進し、宿主と局所微生物群との共生を促進する[61]。ILC1とNK細胞はIFN-γを産生し、細胞内の病原体と闘う。C. dificileが感染すると、ILC1とILC3が協力して感染に対抗する[62]。ILC2は、寄生虫感染時に組織の損傷から守るために、腸内で杯細胞の分化と粘液の産生を誘導する。
腫瘍微小環境
[編集]自然リンパ系細胞のさまざまなグループは、幾つかの方法で腫瘍形成に影響を与える[63][64]。
ILC1は、最も重要な抗腫瘍能力を持つILCの集団であり、NK細胞は腫瘍細胞の表面の欠損したMHCクラスIを認識する能力を持っており[65]、MHCクラスI上に外来抗原を提示している腫瘍細胞を認識して殺す細胞傷害性T細胞と補完的に作用する[66][67]。NK細胞は細胞表面に、腫瘍細胞上に過剰に発現したストレス誘導リガンドに特異的なNK細胞活性化受容体を多数発現している。
ILC1は、サイトカインであるIFN-γとTNF-αを産生することで腫瘍微小環境に影響を与える。IFN-γとTNF-αは、免疫反応の初期に、M1マクロファージ、樹状細胞、細胞傷害性T細胞などの他の免疫細胞を極性化[注 4]させ、炎症環境を作り出す[68]。上手くいけば、これらの細胞が集まって来て、腫瘍化した細胞を殺すことができる。しかし場合によっては、IFN-γやTNF-αが骨髄由来抑制細胞などの免疫抑制性の免疫細胞や抗炎症性サイトカインを誘導し、腫瘍細胞が逃避できるような免疫環境を作ることもある[69][70][64]。
腫瘍監視におけるILC2とILC3の役割は、これらの細胞が存在する組織の微小環境に依存している。
ILC2は、IL-13、IL-4、アンフィレグリンなどの抗炎症免疫反応を促進するサイトカインを産生し、腫瘍の成長を促進する[71]。しかし、状況によってはILC2がIL-5を産生し、好酸球の細胞障害性反応を促進することで、抗腫瘍性反応を惹起する場合がある[72][73]。
ILC3もまた、腫瘍の増殖または抗腫瘍の環境に関与しうる。IL-17の産生は血管の透過性を亢進させるので、腫瘍の成長と転移を促進するが、ILC3の表面にあるMHCクラスIIのアップレギュレーションは、CD4+T細胞を活性化し、抗腫瘍効果を発揮する[74]。また、ILC3は、肺癌における三次リンパ系構造の形成を促進し、保護的な役割を果たすことが報告されている[75]。
肝臓と脂肪組織
[編集]
・Macrophage polarisation:微小環境に応じた細胞の可逆的変化
・Gut homing:血流中のリンパ球が腸管に集まる現象
・MetEnk:メチオニン-エンケファリン
・VAT homeostasis:内臓脂肪組織の恒常性
・Beiging:白色脂肪細胞の褐色化(ベージュ脂肪細胞への変化)
総てのILCサブセットは肝臓に存在し、ウイルスや細菌の感染から組織を守るための免疫反応を制御している[77]。ILC1は肝臓に存在する支配的なILCサブセットである。IFN-γの産生は、肝細胞の生存を促進する[78]。ILC1によるIFN-γの産生は、NK細胞受容体CD226の発現に依存している[78]。ILC1によるIL-12を介したIFN-γの産生は、細胞外のATPによって促進され、IFN-γは肝細胞の生存促進分子であるBcl-2、Bcl-xLをアップレギュレートする[78]。
NK細胞は、ウイルス性のB型およびC型肝炎、局所性の肝線維症、肝癌に対する免疫反応に貢献している。NK細胞は、TRAILやNKG2Dを介して、線維化した肝臓の肝細胞を排除する。
ILCは、食事の負荷への対処や、代謝の恒常性の維持に重要な役割を果たしている。トリプトファン代謝物の産生により、AhR転写因子がIL-22の発現を誘導し、ILC3の存在数を維持し、その結果、腸の恒常性が維持されるのである[7]。ビタミンAの代謝物であるレチノイン酸もまた、IL-22の発現をアップレギュレートする。したがって、AhRシグナル伝達経路およびレチノイン酸がないと、消化管の腸粘膜肥厚症菌感染症などの細菌感染に対する免疫力が低下する[7]。レチノイン酸はまた、ILC1やILC3の腸管帰還マーカーの発現を増強する。このように、食事から得られる栄養素は、感染症や炎症に対するILCの免疫反応を変化させるため、バランスのとれた健康的な食事の重要性が強調される。
ILC2は、IL-5、IL-4、IL-13の産生を介して、脂肪組織における2型免疫環境をサポートしている。これにより、脂肪蓄積、インスリン抵抗性、カロリー消費量が調節される[7]。これが調節されないと、1型炎症が持続し、肥満の原因となる。ILC2は、白色脂肪細胞の褐色化を促進し、その結果、エネルギー消費量が増加する。したがって、組織内のILC2の反応が低下すると、エネルギー恒常性におけるILC2の重要な役割が阻害され、結果としてエネルギー消費量が減少し、脂肪が増加するため、肥満症となる[79]。ILC2に加えて、ILC1も脂肪組織のマクロファージの恒常性維持に貢献しており、ヒトの脂肪組織では常在リンパ球数の5-10%を占めている[11]。高脂肪食はILC1の数を増やし、脂肪組織を活性化し、IFN-γやTNF-αの量を増加させる。ILC1はマクロファージの化学誘引物質であるCCL2を産生するため、ILC1-マクロファージ間のシグナル伝達は脂肪組織の重要な調節因子であると考えられる[80]。この経路は、肝疾患の患者を治療するためのターゲットになる可能性がある。
呼吸器感染症
[編集]ILC2は、上皮細胞や杯細胞の増殖を促進し、その結果、気道における粘液の産生を促進する。これらの機能は、上皮の完全性の回復と維持に貢献している。ILC2は、AhR、IL-9、IL-13の産生を介して、肺の寄生虫感染に対する防御機能を提供している[81]。これらのILC2は、腸で発生し、寄生虫感染と戦うために肺に移動すると考えられている[82]。
ILC1とNK細胞は、ライノウイルスや呼吸器合胞体ウイルス(RSV)などの肺のウイルス感染に反応してIFN-γを分泌する[4]。
また、ILC3はIL-17やIL-22を分泌して、肺炎連鎖球菌感染などの肺感染症にも関与している。ヒトの呼吸器感染症におけるILCの役割を明らかにするには、更なる研究が必要である[83]。
皮膚修復
[編集]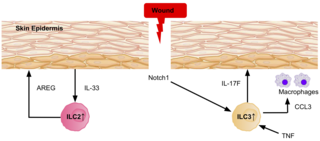
ILC3とILC2は、表皮のNotch1シグナルを介して、マウスとヒトの両方で創部真皮に誘導されることが明らかになっている[54]。ILC3はIL-17Fを分泌し、マクロファージを創傷部位に誘導することで、創傷治癒時の免疫および上皮細胞の反応に役割を果たす。TNFの発現もまた、ILC3の損傷した皮膚表皮への局在を指示することから、創傷治癒に一役買っている[54]。表皮からIL-33が放出されると、ILC2は重要な表皮成長因子であるアンフィレグリンを大量に分泌し、皮膚の創傷治癒に貢献する[54]。
病理
[編集]喘息
[編集]
・Mast Cell:肥満細胞
・Dendritic Cell:樹状細胞
・Basophil:好塩基球
・Eosinophil:好酸球
ILC2は、肺の炎症時に病原体としての役割を果たすことが確認されている。肺の上皮細胞は、さまざまなアレルゲン、真菌、ウイルスなどに反応して、サイトカインであるIL-33やIL-25、あるいはTSLPを発現する。これらのサイトカインはILC2を活性化するため、アレルギー性喘息の患者ではILC2の数が増加し、2型のサイトカイン(IL-4/5/13)が放出される[4]。これらはIL-13を分泌し、アレルギー性肺炎を開始し、さらにTh2分化を促進してIL-13の産生を増加させ、その結果、アレルギー反応を増幅させる[84]。
肺のILC2によるIL-5の産生は、好酸球の動員に繋がり、他の細胞集団は、喘息患者の気道炎症において肺のILC2と相互作用し、ILC2を活性化することが知られている。さらに、ILC2はB細胞の増殖も促進する。ILC2の増加は疾患の重症度と相関していると考えられており、「アレルゲンを経験した」ILC2の一部は、初期の炎症が治まった後も残存し、記憶T細胞に類似した性質を持つことが確認されている。喘息患者がさまざまなアレルゲンに感作されることが多いのは、この「アレルゲンを経験した」ILC2の存在が理由であると考えられる[54]。
このアレルギー免疫反応は、T細胞やB細胞とは独立しているようで、T細胞やB細胞を欠損したマウスでも、IL-33を用いて喘息様症状に似たアレルギー反応が誘発されることが確認されている[85][86]。
他のILCが喘息にどのような影響を与えるかは明らかではないが、IL-17を産生するILC3の数と喘息の重症度との間に相関関係があることが研究で示されている。また、マウスでは、NK細胞とILC1がIFN-γの産生によるILC2の増殖を抑制することが示されており、疾患のコントロールに役立つと考えられています。異なるサブセットのバランスが喘息にどのような影響を与えるかを明らかにするには、ヒトの患者を対象としたさらなる研究が必要である[87]。
自己免疫疾患
[編集]NK細胞は、活性化性、抑制性、接着性、サイトカイン性、走化性などに関する細胞表面受容体を数多く発現している。これら多くの情報を統合することで、NK細胞は自己寛容を維持し、自己細胞のストレス信号を認識することができる[88]。もし、NK細胞活性化の微妙で動的な調節が自己細胞を攻撃する方に偏ると、自己免疫疾患の病態が発生する。NK細胞の制御異常は、多発性硬化症、全身性エリテマトーデス、1型糖尿病など多くの自己免疫疾患に関与している[89]。
ILCを標的とすることは、自己免疫疾患の治療法を開発する上で有益であると考えられている。ILCとT細胞は多くの重複した機能を持っているので、それらの活性化サイトカインを標的にした中和化がより良い選択肢であるかも知れない。また、IL-23、IL-1B、IL-6などの上流の活性化因子や、IL-7などの生存因子を標的とすることも、炎症性疾患の治療法の一つとして考えられる[29]。
アレルギー性鼻炎
[編集]
ILC2細胞の数は、慢性鼻副鼻腔炎患者の鼻茸や、アスピリンで呼吸器疾患が悪化した患者など、アレルギー症状を呈する他の組織でも上昇することが判っている[4]。ILC2の存在量は、疾患の重症度と正の相関がある。
ILC2は、上皮細胞が産生するTSLPと好酸球が産生するIL-4の存在により活性化される。そしてILC2は、IL-4、IL-5、IL-13を産生し、さらに好酸球を活性化するという正のフィードバックループで、炎症を促進する。このループを断ち切ることが、鼻炎の治療に繋がる可能性がある。NK細胞は有益な役割を果たしているようで、アレルギー性鼻炎の人には少なくなっている[90]。
炎症性腸疾患(IBD)と腸管癌
[編集]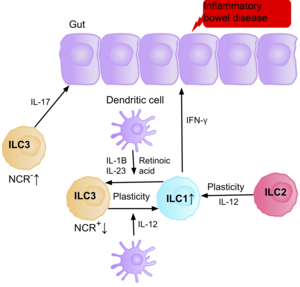
IL-17を産生するNCR- ILC3は、クローン病患者の腸内に多く存在することから、IBDの病態生理に寄与しているとの研究結果が出ている[54]。また、クローン病患者の腸管粘膜に存在するILC1の数は、ILC全体の約10%から40%に増加しており[54]、ILCの増加は病気の重症度と相関している。腸内のILC3とILC1の可塑性[注 5]がクローン病の重要な因子であることを示唆する証拠があり、樹状細胞が産生するIL-12にさらされるとILC3がILC1に分化する[54]。しかし、腸内に存在するIL-23、IL-1B、レチノイン酸は、分化したILC1をILC3に戻すように促すことができる[54]。また、クローン病患者の腸内にはIFN-γを産生するILC2が存在し、サイトカインなどの特定の環境因子に反応して、ILC2が炎症誘発性の表現型を獲得する能力があることも示唆されている[54]。
IBD患者は、慢性炎症時にILC3がILC1の炎症促進表現型を獲得すると、慢性炎症により腸管癌になるリスクが上昇する。IBD患者の腸内にはILCが蓄積しているため、ILCが腫瘍化を促進する役割を担っているのではないかと考えられている。これを裏付けるように、腸癌の腫瘍微小環境では、炎症誘発性サイトカインであるIL-23、IL-17、IL-22の量が増加しているという研究結果がある[91][92][93]。
NK細胞は、抗腫瘍効果のあるIFN-γを分泌する。複数の研究で、腸癌患者の腸や末梢血に存在するNK細胞とIFN-γの量が低下していることが示されている[94][95]。腸癌の環境におけるこれらの細胞の正確な役割については、更なる研究が必要である。
肝癌と肥満
[編集]肝臓のILC1は、IFN-γ、TNF-αの産生により慢性B型肝炎の病態に寄与している。(総)胆管を裏打ちする上皮の障害は、慢性肝炎に伴って頻繁に観察され、これらの胆管の増殖亢進は肝癌と関連している[77]。この増殖亢進は、IL-33がILC2細胞を産生誘導することで生成されるIL-13が引き金となっている旨を示唆する証拠がある。また、ILC2は肝線維化の進行を促進し、ひいては肝がんの発生を促進することも明らかになっている[77]。
特定の食物性の栄養素の利用可能性は、脂肪組織に貯蔵されるエネルギーを変化させることによってILCの免疫恒常性に影響を与えうる。脂肪組織は代謝の恒常性を維持しており、現在では完全に免疫担当組織と考えられている。栄養失調と暴飲暴食は、食事の栄養素の変化を介してILCの反応を調節不全にし、脂肪組織に蓄えられるエネルギーに直接影響を与える[11]。肥満は、消化器微生物叢の変化、脂肪組織から肝臓への遊離脂肪酸の流出の増加、腸管透過性の亢進と関連している[11]。消化管と肝臓は解剖学的に近接しているため、細菌の代謝物が門脈を通って運ばれると、ILC1を含む自然免疫細胞に作用して炎症を誘発し、肝臓の炎症状態の発生に重要な役割を果たす。そのため、肥満に伴う炎症は、インスリン抵抗性や代謝異常の形成により、肝疾患の進行に影響を及ぼす可能性がある[11]。脂肪組織の炎症を制御するILC1は、肝臓疾患やメタボリック症候群の治療対象として期待されている。
また、ILC2は、ヒトやマウスの白色脂肪組織に存在し、肥満の原因となることが確認されている。脂肪組織の恒常性が乱されると、ILC2の反応が低下し、エネルギー恒常性におけるILC2の重要な役割が阻害されるため、エネルギー消費量が減少し、脂肪が増加する点が肥満の特徴である[79]。
皮膚炎
[編集]アトピー性皮膚炎患者の炎症を起こした皮膚では、ILC2の数が健常者よりも高くなっている[54]。患者の皮膚から採取されたILC2は、IL-25、IL-33、TSLP、PGD2受容体の発現量が増加しており、ILC2の活性化に関与していることが示唆された。また、これらの皮膚病変部には好塩基球や肥満細胞が存在し、IL-4、PGD2を産生し、ILC2をさらに活性化させている。


乾癬も炎症性皮膚疾患の一つであり、表皮が肥厚し、T細胞や樹状細胞が主に存在する皮疹を形成する。T細胞は1型免疫反応を示すが、表皮の肥厚と炎症は、Th17細胞やγδT細胞などの他のT細胞がIL-22、IL-17A、IL-17Fを産生することによって起こると考えられている[54]。しかし、より最近のデータでは、ILC3数が増加してこれらのサイトカインを大量に産生していることが示唆されており、乾癬患者の末梢血ではILC3の数が増加しているという[54]。
可塑性
[編集]ILCのサブセットへの分類は単純化された枠組みを提供しているが、上記の分類システムにも拘わらず、幾つかの研究では、ILCの発生と表現型の維持は遥かに複雑で、サブセット間で高度な可塑性があることが示唆されている。幾つかのILCサブセットは、特定のサイトカインの存在下で異なるサブセットに変換する能力があることが確認されている[14][63]。これはT細胞にも共通する特徴であり、この可塑性は、免疫系が多種多様な病原体に対する反応を微調整するために不可欠であると考えられている[14]。ILCの可塑性には、サイトカイン受容体、その転写因子、および転写因子が特定のクロマチン領域にアクセスすることが必要であるが、生体内のどこでサイトカインが産生され、どこで分化が起こるのかはまだ不明である[7]。

慢性閉塞性肺疾患(COPD)の患者に存在するILCは、ILCの可塑性の典型的な例である。ヒトやマウスを対象とした研究では、COPDになると肺に存在するILC2がILC1の表現型を獲得し、IFN-γの分泌が増加し、その結果、炎症が引き起こされることが知られている[96]。タバコの煙などのさまざまな誘因により、IL-12やIL-18が分泌され、ILC2がILC1に分化する。その際、GATA3の発現が低下し、T-betの発現が上昇する[96]。そのため、患者の血中ILC1とILC2の比率は高く、ILC1の多さは病気の重症度と相関している[96]。
ILC3がILC1様細胞に変化する能力は、in vitroおよびin vivoで示されている[97][98][63]。ILC3をIL-2とIL-15で培養すると、T-betとIL-12受容体(IL-12R)β2のアップレギュレーションが起こり、ILC3からILC1への転換が可能となる。また、IL-23はILC1からILC3への変換を促進することが示唆されている[98]。
ILC2にもある程度の可塑性があることを示す証拠が増えて来ており、サイトカインやノッチリガンドなどの特定の環境刺激に曝されるとILC1やILC3に変化する能力が確認されている[99][63]。
炎症、慢性疾患、腫瘍の微小環境などの特定の環境下では、活性化されたNK細胞はILC1の共通マーカーであるCD49aやCXCR6を発現し始め、その可塑性を強める[100][101]。
疾患時のILCの可塑性の程度を明らかにすることは、病原性の原因となりうる他のサブセットへの転換を防止または促進するために有用である[63][102]。
自然免疫系と獲得免疫系
[編集]歴史的には、自然免疫系(英語版)と獲得免疫系(英語版)の区別は、自然免疫系の非特異性と免疫記憶の欠如に焦点を当てていた[103]。しかし、NK細胞や他のILCが獲得免疫反応の活性化や調節に関して機能するという情報が出て来るに連れ、この区別はより明確ではなくなって来た。研究者の中には、自然免疫系の受容体が生殖細胞でコード化されていることと、獲得免疫系の受容体が再構成されていることを対比して定義すべきだという意見もある[88]。
脚注
[編集]注釈
[編集]出典
[編集]- ^ a b Walker, Jennifer A.; Barlow, Jillian L.; McKenzie, Andrew N. J. (2013-02). “Innate lymphoid cells — how did we miss them?” (英語). Nature Reviews Immunology 13 (2): 75–87. doi:10.1038/nri3349. ISSN 1474-1733. PMID 23292121.
- ^ Spits, Hergen; Cupedo, Tom (2012-04-23). “Innate Lymphoid Cells: Emerging Insights in Development, Lineage Relationships, and Function” (英語). Annual Review of Immunology 30 (1): 647–675. doi:10.1146/annurev-immunol-020711-075053. ISSN 0732-0582. PMID 22224763.
- ^ Spits, Hergen; Artis, David; Colonna, Marco; Diefenbach, Andreas; Di Santo, James P.; Eberl, Gerard; Koyasu, Shigeo; Locksley, Richard M. et al. (2013-02). “Innate lymphoid cells — a proposal for uniform nomenclature” (英語). Nature Reviews Immunology 13 (2): 145–149. doi:10.1038/nri3365. ISSN 1474-1733.
- ^ a b c d e f g h i “Innate Lymphoid Cells in Mucosal Immunity”. Frontiers in Immunology 10: 861. (2019). doi:10.3389/fimmu.2019.00861. PMC 6515929. PMID 31134050.
- ^ “A T-bet gradient controls the fate and function of CCR6-RORγt+ innate lymphoid cells”. Nature 494 (7436): 261–5. (February 2013). Bibcode: 2013Natur.494..261K. doi:10.1038/nature11813. PMID 23334414.
- ^ 小安重夫、鈴木志乃/フォトンクリエイト (11 2013). “新しい免疫細胞:ナチュラルヘルパー細胞とは”. RIKEN NEWS 389: 4-7.
- ^ a b c d e f g h i j k l m n o “Innate Lymphoid Cells: 10 Years On”. Cell 174 (5): 1054–1066. (August 2018). doi:10.1016/j.cell.2018.07.017. PMID 30142344.
- ^ Jowett, Geraldine M.; Norman, Michael D. A.; Yu, Tracy T. L.; Rosell Arévalo, Patricia; Hoogland, Dominique; Lust, Suzette T.; Read, Emily; Hamrud, Eva et al. (2020-09-07). “ILC1 drive intestinal epithelial and matrix remodelling” (英語). Nature Materials 20 (2): 250–259. doi:10.1038/s41563-020-0783-8. ISSN 1476-4660. PMC 7611574. PMID 32895507.
- ^ “T-bet and Eomes instruct the development of two distinct natural killer cell lineages in the liver and in the bone marrow”. The Journal of Experimental Medicine 211 (3): 563–77. (March 2014). doi:10.1084/jem.20131560. PMC 3949572. PMID 24516120.
- ^ “T-bet and Eomesodermin in NK Cell Development, Maturation, and Function”. Frontiers in Immunology 7: 241. (2016). doi:10.3389/fimmu.2016.00241. PMC 4913100. PMID 27379101.
- ^ a b c d e f “Natural Killer Cells and Type 1 Innate Lymphoid Cells Are New Actors in Non-alcoholic Fatty Liver Disease”. Frontiers in Immunology 10: 1192. (2019). doi:10.3389/fimmu.2019.01192. PMC 6546848. PMID 31191550.
- ^ “ILC1 Confer Early Host Protection at Initial Sites of Viral Infection”. Cell 171 (4): 795–808.e12. (November 2017). doi:10.1016/j.cell.2017.09.052. PMC 5687850. PMID 29056343.
- ^ “Cutting edge: Salivary gland NK cells develop independently of Nfil3 in steady-state”. Journal of Immunology 192 (10): 4487–91. (May 2014). doi:10.4049/jimmunol.1303469. PMID 24740507.
- ^ a b c “Innate Lymphoid Cells: Diversity, Plasticity, and Unique Functions in Immunity”. Immunity 48 (6): 1104–1117. (June 2018). doi:10.1016/j.immuni.2018.05.013. PMC 6344351. PMID 29924976.
- ^ Moro, Kazuyo; Yamada, Taketo; Tanabe, Masanobu; Takeuchi, Tsutomu; Ikawa, Tomokatsu; Kawamoto, Hiroshi; Furusawa, Jun-Ichi; Ohtani, Masashi et al. (2010-01-28). “Innate production of T(H)2 cytokines by adipose tissue-associated c-Kit(+)Sca-1(+) lymphoid cells”. Nature 463 (7280): 540–544. doi:10.1038/nature08636. ISSN 1476-4687. PMID 20023630.
- ^ Neill, Daniel R.; Wong, See Heng; Bellosi, Agustin; Flynn, Robin J.; Daly, Maria; Langford, Theresa K. A.; Bucks, Christine; Kane, Colleen M. et al. (2010-04). “Nuocytes represent a new innate effector leukocyte that mediates type-2 immunity” (英語). Nature 464 (7293): 1367–1370. doi:10.1038/nature08900. ISSN 0028-0836. PMC 2862165. PMID 20200518.
- ^ Price, A. E.; Liang, H.-E.; Sullivan, B. M.; Reinhardt, R. L.; Eisley, C. J.; Erle, D. J.; Locksley, R. M. (2010-06-22). “Systemically dispersed innate IL-13-expressing cells in type 2 immunity” (英語). Proceedings of the National Academy of Sciences 107 (25): 11489–11494. doi:10.1073/pnas.1003988107. ISSN 0027-8424. PMC 2895098. PMID 20534524.
- ^ a b “Innate Lymphoid Cells: 10 Years On”. Cell 174 (5): 1054–1066. (August 2018). doi:10.1016/j.cell.2018.07.017. PMID 30142344.
- ^ “Innate Lymphoid Cells: 10 Years On”. Cell 174 (5): 1054–1066. (August 2018). doi:10.1016/j.cell.2018.07.017. PMID 30142344.
- ^ “TSLP elicits IL-33-independent innate lymphoid cell responses to promote skin inflammation”. Science Translational Medicine 5 (170): 170ra16. (January 2013). doi:10.1126/scitranslmed.3005374. PMC 3637661. PMID 23363980.
- ^ “Cutaneous immunosurveillance and regulation of inflammation by group 2 innate lymphoid cells”. Nature Immunology 14 (6): 564–73. (June 2013). doi:10.1038/ni.2584. PMC 4282745. PMID 23603794.
- ^ “Nuocytes represent a new innate effector leukocyte that mediates type-2 immunity”. Nature 464 (7293): 1367–70. (April 2010). Bibcode: 2010Natur.464.1367N. doi:10.1038/nature08900. PMC 2862165. PMID 20200518.
- ^ a b “Innate Lymphoid Cells in Mucosal Immunity”. Frontiers in Immunology 10: 861. (2019). doi:10.3389/fimmu.2019.00861. PMC 6515929. PMID 31134050.
- ^ Gold, Matthew J; Antignano, Frann; et al.
- ^ “The transcription factor GATA3 is essential for the function of human type 2 innate lymphoid cells”. Immunity 37 (4): 649–59. (October 2012). doi:10.1016/j.immuni.2012.08.015. PMID 23063330.
- ^ “Differentiation of human innate lymphoid cells (ILCs)”. Current Opinion in Immunology 38: 75–85. (February 2016). doi:10.1016/j.coi.2015.11.005. PMID 26707651.
- ^ “Innate lymphoid cells drive interleukin-23-dependent innate intestinal pathology”. Nature 464 (7293): 1371–5. (April 2010). Bibcode: 2010Natur.464.1371B. doi:10.1038/nature08949. PMC 3796764. PMID 20393462.
- ^ “The IL-23-IL-17 immune axis: from mechanisms to therapeutic testing”. Nature Reviews. Immunology 14 (9): 585–600. (September 2014). doi:10.1038/nri3707. PMC 4281037. PMID 25145755.
- ^ a b c d “Group 3 ILCs: Peacekeepers or Troublemakers? What's Your Gut Telling You?!”. Frontiers in Immunology 10: 676. (2019). doi:10.3389/fimmu.2019.00676. PMC 6460375. PMID 31024537.
- ^ “Human fetal lymphoid tissue-inducer cells are interleukin 17-producing precursors to RORC+ CD127+ natural killer-like cells”. Nature Immunology 10 (1): 66–74. (January 2009). doi:10.1038/ni.1668. PMID 19029905.
- ^ a b “Lymphoid tissue inducer-like cells are an innate source of IL-17 and IL-22”. The Journal of Experimental Medicine 206 (1): 35–41. (January 2009). doi:10.1084/jem.20072713. PMC 2626689. PMID 19114665.
- ^ “A T-bet gradient controls the fate and function of CCR6-RORγt+ innate lymphoid cells”. Nature 494 (7436): 261–5. (February 2013). Bibcode: 2013Natur.494..261K. doi:10.1038/nature11813. PMID 23334414.
- ^ Withers, David R; Fabrina M Gaspal, Emma C Mackley, Clare L Marriott, Ewan A Ross, Guillaume E Desanti, Natalie A Roberts, Andrea J White, Adriana Flores-Langarica, Fiona M McConnell, Graham Anderson, Peter J L Lane (2012-09-01).
- ^ “Developing lymph nodes collect CD4+CD3- LTbeta+ cells that can differentiate to APC, NK cells, and follicular cells but not T or B cells”. Immunity 7 (4): 493–504. (October 1997). doi:10.1016/S1074-7613(00)80371-4. PMID 9354470.
- ^ “The LTi cell, an immunologic chameleon”. Immunity 33 (5): 650–2. (November 2010). doi:10.1016/j.immuni.2010.11.016. PMC 3426921. PMID 21094460.
- ^ a b c d “Lymphoid tissue inducer cells”. Current Biology 21 (10): R381-2. (May 2011). doi:10.1016/j.cub.2011.03.022. PMID 21601793.
- ^ a b “Innate lymphoid cells--how did we miss them?”. Nature Reviews. Immunology 13 (2): 75–87. (February 2013). doi:10.1038/nri3349. PMID 23292121.
- ^ Walker, Jennifer A.; Jillian L. Barlow; Andrew N. J. McKenzie (February 2013). “Innate lymphoid cells — how did we miss them?”. Nature Reviews Immunology 13 (2): 75–87. doi:10.1038/nri3349. ISSN 1474-1733 2013年8月3日閲覧。.
- ^ a b c d e f g “Innate lymphoid cells. Innate lymphoid cells: a new paradigm in immunology”. Science 348 (6237): aaa6566. (May 2015). doi:10.1126/science.aaa6566. PMC 5658207. PMID 25999512.
- ^ a b “Differentiation of type 1 ILCs from a common progenitor to all helper-like innate lymphoid cell lineages”. Cell 157 (2): 340–356. (April 2014). doi:10.1016/j.cell.2014.03.030. PMID 24725403.
- ^ “NFIL3 orchestrates the emergence of common helper innate lymphoid cell precursors”. Cell Reports 10 (12): 2043–54. (March 2015). doi:10.1016/j.celrep.2015.02.057. PMID 25801035.
- ^ a b “Identification and distribution of developing innate lymphoid cells in the fetal mouse intestine”. Nature Immunology 16 (2): 153–60. (February 2015). doi:10.1038/ni.3057. PMC 4297560. PMID 25501629.
- ^ “AHR drives the development of gut ILC22 cells and postnatal lymphoid tissues via pathways dependent on and independent of Notch”. Nature Immunology 13 (2): 144–51. (November 2011). doi:10.1038/ni.2187. PMC 3468413. PMID 22101730.
- ^ “Innate Lymphoid Cells: Diversity, Plasticity, and Unique Functions in Immunity”. Immunity 48 (6): 1104–1117. (June 2018). doi:10.1016/j.immuni.2018.05.013. PMC 6344351. PMID 29924976.
- ^ “Why Innate Lymphoid Cells?”. Immunity 48 (6): 1081–1090. (June 2018). doi:10.1016/j.immuni.2018.06.002. PMC 6145487. PMID 29924974.
- ^ “Group 3 ILCs: Peacekeepers or Troublemakers? What's Your Gut Telling You?!”. Frontiers in Immunology 10: 676. (2019). doi:10.3389/fimmu.2019.00676. PMC 6460375. PMID 31024537.
- ^ “Innate Lymphoid Cells in Helminth Infections-Obligatory or Accessory?”. Frontiers in Immunology 10: 620. (2019). doi:10.3389/fimmu.2019.00620. PMC 6467944. PMID 31024526.
- ^ a b c “Allergic host defences”. Nature 484 (7395): 465–72. (April 2012). Bibcode: 2012Natur.484..465P. doi:10.1038/nature11047. PMC 3596087. PMID 22538607.
- ^ a b c d “Innate Lymphoid Cells: 10 Years On”. Cell 174 (5): 1054–1066. (August 2018). doi:10.1016/j.cell.2018.07.017. PMID 30142344.
- ^ “Adventitial Stromal Cells Define Group 2 Innate Lymphoid Cell Tissue Niches”. Immunity 50 (3): 707–722.e6. (March 2019). doi:10.1016/j.immuni.2019.02.002. PMC 6553479. PMID 30824323.
- ^ “Pulmonary neuroendocrine cells amplify allergic asthma responses”. Science 360 (6393): eaan8546. (June 2018). doi:10.1126/science.aan8546. PMC 6387886. PMID 29599193.
- ^ “Human type 1 innate lymphoid cells accumulate in inflamed mucosal tissues”. Nature Immunology 14 (3): 221–9. (March 2013). doi:10.1038/ni.2534. PMID 23334791.
- ^ “Metabolic Control of Innate Lymphoid Cell Migration”. Frontiers in Immunology 10: 2010. (2019). doi:10.3389/fimmu.2019.02010. PMC 6713999. PMID 31507605.
- ^ a b c d e f g h i j k l m n o p q r s t u v w “Innate lymphoid cells: major players in inflammatory diseases”. Nature Reviews. Immunology 17 (11): 665–678. (November 2017). doi:10.1038/nri.2017.86. PMID 28804130.
- ^ “Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens”. Nature Medicine 14 (3): 282–9. (March 2008). doi:10.1038/nm1720. PMID 18264109.
- ^ “Innate Lymphoid Cells in Mucosal Immunity”. Frontiers in Immunology 10: 861. (2019). doi:10.3389/fimmu.2019.00861. PMC 6515929. PMID 31134050.
- ^ “The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells”. Cell 126 (6): 1121–33. (September 2006). doi:10.1016/j.cell.2006.07.035. PMID 16990136.
- ^ “IL-6 programs T(H)-17 cell differentiation by promoting sequential engagement of the IL-21 and IL-23 pathways”. Nature Immunology 8 (9): 967–74. (September 2007). doi:10.1038/ni1488. PMID 17581537.
- ^ “Glial-cell-derived neuroregulators control type 3 innate lymphoid cells and gut defence”. Nature 535 (7612): 440–443. (July 2016). Bibcode: 2016Natur.535..440I. doi:10.1038/nature18644. PMC 4962913. PMID 27409807.
- ^ a b “Innate lymphoid cells regulate intestinal epithelial cell glycosylation”. Science 345 (6202): 1254009. (September 2014). doi:10.1126/science.1254009. PMC 4774895. PMID 25214634.
- ^ “IgA Function in Relation to the Intestinal Microbiota”. Annual Review of Immunology 36 (1): 359–381. (April 2018). doi:10.1146/annurev-immunol-042617-053238. PMID 29400985.
- ^ “Innate Immune Defenses Mediated by Two ILC Subsets Are Critical for Protection against Acute Clostridium difficile Infection”. Cell Host & Microbe 18 (1): 27–37. (July 2015). doi:10.1016/j.chom.2015.06.011. PMC 4537644. PMID 26159718.
- ^ a b c d e Wagner, Marek; Moro, Kazuyo; Koyasu, Shigeo (May 2017). “Plastic Heterogeneity of Innate Lymphoid Cells in Cancer” (英語). Trends in Cancer 3 (5): 326–335. doi:10.1016/j.trecan.2017.03.008. PMID 28718410.
- ^ a b Wagner, Marek; Koyasu, Shigeo (May 2019). “Cancer Immunoediting by Innate Lymphoid Cells” (英語). Trends in Immunology 40 (5): 415–430. doi:10.1016/j.it.2019.03.004. PMID 30992189.
- ^ “Cancer Immunosurveillance by Tissue-Resident Innate Lymphoid Cells and Innate-like T Cells”. Cell 164 (3): 365–77. (January 2016). doi:10.1016/j.cell.2016.01.002. PMC 4733424. PMID 26806130.
- ^ “Natural killer cells, viruses and cancer”. Nature Reviews. Immunology 1 (1): 41–9. (October 2001). doi:10.1038/35095564. PMID 11905813.
- ^ “A fresh look at tumor immunosurveillance and immunotherapy”. Nature Immunology 2 (4): 293–9. (April 2001). doi:10.1038/86297. PMID 11276199.
- ^ “Intraepithelial type 1 innate lymphoid cells are a unique subset of IL-12- and IL-15-responsive IFN-γ-producing cells”. Immunity 38 (4): 769–81. (April 2013). doi:10.1016/j.immuni.2013.02.010. PMC 3634355. PMID 23453631.
- ^ “Characterization of cytokine-induced myeloid-derived suppressor cells from normal human peripheral blood mononuclear cells”. Journal of Immunology 185 (4): 2273–84. (August 2010). doi:10.4049/jimmunol.1000901. PMC 2923483. PMID 20644162.
- ^ Heeren, A. Marijne, et al. "High and interrelated rates of PD-L1+ CD14+ antigen-presenting cells and regulatory T cells mark the microenvironment of metastatic lymph nodes from patients with cervical cancer." Cancer immunology research (2014): canimm-0149.
- ^ “T helper 2 (Th2) cell differentiation, type 2 innate lymphoid cell (ILC2) development and regulation of interleukin-4 (IL-4) and IL-13 production”. Cytokine 75 (1): 14–24. (September 2015). doi:10.1016/j.cyto.2015.05.010. PMC 4532589. PMID 26044597.
- ^ “Identification of innate IL-5-producing cells and their role in lung eosinophil regulation and antitumor immunity”. Journal of Immunology 188 (2): 703–13. (January 2012). doi:10.4049/jimmunol.1101270. PMID 22174445.
- ^ Wagner, Marek; Ealey, Kafi N.; Tetsu, Hiroe; Kiniwa, Tsuyoshi; Motomura, Yasutaka; Moro, Kazuyo; Koyasu, Shigeo (February 2020). “Tumor-Derived Lactic Acid Contributes to the Paucity of Intratumoral ILC2s” (英語). Cell Reports 30 (8): 2743–2757.e5. doi:10.1016/j.celrep.2020.01.103. PMID 32101749.
- ^ “The Interplay Between Innate Lymphoid Cells and the Tumor Microenvironment”. Frontiers in Immunology 10: 2895. (2019). doi:10.3389/fimmu.2019.02895. PMC 6923277. PMID 31921156.
- ^ “NCR(+)ILC3 concentrate in human lung cancer and associate with intratumoral lymphoid structures”. Nature Communications 6 (1): 8280. (September 2015). Bibcode: 2015NatCo...6.8280C. doi:10.1038/ncomms9280. PMID 26395069.
- ^ “Innate Lymphoid Cells: 10 Years On”. Cell 174 (5): 1054–1066. (August 2018). doi:10.1016/j.cell.2018.07.017. PMID 30142344.
- ^ a b c “Type 2 Innate Lymphoid Cells in Liver and Gut: From Current Knowledge to Future Perspectives”. International Journal of Molecular Sciences 20 (8): 1896. (April 2019). doi:10.3390/ijms20081896. PMC 6514972. PMID 30999584.
- ^ a b c “Type 1 Innate Lymphoid Cells Protect Mice from Acute Liver Injury via Interferon-γ Secretion for Upregulating Bcl-xL Expression in Hepatocytes”. Immunity 52 (1): 96–108.e9. (January 2020). doi:10.1016/j.immuni.2019.11.004. PMC 8108607. PMID 31810881.
- ^ a b “Group 2 innate lymphoid cells promote beiging of white adipose tissue and limit obesity” (英語). Nature 519 (7542): 242–6. (March 2015). Bibcode: 2015Natur.519..242B. doi:10.1038/nature14115. PMC 4447235. PMID 25533952.
- ^ “Adipose Natural Killer Cells Regulate Adipose Tissue Macrophages to Promote Insulin Resistance in Obesity”. Cell Metabolism 23 (4): 685–98. (April 2016). doi:10.1016/j.cmet.2016.03.002. PMC 4833527. PMID 27050305.
- ^ “IL-9-mediated survival of type 2 innate lymphoid cells promotes damage control in helminth-induced lung inflammation”. The Journal of Experimental Medicine 210 (13): 2951–65. (December 2013). doi:10.1084/jem.20130071. PMC 3865473. PMID 24249111.
- ^ “S1P-dependent interorgan trafficking of group 2 innate lymphoid cells supports host defense”. Science 359 (6371): 114–119. (January 2018). Bibcode: 2018Sci...359..114H. doi:10.1126/science.aam5809. PMC 6956613. PMID 29302015.
- ^ “Activation of Type 3 innate lymphoid cells and interleukin 22 secretion in the lungs during Streptococcus pneumoniae infection”. The Journal of Infectious Diseases 210 (3): 493–503. (August 2014). doi:10.1093/infdis/jiu106. PMID 24577508.
- ^ “Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation”. Immunity 40 (3): 425–35. (March 2014). doi:10.1016/j.immuni.2014.01.011. PMC 4210641. PMID 24613091.
- ^ “IL-33 and Airway Inflammation”. Allergy, Asthma & Immunology Research 3 (2): 81–8. (April 2011). doi:10.4168/aair.2011.3.2.81. PMC 3062800. PMID 21461246.
- ^ “Percutaneous sensitization with allergens through barrier-disrupted skin elicits a Th2-dominant cytokine response”. European Journal of Immunology 28 (3): 769–79. (March 1998). doi:10.1002/(SICI)1521-4141(199803)28:03<769::AID-IMMU769>3.0.CO;2-H. PMID 9541570.
- ^ “Interleukin-17-producing innate lymphoid cells and the NLRP3 inflammasome facilitate obesity-associated airway hyperreactivity”. Nature Medicine 20 (1): 54–61. (January 2014). doi:10.1038/nm.3423. PMC 3912313. PMID 24336249.
- ^ a b “Innate or adaptive immunity? The example of natural killer cells”. Science 331 (6013): 44–9. (January 2011). Bibcode: 2011Sci...331...44V. doi:10.1126/science.1198687. PMC 3089969. PMID 21212348.
- ^ “The role of NK cells in autoimmune disease”. Autoimmunity 35 (1): 1–14. (February 2002). doi:10.1080/08916930290005864. PMID 11908701.
- ^ “Perturbations of natural killer cell regulatory functions in respiratory allergic diseases”. The Journal of Allergy and Clinical Immunology 121 (2): 479–85. (February 2008). doi:10.1016/j.jaci.2007.09.047. PMID 18061653.
- ^ “IL-23 promotes tumour incidence and growth”. Nature 442 (7101): 461–5. (July 2006). Bibcode: 2006Natur.442..461L. doi:10.1038/nature04808. PMID 16688182.
- ^ “A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses”. Nature Medicine 15 (9): 1016–22. (September 2009). doi:10.1038/nm.2015. PMC 3034219. PMID 19701202.
- ^ “Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth”. Nature 491 (7423): 254–8. (November 2012). Bibcode: 2012Natur.491..254G. doi:10.1038/nature11465. PMC 3601659. PMID 23034650.
- ^ “Polarization of ILC2s in peripheral blood might contribute to immunosuppressive microenvironment in patients with gastric cancer”. Journal of Immunology Research 2014: 923135. (2014). doi:10.1155/2014/923135. PMC 3987940. PMID 24741632.
- ^ “Natural killer cell activity for IFN-gamma production as a supportive diagnostic marker for gastric cancer”. Oncotarget 8 (41): 70431–70440. (September 2017). doi:10.18632/oncotarget.19712. PMC 5642566. PMID 29050291.
- ^ a b c “IL-1β, IL-4 and IL-12 control the fate of group 2 innate lymphoid cells in human airway inflammation in the lungs”. Nature Immunology 17 (6): 636–45. (June 2016). doi:10.1038/ni.3444. PMID 27111145.
- ^ “Expansion of human NK-22 cells with IL-7, IL-2, and IL-1beta reveals intrinsic functional plasticity”. Proceedings of the National Academy of Sciences of the United States of America 107 (24): 10961–6. (June 2010). Bibcode: 2010PNAS..10710961C. doi:10.1073/pnas.1005641107. PMC 2890739. PMID 20534450.
- ^ a b “Interleukin-12 and -23 Control Plasticity of CD127(+) Group 1 and Group 3 Innate Lymphoid Cells in the Intestinal Lamina Propria”. Immunity 43 (1): 146–60. (July 2015). doi:10.1016/j.immuni.2015.06.019. PMID 26187413.
- ^ “Cutting Edge: Notch Signaling Promotes the Plasticity of Group-2 Innate Lymphoid Cells”. Journal of Immunology 198 (5): 1798–1803. (March 2017). doi:10.4049/jimmunol.1601421. PMC 5321819. PMID 28115527.
- ^ “Tumor immunoevasion by the conversion of effector NK cells into type 1 innate lymphoid cells”. Nature Immunology 18 (9): 1004–1015. (September 2017). doi:10.1038/ni.3800. PMID 28759001.
- ^ “SMAD4 impedes the conversion of NK cells into ILC1-like cells by curtailing non-canonical TGF-β signaling”. Nature Immunology 18 (9): 995–1003. (September 2017). doi:10.1038/ni.3809. PMC 5712491. PMID 28759002.
- ^ Bald, Tobias; Wagner, Marek; Gao, Yulong; Koyasu, Shigeo; Smyth, Mark J. (February 2019). “Hide and seek: Plasticity of innate lymphoid cells in cancer” (英語). Seminars in Immunology 41: 101273. doi:10.1016/j.smim.2019.04.001. PMID 30979591.
- ^ “Shades of grey--the blurring view of innate and adaptive immunity”. Nature Reviews. Immunology 13 (2): 73–4. (February 2013). doi:10.1038/nri3389. PMID 23469373.
