「MRNA-1273」の版間の差分
m編集の要約なし |
編集の要約なし |
||
| (3人の利用者による、間の10版が非表示) | |||
| 1行目: | 1行目: | ||
{{小文字}} |
{{小文字}} |
||
{{Pathnav|[[SARSコロナウイルス2|新型コロナウイルス (SARS-CoV-2)]]|[[新型コロナウイルス感染症 (2019年)|新型コロナウイルス感染症(COVID-19)]]|COVID-19ワクチン|this=モデルナ (MRNA-1273)|frame=1}} |
{{Pathnav|[[SARSコロナウイルス2|新型コロナウイルス (SARS-CoV-2)]]|[[新型コロナウイルス感染症 (2019年)|新型コロナウイルス感染症(COVID-19)]]|COVID-19ワクチン|this=モデルナ (MRNA-1273)|frame=1}} |
||
{{Infobox drug|Verifiedfields=|B=|Li=|K=|I=|Gd=|Fe=|F=|Co=|Cl=|Ca=|Br=|Bi=|Au=|Mn=|As=|Al=|Ag=|H=|C=|chemical_formula=|chemical_formula_ref=|IUPAC_name=|synonyms=mRNA-1273, CX-024414, COVID-19 Vaccine Moderna, COVID-19 mRNA Vaccine Moderna<!-- Chemical and physical data -->|PDB_ligand=|NIAID_ChemDB=|ChEMBL=|Mg=|N=|ChEBI=|StdInChI=|sol_units=|solubility=|boiling_notes=|boiling_point=|melting_notes=|melting_high=|melting_point=|density_notes=|density=|StdInChIKey=|StdInChI_comment=|SMILES=|Na=|molecular_weight_comment=|molecular_weight=|charge=|Zn=|Tc=|Sr=|Se=|Sb=|S=|Pt=|P=|O=|ChEMBL_Ref=|ChEBI_Ref=|verifiedrevid=|licence_EU=|legal_AU=<!-- S2, S3, S4, S5, S6, S7, S8, S9 or Unscheduled -->|ATC_supplemental=<!-- Legal status -->|ATC_suffix=|ATC_prefix=None <!-- scheduled to be J07BX03 in 2022 -->|class=|routes_of_administration=[[筋肉内注射]]|pregnancy_category=|pregnancy_AU_comment=|pregnancy_AU=|licence_US=|DailyMedID=Moderna_COVID-19_Vaccine|MedlinePlus=|legal_BR=<!-- OTC, A1, A2, A3, B1, B2, C1, C2, C3, C4, C5, D1, D2, E, F -->|Drugs.com=|tradename=|pronounce={{IPAc-en|m|ə|ˈ|d|ɜːr|n|ə}} {{respell|mə|DUR|nə}}<ref>{{cite AV media |people=Moderna|date=October 23, 2019|title=mRNA-3704 and Methylmalonic Acidemia|medium=Video|url=https://www.youtube.com/watch?v=eb8OHaF8wio|access-date=January 19, 2021|publisher=YouTube}}</ref>|vaccine_type=mRNA<!-- Clinical data -->|target=[[COVID-19]]|caption=モデルナCOVID-19ワクチンが入ったバイアル<!-- Vaccine data -->|width=250|alt=|image=Moderna COVID-19 vaccine.jpg|type=vaccine|INN=|drug_name=|legal_AU_comment=|legal_BR_comment=|KEGG=|legal_status=<!-- For countries not listed above --><!-- Identifiers -->|KEGG_Ref=|UNII=EPK39PL4R4|UNII_Ref=|ChemSpiderID=|ChemSpiderID_Ref=|DrugBank=DB15654|DrugBank_Ref=|IUPHAR_ligand=|PubChem=|CAS_supplemental=|CAS_number=|CAS_number_Ref=|legal_UN_comment=|legal_CA=Authorized by interim order|legal_UN=<!-- N I, II, III, IV / P I, II, III, IV -->|legal_EU_comment=<ref name="COVID-19 Vaccine Moderna EPAR">{{cite web | title=COVID-19 Vaccine Moderna EPAR | website=[[:en:European Medicines Agency|欧州医薬品庁]] (EMA) | url=https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-moderna | access-date=20 January 2021}}</ref><ref name="EU approval" />|legal_EU=Conditional marketing authorization granted|legal_US_comment=([[:en:Emergency Use Authorization|緊急使用許可]])<ref name="FDA PR 20201218">{{cite press release | title=FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine | website=U.S. [[:en:Food and Drug Administration|アメリカ食品医薬品局]] (FDA) | url=https://www.fda.gov/news-events/press-announcements/fda-takes-additional-action-fight-against-covid-19-issuing-emergency-use-authorization-second-covid | access-date=18 December 2020}}</ref><ref name="Moderna COVID-19 Vaccine FDA label">{{cite web | title=Moderna COVID-19 Vaccine- cx-024414 injection, suspension | website=DailyMed | url=https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=e0651c7a-2fe2-459d-a766-0d59e919f058 | access-date=20 December 2020}}</ref><ref name="Moderna COVID-19 Vaccine FDA EUA">{{cite report | url=https://www.fda.gov/media/144636/download | format=PDF | title=Moderna COVID-19 Vaccine Emergency Use Authorization | website=U.S. [[:en:Food and Drug Administration|アメリカ食品医薬品局]] (FDA) | date=18 December 2020 | accessdate=20 December 2020}} {{PD-notice}}</ref>|legal_US=Unapproved|legal_UK_comment=<ref>{{cite web | title=Information for Healthcare Professionals on COVID-19 Vaccine Moderna | website=[[:en:Medicines and Healthcare products Regulatory Agency|医薬品・医療製品規制庁]] (MHRA) | date=8 January 2021 | url=https://www.gov.uk/government/publications/regulatory-approval-of-covid-19-vaccine-moderna/information-for-healthcare-professionals-on-covid-19-vaccine-moderna | access-date=8 January 2021}}</ref><ref>{{cite web | title=Conditions of Authorisation for COVID-19 Vaccine Moderna | website=[[:en:Medicines and Healthcare products Regulatory Agency|医薬品・医療製品規制庁]] (MHRA) | date=8 January 2021 | url=https://www.gov.uk/government/publications/regulatory-approval-of-covid-19-vaccine-moderna/conditions-of-authorisation-for-covid-19-vaccine-moderna | access-date=9 January 2021}}</ref>|legal_UK=Conditional and temporary authorization to supply|legal_NZ_comment=|legal_NZ=<!-- Class A, B, C -->|legal_DE_comment=|legal_DE=<!-- Anlage I, II, III or Unscheduled -->|legal_CA_comment=<ref name="CA Moderna decision">{{cite web | title=Regulatory Decision Summary - Moderna COVID-19 Vaccine | website=[[:en:Health Canada|カナダ保健省]] | date=23 December 2020 | url=https://covid-vaccine.canada.ca/info/regulatory-decision-summary-detailTwo.html?linkID=RDS00736 | access-date=23 December 2020}}</ref><ref name="CA Moderna product description">{{cite web | title=Moderna COVID-19 Vaccine (mRNA-1273 SARS-CoV-2) | website=COVID-19 vaccines and treatments portal | date=23 December 2020 | url=https://covid-vaccine.canada.ca/moderna-covid-19-vaccine/product-details | access-date=23 December 2020}}</ref>|specific_rotation=|legal_JP=<!-- 日本における承認状況を簡潔に -->|mab_type=legal_JP|legal_JP_comment=<!-- 日本における承認状況を裏付ける情報源 -->}} |
|||
[[ファイル:Moderna COVID-19 vaccine.jpg|thumb|right|250px|ワクチンが入ったガラス瓶]] |
|||
'''モデルナCOVID-19ワクチン'''(コードネーム: '''mRNA-1273''')は、[[アメリカ国立アレルギー・感染症研究所]] (NIAID) 、[[アメリカ生物医学先端研究開発局]] (BARDA) 、及び[[モデルナ]]により開発された[[COVID-19ワクチン]]。[[筋肉内注射]]により4週間開けて2回に分けて0.5mLが投与される<ref name="IDSA">{{cite web | title = Moderna COVID-19 Vaccine | work = Dosing & Administration | publisher = [[Infectious Diseases Society of America]] | date = 4 January 2021 | url = https://www.idsociety.org/covid-19-real-time-learning-network/vaccines/moderna-covid-19-vaccine/ | access-date = 5 January 2021 }}</ref>。 |
'''モデルナCOVID-19ワクチン'''(コードネーム: '''mRNA-1273''')は、[[アメリカ国立アレルギー・感染症研究所]] (NIAID) 、[[アメリカ生物医学先端研究開発局]] (BARDA) 、及び[[モデルナ]]により開発された[[COVID-19ワクチン]]。[[筋肉内注射]]により4週間開けて2回に分けて0.5mLが投与される<ref name="IDSA">{{cite web | title = Moderna COVID-19 Vaccine | work = Dosing & Administration | publisher = [[Infectious Diseases Society of America]] | date = 4 January 2021 | url = https://www.idsociety.org/covid-19-real-time-learning-network/vaccines/moderna-covid-19-vaccine/ | access-date = 5 January 2021 }}</ref>。 |
||
これは、[[SARSコロナウイルス2|SARS-CoV-2]]の[[スパイクタンパク質]]をコードする[[ヌクレオシド修飾メッセンジャーRNA|ヌクレオシド修飾mRNA]] (modRNA) を脂質ナノ粒子にカプセル化した[[RNAワクチン]]である。2020年にCOVID-19に対して開発及び展開された2つのRNAワクチンの1つである(もう1つは[[tozinameran|ファイザー-バイオンテックワクチン]]である)。 |
|||
2020年12月8日、米国の[[アメリカ食品医薬品局]] (FDA) から[[緊急使用許可]]が発行された<ref name="FDA PR 20201218"> |
2020年12月8日、米国の[[アメリカ食品医薬品局]] (FDA) から[[緊急使用許可]]が発行された<ref name="FDA PR 20201218"></ref><ref name="nih-eua">{{cite news |title=Statement from NIH and BARDA on the FDA Emergency Use Authorization of the Moderna COVID-19 Vaccine |url=https://www.nih.gov/news-events/news-releases/statement-nih-barda-fda-emergency-use-authorization-moderna-covid-19-vaccine |access-date=19 December 2020 |agency=US National Institutes of Health |date=18 December 2020}}</ref><ref name="CDC ACIP Moderna COVID-19 Vaccine">{{cite journal | last=Oliver | first=Sara E. | last2=Gargano | first2=Julia W. | last3=Marin | first3=Mona | last4=Wallace | first4=Megan | last5=Curran | first5=Kathryn G. | last6=Chamberland | first6=Mary | last7=McClung | first7=Nancy | last8=Campos-Outcalt | first8=Doug | last9=Morgan | first9=Rebecca L. | last10=Mbaeyi | first10=Sarah | last11=Romero | first11=José R. | last12=Talbot | first12=H. Keipp | last13=Lee | first13=Grace M. | last14=Bell | first14=Beth P. | last15=Dooling | first15=Kathleen | display-authors=6 | title=The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Moderna COVID-19 Vaccine — United States, December 2020 | journal=MMWR. Morbidity and Mortality Weekly Report | volume=69 | issue=5152 | date=December 2020 | doi=10.15585/mmwr.mm695152e1 | url=https://www.cdc.gov/mmwr/volumes/69/wr/pdfs/mm695152e1-H.pdf | name-list-style=vanc}}</ref><ref name="lovelace">{{cite news |first=Berkeley | last = Lovelace Jr | name-list-style = vanc |date=19 December 2020|title=FDA approves second Covid vaccine for emergency use as it clears Moderna's for U.S. distribution|url=https://www.cnbc.com/2020/12/18/moderna-covid-vaccine-approved-fda-for-emergency-use.html|access-date=19 December 2020|work=CNBC}}</ref>。2020年12月23日にカナダで<ref name="CA Moderna decision"></ref><ref name="CA Moderna product description">{{cite web | title=Moderna COVID-19 Vaccine (mRNA-1273 SARS-CoV-2) | website=COVID-19 vaccines and treatments portal | date=23 December 2020 | url=https://covid-vaccine.canada.ca/moderna-covid-19-vaccine/product-details | access-date=23 December 2020}}</ref>、2021年1月6日に[[欧州連合]]で<ref name="COVID-19 Vaccine Moderna EPAR"></ref><ref name="EU UR info">{{cite web | title=COVID-19 Vaccine Moderna | website=Union Register of medicinal products | url=https://ec.europa.eu/health/documents/community-register/html/h1507.htm | access-date=14 January 2021}}</ref><ref name="EU approval">{{Cite press release|title=European Commission authorises second safe and effective vaccine against COVID-19|url=https://ec.europa.eu/commission/presscorner/detail/en/ip_21_3|access-date=6 January 2021|website=European Commission }}</ref>、2021年1月8日にイギリスで使用が認可された<ref>{{cite web | title=Moderna vaccine becomes third COVID-19 vaccine approved by UK regulator | website=U.K. Government | date=8 January 2021 | url=https://www.gov.uk/government/news/moderna-vaccine-becomes-third-covid-19-vaccine-approved-by-uk-regulator | access-date=8 January 2021}}</ref>。 |
||
== |
== 設計 == |
||
2020年1月、モデルナは、[[SARS-CoV-2]]に対する免疫を誘導する[[RNAワクチン]](mRNA-1273)の開発を発表した<ref>{{cite news|url=https://www.reuters.com/article/us-china-health-vaccines-idUSKBN1ZN2J8|title=With Wuhan virus genetic code in hand, scientists begin work on a vaccine |last1=Steenhuysen |first1=Julie |last2=Kelland |first2=Kate | name-list-style = vanc |date=2020-01-24|work=Reuters|access-date=2020-01-26|archive-date=2020-01-25|archive-url=https://web.archive.org/web/20200125203723/https://www.reuters.com/article/us-china-health-vaccines-idUSKBN1ZN2J8|url-status=live}}</ref><ref name="carey">{{cite web | first = Karen | last = Carey | name-list-style = vanc |title=Increasing number of biopharma drugs target COVID-19 as virus spreads |url=https://www.bioworld.com/articles/433331-increasing-number-of-biopharma-drugs-target-covid-19-as-virus-spreads |publisher=BioWorld |access-date=1 March 2020 |date=26 February 2020 |archive-date=27 February 2020 |archive-url=https://web.archive.org/web/20200227150718/https://www.bioworld.com/articles/433331-increasing-number-of-biopharma-drugs-target-covid-19-as-virus-spreads |url-status=live }}</ref><ref name="everett">{{cite web | first = Gwen | last = Everett | name-list-style = vanc |title=These 5 drug developers have jumped this week on hopes they can provide a coronavirus treatment |url=https://markets.businessinsider.com/news/stocks/drug-stocks-gain-companies-coronavirus-vaccine-potential-wall-street-buys-2020-2-1028947495 |publisher=Markets Insider |access-date=1 March 2020 |date=27 February 2020 |archive-date=16 November 2020 |archive-url=https://web.archive.org/web/20201116154220/https://markets.businessinsider.com/news/stocks/drug-stocks-gain-companies-coronavirus-vaccine-potential-wall-street-buys-2020-2-1028947495 |url-status=live }}</ref>。モデルナの技術は、mRNA-1273と命名された[[ヌクレオシド修飾メッセンジャーRNA]](modRNA)化合物を使用している。mRNAは、ヒトの細胞内に入ると、その細胞の[[小胞体]]と結合する。mRNA-1273は、その細胞の通常の産生プロセスを使用して特定のタンパク質を作るように細胞に指示するようにコード化されている。いったんそれが細胞から排出されると、最終的には免疫系によって検出され、免疫系は効果的な抗体の産生を開始する。この発表を受け、モデルナの株価は劇的に上昇し、CEOをはじめとする経営陣は保有株の大規模なプログラム売却を開始した<ref>{{cite web | url=https://www.bloomberg.com/news/articles/2020-05-18/mit-professor-s-moderna-stake-on-the-brink-of-topping-1-billion | title=MIT Professor's Moderna Stake on the Brink of Topping $1 Billion | first1=Devon | last1=Pendleton | first2=Tom | last2=Maloney | name-list-style = vanc | website=[[:en:Bloomberg News|Bloomberg News]] | date=18 May 2020 | access-date=18 May 2020 | quote=CEO Bancel, other Moderna executives have been selling shares }}</ref>。mRNA-1273のドラッグデリバリーシステムは、{{仮リンク|PEG化|en|PEGylation}}[[リポソーム|脂質]]{{仮リンク|ナノ粒子ドラッグデリバリー|en|Nanoparticle drug delivery}}(LNP)システムを採用している<ref name="nylj1" />。 |
|||
{{reflist}} |
|||
== 組成 == |
|||
ワクチンには以下の成分が含まれている<ref>{{cite report|url=https://www.fda.gov/media/144638/download|format=PDF|title="Fact sheet for recipients and caregivers - Emergency Use Authorization (EUA) of the Moderna COVID-19 vaccine"|website=U.S. [[:en:Food and Drug Administration|Food and Drug Administration]] (FDA)|date=December 2020|accessdate=31 December 2020}}</ref>。 |
|||
* 融合前構造で安定化されたSARS-CoV-2スパイク糖タンパク質(S)をコードするヌクレオシド修飾メッセンジャーRNA<ref>[https://www.nejm.org/doi/full/10.1056/NEJMoa2022483 An mRNA Vaccine against SARS-CoV-2 — Preliminary Report], Lisa A. Jackson et al., ''New England Journal of Medicine'' '''383''' (Nov. 12, 2020), pp. 1920-1931, {{doi|10.1056/NEJMoa2022483}}.</ref> |
|||
* [[脂質]] |
|||
** [[:en:SM-102|SM-102]] |
|||
** [[ポリエチレングリコール]][PEG]2000-ジミリストイルグリセロール[DMG] |
|||
** [[コレステロール]] |
|||
** および {{仮リンク|1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン|en|1,2-distearoyl-sn-glycero-3-phosphocholine}}[DSPC] |
|||
* [[トリスヒドロキシメチルアミノメタン|トロメタミン]] |
|||
* トロメタミン[[:en:Hydrochloride|塩酸塩]] |
|||
* [[酢酸]] |
|||
* [[酢酸ナトリウム]] |
|||
* および [[スクロース]] |
|||
== 臨床試験 == |
|||
=== 第I相/第II相試験 === |
|||
2020年3月、[[アメリカ国立アレルギー・感染症研究所]]との協力により、mRNA-1273のヒト[[治験#phase1trial|第I相臨床試験]]が開始された<ref>{{cite web |title=NIH clinical trial of investigational vaccine for COVID-19 begins |url=https://www.nih.gov/news-events/news-releases/nih-clinical-trial-investigational-vaccine-covid-19-begins |website=National Institutes of Health (NIH) |access-date=18 March 2020 |date=16 March 2020 |archive-date=19 March 2020 |archive-url=https://web.archive.org/web/20200319120523/https://www.nih.gov/news-events/news-releases/nih-clinical-trial-investigational-vaccine-covid-19-begins |url-status=live }}</ref>。4月、[[アメリカ生物医学先端研究開発局]](BARDA)がモデルナのワクチン開発に最大4億8,300万ドルを割り当てた<ref name="bigbet">{{cite web|title=In quest for vaccine, US makes 'big bet' on company with unproven technology|url=https://www.cnn.com/2020/05/01/us/coronavirus-moderna-vaccine-invs/index.html |last1=Kuznia |first1=Robert |last2=Polglase|first2=Katie |last3=Mezzofiore|first3=Gianluca | name-list-style = vanc |date=1 May 2020 |website=CNN |url-status=live |archive-url= https://web.archive.org/web/20200513005730/https://www.cnn.com/2020/05/01/us/coronavirus-moderna-vaccine-invs/index.html |archive-date=2020-05-13 |access-date=2020-05-02}}</ref>。5月に開始される[[治験#phase2trial|第II相]]投与および有効性試験の計画は、[[アメリカ食品医薬品局]](FDA)によって承認された<ref name="keown">{{cite web|title=Moderna moves into Phase II testing of COVID-19 vaccine candidate| first = Alex | last = Keown | name-list-style = vanc |url=https://www.biospace.com/article/fda-greenlights-phase-ii-for-moderna-s-covid-19-vaccine-candidate/|publisher=BioSpace|date=2020-05-07|access-date=2020-05-09|archive-date=16 November 2020|archive-url=https://web.archive.org/web/20201116154405/https://www.biospace.com/article/fda-greenlights-phase-ii-for-moderna-s-covid-19-vaccine-candidate/|url-status=live}}</ref>。モデルナは、スイスのワクチンメーカーである[[ロンザグループ]]とパートナーシップを結び<ref>{{cite web|title=Moderna aims for a billion COVID-19 shots a year with Lonza manufacturing tie-up| first = Kyle | last = Blankenship | name-list-style = vanc |url=https://www.fiercepharma.com/manufacturing/moderna-aims-for-a-billion-covid-19-shots-a-year-lonza-manufacturing-tie-up|website=FiercePharma|date=2020-05-01|access-date=2020-05-09|archive-date=16 November 2020|archive-url=https://web.archive.org/web/20201116154319/https://www.fiercepharma.com/manufacturing/moderna-aims-for-a-billion-covid-19-shots-a-year-lonza-manufacturing-tie-up|url-status=live}}</ref>、年間3億回分を供給することになった<ref>{{cite web|url=https://www.swissinfo.ch/eng/sci-tech/swiss-factory-rushes-to-prepare-for-moderna-covid-19-vaccine/46081656|title=Swiss factory rushes to prepare for Moderna Covid-19 vaccine|website=SWI swissinfo.ch|access-date=2020-10-07|archive-date=16 November 2020|archive-url=https://web.archive.org/web/20201116154307/https://www.swissinfo.ch/eng/sci-tech/swiss-factory-rushes-to-prepare-for-moderna-covid-19-vaccine/46081656|url-status=live}}</ref>。 |
|||
2020年5月25日、モデルナは、候補ワクチンであるmRNA-1273の2回投与に対する安全性と[[抗体]]反応の違いを評価するために、成人600人の参加者を募集する{{仮リンク|臨床研究のフェーズ|en|Phases of clinical research|label=第IIa相臨床試験}}を開始し、2021年の試験終了を予定している<ref name="mod-04405076">{{ClinicalTrialsGov|NCT04405076|Dose-Confirmation Study to Evaluate the Safety, Reactogenicity, and Immunogenicity of mRNA-1273 COVID-19 Vaccine in Adults Aged 18 Years and Older}}</ref>。2020年6月、モデルナは{{仮リンク|キャタレント (医薬品)|en|Catalent|label=キャタレント}}社とパートナーシップを締結し、キャタレントがワクチン候補の充填とパッケージ化を行う。キャタレントは保管と流通も提供する<ref>{{cite news| author = Reuters Staff |date=2020-06-25|title=Moderna eyes third quarter for first doses of potential COVID-19 vaccine with Catalent deal|work=Reuters|url=https://www.reuters.com/article/us-health-coronavirus-moderna-catalent-idUSKBN23W1SI|access-date=6 November 2020|archive-date=16 November 2020|archive-url=https://web.archive.org/web/20201116154230/https://www.reuters.com/article/us-health-coronavirus-moderna-catalent-idUSKBN23W1SI|url-status=live}}</ref>。 |
|||
7月9日、モデルナは、自社のワクチンが承認された場合に備えて、ラボラトリ・ファーマシューティカル・ロビ社とのインフィル製造契約を発表した<ref>{{cite web|url=https://www.marketwatch.com/story/moderna-signs-on-for-another-covid-19-vaccine-manufacturing-deal-2020-07-09|title=Moderna signs on for another COVID-19 vaccine manufacturing deal|publisher=MarketWatch| last = Lee | first = Jaimy | name-list-style = vanc |access-date=9 July 2020|archive-date=16 November 2020|archive-url=https://web.archive.org/web/20201116154219/https://www.marketwatch.com/story/moderna-signs-on-for-another-covid-19-vaccine-manufacturing-deal-2020-07-09|url-status=live}}</ref>。 |
|||
2020年7月14日、モデルナの科学者は、mRNA-1273の第I相用量漸増臨床試験の予備結果を発表し、注射後15日目という早い時期にS1/S2に対する中和抗体の用量依存的誘導を示した。[[発熱]]、倦怠感、頭痛、[[筋肉痛]]、注射部位の痛みなどの軽度から中等度の[[副作用|有害反応]]はすべての投与群で認められたが、投与量が増えるにつれてありがち<!-- were common -->になった<ref name="jackson" /><ref name="jackson-app">{{cite journal | vauthors = Jackson LA, Anderson EJ, Rouphael NG, Roberts PC, Makhene M, Coler RN, McCullough MP, Chappell JD, Denison MR, Stevens LJ, Pruijssers AJ, McDermott A, Flach B, Doria-Rose NA, Corbett KS, Morabito KM, O'Dell S, Schmidt SD, Swanson PA, Padilla M, Mascola JR, Neuzil KM, Bennett H, Sun W, Peters E, Makowski M, Albert J, Cross K, Buchanan W, Pikaart-Tautges R, Ledgerwood JE, Graham BS, Beigel JH | display-authors = 6 | title = An mRNA Vaccine against SARS-CoV-2 - Preliminary Report | journal = The New England Journal of Medicine | volume = 383 | issue = 20 | pages = 1920–1931 | date = November 2020 | pmid = 32663912 | pmc = 7377258 | doi = 10.1056/NEJMoa2022483 }}</ref>。低用量のワクチンは、安全かつ有効と判断され、100-μgを29日間隔で2回投与した[[治験#phase3trial|第III相臨床試験]]を進めることになった<ref name="jackson" />。 |
|||
2020年7月、モデルナは、[[治験#phase1trial|第I相臨床試験]]において、{{仮リンク|Operation Warp Speed|en|Operation Warp Speed}}の候補薬が、健康な成人において[[中和抗体]]の産生につながったことを速報で発表した<ref name="jackson">{{cite journal | vauthors = Jackson LA, Anderson EJ, Rouphael NG, Roberts PC, Makhene M, Coler RN, McCullough MP, Chappell JD, Denison MR, Stevens LJ, Pruijssers AJ, McDermott A, Flach B, Doria-Rose NA, Corbett KS, Morabito KM, O'Dell S, Schmidt SD, Swanson PA, Padilla M, Mascola JR, Neuzil KM, Bennett H, Sun W, Peters E, Makowski M, Albert J, Cross K, Buchanan W, Pikaart-Tautges R, Ledgerwood JE, Graham BS, Beigel JH | display-authors = 6 | title = An mRNA Vaccine against SARS-CoV-2 - Preliminary Report | journal = The New England Journal of Medicine | volume = 383 | issue = 20 | pages = 1920–1931 | date = November 2020 | pmid = 32663912 | pmc = 7377258 | doi = 10.1056/NEJMoa2022483 | doi-access = free }}</ref><ref>{{cite web|url=https://www.cnbc.com/2020/07/14/stock-market-futures-open-to-close-news.html|title=Dow futures jump more than 200 points after Moderna says its vaccine produces antibodies to coronavirus| first = Yun | last = Li | name-list-style = vanc |publisher=[[:en:CNBC|CNBC]]|date=14 July 2020|access-date=15 July 2020|archive-date=16 November 2020|archive-url=https://web.archive.org/web/20201116154335/https://www.cnbc.com/2020/07/14/stock-market-futures-open-to-close-news.html|url-status=live}}</ref>。「モデルナがより大きな試験で進める100マイクログラムの用量では、15人の患者全員が疲労、悪寒、頭痛、筋肉痛、注射部位の痛みなどの[[副作用|有害反応]]を経験した」<ref name="mhdg" />。やっかいな高用量は、7月に将来の試験から破棄された<ref name="mhdg">{{cite news |last1=Herper |first1=Matthew |last2=Garde |first2=Damian | name-list-style = vanc |title=First data for Moderna Covid-19 vaccine show it spurs an immune response |url=https://www.statnews.com/2020/07/14/moderna-covid19-vaccine-first-data-show-spurs-immune-response/ |work=[[:en:Stat (website)|Stat]] |publisher=Boston Globe Media |date=14 July 2020 |access-date=15 July 2020 |archive-date=14 July 2020 |archive-url=https://web.archive.org/web/20200714221558/https://www.statnews.com/2020/07/14/moderna-covid19-vaccine-first-data-show-spurs-immune-response/ |url-status=live }}</ref>。 |
|||
=== 第III相試験 === |
|||
7月27日、モデルナとアメリカ国立アレルギー・感染症研究所は、米国で第III相試験を開始し、3万人のボランティアを登録して、100 μgのmRNA-1273ワクチンを2回接種する群と、0.9%塩化ナトリウムの[[プラセボ]]を投与する群の2つのグループに割り振る計画を立てた<ref name="palca">{{cite news |last1=Palca |first1=Joe | name-list-style = vanc |title=COVID-19 vaccine candidate heads to widespread testing in U.S. |url=https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people |access-date=27 July 2020 |work=NPR |date=27 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084836/https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people/ |url-status=live }}</ref>。8月7日の時点で、4,500人以上のボランティアが登録していた。 |
|||
2020年9月、モデルナは臨床試験の詳細な試験計画を発表した<ref>{{cite web|title=Moderna, in bid for transparency, discloses detailed plan of coronavirus vaccine trial|url=https://www.biopharmadive.com/news/moderna-coronavirus-vaccine-study-protocol-november/585386/|access-date=2020-09-18|website=BioPharma Dive|archive-date=16 November 2020|archive-url=https://web.archive.org/web/20201116154224/https://www.biopharmadive.com/news/moderna-coronavirus-vaccine-study-protocol-november/585386/|url-status=live}}</ref>。9月30日、CEOのStéphane Bancelは、試験が成功すれば、早ければ2021年3月下旬か4月上旬にワクチンが一般に提供される可能性があると述べた<ref>{{cite web |last=Mascarenhas |first=Lauren| name-list-style = vanc |date=1 October 2020|title=Moderna chief says Covid-19 vaccine could be widely available by late March |url=https://www.cnn.com/2020/10/01/health/moderna-coronavirus-vaccine-bancel-bn/index.html|url-status=live |archive-url=https://web.archive.org/web/20201116154301/https://www.cnn.com/2020/10/01/health/moderna-coronavirus-vaccine-bancel-bn/index.html|archive-date=16 November 2020 |access-date=2020-10-02 |website=CNN}}</ref>。2020年10月の時点で、モデルナは第III相試験に必要な3万人の参加者の登録を完了していた<ref>{{cite web |first=Elizabeth | last = Cohen | name-list-style = vanc |title=First large-scale US Covid-19 vaccine trial reaches target of 30,000 participants|url=https://www.cnn.com/2020/10/22/health/moderna-covid-19-vaccine-trial-30000-participants/index.html|access-date=2020-10-23|website=CNN|archive-date=16 November 2020|archive-url=https://web.archive.org/web/20201116154329/https://www.cnn.com/2020/10/22/health/moderna-covid-19-vaccine-trial-30000-participants/index.html|url-status=live}}</ref>。アメリカ国立アレルギー・感染症研究所は、2020年11月15日に、全体的な試験結果が良好であったと発表した<ref>{{cite web|title=Promising Interim Results from Clinical Trial of NIH-Moderna COVID-19 Vaccine|url=https://www.nih.gov/news-events/news-releases/promising-interim-results-clinical-trial-nih-moderna-covid-19-vaccine|website=National Institutes of Health (NIH)|date=15 November 2020|accessdate=2021-02-20}}</ref>。 |
|||
2020年12月30日、モデルナは[[治験#phase3trial|第III相臨床試験]]の結果を発表し、COVID-19の感染予防に94%の有効性を示した<ref name="Baden">{{cite journal |last1=Baden |first1=Lindsey R. |title=Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine |journal=New England Journal of Medicine |date=30 December 2020 |pages=NEJMoa2035389 |doi=10.1056/NEJMoa2035389|doi-access=free }}</ref><ref name="cnbc11-16">{{cite news | first1 = Berkeley | last1 = Lovelace Jr | first2 = Noah | last2 = Higgins-Dunn | name-list-style = vanc |title= Moderna says preliminary trial data shows its coronavirus vaccine is more than 94% effective, shares soar|url=https://www.cnbc.com/2020/11/16/moderna-says-its-coronavirus-vaccine-is-more-than-94percent-effective.html |access-date=17 November 2020 |work=CNBC |date=16 November 2020}}</ref><ref name="NYT-20201120">{{cite news |last=Zimmer |first=Carl | name-list-style = vanc |author-link=Carl Zimmer |title=2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works. |url=https://www.nytimes.com/2020/11/20/health/covid-vaccine-95-effective.html |date=20 November 2020 |work=The New York Times |access-date=21 November 2020 }}</ref>。[[副作用|有害反応]]としては、注射部位の痛み、倦怠感、筋肉痛、頭痛などのインフルエンザ様症状があった<ref name="cnbc11-16" />。本試験は現在進行中であり、2022年後半に終了する予定である<ref name="NCT04470427">{{ClinicalTrialsGov|NCT04470427|A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19}}</ref>。 |
|||
2020年11月、''[[Nature (journal)|Nature]]''誌は、「LNP製剤の違いやmRNA二次構造の違いが、モデルナとバイオンテックの熱安定性の違いを説明する可能性はあるが、多くの専門家は、両方のワクチン製品が最終的にはさまざまな温度で同様の保存要件と保存期間を持つことが証明されると考えている」と報告している<ref name="nature1">{{cite journal | vauthors = Dolgin E | title = COVID-19 vaccines poised for launch, but impact on pandemic unclear | journal = Nature Biotechnology | date = November 2020 | pmid = 33239758 | doi = 10.1038/d41587-020-00022-y | s2cid = 227176634 }}</ref>。 |
|||
2020年9月以降、モデルナはロシュ・ダイアグノスティックス社のElecsys Anti-SARS-CoV-2 S試験を使用しており、2020年11月25日に米国食品医薬品局(FDA)から緊急使用許可(EUA)を取得している。微生物臨床アッセイの独立系サプライヤーによると、「これにより、SARS-CoV-2抗体の定量的な測定が容易になり、ワクチンによる保護と抗受容体結合ドメイン(RBD)抗体のレベルとの相関関係を確立するのに役立つ」としている。パートナーシップは、2020年12月9日にロシュによて発表された<ref>{{cite web | url = https://www.rapidmicrobiology.com/news/moderna-use-roche-antibody-test-during-vaccine-trials | title = Moderna Use Roche Antibody Test During Vaccine Trials | work = rapidmicrobiology.com | access-date = 13 December 2020 }}</ref>。 |
|||
2020年12月のFDAによる、mRNA-1273の第III相臨床試験の中間結果のレビューで、COVID-19感染症に対して安全かつ有効であることが示され、結果としてFDAからEUAが発行された<ref name="nih-eua" />。 |
|||
モデルナのワクチン候補薬が18歳未満の人に安全で効果的かどうか、またどのくらいの期間で[[免疫力]]を発揮するのかは不明である<ref name="cnbc11-16" />。 |
|||
2021年1月、モデルナは、第I相試験で2回ワクチン接種を受けた人に、3回目のワクチンを提供することを発表した。このブースターは、2回目の接種から6ヶ月から12ヶ月後に提供される。同社は、抗体持続性データがそれを正当化するならば、第III相試験の参加者を対象に3回目の接種も検討する可能性があると述べている<ref>{{Cite news|last=Rio|first=Giulia McDonnell Nieto del|date=2021-01-15|title=Covid-19: Over Two Million Around the World Have Died From the Virus|work=The New York Times|url=https://www.nytimes.com/live/2021/01/15/world/covid19-coronavirus|access-date=2021-01-18|issn=0362-4331}}</ref><ref>{{Cite web|last=Tirrell|first=Meg|date=2021-01-14|title=Moderna looks to test Covid-19 booster shots a year after initial vaccination|url=https://www.cnbc.com/2021/01/14/moderna-looks-to-test-covid-19-booster-shots-a-year-after-initial-vaccination.html|access-date=2021-01-18|website=CNBC}}</ref><ref>{{Cite web|title=Moderna Explores Whether Third Covid-19 Vaccine Dose Adds Extra Protection |url=https://www.wsj.com/livecoverage/covid-2021-01-15/card/unPKRidYM3KYhZ9cEVTs|access-date=2021-01-18|website=The Wall Street Journal}}</ref>。 |
|||
2021年1月、モデルナは、南アフリカで発見されたウイルス変異に対するブースター接種として使用できる新しいワクチンの開発を開始した<ref>{{cite web|url=https://investors.modernatx.com/static-files/1f770088-5909-457b-af99-7ff2454ba28a|format=PDF|title=Moderna COVID-19 Vaccine Update|date=25 January 2021|accessdate=2021-02-20}}</ref><ref name="NYT 20210125">{{cite web | title=Is the Covid-19 Vaccine Effective Against New South African Variant? | website=[[:en:The New York Times|The New York Times]] | date=25 January 2021 | url=https://www.nytimes.com/2021/01/25/health/coronavirus-moderna-vaccine-variant.html | access-date=25 January 2021}}</ref>。また、既存のワクチンの3回目の注射でウイルスの変異を防ぐことができるかどうかの試験も開始した<ref name="NYT 20210125" />。 |
|||
== 保管要件 == |
|||
[[File:Vaccine storage (2021) (cropped).jpg|thumb|upright|従来の医療用冷凍庫に保存されているモデナワクチン]] |
|||
モデルナのニュースは、[[ファイザー]]社-[[バイオンテック]]社のワクチン候補[[BNT162b2]]の予備的な結果に続くもので、モデルナは同様の有効性を示しているが、ファイザー・バイオンテックのワクチン候補は-80~-60℃の{{仮リンク|超低温冷凍庫|en|ULT freezer}}での保管が必要なのに対し、モデルナは2~8℃の標準的な医療用冷蔵庫で30日間まで、または-20℃で4ヶ月間まで保管できる<ref name="Vaccination Storage">{{cite web | title=Pfizer-BioNTech COVID-19 Vaccine Vaccination Storage & Dry Ice Safety Handling | publisher=Pfizer | url=https://www.cvdvaccine-us.com/product-storage-and-dry-ice | access-date=17 December 2020}}</ref><ref name="cnbc11-16" />。低所得国では通常、冷蔵庫保管による[[コールドチェーン]](低温に保つ物流方式)能力がある<ref>{{cite news|url=https://fortune.com/2020/12/05/china-covid-19-vaccines-approval-sinovac-sinopharm/|title=How China's COVID-19 could fill the gaps left by Pfizer, Moderna, AstraZeneca|work=Fortune|date=5 December 2020|access-date=5 December 2020|archive-date=12 December 2020|archive-url=https://web.archive.org/web/20201212204815/https://fortune.com/2020/12/05/china-covid-19-vaccines-approval-sinovac-sinopharm/|url-status=live}}</ref><ref>{{cite news|url=https://jakartaglobe.id/business/pfizers-vaccine-is-out-of-the-question-as-indonesia-lacks-refrigerators-state-pharma-boss|title=Pfizer's Vaccine Is Out of the Question as Indonesia Lacks Refrigerators: State Pharma Boss|work=Jakarta Globe|date=22 November 2020|access-date=5 December 2020|archive-date=7 December 2020|archive-url=https://web.archive.org/web/20201207124956/https://jakartaglobe.id/business/pfizers-vaccine-is-out-of-the-question-as-indonesia-lacks-refrigerators-state-pharma-boss/|url-status=live}}</ref>。 |
|||
== 有効性 == |
|||
中間一次有効性分析、SARS-CoV-2が陰性で大きなプロトコル逸脱がなく、1スケジュールにつき2回の治験薬投与を受けた全参加者を対象とした、プロトコルごとのセットに基づいて行われた。主要評価項目は、'''2回目の投与から少なくとも14日後に発症するCOVID-19の予防におけるプロトコル定義された'''ワクチン有効性(VE)であった。症例は盲検委員会により判定された。中間または一次分析において、帰無仮説であるVEが30%以下であることが棄却されれば、一次有効性の成功基準を満たすことになる。今回の有効性分析は、あらかじめ設定した第一次中間分析の時点である95例の判定結果に基づいて行ったものである<ref name=":0">{{Cite web|date=December 17, 2020|title=Vaccines and Related Biological Products Advisory Committee Meeting|url=https://www.fda.gov/media/144434/download|publisher=U.S. [[:en:Food and Drug Administration|Food and Drug Administration]] (FDA)|accessdate=2021-02-20}}</ref>。そのデータを以下に示す。 |
|||
{| class="wikitable mw-collapsible" |
|||
|+ 主要評価項目であるCOVID-19の2回目投与後14日目からの中間分析をプロトコルセットごとに実施<ref name=":0" /> |
|||
|- |
|||
! rowspan="2" | 主要評価項目: COVID-19 |
|||
! colspan="2" | 症例数 n (%) <br />[[罹患率]] 1000人年あたり |
|||
! rowspan="2" | ワクチン有効性 <br />(95% 信頼区間) |
|||
|- |
|||
! ワクチングループ (N = 13,934) |
|||
! プラセボグループ (N = 13,883) |
|||
|- |
|||
|All participants |
|||
|5 cases in 13,934 (<0.1%) |
|||
1.840 |
|||
|90 cases in 13,883 (0.6%) |
|||
33.365 |
|||
|94.5% (86.5-97.8%) |
|||
|- |
|||
|Participants 18–64 years of age |
|||
|5 cases in 10,407 (<0.1%) |
|||
2.504 |
|||
|75 cases in 10,384 (0.7%) |
|||
37.788 |
|||
|93.4% (83.7-97.3%) |
|||
|- |
|||
|65 and older |
|||
|0 cases in 3,527 |
|||
|15 cases in 3,499 (0.4%) |
|||
|100% |
|||
|- |
|||
|Chronic lung disease |
|||
|0/661 |
|||
|6/673 |
|||
|100% |
|||
|- |
|||
|Significant cardiac disease |
|||
|0/686 |
|||
|3/678 |
|||
|100% |
|||
|- |
|||
|Severe obesity (BMI>40) |
|||
|1/901 |
|||
|11/884 |
|||
|91.2% (32-98.9%) |
|||
|- |
|||
|Diabetes |
|||
|0/1338 |
|||
|7/1309 |
|||
|100% |
|||
|- |
|||
|Liver disease |
|||
|0/93 |
|||
|0/90 |
|||
| |
|||
|- |
|||
|Obesity (BMI>30) |
|||
|2/5269 |
|||
|46/5207 |
|||
|95.8% (82.6-99%) |
|||
|} |
|||
== 製造 == |
|||
[[File:South Carolina National Guard receives first shipment of Moderna COVID-19 vaccines (50747385983).jpg|thumb|保冷パックで固定されたモデルナワクチンボックスが入っている断熱輸送用コンテナ]] |
|||
モデルナは、ワクチン製造プロセスをスケールアップするために、{{仮リンク|医薬品製造受託機関|en|Contract manufacturing organization}}に大きく依存している。モデルナは[[ロンザグループ]]と契約し、米国のニューハンプシャー州[[ポーツマス (ニューハンプシャー州)|ポーツマス]]とスイスの{{仮リンク|フィスプ|en|Visp}}の施設でワクチンを製造しており、必要な脂質[[賦形剤]]をCordenPharmaから購入している<ref name="Mullin">{{cite news | vauthors = Mullin R |title=Pfizer, Moderna ready vaccine manufacturing networks |url=https://cen.acs.org/business/outsourcing/Pfizer-Moderna-ready-vaccine-manufacturing/98/i46 |access-date=21 December 2020 |work=Chemical & Engineering News |publisher=American Chemical Society |date=25 November 2020 |location=Washington, D.C.}}</ref>。バイアルの充填と包装の作業については、モデルナは米国の{{仮リンク|キャタレント (医薬品)|en|Catalent|label=キャタレント}}とスペインのラボラトリ・ファーマシューティカル・ロビと契約を結んでいる<ref name="Mullin" />。 |
|||
== 事前買取契約 == |
|||
2020年6月、[[シンガポール]]はモデルナとの事前購入契約に署名し、早期にワクチンの在庫を確保するために価格プレミアムを支払ったと報じられたが、政府は商業上の機密性と機密保持条項を理由に、実際の価格と数量を提供を拒否した<ref>{{cite web |title=Securing Singapore's access to COVID-19 vaccines |url=https://www.gov.sg/article/securing-singapores-access-to-covid-19-vaccines |website=www.gov.sg |publisher=Singapore Government |access-date=1 February 2021 |date=14 December 2020}}</ref><ref>{{cite news |last1=Khalik |first1=Salma |title=How Singapore picked its Covid-19 vaccines |url=https://www.straitstimes.com/singapore/health/how-singapore-picked-its-covid-19-vaccines |access-date=1 February 2021 |work=The Straits Times |date=1 February 2021 }}</ref>。 |
|||
2020年8月11日、米国政府は、モデルナが見込むワクチンの1億回分を購入する契約に署名し<ref>{{cite web|agency=Reuters|date=11 August 2020|title=Trump says U.S. inks agreement with Moderna for 100 mln doses of COVID-19 vaccine candidate|url=https://finance.yahoo.com/news/trump-says-u-inks-agreement-214658966.html|url-status=live|archive-url=https://web.archive.org/web/20201116154229/https://finance.yahoo.com/news/trump-says-u-inks-agreement-214658966.html|archive-date=16 November 2020|access-date=2020-08-12|website=finance.yahoo.com}}</ref>、モデルナは1コースあたり50~60ドルの価格設定を計画しているとフィナンシャル・タイムズ紙は報じている<ref>{{cite web|url=https://www.ft.com/content/405c0d07-d15a-4f5b-8a77-3c2fbd5d4c1c|newspaper=Financial Times|title=Moderna pitches virus vaccine at about $32-$37 per course|date=5 August 2020|access-date=29 July 2020|archive-date=16 November 2020|archive-url=https://web.archive.org/web/20201116154231/https://www.ft.com/content/405c0d07-d15a-4f5b-8a77-3c2fbd5d4c1c|url-status=live}}{{subscription required}}</ref>。2020年11月、モデルナは同社のワクチンを購入する政府に対し、1回あたり25ドルから37ドルの間で請求することを表明しているが、EUはモデルナから購入する予定の1億6000万回分に対して、1回あたり25ドル以下の価格を求めているという<ref>{{cite news|date=22 November 2020|title=Donald Trump appears to admit Covid is 'running wild' in the US|work=[[:en:The Guardian|The Guardian]]|url=https://www.theguardian.com/us-news/2020/nov/22/donald-trump-appears-to-admits-covid-is-running-wild-in-the-us|access-date=22 November 2020|issn=0261-3077|quote=Moderna told the Germany [sic] weekly Welt am Sonntag that it will charge governments between $25 and $37 per dose of its Covid vaccine candidate, depending on the amount ordered.}}</ref><ref>{{cite news|last=Guarascio|first=Francesco | name-list-style = vanc |date=24 November 2020|title=EU secures 160 million doses of Moderna's COVID-19 vaccine|work=Reuters|url=https://www.reuters.com/article/health-coronavirus-eu-moderna-idUSKBN2841GE|access-date=25 November 2020}}</ref>。 |
|||
2020年、モデルナは、欧州連合(EU)との間で1億6,000万回分、カナダとの間で最大5,600万回分のmRNA-1273の購入契約を取得している<ref name="ec">{{cite web |title=Coronavirus: Commission approves contract with Moderna to ensure access to a potential vaccine |url=https://ec.europa.eu/commission/presscorner/detail/en/IP_20_2200 |publisher=European Commission |access-date=4 December 2020 |date=25 November 2020}}</ref><ref name="pmo">{{cite web |title=New agreements to secure additional vaccine candidates for COVID-19 |url=https://pm.gc.ca/en/news/news-releases/2020/09/25/new-agreements-secure-additional-vaccine-candidates-covid-19 |publisher=Prime Minister's Office, Government of Canada |access-date=4 December 2020 |date=25 September 2020}}</ref>。12月17日、[[:en:Minister of Budget (Belgium)|ベルギーの予算担当大臣]]の[[Twitter|ツイート]]によると、EUは1回あたり18米ドルを支払う一方、米国は1回あたり15米ドルを支払うと[[ニューヨーク・タイムズ]]紙が報じている<ref>{{cite news|title=A European Official Reveals a Secret: The U.S. Is Paying More for Coronavirus Vaccines | vauthors = Stevis-Gridneff M, Sanger-Katz M, Weiland N |work=[[:en:The New York Times]]|date=18 December 2020|access-date=19 December 2020|url=https://www.nytimes.com/2020/12/18/upshot/coronavirus-vaccines-prices-europe-united-states.html}}</ref>。 |
|||
==承認== |
|||
[[File:South Carolina National Guard administers its first Moderna COVID-19 vaccinations (50752619036).jpg|thumb|モデルナワクチンを投与されている米軍関係者]] |
|||
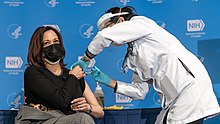
[[File:Kamala Harris getting her second COVID-19 vaccination.jpg|thumb|2021年1月にモデルナワクチンの2回目の接種を受ける[[カマラ・ハリス]]副大統領(米国) |
|||
]] |
|||
=== 迅速 === |
|||
2020年12月現在、mRNA-1273は、英国、欧州連合(EU)、カナダ、および米国でのワクチンの迅速な展開を可能にする[[緊急使用許可]](EUA)に向けて複数の国から評価を受けていた<ref name="CNN">{{cite news|url=https://www.cnn.com/2020/11/30/health/moderna-vaccine-fda-eua-application/index.html|work=CNN| first = Elizabeth | last = Cohen | name-list-style = vanc |title=Moderna applies for FDA authorization for its Covid-19 vaccine|date=30 November 2020|access-date=4 December 2020}}</ref><ref name="burger">{{cite news | first = Ludwig | last = Burger | name-list-style = vanc |title=COVID-19 vaccine sprint as Pfizer-BioNTech, Moderna seek emergency EU approval |url=https://www.reuters.com/article/us-health-coronavirus-vaccines-pfizer/covid-19-vaccine-sprint-as-pfizer-biontech-moderna-seek-emergency-eu-approval-idUSKBN28B4F3 |access-date=4 December 2020 |work=Reuters |date=1 December 2020}}</ref><ref name="kuchler">{{cite news | first = Hannah | last = Kuchler | name-list-style = vanc |title=Canada could be among the first to clear Moderna's COVID-19 vaccine for use |url=https://financialpost.com/financial-times/canada-could-be-among-the-first-to-clear-modernas-covid-19-vaccine-for-use |access-date=4 December 2020 |work=The Financial Post |date=30 November 2020}}</ref><ref name="parsons">{{cite web |last1=Parsons|first1=Lucy | name-list-style = vanc |title=UK's MHRA starts rolling review of Moderna's COVID-19 vaccine |url=http://www.pharmatimes.com/news/uks_mhra_starts_rolling_review_of_modernas_covid-19_vaccine_1355243 |publisher=PharmaTimes |access-date=4 December 2020 |date=28 October 2020}}</ref>。 |
|||
2020年12月18日、mRNA-1273は[[アメリカ食品医薬品局]](FDA)よりEUAの承認を取得した<ref name="FDA PR 20201218" /><ref name="Moderna COVID-19 Vaccine FDA EUA" /><ref name="nih-eua" />。これは、モデルナの製品としては初めてFDAの認可を受けた製品となる<ref>{{cite news|last=Lee|first=Jaimy | name-list-style = vanc |title=Moderna nears its first-ever FDA authorization, for its COVID-19 vaccine|url=https://www.marketwatch.com/story/moderna-nears-its-first-ever-fda-authorization-for-its-covid-19-vaccine-11608134670|access-date=19 December 2020|website=MarketWatch }}</ref><ref name="CDC ACIP Moderna COVID-19 Vaccine" />。 |
|||
2020年12月23日、mRNA-1273は[[カナダ保健省]]によって承認された<ref name="CA Moderna decision" /><ref name="CA Moderna product description" />。[[ジャスティン・トルドー]]首相は以前、承認後48時間以内に納入を開始し、12月末までに168,000回分を納入される述べた<ref>{{Cite news|last=Austen|first=Ian|date=23 December 2020|title=Canada approves the Moderna vaccine, paving the way for inoculations in its vast Far North |work=The New York Times|url=https://www.nytimes.com/2020/12/23/world/canada-moderna.html|access-date=24 December 2020}}</ref>。 |
|||
2021年1月5日、[[:en:Ministry of Health (Israel)|イスラエル保健省]]はmRNA-1273の[[イスラエル]]での使用を承認した<ref>{{Cite news|title=Israel authorises use of Moderna's COVID-19 vaccine|url=https://news.yahoo.com/israels-health-ministry-authorizes-modernas-003044659.html|access-date=5 January 2021|website=Yahoo! News }}</ref>。 |
|||
2021年2月3日、mRNA-1273は[[シンガポール]]での使用を[[:en:Health Sciences Authority|保健科学庁]]より承認され<ref>{{Cite web|date=3 February 2021|title=Singapore becomes first in Asia to approve Moderna's COVID-19 vaccine|url=https://www.reuters.com/article/us-health-coronavirus-singapore/singapore-becomes-first-in-asia-to-approve-modernas-covid-19-vaccine-idUSKBN2A30ZM|access-date=3 February 2021|website=[[:en:Reuters|Reuters]]}}</ref>、2月17日に最初の出荷分が到着した<ref>{{Cite web|title=First shipment of Moderna's COVID-19 vaccine arrives in Singapore|url=https://www.channelnewsasia.com/news/singapore/moderna-covid-19-vaccine-first-shipment-arrives-sia-singapore-14217650|access-date=2021-02-17|website=CNA|language=en}}</ref>。 |
|||
=== 標準 === |
|||
2021年1月6日、欧州医薬品庁(EMA)は条件付き製造販売承認の付与を勧告し<ref name="COVID-19 Vaccine Moderna EPAR" /><ref>{{cite press release|date=6 January 2021|title=EMA recommends COVID-19 Vaccine Moderna for authorisation in the EU|url=https://www.ema.europa.eu/en/news/ema-recommends-covid-19-vaccine-moderna-authorisation-eu|access-date=6 January 2021|publisher=European Medicines Agency}}</ref>、同日、欧州委員会によって承認された<ref name="EU approval">{{Cite press release|title=European Commission authorises second safe and effective vaccine against COVID-19|url=https://ec.europa.eu/commission/presscorner/detail/en/ip_21_3|access-date=6 January 2021|website=European Commission }}</ref><ref name="EU UR info" />。 |
|||
2021年1月12日、スイスメディック社は、スイスでモデルナCOVID-19 mRNAワクチンの一時的な承認を取得した<ref>{{cite news | last=Miller | first=John | title=Swiss drugs regulator approves Moderna's COVID-19 vaccine | website=Reuters | date=12 January 2021 | url=https://www.reuters.com/article/us-health-coronavirus-swiss-vaccine-idUSKBN29H1JE | access-date=17 January 2021}}</ref><ref>{{cite press release|title=Swissmedic grants authorisation for the COVID-19 vaccine from Moderna |url=https://www.swissmedic.ch/swissmedic/en/home/news/coronavirus-covid-19/zulassung-covid-19-impfstoff-moderna.html |website=Swissmedic |date=2020-01-12 |access-date=2020-01-12}}</ref>。 |
|||
== 社会文化 == |
|||
=== 論争 === |
|||
2020年5月、第I相試験前段階のヒト試験の候補45例中8例のみの部分的で非査読の結果を金融市場に直接公開した後、CEOは[[CNBC]]で同社の資金調達のために12.5億ドルの即時権利発行を発表し、評価額は300億ドルとなったが<ref>{{cite newspaper | newspaper=[[:en:The Los Angeles Times|The Los Angeles Times]] | access-date=19 May 2020 | date=19 May 2020 | title=Column: Moderna's vaccine results boosted its share offering – and it's hardly a coincidence | first=Michael | last=Hiltzik | name-list-style = vanc | url=https://www.latimes.com/business/story/2020-05-19/moderna-vaccine-share-price-coronavirus-covid-19 | archive-date=16 November 2020 | archive-url=https://web.archive.org/web/20201116154214/https://www.latimes.com/business/story/2020-05-19/moderna-vaccine-share-price-coronavirus-covid-19 | url-status=live }}</ref>、''[[:en:Stat (website)|Stat]]''は「ワクチンの専門家はモデルナがCOVID-19ワクチンの評価に重要なデータを出さなかったと言っている」と述べた<ref>{{cite web | url=https://www.statnews.com/2020/05/19/vaccine-experts-say-moderna-didnt-produce-data-critical-to-assessing-covid-19-vaccine/ | title=Vaccine experts say Moderna didn't produce data critical to assessing Covid-19 vaccine | date=19 May 2020 | access-date=19 May 2020 | first=Helen | last=Branswell | name-list-style = vanc | website=[[:en:Stat (website)|Stat]] | archive-date=16 November 2020 | archive-url=https://web.archive.org/web/20201116154251/https://www.statnews.com/2020/05/19/vaccine-experts-say-moderna-didnt-produce-data-critical-to-assessing-covid-19-vaccine/ | url-status=live }}</ref>。 |
|||
7月7日には、同社が臨床試験のデータを共有する気がないことをめぐって、モデルナと政府科学者との間で論争が起きていたことが明らかになった<ref name="reuters6">{{cite news | url=https://www.reuters.com/article/us-health-coronavirus-moderna-exclusive/exclusive-moderna-spars-with-us-scientists-over-covid-19-vaccine-trials-idUSKBN2481EU | title=Exclusive: Moderna spars with U.S. scientists over COVID-19 vaccine trials | first1=Marisa | last1=Taylor | first2=Robin | last2=Respaut | name-list-style = vanc | work=Reuters | date=7 July 2020 | access-date=10 July 2020 | archive-date=16 November 2020 | archive-url=https://web.archive.org/web/20201116154217/https://www.reuters.com/article/us-health-coronavirus-moderna-exclusive/exclusive-moderna-spars-with-us-scientists-over-covid-19-vaccine-trials-idUSKBN2481EU | url-status=live }}</ref>。 |
|||
妊娠中の女性と授乳中の女性は、緊急使用許可を得るための最初の試験から除外されたが<ref>[https://www.usatoday.com/story/news/nation/2020/11/23/pregnant-women-excluded-pfizer-moderna-covid-19-vaccine-trials/6352679002/ Pregnant women haven't been included in promising COVID-19 vaccine trials]</ref>、これらの人々を対象とした試験は2021年に実施される予定である<ref>[https://www.statnews.com/2020/12/09/covid-19-vaccine-shoud-be-option-for-pregnant-lactating-health-workers/ FDA: Leave the door open to Covid-19 vaccination for pregnant and lactating health workers]</ref>。 |
|||
モデルナはまた、臨床試験に十分な有色人種の人数を採用できなかったことで批判に直面した<ref>{{cite news|agency=[[:en:Reuters|Reuters]]|work=NBC News|title=Moderna vaccine trial contractors fail to enroll enough people of color, prompting slowdown|url=https://www.nbcnews.com/news/nbcblk/moderna-vaccine-trial-contractors-fail-enroll-enough-people-color-prompting-n1242267|date=6 October 2020|access-date=17 November 2020}}</ref>。 |
|||
=== 特許訴訟 === |
|||
mRNA-1273の{{仮リンク|PEG化|en|PEGylation}}[[リポソーム|脂質]]{{仮リンク|ナノ粒子ドラッグデリバリー|en|Nanoparticle drug delivery}}(LNP)システムは、モデルナが以前にLNP技術のライセンスを取得していた{{仮リンク|アービュータス・バイオファーマ|en|Arbutus Biopharma}}との間で継続的な特許訴訟の対象となっている<ref name="nylj1">{{cite magazine | journal=[[:en:New York Law Journal|New York Law Journal]] | title=Patent Issues Highlight Risks of Moderna's COVID-19 Vaccine | date=14 September 2020 | url=https://www.law.com/newyorklawjournal/2020/09/14/patent-issues-highlight-risks-of-modernas-covid-19-vaccine/ | first1= Dorothy R. | last1=Auth | first2=Michael B.|last2=Powell | name-list-style = vanc | access-date=1 December 2020 | url-access=registration }}</ref><ref>{{cite magazine | magazine=[[:en:Forbes|Forbes]] | url=https://www.forbes.com/sites/nathanvardi/2020/07/29/modernas-mysterious-coronavirus-vaccine-delivery-system/?sh=6e8879fb62d9 | title=Moderna's Mysterious Coronavirus Vaccine Delivery System | first=Nathan | last=Vardi | name-list-style = vanc | date=29 June 2020 | access-date=1 December 2020}}</ref>。2020年9月4日、''[[Nature Biotechnology]]''誌は、進行中の訴訟でモデルナが重要な争点を失ったと報じた<ref>{{cite journal | title = Moderna loses key patent challenge | journal = Nature Biotechnology | volume = 38 | issue = 9 | pages = 1009 | date = September 2020 | pmid = 32887970 | doi = 10.1038/s41587-020-0674-1 | s2cid = 221504018 | doi-access = free }}</ref>。 |
|||
== 脚注 == |
|||
{{reflist|3}} |
|||
== 外部リンク == |
== 外部リンク == |
||
{{Commonscat}} |
|||
{{scholia}} |
|||
* {{cite web | url=https://www.fda.gov/media/144452/download | format=PDF | title=VRBPAC mRNA-1273 Sponsor Briefing Document | publisher = Moderna | date = 17 December 2020|accessdate=2021-1}} |
* {{cite web | url=https://www.fda.gov/media/144452/download | format=PDF | title=VRBPAC mRNA-1273 Sponsor Briefing Document | publisher = Moderna | date = 17 December 2020|accessdate=2021-1}} |
||
* {{cite web|url=https://www.modernatx.com/sites/default/files/mRNA-1273-P301-Protocol.pdf|title=Clinical Study Protocol mRNA-1273-P301|publisher=[[:en:Moderna|Moderna]]|accessdate=2021-02-20}} |
|||
*[https://www.ema.europa.eu/en/documents/assessment-report/covid-19-vaccine-moderna-epar-public-assessment-report_en.pdf COVID-19 Vaccine Moderna assessment report] [[:en:European Medicines Agency|European Medicines Agency]] |
|||
* {{cite web | title=How Moderna's Covid-19 Vaccine Works | website=[[The New York Times]] | url=https://www.nytimes.com/interactive/2020/health/moderna-covid-19-vaccine.html |accessdate=2021-1}} |
* {{cite web | title=How Moderna's Covid-19 Vaccine Works | website=[[The New York Times]] | url=https://www.nytimes.com/interactive/2020/health/moderna-covid-19-vaccine.html |accessdate=2021-1}} |
||
{{2019-nCoV}} |
|||
{{Medical-stub}} |
{{Medical-stub}} |
||
{{2019-nCoV}} |
|||
{{DEFAULTSORT:MRNA-1273}} |
{{DEFAULTSORT:MRNA-1273}} |
||
[[Category:COVID-19ワクチン]] |
[[Category:COVID-19ワクチン]] |
||
2021年2月27日 (土) 21:41時点における版
 モデルナCOVID-19ワクチンが入ったバイアル | |
| ワクチン概要 | |
|---|---|
| 病気 | COVID-19 |
| 種別 | ? |
| 臨床データ | |
| 発音 | [məˈdɜːrnə] mə-DUR-nə[10] |
| ライセンス | US Daily Med:リンク |
| 法的規制 | |
| データベースID | |
| ATCコード | None |
| DrugBank | DB15654 |
| UNII | EPK39PL4R4 |
モデルナCOVID-19ワクチン(コードネーム: mRNA-1273)は、アメリカ国立アレルギー・感染症研究所 (NIAID) 、アメリカ生物医学先端研究開発局 (BARDA) 、及びモデルナにより開発されたCOVID-19ワクチン。筋肉内注射により4週間開けて2回に分けて0.5mLが投与される[11]。
これは、SARS-CoV-2のスパイクタンパク質をコードするヌクレオシド修飾mRNA (modRNA) を脂質ナノ粒子にカプセル化したRNAワクチンである。2020年にCOVID-19に対して開発及び展開された2つのRNAワクチンの1つである(もう1つはファイザー-バイオンテックワクチンである)。
2020年12月8日、米国のアメリカ食品医薬品局 (FDA) から緊急使用許可が発行された[7][12][13][14]。2020年12月23日にカナダで[1][2]、2021年1月6日に欧州連合で[3][15][4]、2021年1月8日にイギリスで使用が認可された[16]。
設計
2020年1月、モデルナは、SARS-CoV-2に対する免疫を誘導するRNAワクチン(mRNA-1273)の開発を発表した[17][18][19]。モデルナの技術は、mRNA-1273と命名されたヌクレオシド修飾メッセンジャーRNA(modRNA)化合物を使用している。mRNAは、ヒトの細胞内に入ると、その細胞の小胞体と結合する。mRNA-1273は、その細胞の通常の産生プロセスを使用して特定のタンパク質を作るように細胞に指示するようにコード化されている。いったんそれが細胞から排出されると、最終的には免疫系によって検出され、免疫系は効果的な抗体の産生を開始する。この発表を受け、モデルナの株価は劇的に上昇し、CEOをはじめとする経営陣は保有株の大規模なプログラム売却を開始した[20]。mRNA-1273のドラッグデリバリーシステムは、PEG化脂質ナノ粒子ドラッグデリバリー(LNP)システムを採用している[21]。
組成
ワクチンには以下の成分が含まれている[22]。
- 融合前構造で安定化されたSARS-CoV-2スパイク糖タンパク質(S)をコードするヌクレオシド修飾メッセンジャーRNA[23]
- 脂質
- SM-102
- ポリエチレングリコール[PEG]2000-ジミリストイルグリセロール[DMG]
- コレステロール
- および 1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン[DSPC]
- トロメタミン
- トロメタミン塩酸塩
- 酢酸
- 酢酸ナトリウム
- および スクロース
臨床試験
第I相/第II相試験
2020年3月、アメリカ国立アレルギー・感染症研究所との協力により、mRNA-1273のヒト第I相臨床試験が開始された[24]。4月、アメリカ生物医学先端研究開発局(BARDA)がモデルナのワクチン開発に最大4億8,300万ドルを割り当てた[25]。5月に開始される第II相投与および有効性試験の計画は、アメリカ食品医薬品局(FDA)によって承認された[26]。モデルナは、スイスのワクチンメーカーであるロンザグループとパートナーシップを結び[27]、年間3億回分を供給することになった[28]。
2020年5月25日、モデルナは、候補ワクチンであるmRNA-1273の2回投与に対する安全性と抗体反応の違いを評価するために、成人600人の参加者を募集する第IIa相臨床試験を開始し、2021年の試験終了を予定している[29]。2020年6月、モデルナはキャタレント社とパートナーシップを締結し、キャタレントがワクチン候補の充填とパッケージ化を行う。キャタレントは保管と流通も提供する[30]。
7月9日、モデルナは、自社のワクチンが承認された場合に備えて、ラボラトリ・ファーマシューティカル・ロビ社とのインフィル製造契約を発表した[31]。
2020年7月14日、モデルナの科学者は、mRNA-1273の第I相用量漸増臨床試験の予備結果を発表し、注射後15日目という早い時期にS1/S2に対する中和抗体の用量依存的誘導を示した。発熱、倦怠感、頭痛、筋肉痛、注射部位の痛みなどの軽度から中等度の有害反応はすべての投与群で認められたが、投与量が増えるにつれてありがちになった[32][33]。低用量のワクチンは、安全かつ有効と判断され、100-μgを29日間隔で2回投与した第III相臨床試験を進めることになった[32]。
2020年7月、モデルナは、第I相臨床試験において、Operation Warp Speedの候補薬が、健康な成人において中和抗体の産生につながったことを速報で発表した[32][34]。「モデルナがより大きな試験で進める100マイクログラムの用量では、15人の患者全員が疲労、悪寒、頭痛、筋肉痛、注射部位の痛みなどの有害反応を経験した」[35]。やっかいな高用量は、7月に将来の試験から破棄された[35]。
第III相試験
7月27日、モデルナとアメリカ国立アレルギー・感染症研究所は、米国で第III相試験を開始し、3万人のボランティアを登録して、100 μgのmRNA-1273ワクチンを2回接種する群と、0.9%塩化ナトリウムのプラセボを投与する群の2つのグループに割り振る計画を立てた[36]。8月7日の時点で、4,500人以上のボランティアが登録していた。
2020年9月、モデルナは臨床試験の詳細な試験計画を発表した[37]。9月30日、CEOのStéphane Bancelは、試験が成功すれば、早ければ2021年3月下旬か4月上旬にワクチンが一般に提供される可能性があると述べた[38]。2020年10月の時点で、モデルナは第III相試験に必要な3万人の参加者の登録を完了していた[39]。アメリカ国立アレルギー・感染症研究所は、2020年11月15日に、全体的な試験結果が良好であったと発表した[40]。
2020年12月30日、モデルナは第III相臨床試験の結果を発表し、COVID-19の感染予防に94%の有効性を示した[41][42][43]。有害反応としては、注射部位の痛み、倦怠感、筋肉痛、頭痛などのインフルエンザ様症状があった[42]。本試験は現在進行中であり、2022年後半に終了する予定である[44]。
2020年11月、Nature誌は、「LNP製剤の違いやmRNA二次構造の違いが、モデルナとバイオンテックの熱安定性の違いを説明する可能性はあるが、多くの専門家は、両方のワクチン製品が最終的にはさまざまな温度で同様の保存要件と保存期間を持つことが証明されると考えている」と報告している[45]。
2020年9月以降、モデルナはロシュ・ダイアグノスティックス社のElecsys Anti-SARS-CoV-2 S試験を使用しており、2020年11月25日に米国食品医薬品局(FDA)から緊急使用許可(EUA)を取得している。微生物臨床アッセイの独立系サプライヤーによると、「これにより、SARS-CoV-2抗体の定量的な測定が容易になり、ワクチンによる保護と抗受容体結合ドメイン(RBD)抗体のレベルとの相関関係を確立するのに役立つ」としている。パートナーシップは、2020年12月9日にロシュによて発表された[46]。
2020年12月のFDAによる、mRNA-1273の第III相臨床試験の中間結果のレビューで、COVID-19感染症に対して安全かつ有効であることが示され、結果としてFDAからEUAが発行された[12]。
モデルナのワクチン候補薬が18歳未満の人に安全で効果的かどうか、またどのくらいの期間で免疫力を発揮するのかは不明である[42]。
2021年1月、モデルナは、第I相試験で2回ワクチン接種を受けた人に、3回目のワクチンを提供することを発表した。このブースターは、2回目の接種から6ヶ月から12ヶ月後に提供される。同社は、抗体持続性データがそれを正当化するならば、第III相試験の参加者を対象に3回目の接種も検討する可能性があると述べている[47][48][49]。
2021年1月、モデルナは、南アフリカで発見されたウイルス変異に対するブースター接種として使用できる新しいワクチンの開発を開始した[50][51]。また、既存のワクチンの3回目の注射でウイルスの変異を防ぐことができるかどうかの試験も開始した[51]。
保管要件

モデルナのニュースは、ファイザー社-バイオンテック社のワクチン候補BNT162b2の予備的な結果に続くもので、モデルナは同様の有効性を示しているが、ファイザー・バイオンテックのワクチン候補は-80~-60℃の超低温冷凍庫での保管が必要なのに対し、モデルナは2~8℃の標準的な医療用冷蔵庫で30日間まで、または-20℃で4ヶ月間まで保管できる[52][42]。低所得国では通常、冷蔵庫保管によるコールドチェーン(低温に保つ物流方式)能力がある[53][54]。
有効性
中間一次有効性分析、SARS-CoV-2が陰性で大きなプロトコル逸脱がなく、1スケジュールにつき2回の治験薬投与を受けた全参加者を対象とした、プロトコルごとのセットに基づいて行われた。主要評価項目は、2回目の投与から少なくとも14日後に発症するCOVID-19の予防におけるプロトコル定義されたワクチン有効性(VE)であった。症例は盲検委員会により判定された。中間または一次分析において、帰無仮説であるVEが30%以下であることが棄却されれば、一次有効性の成功基準を満たすことになる。今回の有効性分析は、あらかじめ設定した第一次中間分析の時点である95例の判定結果に基づいて行ったものである[55]。そのデータを以下に示す。
| 主要評価項目: COVID-19 | 症例数 n (%) 罹患率 1000人年あたり |
ワクチン有効性 (95% 信頼区間) | |
|---|---|---|---|
| ワクチングループ (N = 13,934) | プラセボグループ (N = 13,883) | ||
| All participants | 5 cases in 13,934 (<0.1%)
1.840 |
90 cases in 13,883 (0.6%)
33.365 |
94.5% (86.5-97.8%) |
| Participants 18–64 years of age | 5 cases in 10,407 (<0.1%)
2.504 |
75 cases in 10,384 (0.7%)
37.788 |
93.4% (83.7-97.3%) |
| 65 and older | 0 cases in 3,527 | 15 cases in 3,499 (0.4%) | 100% |
| Chronic lung disease | 0/661 | 6/673 | 100% |
| Significant cardiac disease | 0/686 | 3/678 | 100% |
| Severe obesity (BMI>40) | 1/901 | 11/884 | 91.2% (32-98.9%) |
| Diabetes | 0/1338 | 7/1309 | 100% |
| Liver disease | 0/93 | 0/90 | |
| Obesity (BMI>30) | 2/5269 | 46/5207 | 95.8% (82.6-99%) |
製造

モデルナは、ワクチン製造プロセスをスケールアップするために、医薬品製造受託機関に大きく依存している。モデルナはロンザグループと契約し、米国のニューハンプシャー州ポーツマスとスイスのフィスプの施設でワクチンを製造しており、必要な脂質賦形剤をCordenPharmaから購入している[56]。バイアルの充填と包装の作業については、モデルナは米国のキャタレントとスペインのラボラトリ・ファーマシューティカル・ロビと契約を結んでいる[56]。
事前買取契約
2020年6月、シンガポールはモデルナとの事前購入契約に署名し、早期にワクチンの在庫を確保するために価格プレミアムを支払ったと報じられたが、政府は商業上の機密性と機密保持条項を理由に、実際の価格と数量を提供を拒否した[57][58]。
2020年8月11日、米国政府は、モデルナが見込むワクチンの1億回分を購入する契約に署名し[59]、モデルナは1コースあたり50~60ドルの価格設定を計画しているとフィナンシャル・タイムズ紙は報じている[60]。2020年11月、モデルナは同社のワクチンを購入する政府に対し、1回あたり25ドルから37ドルの間で請求することを表明しているが、EUはモデルナから購入する予定の1億6000万回分に対して、1回あたり25ドル以下の価格を求めているという[61][62]。
2020年、モデルナは、欧州連合(EU)との間で1億6,000万回分、カナダとの間で最大5,600万回分のmRNA-1273の購入契約を取得している[63][64]。12月17日、ベルギーの予算担当大臣のツイートによると、EUは1回あたり18米ドルを支払う一方、米国は1回あたり15米ドルを支払うとニューヨーク・タイムズ紙が報じている[65]。
承認

迅速
2020年12月現在、mRNA-1273は、英国、欧州連合(EU)、カナダ、および米国でのワクチンの迅速な展開を可能にする緊急使用許可(EUA)に向けて複数の国から評価を受けていた[66][67][68][69]。
2020年12月18日、mRNA-1273はアメリカ食品医薬品局(FDA)よりEUAの承認を取得した[7][9][12]。これは、モデルナの製品としては初めてFDAの認可を受けた製品となる[70][13]。
2020年12月23日、mRNA-1273はカナダ保健省によって承認された[1][2]。ジャスティン・トルドー首相は以前、承認後48時間以内に納入を開始し、12月末までに168,000回分を納入される述べた[71]。
2021年1月5日、イスラエル保健省はmRNA-1273のイスラエルでの使用を承認した[72]。
2021年2月3日、mRNA-1273はシンガポールでの使用を保健科学庁より承認され[73]、2月17日に最初の出荷分が到着した[74]。
標準
2021年1月6日、欧州医薬品庁(EMA)は条件付き製造販売承認の付与を勧告し[3][75]、同日、欧州委員会によって承認された[4][15]。
2021年1月12日、スイスメディック社は、スイスでモデルナCOVID-19 mRNAワクチンの一時的な承認を取得した[76][77]。
社会文化
論争
2020年5月、第I相試験前段階のヒト試験の候補45例中8例のみの部分的で非査読の結果を金融市場に直接公開した後、CEOはCNBCで同社の資金調達のために12.5億ドルの即時権利発行を発表し、評価額は300億ドルとなったが[78]、Statは「ワクチンの専門家はモデルナがCOVID-19ワクチンの評価に重要なデータを出さなかったと言っている」と述べた[79]。
7月7日には、同社が臨床試験のデータを共有する気がないことをめぐって、モデルナと政府科学者との間で論争が起きていたことが明らかになった[80]。
妊娠中の女性と授乳中の女性は、緊急使用許可を得るための最初の試験から除外されたが[81]、これらの人々を対象とした試験は2021年に実施される予定である[82]。
モデルナはまた、臨床試験に十分な有色人種の人数を採用できなかったことで批判に直面した[83]。
特許訴訟
mRNA-1273のPEG化脂質ナノ粒子ドラッグデリバリー(LNP)システムは、モデルナが以前にLNP技術のライセンスを取得していたアービュータス・バイオファーマとの間で継続的な特許訴訟の対象となっている[21][84]。2020年9月4日、Nature Biotechnology誌は、進行中の訴訟でモデルナが重要な争点を失ったと報じた[85]。
脚注
- ^ a b c “Regulatory Decision Summary - Moderna COVID-19 Vaccine”. カナダ保健省 (23 December 2020). 23 December 2020閲覧。
- ^ a b c “Moderna COVID-19 Vaccine (mRNA-1273 SARS-CoV-2)”. COVID-19 vaccines and treatments portal (23 December 2020). 23 December 2020閲覧。
- ^ a b c “COVID-19 Vaccine Moderna EPAR”. 欧州医薬品庁 (EMA). 20 January 2021閲覧。
- ^ a b c "European Commission authorises second safe and effective vaccine against COVID-19". European Commission (Press release). 2021年1月6日閲覧。
- ^ “Information for Healthcare Professionals on COVID-19 Vaccine Moderna”. 医薬品・医療製品規制庁 (MHRA) (8 January 2021). 8 January 2021閲覧。
- ^ “Conditions of Authorisation for COVID-19 Vaccine Moderna”. 医薬品・医療製品規制庁 (MHRA) (8 January 2021). 9 January 2021閲覧。
- ^ a b c "FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine". U.S. アメリカ食品医薬品局 (FDA) (Press release). 2020年12月18日閲覧。
- ^ “Moderna COVID-19 Vaccine- cx-024414 injection, suspension”. DailyMed. 20 December 2020閲覧。
- ^ a b Moderna COVID-19 Vaccine Emergency Use Authorization (PDF). U.S. アメリカ食品医薬品局 (FDA) (Report). 18 December 2020. 2020年12月20日閲覧。
 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
- ^ Moderna (23 October 2019). mRNA-3704 and Methylmalonic Acidemia (Video). YouTube. 2021年1月19日閲覧。
- ^ “Moderna COVID-19 Vaccine”. Dosing & Administration. Infectious Diseases Society of America (4 January 2021). 5 January 2021閲覧。
- ^ a b c “Statement from NIH and BARDA on the FDA Emergency Use Authorization of the Moderna COVID-19 Vaccine”. US National Institutes of Health. (18 December 2020) 19 December 2020閲覧。
- ^ a b Oliver, Sara E.; Gargano, Julia W.; Marin, Mona; Wallace, Megan; Curran, Kathryn G.; Chamberland, Mary et al. (December 2020). “The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Moderna COVID-19 Vaccine — United States, December 2020”. MMWR. Morbidity and Mortality Weekly Report 69 (5152). doi:10.15585/mmwr.mm695152e1.
- ^ Lovelace Jr, Berkeley (19 December 2020). “FDA approves second Covid vaccine for emergency use as it clears Moderna's for U.S. distribution”. CNBC 19 December 2020閲覧。
- ^ a b “COVID-19 Vaccine Moderna”. Union Register of medicinal products. 14 January 2021閲覧。
- ^ “Moderna vaccine becomes third COVID-19 vaccine approved by UK regulator”. U.K. Government (8 January 2021). 8 January 2021閲覧。
- ^ Steenhuysen, Julie; Kelland, Kate (2020年1月24日). “With Wuhan virus genetic code in hand, scientists begin work on a vaccine”. Reuters. オリジナルの2020年1月25日時点におけるアーカイブ。 2020年1月26日閲覧。
- ^ Carey, Karen (26 February 2020). “Increasing number of biopharma drugs target COVID-19 as virus spreads”. BioWorld. 27 February 2020時点のオリジナルよりアーカイブ。1 March 2020閲覧。
- ^ Everett, Gwen (27 February 2020). “These 5 drug developers have jumped this week on hopes they can provide a coronavirus treatment”. Markets Insider. 16 November 2020時点のオリジナルよりアーカイブ。1 March 2020閲覧。
- ^ “MIT Professor's Moderna Stake on the Brink of Topping $1 Billion”. Bloomberg News (18 May 2020). 18 May 2020閲覧。 “CEO Bancel, other Moderna executives have been selling shares”
- ^ a b Auth, Dorothy R.; Powell, Michael B. (14 September 2020). “Patent Issues Highlight Risks of Moderna's COVID-19 Vaccine”. New York Law Journal 1 December 2020閲覧。.
- ^ "Fact sheet for recipients and caregivers - Emergency Use Authorization (EUA) of the Moderna COVID-19 vaccine" (PDF). U.S. Food and Drug Administration (FDA) (Report). December 2020. 2020年12月31日閲覧。
- ^ An mRNA Vaccine against SARS-CoV-2 — Preliminary Report, Lisa A. Jackson et al., New England Journal of Medicine 383 (Nov. 12, 2020), pp. 1920-1931, doi:10.1056/NEJMoa2022483.
- ^ “NIH clinical trial of investigational vaccine for COVID-19 begins”. National Institutes of Health (NIH) (16 March 2020). 19 March 2020時点のオリジナルよりアーカイブ。18 March 2020閲覧。
- ^ “In quest for vaccine, US makes 'big bet' on company with unproven technology”. CNN (1 May 2020). 2020年5月13日時点のオリジナルよりアーカイブ。2020年5月2日閲覧。
- ^ Keown, Alex (2020年5月7日). “Moderna moves into Phase II testing of COVID-19 vaccine candidate”. BioSpace. 16 November 2020時点のオリジナルよりアーカイブ。2020年5月9日閲覧。
- ^ Blankenship, Kyle (2020年5月1日). “Moderna aims for a billion COVID-19 shots a year with Lonza manufacturing tie-up”. FiercePharma. 16 November 2020時点のオリジナルよりアーカイブ。2020年5月9日閲覧。
- ^ “Swiss factory rushes to prepare for Moderna Covid-19 vaccine”. SWI swissinfo.ch. 16 November 2020時点のオリジナルよりアーカイブ。2020年10月7日閲覧。
- ^ 臨床試験番号 NCT04405076 研究名 "Dose-Confirmation Study to Evaluate the Safety, Reactogenicity, and Immunogenicity of mRNA-1273 COVID-19 Vaccine in Adults Aged 18 Years and Older" - ClinicalTrials.gov
- ^ Reuters Staff (2020年6月25日). “Moderna eyes third quarter for first doses of potential COVID-19 vaccine with Catalent deal”. Reuters. オリジナルの16 November 2020時点におけるアーカイブ。 6 November 2020閲覧。
- ^ Lee, Jaimy. “Moderna signs on for another COVID-19 vaccine manufacturing deal”. MarketWatch. 16 November 2020時点のオリジナルよりアーカイブ。9 July 2020閲覧。
- ^ a b c “An mRNA Vaccine against SARS-CoV-2 - Preliminary Report”. The New England Journal of Medicine 383 (20): 1920–1931. (November 2020). doi:10.1056/NEJMoa2022483. PMC 7377258. PMID 32663912.
- ^ “An mRNA Vaccine against SARS-CoV-2 - Preliminary Report”. The New England Journal of Medicine 383 (20): 1920–1931. (November 2020). doi:10.1056/NEJMoa2022483. PMC 7377258. PMID 32663912.
- ^ Li, Yun (14 July 2020). “Dow futures jump more than 200 points after Moderna says its vaccine produces antibodies to coronavirus”. CNBC. 16 November 2020時点のオリジナルよりアーカイブ。15 July 2020閲覧。
- ^ a b Herper, Matthew; Garde, Damian (14 July 2020). “First data for Moderna Covid-19 vaccine show it spurs an immune response”. Stat (Boston Globe Media). オリジナルの14 July 2020時点におけるアーカイブ。 15 July 2020閲覧。
- ^ Palca, Joe (27 July 2020). “COVID-19 vaccine candidate heads to widespread testing in U.S.”. NPR. オリジナルの11 October 2020時点におけるアーカイブ。 27 July 2020閲覧。
- ^ “Moderna, in bid for transparency, discloses detailed plan of coronavirus vaccine trial”. BioPharma Dive. 16 November 2020時点のオリジナルよりアーカイブ。2020年9月18日閲覧。
- ^ Mascarenhas, Lauren (1 October 2020). “Moderna chief says Covid-19 vaccine could be widely available by late March”. CNN. 16 November 2020時点のオリジナルよりアーカイブ。2020年10月2日閲覧。
- ^ Cohen, Elizabeth. “First large-scale US Covid-19 vaccine trial reaches target of 30,000 participants”. CNN. 16 November 2020時点のオリジナルよりアーカイブ。2020年10月23日閲覧。
- ^ “Promising Interim Results from Clinical Trial of NIH-Moderna COVID-19 Vaccine”. National Institutes of Health (NIH) (15 November 2020). 2021年2月20日閲覧。
- ^ Baden, Lindsey R. (30 December 2020). “Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine”. New England Journal of Medicine: NEJMoa2035389. doi:10.1056/NEJMoa2035389.
- ^ a b c d Lovelace Jr, Berkeley; Higgins-Dunn, Noah (16 November 2020). “Moderna says preliminary trial data shows its coronavirus vaccine is more than 94% effective, shares soar”. CNBC 17 November 2020閲覧。
- ^ Zimmer, Carl (20 November 2020). “2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works.”. The New York Times 21 November 2020閲覧。
- ^ 臨床試験番号 NCT04470427 研究名 "A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19" - ClinicalTrials.gov
- ^ “COVID-19 vaccines poised for launch, but impact on pandemic unclear”. Nature Biotechnology. (November 2020). doi:10.1038/d41587-020-00022-y. PMID 33239758.
- ^ “Moderna Use Roche Antibody Test During Vaccine Trials”. rapidmicrobiology.com. 13 December 2020閲覧。
- ^ Rio, Giulia McDonnell Nieto del (2021年1月15日). “Covid-19: Over Two Million Around the World Have Died From the Virus”. The New York Times. ISSN 0362-4331 2021年1月18日閲覧。
- ^ Tirrell, Meg (2021年1月14日). “Moderna looks to test Covid-19 booster shots a year after initial vaccination”. CNBC. 2021年1月18日閲覧。
- ^ “Moderna Explores Whether Third Covid-19 Vaccine Dose Adds Extra Protection”. The Wall Street Journal. 2021年1月18日閲覧。
- ^ “Moderna COVID-19 Vaccine Update” (PDF) (25 January 2021). 2021年2月20日閲覧。
- ^ a b “Is the Covid-19 Vaccine Effective Against New South African Variant?”. The New York Times (25 January 2021). 25 January 2021閲覧。
- ^ “Pfizer-BioNTech COVID-19 Vaccine Vaccination Storage & Dry Ice Safety Handling”. Pfizer. 17 December 2020閲覧。
- ^ “How China's COVID-19 could fill the gaps left by Pfizer, Moderna, AstraZeneca”. Fortune. (5 December 2020). オリジナルの12 December 2020時点におけるアーカイブ。 5 December 2020閲覧。
- ^ “Pfizer's Vaccine Is Out of the Question as Indonesia Lacks Refrigerators: State Pharma Boss”. Jakarta Globe. (22 November 2020). オリジナルの7 December 2020時点におけるアーカイブ。 5 December 2020閲覧。
- ^ a b “Vaccines and Related Biological Products Advisory Committee Meeting”. U.S. Food and Drug Administration (FDA) (December 17, 2020). 2021年2月20日閲覧。
- ^ a b “Pfizer, Moderna ready vaccine manufacturing networks”. Chemical & Engineering News (Washington, D.C.: American Chemical Society). (25 November 2020) 21 December 2020閲覧。
- ^ “Securing Singapore's access to COVID-19 vaccines”. www.gov.sg. Singapore Government (14 December 2020). 1 February 2021閲覧。
- ^ Khalik, Salma (1 February 2021). “How Singapore picked its Covid-19 vaccines”. The Straits Times 1 February 2021閲覧。
- ^ “Trump says U.S. inks agreement with Moderna for 100 mln doses of COVID-19 vaccine candidate”. finance.yahoo.com (11 August 2020). 16 November 2020時点のオリジナルよりアーカイブ。2020年8月12日閲覧。
- ^ “Moderna pitches virus vaccine at about $32-$37 per course” (5 August 2020). 16 November 2020時点のオリジナルよりアーカイブ。29 July 2020閲覧。(
 要購読契約)
要購読契約)
- ^ “Donald Trump appears to admit Covid is 'running wild' in the US”. The Guardian. (22 November 2020). ISSN 0261-3077 22 November 2020閲覧. "Moderna told the Germany [sic] weekly Welt am Sonntag that it will charge governments between $25 and $37 per dose of its Covid vaccine candidate, depending on the amount ordered."
- ^ Guarascio, Francesco (24 November 2020). “EU secures 160 million doses of Moderna's COVID-19 vaccine”. Reuters 25 November 2020閲覧。
- ^ “Coronavirus: Commission approves contract with Moderna to ensure access to a potential vaccine”. European Commission (25 November 2020). 4 December 2020閲覧。
- ^ “New agreements to secure additional vaccine candidates for COVID-19”. Prime Minister's Office, Government of Canada (25 September 2020). 4 December 2020閲覧。
- ^ “A European Official Reveals a Secret: The U.S. Is Paying More for Coronavirus Vaccines”. en:The New York Times. (18 December 2020) 19 December 2020閲覧。
- ^ Cohen, Elizabeth (30 November 2020). “Moderna applies for FDA authorization for its Covid-19 vaccine”. CNN 4 December 2020閲覧。
- ^ Burger, Ludwig (1 December 2020). “COVID-19 vaccine sprint as Pfizer-BioNTech, Moderna seek emergency EU approval”. Reuters 4 December 2020閲覧。
- ^ Kuchler, Hannah (30 November 2020). “Canada could be among the first to clear Moderna's COVID-19 vaccine for use”. The Financial Post 4 December 2020閲覧。
- ^ “UK's MHRA starts rolling review of Moderna's COVID-19 vaccine”. PharmaTimes (28 October 2020). 4 December 2020閲覧。
- ^ Lee, Jaimy. “Moderna nears its first-ever FDA authorization, for its COVID-19 vaccine” 19 December 2020閲覧。
- ^ Austen, Ian (23 December 2020). “Canada approves the Moderna vaccine, paving the way for inoculations in its vast Far North”. The New York Times 24 December 2020閲覧。
- ^ “Israel authorises use of Moderna's COVID-19 vaccine” 5 January 2021閲覧。
- ^ “Singapore becomes first in Asia to approve Moderna's COVID-19 vaccine”. Reuters (3 February 2021). 3 February 2021閲覧。
- ^ “First shipment of Moderna's COVID-19 vaccine arrives in Singapore” (英語). CNA. 2021年2月17日閲覧。
- ^ "EMA recommends COVID-19 Vaccine Moderna for authorisation in the EU" (Press release). European Medicines Agency. 6 January 2021. 2021年1月6日閲覧。
- ^ Miller, John (12 January 2021). “Swiss drugs regulator approves Moderna's COVID-19 vaccine” 17 January 2021閲覧。
- ^ "Swissmedic grants authorisation for the COVID-19 vaccine from Moderna". Swissmedic (Press release). 12 January 2020. 2020年1月12日閲覧。
- ^ Hiltzik, Michael (19 May 2020). “Column: Moderna's vaccine results boosted its share offering – and it's hardly a coincidence”. The Los Angeles Times. オリジナルの16 November 2020時点におけるアーカイブ。 19 May 2020閲覧。
- ^ Branswell, Helen (19 May 2020). “Vaccine experts say Moderna didn't produce data critical to assessing Covid-19 vaccine”. Stat. 16 November 2020時点のオリジナルよりアーカイブ。19 May 2020閲覧。
- ^ Taylor, Marisa; Respaut, Robin (7 July 2020). “Exclusive: Moderna spars with U.S. scientists over COVID-19 vaccine trials”. Reuters. オリジナルの16 November 2020時点におけるアーカイブ。 10 July 2020閲覧。
- ^ Pregnant women haven't been included in promising COVID-19 vaccine trials
- ^ FDA: Leave the door open to Covid-19 vaccination for pregnant and lactating health workers
- ^ “Moderna vaccine trial contractors fail to enroll enough people of color, prompting slowdown”. NBC News. Reuters. (6 October 2020) 17 November 2020閲覧。
- ^ Vardi, Nathan (29 June 2020). “Moderna's Mysterious Coronavirus Vaccine Delivery System”. Forbes 1 December 2020閲覧。.
- ^ “Moderna loses key patent challenge”. Nature Biotechnology 38 (9): 1009. (September 2020). doi:10.1038/s41587-020-0674-1. PMID 32887970.
外部リンク
- “VRBPAC mRNA-1273 Sponsor Briefing Document” (PDF). Moderna (17 December 2020). 2021年1月閲覧。
- “Clinical Study Protocol mRNA-1273-P301”. Moderna. 2021年2月20日閲覧。
- COVID-19 Vaccine Moderna assessment report European Medicines Agency
- “How Moderna's Covid-19 Vaccine Works”. The New York Times. 2021年1月閲覧。
