「微生物叢」の版間の差分
La musique (会話 | 投稿記録) Add pronunciations and links to Wiktionary. |
邦文論文なので書誌情報も日本語 |
||
| (2人の利用者による、間の31版が非表示) | |||
| 1行目: | 1行目: | ||
'''微生物叢'''(びせいぶつそう、{{lang-en-short|[[:en:wikt:microbiota|microbiota]]}} {{IPA-en|ˌmaɪkɹoʊbaɪˈoʊtə}})とは[[生態系]]における生きた微生物の集合のことであり、それらの[[遺伝情報]]を含意して'''マイクロバイオーム'''({{lang-en-short|[[:en:wikt:microbiome|microbiome]]}} {{IPA-en|ˌmaɪkɹoʊbaɪˈoʊm}})と呼ばれることもある。微生物叢は[[細菌]]、[[古細菌]]、[[真菌]]、[[寄生虫]]、[[ウイルス]]によって構成されており、この構成成分の組成構造は微生物叢が定着する環境ごとに異なっている。微生物叢はヒトを含めた動物の体に定着し、植物と共生、また海中から地下鉄の車内まで様々な環境に存在している。 |
|||
ヒトの体にも微生物は定着しており、ヒトの微生物叢はヒトの健康状態と密接に関連している。そのため、特に[[腸内細菌]]は医学的な観点からも古くから研究されてきた。古典的には分離培養に依存した研究が行われていたが、[[16S rRNA]]遺伝子の配列に基づく系統分類法が提唱されてからは、分離培養を伴わない方法により未培養の微生物を含めた解析が行われるようになった。近年の[[DNAシークエンシング|DNAシークエンス]]技術の発展に伴い、微生物叢の研究は急速に進展、様々な疾患との関連性が明らかにされている。 |
|||
細菌叢は'''フローラ'''({{lang-en-short|[[:en:wikt:flora|flora]]}} {{IPA-en|ˈflɔː.ɹə}})とも呼ばれるが、これは分類学の用語で植物群集([[植物相]])の意味で、かつては細菌が植物の中に分類されていたためである<ref>{{Cite web|title=腸内フローラ - 健康用語の基礎知識|url=https://institute.yakult.co.jp/dictionary/word_5.php|website=ヤクルト中央研究所|accessdate=2020-02-05|language=ja}}</ref>。 |
|||
== 定義と語源 == |
|||
21世紀となり、[[ゲノムプロジェクト]]やコンピュータの性能向上によって、[[ヒトマイクロバイオーム]]の研究が進展するようになり注目を浴びている<ref name="naid40019418088"/>。 |
|||
[[ファイル:Relative scale.svg|サムネイル|ミリメートル単位の原核生物から数十ナノメートル単位のウイルスまで、様々な微生物が微生物叢を構成する。]] |
|||
微生物叢は生きた微生物集団の全体であり、また微生物集団が有する遺伝情報の全体を指してマイクロバイオーム (microbiome) と呼ばれることもある<ref name=":0">{{Cite book|title=実験医学別冊 もっとよくわかる!シリーズ もっとよくわかる!腸内細菌叢 健康と疾患を司る“もう1つの臓器”|url=https://www.worldcat.org/oclc/1122630567|location=|isbn=978-4-7581-2206-1|oclc=1122630567|others=福田真嗣|date=|year=|publisher=羊土社}}</ref>。従来は微生物叢を意味する用語として、生態学において叢(くさむら、多くのものが集まっている)を意味する用語であるフローラの語が用いられてきたが、マイクロバイオーム解析の興隆と共に微生物叢 (microbiota) が支配的に用いられるようになった<ref name=":0" /><ref>{{Cite journal|author=本間 央之|year=2014|title=医療イノベーションに向けた 腸管微生物叢研究の展開 ―微生物叢移植とその発展型を巡る研究開発と実用化の動向―|url=https://www.nistep.go.jp/wp/wp-content/uploads/NISTEP-STT146J-37.pdf|journal=科学技術動向研究|volume=|issue=146|page=}}</ref>。また、微生物叢研究は[[メタゲノミクス|メタゲノム解析]]と呼ばれる解析技術によって発展してきた。メタゲノムとはギリシャ語で「高次」や「超越」を意味する「メタ」と、すべての遺伝子全体を意味する「[[ゲノム]]」を組み合わせた造語である。メタゲノム解析においては微生物群集の遺伝子全体を、DNAの混合物として培養を行わずに網羅的に解析する<ref>{{Cite journal|last=Inoue|first=Ryo|date=2019-03-14|title=ABCs for analysis of gut microbiota|url=https://doi.org/10.4109/jslab.30.27|journal=Japanese Journal of Lactic Acid Bacteria|volume=30|issue=1|pages=27-31|doi=10.4109/jslab.30.27|issn=1343-327X}}</ref><ref>{{Cite journal|last=Kusumoto|first=Ken-Ichi|date=2011|title=Metagenomic Analysis|url=https://doi.org/10.3136/nskkk.58.136|journal=Nippon Shokuhin Kagaku Kogaku Kaishi|volume=58|issue=3|pages=136-136|doi=10.3136/nskkk.58.136|issn=1341-027X}}</ref><ref name=":1">{{Cite journal|last=Rowan-Nash|first=Aislinn D.|last2=Korry|first2=Benjamin J.|last3=Mylonakis|first3=Eleftherios|last4=Belenky|first4=Peter|date=2019-01-09|title=Cross-Domain and Viral Interactions in the Microbiome|url=https://mmbr.asm.org/content/83/1/e00044-18|journal=Microbiology and Molecular Biology Reviews|volume=83|issue=1|pages=e00044-18, /mmbr/83/1/e00044-18.atom|language=en|doi=10.1128/MMBR.00044-18|issn=1092-2172|pmid=30626617|pmc=PMC6383444}}</ref>。微生物が[[細菌]]、[[古細菌]]、[[真菌]]、[[蠕虫]]などの寄生虫、及び[[ウイルス]]を内包するように、微生物叢もまた細菌をはじめとした様々な微生物によって構成される。一方で、微生物叢の研究の多くは[[腸内細菌]]をはじめとした細菌に焦点を当てており<ref name=":1" />、マイクロバイオームが常在細菌と同義的に用いられることもある<ref>{{Cite journal|last=Moyes|first=David L.|last2=Naglik|first2=Julian R.|date=2012-06-14|title=The Mycobiome: Influencing IBD Severity|url=https://www.cell.com/cell-host-microbe/abstract/S1931-3128(12)00171-0|journal=Cell Host & Microbe|volume=11|issue=6|pages=551-552|language=English|doi=10.1016/j.chom.2012.05.009|issn=1931-3128|pmid=22704612}}</ref>。ヒト微生物叢の遺伝情報の規模はヒトそのものの遺伝情報の規模よりも大きく、それ故に「第二のゲノム」と称されることもある<ref>{{Cite journal|last=Zhao|first=Liping|date=2010-06|title=The tale of our other genome|url=https://www.nature.com/articles/465879a|journal=Nature|volume=465|issue=7300|pages=879-880|language=en|doi=10.1038/465879a|issn=1476-4687}}</ref><ref>{{Cite journal|last=Grice|first=Elizabeth A.|last2=Segre|first2=Julia A.|date=2012|title=The human microbiome: our second genome|url=https://www.ncbi.nlm.nih.gov/pubmed/22703178|journal=Annual Review of Genomics and Human Genetics|volume=13|pages=151-170|doi=10.1146/annurev-genom-090711-163814|issn=1545-293X|pmid=22703178|pmc=3518434}}</ref>。 |
|||
== 微生物叢の構成要素とその解析手法 == |
|||
==ヒトマイクロバイオーム== |
|||
{{Main|ヒトマイクロバイオーム}} |
|||
=== 細菌叢 === |
|||
2010年に欧州の研究者によって、ヒトの消化器に1000種以上、330万個の微生物の遺伝子の数があることが判明し、これは[[ヒトゲノム]]の遺伝子2万5千の約150倍として注目を受けた<ref name="naid40019418088">{{Cite journal |和書|author=J・アッカーマン |date=2012-10 |title=究極のソーシャルネット |journal=日経サイエンス |volume=42 |issue=10 |pages=40-48 |naid=40019418088}}</ref>。人類のDNAは99.9%が同じだが、ヒトマイクロバイオームでは構成が同じ人はいない<ref name="naid40019418088"/>。 |
|||
細菌叢は微生物集団が有する遺伝情報の全体がマイクロバイオームと呼ばれるように、細菌集団が有する遺伝情報の全体をバクテリオーム (bacteriome) と呼ぶ。先述の通り、微生物叢を構成する要素の中でも、細菌の成分は特に重点を置かれて研究が進められてきた<ref name=":1" />。 |
|||
[[ファイル:Journal.pone.0035647.g002.tif|左|サムネイル|[[シュードモナス属]]16S rRNAの超可変領域。細菌の16S rRNAには9か所の多様性の大きい部位が存在し、その領域を挟むようにプライマーを設計することで、菌種ごとに異なる配列をPCR法により増幅することができる。]] |
|||
細菌叢の組成を明らかにするためには、様々な生物で保存されており、適度に系統間では配列が異なる[[16S rRNA]]遺伝子のDNA配列をマーカー遺伝子として解析し、その存在比から細菌叢を構成する菌種の特定や組成を推定することが一般に行われる。また、その手法のことをメタ16S解析と呼ぶ<ref name=":2">{{Cite book|title=今すぐ始める! メタゲノム解析 実験プロトコール ヒト常在細菌叢から環境メタゲノムまでサンプル調製と解析のコツ|url=https://www.worldcat.org/oclc/1089711913|publisher=羊土社|date=2016|isbn=978-4-7581-0197-4|oclc=1089711913|others=服部 正平|year=}}</ref>。この手法は比較的簡単、安価に行える、真正細菌だけでなく古細菌も同時に評価できるといった利点をもつ。ただし、[[ポリメラーゼ連鎖反応|PCR]]によりDNA配列のコピー数を増幅する作業が必要であり、この過程で特定の分類群に対してその組成を過大/過少に評価してしまうようなバイアスが生じる<ref name=":1" />。また、古くから行われてきた手法であり、データベースに登録された既存のデータや、データ解析ツールが充実しているのもこの手法である<ref name=":3" />。 |
|||
一方で、全メタゲノム解析は試料に含まれる全てのDNA配列を解析する手法であり、微生物叢の遺伝情報を詳細に解析できる上、細菌のみならず真菌やDNAウイルスについても同時に評価できるという利点を持つ。しかしながら比較的高価で複雑な解析が必要であり、一般性には劣る<ref name=":1" /><ref name=":3">{{Cite journal|last=Knight|first=Rob|last2=Vrbanac|first2=Alison|last3=Taylor|first3=Bryn C.|last4=Aksenov|first4=Alexander|last5=Callewaert|first5=Chris|last6=Debelius|first6=Justine|last7=Gonzalez|first7=Antonio|last8=Kosciolek|first8=Tomasz|last9=McCall|first9=Laura-Isobel|date=07 2018|title=Best practices for analysing microbiomes|url=https://www.ncbi.nlm.nih.gov/pubmed/29795328|journal=Nature Reviews. Microbiology|volume=16|issue=7|pages=410-422|doi=10.1038/s41579-018-0029-9|issn=1740-1534|pmid=29795328}}</ref>。 |
|||
[[腸内細菌叢]]には、ヒトの細胞数に近い約40兆個の細菌が存在し、皮膚、口腔、鼻腔、膣などにも微生物が存在している<ref name="naid130006191772">{{Cite journal |和書|author1=坂田恒昭 |author2=松本弥生 |date=2017 |title=日本マイクロバイオームコンソーシアム(JMBC)の設立 |journal=ファルマシア |volume=53 |issue=11 |pages=1095-1097 |naid=130006191772 |doi=10.14894/faruawpsj.53.11_1095 |url=https://doi.org/10.14894/faruawpsj.53.11_1095}}</ref>。 |
|||
また、メタトランスクリプトーム解析は試料に含まれる全[[RNA]]を解析するもので、死んだ細菌でも安定しているDNAを解析するメタ16S解析や全メタゲノム解析と異なり、原則的に生きている細菌の遺伝情報だけを解析できる。ただし、上記の手法に比べるとrRNAの除去が必要など、実験系が複雑であり、解析により多額の費用がかかる<ref name=":3" />。 |
|||
=== 真菌叢 === |
|||
カビや酵母といった真菌もまた微生物叢の構成要素として注目されている<ref name=":1" />。真菌の研究は19世紀から行われてきたが、環境中の真菌全体を捉える真菌叢の研究の歴史は浅く、mycobiologyとmicrobiomeを組み合わせた造語であるmycobiomeの語が提案されたのは2010年のことである<ref>{{Cite journal|last=Cui|first=Lijia|last2=Morris|first2=Alison|last3=Ghedin|first3=Elodie|date=2013|title=The human mycobiome in health and disease|url=https://www.ncbi.nlm.nih.gov/pubmed/23899327|journal=Genome Medicine|volume=5|issue=7|pages=63|doi=10.1186/gm467|issn=1756-994X|pmid=23899327|pmc=3978422}}</ref>。また、真菌叢解析に関する報告は細菌叢解析に関するものに比べると格段に少ない。しかしながら、解析の手法に大きな差はない<ref name=":2" />。細菌叢の解析には16S rRNA遺伝子の配列がマーカーとして利用されるが、真菌叢の解析においてはリボソームRNA遺伝子を隔てる内部転写スペーサー (internal transcribed spacer, ITS) 領域や、細菌の16S rRNA遺伝子に相当する18S rRNA遺伝子がマーカー遺伝子として用いられる。ただし、真菌叢の解析はデータベースの不足から細菌叢の解析と比べ困難である。ヒトの身体の場合、[[粘膜]]においては[[カンジダ属]]が優位だが、皮膚では[[マラセチア属]]が優占する<ref name=":1" />。 |
|||
=== ウイルス叢 === |
|||
[[ファイル:Phage.jpg|左|サムネイル|[[大腸菌]]に吸着するバクテリオファージの[[透過型電子顕微鏡]]像。およそ200,000倍。]] |
|||
他の微生物と同様にウイルスもまた人体に普遍的に常在しており、DNAウイルスやRNAウイルスを含むすべてのウイルスの集合をviromeと呼ぶ。ウイルスは細菌や真菌と異なり、全てのウイルスで共通して存在するような保存配列を持たない。そのため、ウイルス叢の解析においてはしばしば試料に含まれる全ての遺伝情報を解析するメタゲノム解析が用いられる。また、人体に生息するDNAウイルスの多くは、常在細菌に感染している[[ファージ|バクテリオファージ]]であり、ウイルス叢の研究は細菌叢との関連で扱われることが多い<ref name=":1" />。ただし、ウイルスのゲノムは一般に細菌や哺乳類のゲノムに比べ小さく、メタゲノム解析で得られるウイルスDNA配列はメタゲノム全体の小さな割合を占めるに過ぎない。また、ファージのDNA配列は溶原化と呼ばれる過程を経て、細菌のゲノムに取り込まれて存在していることがあり、配列情報だけではウイルス粒子として存在する配列と細菌ゲノムに取り込まれた配列とを区別できない。そのため、厳密にウイルス粒子として存在するウイルスの遺伝情報を定量的に評価するためには、事前に細菌の菌体より孔の目が細かい膜を用いたろ過、ウイルス粒子外のDNAを分解する酵素処理、遠心分離による分画などを行うことで、ウイルス粒子内のDNAを抽出する手法が採用されることがある<ref>{{Cite journal|last=Mohiuddin|first=Mohammad|last2=Schellhorn|first2=Herb|date=2015|title=Spatial and temporal dynamics of virus occurrence in two freshwater lakes captured through metagenomic analysis|url=https://www.frontiersin.org/articles/10.3389/fmicb.2015.00960/full|journal=Frontiers in Microbiology|volume=6|language=English|doi=10.3389/fmicb.2015.00960|issn=1664-302X}}</ref><ref>{{Cite journal|last=Kleiner|first=Manuel|last2=Hooper|first2=Lora V.|last3=Duerkop|first3=Breck A.|date=2015-01-22|title=Evaluation of methods to purify virus-like particles for metagenomic sequencing of intestinal viromes|url=https://doi.org/10.1186/s12864-014-1207-4|journal=BMC Genomics|volume=16|issue=1|pages=7|language=en|doi=10.1186/s12864-014-1207-4|issn=1471-2164|pmid=25608871|pmc=PMC4308010}}</ref>。ファージは宿主となる細菌を殺したり、新しい遺伝子を付与することで、細菌叢に影響を及ぼしていると考えられている<ref>{{Cite book|title=Metagenomics of the Human Body|first=Matthew|year=|editor-last=Nelson|editor-first=Karen E.|last2=Rohwer|first2=Forest|last=Haynes|language=en|url=https://doi.org/10.1007/978-1-4419-7089-3_4|doi=10.1007/978-1-4419-7089-3_4|pages=63-77|pmc=PMC7122492|isbn=978-1-4419-7089-3|location=New York, NY|date=2011|publisher=Springer|chapter=The Human Virome}}</ref>。環境中にもウイルスは存在しており、最初期のウイルス叢研究は海水中のウイルス叢を解析したものであった<ref>{{Cite journal|last=Wylie|first=Kristine M.|last2=Weinstock|first2=George M.|last3=Storch|first3=Gregory A.|date=2012-10-01|title=Emerging view of the human virome|url=http://www.sciencedirect.com/science/article/pii/S1931524412001284|journal=Translational Research|volume=160|issue=4|pages=283-290|language=en|doi=10.1016/j.trsl.2012.03.006|issn=1931-5244}}</ref><ref>{{Cite journal|last=Breitbart|first=Mya|last2=Salamon|first2=Peter|last3=Andresen|first3=Bjarne|last4=Mahaffy|first4=Joseph M.|last5=Segall|first5=Anca M.|last6=Mead|first6=David|last7=Azam|first7=Farooq|last8=Rohwer|first8=Forest|date=2002-10-29|title=Genomic analysis of uncultured marine viral communities|url=https://www.ncbi.nlm.nih.gov/pubmed/12384570|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=99|issue=22|pages=14250-14255|doi=10.1073/pnas.202488399|issn=0027-8424|pmid=12384570|pmc=PMC137870}}</ref>。 |
|||
== 宿主や環境と微生物叢 == |
|||
=== ヒトと微生物叢 === |
|||
[[ファイル:Skin-Microbiome-Human.png|サムネイル|ヒトの皮膚微生物叢。皮膚の微生物叢はその解剖学的部位によってそれを構成する細菌種の組成が異なっている<ref name=":7" />。]] |
|||
腸内をはじめヒトの体には微生物が定着している。[[大腸]]には特に多数の細菌が生息しており、重量は体重70kgの成人男性で0.2kgに過ぎないが、細胞数では約40兆に及ぶと推定されている。この数は個人の全細胞の数を超える<ref>{{Cite journal|last=Sender|first=Ron|last2=Fuchs|first2=Shai|last3=Milo|first3=Ron|date=2016-08-19|title=Revised Estimates for the Number of Human and Bacteria Cells in the Body|url=https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1002533|journal=PLOS Biology|volume=14|issue=8|pages=e1002533|language=en|doi=10.1371/journal.pbio.1002533|issn=1545-7885|pmid=27541692|pmc=PMC4991899}}</ref>。ヒトの微生物叢はヒトの疾病との関連性から重点的に研究が進められてきた。その中でも腸内細菌叢に関する研究が特に焦点を当てられてきており、腸管の走行に沿って腸内細菌叢の構造が変化することや、様々な疾病との関連が明らかにされている。同様に、口腔、皮膚、膣などの微生物叢も疾患との関連などから研究されてきた<ref name=":1" />。また、ヒトの微生物叢の大規模な調査として、アメリカのHuman Microbiome ProjectやヨーロッパのMetaHITなどの国家規模のプロジェクトが実施されている<ref name=":5" /><ref>{{Cite journal|last=Qin|first=Junjie|last2=Li|first2=Ruiqiang|last3=Raes|first3=Jeroen|last4=Arumugam|first4=Manimozhiyan|last5=Burgdorf|first5=Kristoffer Solvsten|last6=Manichanh|first6=Chaysavanh|last7=Nielsen|first7=Trine|last8=Pons|first8=Nicolas|last9=Levenez|first9=Florence|date=2010-03|title=A human gut microbial gene catalogue established by metagenomic sequencing|url=https://www.nature.com/articles/nature08821|journal=Nature|volume=464|issue=7285|pages=59-65|language=en|doi=10.1038/nature08821|issn=1476-4687}}</ref>。 |
|||
ヒトの微生物叢は腸管、口腔、皮膚、膣といった部位ごとに、構成する細菌種が異なり、例えば異なるヒトの腸管の微生物叢を比べた場合と、同一のヒトの腸管の微生物叢と口腔の微生物叢を比較した場合、前者の方が互いに類似性が高い<ref>{{Cite journal|last=Costello|first=Elizabeth K.|last2=Lauber|first2=Christian L.|last3=Hamady|first3=Micah|last4=Fierer|first4=Noah|last5=Gordon|first5=Jeffrey I.|last6=Knight|first6=Rob|date=2009-12-18|title=Bacterial Community Variation in Human Body Habitats Across Space and Time|url=https://science.sciencemag.org/content/326/5960/1694|journal=Science|volume=326|issue=5960|pages=1694-1697|language=en|doi=10.1126/science.1177486|issn=0036-8075|pmid=19892944}}</ref><ref name=":9">{{Cite journal|last=The Human Microbiome Project Consortium|date=2012-06|title=Structure, function and diversity of the healthy human microbiome|url=http://www.nature.com/articles/nature11234|journal=Nature|volume=486|issue=7402|pages=207-214|language=en|doi=10.1038/nature11234|issn=0028-0836|pmid=22699609|pmc=PMC3564958}}</ref>。 |
|||
==== 腸管の微生物叢 ==== |
|||
腸管の微生物叢については特に3つのエンテロタイプと呼ばれる微生物叢のグループが提唱されている。3つのエンテロタイプはそれぞれに特有な細菌の系統によって特徴付けることができ、これらの特徴的なグループは地域に依存せずに存在する<ref>{{Cite journal|last=Arumugam|first=Manimozhiyan|last2=Raes|first2=Jeroen|last3=Pelletier|first3=Eric|last4=Le Paslier|first4=Denis|last5=Yamada|first5=Takuji|last6=Mende|first6=Daniel R.|last7=Fernandes|first7=Gabriel R.|last8=Tap|first8=Julien|last9=Bruls|first9=Thomas|date=2011-05-12|title=Enterotypes of the human gut microbiome|url=https://www.ncbi.nlm.nih.gov/pubmed/21508958|journal=Nature|volume=473|issue=7346|pages=174-180|doi=10.1038/nature09944|issn=1476-4687|pmid=21508958|pmc=3728647}}</ref><ref>{{Citation|title=新たな臓器としての腸内細菌叢|url=https://doi.org/10.11405/nisshoshi.112.1939|publisher=一般財団法人 日本消化器病学会|date=2015|accessdate=2020-08-02|doi=10.11405/nisshoshi.112.1939|language=ja|first=朗|last=安藤}}</ref>。 |
|||
近年の研究成果から疾患と細菌叢の関係が明らかにされてきた。例えば[[肥満]]とそれに伴う[[2型糖尿病]]のような生活習慣病は、ヒトの遺伝情報だけではなく、腸内細菌叢を構成する細菌種の割合とも関係していることが疫学調査や動物実験から明らかにされた<ref>{{Cite journal|last=Qin|first=Junjie|last2=Li|first2=Yingrui|last3=Cai|first3=Zhiming|last4=Li|first4=Shenghui|last5=Zhu|first5=Jianfeng|last6=Zhang|first6=Fan|last7=Liang|first7=Suisha|last8=Zhang|first8=Wenwei|last9=Guan|first9=Yuanlin|date=2012-10|title=A metagenome-wide association study of gut microbiota in type 2 diabetes|url=https://www.nature.com/articles/nature11450|journal=Nature|volume=490|issue=7418|pages=55-60|language=en|doi=10.1038/nature11450|issn=1476-4687}}</ref><ref>{{Cite journal|last=Larsen|first=Nadja|last2=Vogensen|first2=Finn K.|last3=Berg|first3=Frans W. J. van den|last4=Nielsen|first4=Dennis Sandris|last5=Andreasen|first5=Anne Sofie|last6=Pedersen|first6=Bente K.|last7=Al-Soud|first7=Waleed Abu|last8=Sørensen|first8=Søren J.|last9=Hansen|first9=Lars H.|date=2010-02-05|title=Gut Microbiota in Human Adults with Type 2 Diabetes Differs from Non-Diabetic Adults|url=https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0009085|journal=PLOS ONE|volume=5|issue=2|pages=e9085|language=en|doi=10.1371/journal.pone.0009085|issn=1932-6203|pmid=20140211|pmc=PMC2816710}}</ref><ref>{{Cite journal|last=Ussar|first=Siegfried|last2=Griffin|first2=Nicholas W.|last3=Bezy|first3=Olivier|last4=Fujisaka|first4=Shiho|last5=Vienberg|first5=Sara|last6=Softic|first6=Samir|last7=Deng|first7=Luxue|last8=Bry|first8=Lynn|last9=Gordon|first9=Jeffrey I.|date=2015-09-01|title=Interactions between Gut Microbiota, Host Genetics and Diet Modulate the Predisposition to Obesity and Metabolic Syndrome|url=https://www.ncbi.nlm.nih.gov/pubmed/26299453|journal=Cell Metabolism|volume=22|issue=3|pages=516-530|doi=10.1016/j.cmet.2015.07.007|issn=1932-7420|pmid=26299453|pmc=4570502}}</ref>。 |
|||
環境が清潔だと[[アレルギー]]性疾患に罹患しやすいとする[[衛生仮説]]も微生物叢との関連から説明され得る<ref name=":1" />。経済的豊かな富裕国では病原性のない、または病原性の弱い寄生虫や真菌、乳酸菌といった常在性の微生物に感染する機会が失われている。一方でこのような微生物は免疫の過剰応答を抑える[[制御性T細胞]]の誘導を活性化する働きがあり、それ故に富裕国では[[炎症性腸疾患]]などのアレルギー性疾患が増加しているとするものである<ref>{{Cite journal|last=Rook|first=G. a. W.|last2=Brunet|first2=L. R.|date=2005-03|title=Microbes, immunoregulation, and the gut|url=https://www.ncbi.nlm.nih.gov/pubmed/15710972|journal=Gut|volume=54|issue=3|pages=317-320|doi=10.1136/gut.2004.053785|issn=0017-5749|pmid=15710972|pmc=1774411}}</ref>。実際に様々な研究が炎症性腸疾患と微生物叢の関連性を示しており、細菌叢の多様性([[α多様性]])が失われて特定の菌種が増加することなどの変化が起きると考えられているが、因果関係の証明には至っていない<ref>{{Cite journal|last=Lane|first=Erin R.|last2=Zisman|first2=Timothy L.|last3=Suskind|first3=David L.|date=2017|title=The microbiota in inflammatory bowel disease: current and therapeutic insights|url=https://www.ncbi.nlm.nih.gov/pubmed/28652796|journal=Journal of Inflammation Research|volume=10|pages=63-73|doi=10.2147/JIR.S116088|issn=1178-7031|pmid=28652796|pmc=5473501}}</ref>。 |
|||
==== 口腔の微生物叢 ==== |
|||
口腔にはおよそ700種程の細菌が生息すると推定されている。[[レンサ球菌属]]に代表される一部の細菌は口腔の全域に存在するが、特定の部位にのみ生息する細菌もあり、例えばRothia属の細菌は舌や歯の表面にしかいない。歯はヒトの体で唯一生理的に表皮の脱落が生じない部位であり、[[バイオフィルム]]の形成が行われるなど、微生物にとって絶好の生息地となる。また、他にも虫歯の治療のための歯冠やインプラントなどの表面も同様にバイオフィルム形成に影響し、口腔微生物叢の構成に変化を与えやすい<ref name=":12">{{Cite journal|last=Kilian|first=M.|last2=Chapple|first2=I. L. C.|last3=Hannig|first3=M.|last4=Marsh|first4=P. D.|last5=Meuric|first5=V.|last6=Pedersen|first6=A. M. L.|last7=Tonetti|first7=M. S.|last8=Wade|first8=W. G.|last9=Zaura|first9=E.|date=2016-11|title=The oral microbiome - an update for oral healthcare professionals|url=https://www.nature.com/articles/sj.bdj.2016.865|journal=British Dental Journal|volume=221|issue=10|pages=657-666|language=en|doi=10.1038/sj.bdj.2016.865|issn=1476-5373}}</ref><ref name=":13" />。 |
|||
人類の歴史とともに食生活は変化し、それに伴って口腔微生物叢も変化してきたと考えられている。例えば耕作により人類は精製糖を食生活に取り入れたが、[[Streptococcus mutans|''Streptococcus mutans'']]は増加した酸化ストレスへの防御機構と自ら産生する酸性の代謝産物への抵抗性を獲得し、他の細菌に優占するようになったとされる<ref name=":12" />。 |
|||
[[虫歯]]や[[歯周炎]]に代表される口腔の疾患は特定の細菌が原因となるのではなく、複数の常在細菌の集団が特定の条件で引き起こすと考えられている<ref name=":13">{{Cite journal|last=Krishnan|first=K|last2=Chen|first2=T|last3=Paster|first3=Bj|date=2017-04|title=A practical guide to the oral microbiome and its relation to health and disease|url=http://doi.wiley.com/10.1111/odi.12509|journal=Oral Diseases|volume=23|issue=3|pages=276-286|language=en|doi=10.1111/odi.12509|pmid=27219464|pmc=PMC5122475}}</ref>。また、口腔の疾患に関連した細菌は、数は少ないながらも常在している。そのため、口腔の疾患は病原体が新規に感染するのではなく、口腔微生物叢におけるバランスが破綻することによって引き起こされるという説が現在は受け入れられている<ref name=":12" />。 |
|||
==== 皮膚の微生物叢 ==== |
|||
腸管と同様に皮膚もまた独自の微生物叢を構成しており、皮膚の微生物叢においては[[プロピオニバクテリウム属]]、[[コリネバクテリウム属]]、[[ストレプトコッカス属]]の細菌とそれに感染するファージ、マラセチアなどの真菌、ポリオーマウイルスが主体となっている<ref>{{Cite journal|last=NISC Comparative Sequencing Program|last2=Oh|first2=Julia|last3=Byrd|first3=Allyson L.|last4=Deming|first4=Clay|last5=Conlan|first5=Sean|last6=Kong|first6=Heidi H.|last7=Segre|first7=Julia A.|date=2014-10|title=Biogeography and individuality shape function in the human skin metagenome|url=http://www.nature.com/articles/nature13786|journal=Nature|volume=514|issue=7520|pages=59-64|language=en|doi=10.1038/nature13786|issn=0028-0836|pmid=25279917|pmc=PMC4185404}}</ref>。健常者の皮膚微生物叢は[[黄色ブドウ球菌]]の増殖を抑制する働きを持つが、[[アトピー性皮膚炎]]の患者においては皮膚微生物叢が破綻して黄色ブドウ球菌が増殖している。また、[[尋常性痤瘡|ニキビ]]は皮膚微生物叢で最も比率の大きい種である[[アクネ菌]]との関連が指摘されている。アクネ菌は健常な皮膚における常在細菌だが、ニキビ患部においては特定の系統が増加している<ref name=":7" />。 |
|||
==== 膣の微生物叢 ==== |
|||
[[ファイル:Lactobacillus sp 01.png|サムネイル|膣の微生物叢の主要な構成種である[[ラクトバシラス属]]の細菌と膣の[[上皮細胞|扁平上皮細胞]]。[[グラム陽性菌|グラム陽性]]のラクトバシラス属細菌は青紫色に染色される。]] |
|||
膣微生物叢は偏った構造を持っており、構成種のほとんどが[[ラクトバシラス属]]に属する細菌である。一方でラクトバシラス属の中では様々な種の細菌が存在しており、個人間ではラクトバシラス属の多様性が大きく異なる。また、膣微生物叢の組成はpHの影響を受け、pHが高くなるとラクトバシラス属の減少が認められる<ref name=":9" />。ラクトバシラス属は乳酸菌を産生することでpH3.5-4.5の酸性環境を整えており、これが膣を有害な病原体から守ると考えられている<ref>{{Cite journal|last=Ma|first=Bing|last2=Forney|first2=Larry J.|last3=Ravel|first3=Jacques|date=2012|title=Vaginal microbiome: rethinking health and disease|url=https://www.ncbi.nlm.nih.gov/pubmed/22746335|journal=Annual Review of Microbiology|volume=66|pages=371-389|doi=10.1146/annurev-micro-092611-150157|issn=1545-3251|pmid=22746335|pmc=3780402}}</ref>。[[細菌性膣炎]]は膣の疾患で、悪臭を伴う、白色粘稠の分泌物が症状として認められる。細菌性膣炎では、pHが上昇し、ラクトバシラス属が減少する一方で、''Gardnerella vaginalis''などラクトバシラス属以外の細菌が増加することが知られる<ref>{{Cite journal|last=Kaambo|first=Evelyn|last2=Africa|first2=Charlene|last3=Chambuso|first3=Ramadhani|last4=Passmore|first4=Jo-Ann Shelley|date=2018|title=Vaginal Microbiomes Associated With Aerobic Vaginitis and Bacterial Vaginosis|url=https://www.frontiersin.org/articles/10.3389/fpubh.2018.00078/full|journal=Frontiers in Public Health|volume=6|language=English|doi=10.3389/fpubh.2018.00078|issn=2296-2565}}</ref>。 |
|||
==== ヒトの微生物叢の由来と定着 ==== |
|||
ヒトに定着している微生物はどこからやってくるのか。新生児の微生物叢は母体に由来しているようである。新生児の細菌叢と母体の細菌叢を比較した調査によると、新生児の細菌叢は出産の形態に影響を受ける。自然分娩の場合は母体の膣の細菌叢が新生児に定着し、ラクトバシラス属菌が優占種となる。一方で[[帝王切開]]の場合は母体の細菌叢が定着し、プロピオニバクテリウム属菌をはじめとした皮膚の常在細菌が優占種となる<ref>{{Cite journal|last=Dominguez-Bello|first=Maria G.|last2=Costello|first2=Elizabeth K.|last3=Contreras|first3=Monica|last4=Magris|first4=Magda|last5=Hidalgo|first5=Glida|last6=Fierer|first6=Noah|last7=Knight|first7=Rob|date=2010-06-29|title=Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns|url=https://www.pnas.org/content/107/26/11971|journal=Proceedings of the National Academy of Sciences|volume=107|issue=26|pages=11971-11975|language=en|doi=10.1073/pnas.1002601107|issn=0027-8424|pmid=20566857}}</ref>。分娩形態の違いにより生じる新生児における微生物叢の違いは12-24ヶ月齢までに徐々に消えていく<ref name=":11" />。分娩前の胎児が微生物叢を持つかについては議論があった。胎児が無菌的であるか否かについては150年前から議論されていたが、20世期の後半になって一旦は胎児は無菌であり、出産中とその後に微生物叢を獲得するという説が定説となる。しかしながら、近代的なDNAシークエンシング技術の開発によって、従来無菌的であると考えられていた[[羊水]]、[[胎盤]]、[[臍帯血]]、[[胎便]]からも細菌が検出されたことから、再び胎児の子宮内における微生物叢の獲得が主張されたきた<ref name=":0" /><ref>{{Cite journal|last=Perez-Muñoz|first=Maria Elisa|last2=Arrieta|first2=Marie-Claire|last3=Ramer-Tait|first3=Amanda E.|last4=Walter|first4=Jens|date=2017-04-28|title=A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome|url=https://doi.org/10.1186/s40168-017-0268-4|journal=Microbiome|volume=5|issue=1|pages=48|language=en|doi=10.1186/s40168-017-0268-4|issn=2049-2618|pmid=28454555|pmc=PMC5410102}}</ref>。もっともDNAの抽出試薬も細菌DNAに汚染されているなどの理由から、試料から得られるDNAの量が少ない場合は、試料に由来しない細菌DNAを検出してしまう可能性があるなど、実験系に制限があることが知られる。そのため、子宮内における微生物の検出には確定的な結論は出ていない<ref name=":11">{{Cite journal|last=Tamburini|first=Sabrina|last2=Shen|first2=Nan|last3=Wu|first3=Han Chih|last4=Clemente|first4=Jose C|date=2016-07|title=The microbiome in early life: implications for health outcomes|url=http://www.nature.com/articles/nm.4142|journal=Nature Medicine|volume=22|issue=7|pages=713-722|language=en|doi=10.1038/nm.4142|issn=1078-8956}}</ref>。実際、子宮内における微生物の検出には否定的な見解が示されている。537人の妊婦を対象とした研究によると、妊娠中の胎盤は基本的に無菌的であると考えられ、唯一の例外は約5%の妊婦でB群[[レンサ球菌]]が検出されたことのみであった<ref>{{Cite journal|last=de Goffau|first=Marcus C.|last2=Lager|first2=Susanne|last3=Sovio|first3=Ulla|last4=Gaccioli|first4=Francesca|last5=Cook|first5=Emma|last6=Peacock|first6=Sharon J.|last7=Parkhill|first7=Julian|last8=Charnock-Jones|first8=D. Stephen|last9=Smith|first9=Gordon C. S.|date=2019-07-10|title=Human placenta has no microbiome but can harbour potential pathogens|url= https://www.nature.com/articles/s41586-019-1451-5|journal=Nature|volume=572|issue=7769|pages=329-334|doi=10.1038/s41586-019-1451-5|issn=0028-0836|pmid=31367035|pmc=6697540}}</ref>。 |
|||
抗生物質は新生児の微生物叢に影響を及ぼし、新生児への持続的投与は喘息、2型糖尿病、炎症性腸疾患、乳アレルギーなどの疾患と関連する可能性がある。もっとも、否定的見解もしめされており、また、相関関係は必ずしも因果関係を意味しない。食事もまた微生物叢に影響を与える。[[母乳栄養]]は粉ミルクに比べ、新生児と母体の双方に健康上の利点があるとされるが、母乳に分泌される[[免疫グロブリンA]]、[[ラクトフェリン]]、[[ディフェンシン]]が少なからずこれに寄与すると考えられる<ref name=":11" />。 |
|||
=== ヒト以外の動物と微生物叢 === |
|||
ヒトと同様に様々な動物が微生物と共生関係にあり、固有の微生物叢を持つ。微生物叢はそれを保持する動物の行動によって構成が変化し、また微生物叢が宿主となる動物の行動に影響を与えるとされる<ref>{{Cite journal|last=Ezenwa|first=V. O.|last2=Gerardo|first2=N. M.|last3=Inouye|first3=D. W.|last4=Medina|first4=M.|last5=Xavier|first5=J. B.|date=2012-10-12|title=Animal Behavior and the Microbiome|url=https://www.sciencemag.org/lookup/doi/10.1126/science.1227412|journal=Science|volume=338|issue=6104|pages=198-199|language=en|doi=10.1126/science.1227412|issn=0036-8075}}</ref>。一方でアリなどの一部の動物は、病的な状態や一過性に微生物が寄生することを除くと、共生関係にある微生物叢が存在しない場合もあると指摘する研究もある<ref>{{Cite journal|last=Hammer|first=Tobin J.|last2=Sanders|first2=Jon G.|last3=Fierer|first3=Noah|date=2019-05-01|title=Not all animals need a microbiome|url=https://academic.oup.com/femsle/article/366/10/fnz117/5499024|journal=FEMS Microbiology Letters|volume=366|issue=10|language=en|doi=10.1093/femsle/fnz117|issn=0378-1097}}</ref>。 |
|||
一般に動物の腸内細菌叢は食性によって変わる。[[レッサーパンダ]]と[[ジャイアントパンダ]]はその例外であり、これらの動物は草食動物であるが、その腸内細菌叢はむしろ肉食動物のものである。これはパンダが最近になって食性を肉食から草食へと変化させたことを反映させているのかもしれない<ref name=":10">{{Cite journal|last=Karasov|first=William H.|last2=Douglas|first2=Angela E.|date=2013-4|title=Comparative Digestive Physiology|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4458075/|journal=Comprehensive Physiology|volume=3|issue=2|pages=741-783|doi=10.1002/cphy.c110054|issn=2040-4603|pmid=23720328|pmc=4458075}}</ref>。 |
|||
[[ウシ]]に代表される反芻動物は、胃が4つの部屋に分画されており、食道から直接つながる第一胃は食物の発酵槽として働く。草食動物であるウシは草本を栄養源として利用するが、一般に植物の葉は果実や動物の肉と比べて栄養の利用効率が低い。これは植物の葉が[[セルロース]]に代表される不溶性の多糖類から構成されるためであるが、反芻動物はこの不溶性の多糖類を第一胃の微生物による発酵で分解し、最終生産物として得られる[[酢酸]]、[[酪酸]]、[[プロピオン酸]]などの短鎖脂肪酸(揮発性脂肪酸とも呼ばれる)を吸収する。反芻動物はこの短鎖脂肪酸を材料に糖新生、脂肪新生という過程を経て糖や脂肪を合成している<ref name=":10" />。反芻動物の飼料利用効率は農業において重要であり、第一胃の微生物叢と飼料利用効率の相関が調査されている。それによると、ウシの飼料利用効率は第一胃に[[フィルミクテス門|フィルミクテス]]が多い場合に高いとされている<ref>{{Cite journal|last=Myer|first=Phillip R.|date=2019-06-25|title=Bovine Genome-Microbiome Interactions: Metagenomic Frontier for the Selection of Efficient Productivity in Cattle Systems|url=https://msystems.asm.org/content/4/3/e00103-19|journal=mSystems|volume=4|issue=3|language=en|doi=10.1128/mSystems.00103-19|issn=2379-5077|pmid=31219789}}</ref>。 |
|||
細菌叢や特定の細菌が、それを保持する宿主に及ぼす生理作用を明らかにするために、[[ノトバイオート]]技術が用いられる。ヒトの細菌叢がヒトの健康に及ぼす影響を明らかにするためには、ヒトそのものを研究材料とすることがもっとも直接的な方法だが、遺伝的、環境的な背景を揃えた実験群を用意することは困難であり、また、健康を害するおそれのある処置を伴う実験は倫理的に行うことができない。そのため、ヒトの腸内細菌の研究であっても実験動物を用いた実験が必要となる。既知の細菌のみが腸内などに定着しているノトバイオート動物の作製においては、細菌の株やその混合物を何の微生物も定着していない[[無菌動物]]に接種する。さらに、細菌を移植されたノトバイオート動物の病態や健康状態の変化を観察することで、移植した細菌叢が宿主に与える生理作用を調べる。現在広く用いられる無菌動物は[[マウス]]と[[ラット]]だが、無菌動物を用いた初期の研究では[[モルモット]]が多く用いられた。他にも[[ウサギ]]、[[ブタ]]、[[ヤギ]]、[[ヒツジ]]、[[ウシ]]、[[ウマ]]、[[イヌ]]、[[ニワトリ]]などの動物でも無菌化が行われている<ref name=":2" />。 |
|||
=== 植物と微生物叢 === |
|||
[[File:Representative microbial networks in different plant habitats.webp|thumb|upright=1.7| {{center|'''植物の各部位における典型的な微生物ネットワーク'''}} 土壌、空気中、根圏、葉圏、そして植物組織内における微生物群集の模式図。各種の生息地において、微生物(色で塗られた円で示される)は共生的にも競合的にも関わり、無関係のこともある(線が引かれていない円)。「ハブ」や「楔」に例えられる特定の種(太い線で示される)はネットワーク内の微生物との関係性が強く、微生物叢の構造に強く働きかける。(a) 根圏の微生物は主に土壌に由来する。(b) 葉圏の微生物は多様な由来を持っており、エアロゾル、昆虫、塵がそれに当たる。(c) 地上部の微生物叢と地中部の微生物叢の移動も存在する<ref>Hassani, M.A., Durán, P. and Hacquard, S. (2018) "Microbial interactions within the plant holobiont". ''Microbiome'', '''6'''(1): 58. {{doi|10.1186/s40168-018-0445-0}}. [[File:CC-BY icon.svg|50px]] Material was copied from this source, which is available under a [https://creativecommons.org/licenses/by/4.0/ Creative Commons Attribution 4.0 International License].</ref>。]] |
|||
様々な栄養素を提供する植物は微生物にとって魅力的な宿主である。植物に寄生する微生物は[[エピファイト]](植物の表面に存在する微生物)または[[エンドファイト]](植物の組織内に存在する微生物)として存在している<ref>{{Cite journal|last=Berlec|first=Aleš|date=2012-09-01|title=Novel techniques and findings in the study of plant microbiota: Search for plant probiotics|journal=Plant Science|volume=193-194|pages=96-102|doi=10.1016/j.plantsci.2012.05.010|pmid=22794922}}</ref><ref>{{Cite journal| last=Whipps| first=J.m.| last2=Hand| first2=P.|last3=Pink|first3=D.|last4=Bending|first4=G.d.|date=2008-12-01|title=Phyllosphere microbiology with special reference to diversity and plant genotype|journal=Journal of Applied Microbiology| language=en| volume=105| issue=6| pages=1744-1755|doi=10.1111/j.1365-2672.2008.03906.x| pmid=19120625|issn=1365-2672| url=http://wrap.warwick.ac.uk/449/1/WRAP_Bending_JAM_review_revised_4_April_2008.pdf}}</ref>。[[卵菌]]と[[真菌]]は収斂進化の果てに類似した形態を持つようになり、生態学的ニッチを共有するようになった。これらの生物は[[菌糸]]を持っており、その脚を宿主の細胞へと浸透させる。共生的関係において植物は共生真菌と物質交換を行っており、ヘキソースの代わりに無機リン酸を得ている。この共生関係は古代から続いていると考えられており、これが植物の地上進出を助けたと推測されている<ref name=pnas>{{cite journal |
|||
| vauthors=Remy W, Taylor TN, Hass H, Kerp H |
|||
| title=Four hundred-million-year-old vesicular arbuscular mycorrhizae |
|||
| journal=Proc. Natl. Acad. Sci. USA|year=1994|volume=91|issue=25|pages=11841-3 |
|||
| bibcode=1994PNAS...9111841R |
|||
| doi=10.1073/pnas.91.25.11841 |
|||
| pmid=11607500 |
|||
| pmc=45331 |
|||
}}</ref><ref>{{cite journal |
|||
|vauthors=Chibucos MC, Tyler BM | title=Common themes in nutrient acquisition by plant symbiotic microbes, described by the Gene Ontology |
|||
| journal=BMC Microbiology|year=2009|volume=9(Suppl 1)|pages=S6 |
|||
| doi=10.1186/1471-2180-9-S1-S6 |
|||
| pmid=19278554 |
|||
| pmc=2654666 |
|||
}}</ref>。[[植物成長促進根圏細菌]](plant growth-promoting rhizobacteria:PGPR)は植物の成長を促進する働きを持つ[[根圏細菌|根圏微生物]]で、[[窒素固定]]、リンなどの無機物の可溶化、植物ホルモンの合成、無機物の取り込み、病原体からの防御といった植物に必須な機能を提供する<ref>{{cite book |
|||
| title=Soil microbial ecology: applications in agricultural and environmental management |
|||
| chapter=Plant growth-promoting rhizobacteria as biological control agents |
|||
| last=Kloepper |
|||
| first=J. W |
|||
| editor=Metting, F. B. Jr |
|||
| year=1993 |
|||
| publisher=Marcel Dekker Inc |
|||
| location=New York |
|||
| isbn=978-0-8247-8737-0 |
|||
|pages=255-274}}</ref><ref name=BloembergLugt2001>{{Cite journal | last1 = Bloemberg | first1 = G. V. | last2 = Lugtenberg | first2 = B. J. J. | doi = 10.1016/S1369-5266(00)00183-7 | title = Molecular basis of plant growth promotion and biocontrol by rhizobacteria | journal = Current Opinion in Plant Biology | volume = 4 | issue = 4 | pages = 343-350 | year = 2001 | pmid = 11418345| pmc = }}</ref>。PGPRは生態学的ニッチや基質の獲得を病原体と競合したり、[[アレロケミカル]]を産生したり、全身的な抵抗性誘導 (induced systemic resistance: ISR) を引き起こすことで、植物を病原体から守る<ref name= pgpg>{{cite journal|vauthors=Compant S, Duffy B, Nowak J, Clément C, Barka EA | title=Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects| journal=Appl Environ Microbiol|year=2005|volume=71|issue=9|pages=4951-9| doi=10.1128/AEM.71.9.4951-4959.2005| pmc=1214602|pmid=16151072}}</ref><ref>{{Cite journal|和書|author=百町満朗 |title=生物防除研究の現状と展望 |url=https://hdl.handle.net/20.500.12099/53022 |journal=日本植物病理學會報 |publisher=日本植物病理學會 |year=2013 |month=aug |volume=79 |issue=3 |pages=123-127 |naid=10031191400 |doi=10.3186/jjphytopath.79.123 |issn=00319473}}</ref>。 |
|||
[[File:Cycas coralloid root XS high.jpg|thumb|200px|left| ソテツの珊瑚状も根粒の切片を光学顕微鏡で観察すると、共生菌であるシアノバクテリアの層が観察される。]] |
|||
{{clear left}} |
|||
=== 環境と微生物叢 === |
|||
2018年に発表された研究によると、地球上にはおよそ550Gtの炭素が生体物質(バイオマス)として存在し、70Gtのバイオマスを占める細菌は450Gtを占める植物に次いでいる。真菌、古細菌、原生生物もそれぞれ12Gt、7Gt、4Gtのバイオマスを占めるが、ヒトを含めた動物のそれは2Gtに過ぎない<ref>{{Cite journal|last=Bar-On|first=Yinon M.|last2=Phillips|first2=Rob|last3=Milo|first3=Ron|date=2018-05-21|title=The biomass distribution on Earth|url=https://www.pnas.org/content/115/25/6506|journal=Proceedings of the National Academy of Sciences|volume=115|issue=25|pages=6506-6511|language=en|doi=10.1073/pnas.1711842115|issn=0027-8424}}</ref>。 |
|||
土壌は一様ではなく、pHや塩分濃度、酸素濃度などの勾配が存在し、土壌微生物叢は土壌環境によって構成を変化させる。土壌の微生物叢では細菌と真菌が多数を占め、その比率は他の成分である古細菌、ウイルス、原生生物の100倍から10000倍に及ぶ<ref>{{Cite journal|last=Fierer|first=Noah|date=2017-10|title=Embracing the unknown: disentangling the complexities of the soil microbiome|url=http://www.nature.com/articles/nrmicro.2017.87|journal=Nature Reviews Microbiology|volume=15|issue=10|pages=579-590|language=en|doi=10.1038/nrmicro.2017.87|issn=1740-1526}}</ref>。 |
|||
建造環境は人工的に造られた環境の事をいい、建造物や交通機関を含む全ての人工的な環境を言う。建造環境は地球上の他の環境と比較して微生物の生息には適さず、選択圧により一部の微生物しか生息しないため、自然環境と比べると独特の微生物群集を保持する。建造環境の微生物は主にヒトの皮膚や口腔微生物叢に由来すると考えられているが、一方で農村においては動物由来の微生物などより多様な微生物が生息する<ref>{{Cite journal|last=Gilbert|first=Jack A.|last2=Stephens|first2=Brent|date=2018-11|title=Microbiology of the built environment|url=http://www.nature.com/articles/s41579-018-0065-5|journal=Nature Reviews Microbiology|volume=16|issue=11|pages=661-670|language=en|doi=10.1038/s41579-018-0065-5|issn=1740-1526}}</ref>。[[コーネル大学]]のグループは[[ニューヨーク]]の地下鉄の駅構内と[[地下鉄]]車両の車内を綿棒でぬぐい、地下鉄の微生物叢の調査を行った。およそ半分の配列は未知の配列であり、残りのほとんどは細菌のものであった。ニューヨークの地下鉄は世界でも最大規模であり、多数のヒトが利用するにも関わらず、ヒトのDNA配列は0.2%を占めるに過ぎない<ref>{{Cite journal|last=Afshinnekoo|first=Ebrahim|last2=Meydan|first2=Cem|last3=Chowdhury|first3=Shanin|last4=Jaroudi|first4=Dyala|last5=Boyer|first5=Collin|last6=Bernstein|first6=Nick|last7=Maritz|first7=Julia M.|last8=Reeves|first8=Darryl|last9=Gandara|first9=Jorge|date=2015-07-29|title=Geospatial Resolution of Human and Bacterial Diversity with City-Scale Metagenomics|url=http://www.sciencedirect.com/science/article/pii/S2405471215000022|journal=Cell Systems|volume=1|issue=1|pages=72-87|language=en|doi=10.1016/j.cels.2015.01.001|issn=2405-4712}}</ref>。 |
|||
=== 食品と微生物叢 === |
|||
食品の[[発酵]]と微生物群集の関係性については、[[チーズ]]を含めた乳製品や酒類をはじめとした多数の食品・飲料で調査がなされてきた。発酵に影響を及ぼす外的要因としてはpH、水分活性、塩濃度、温度等が知られる。発酵食品の中には真菌が重要な役割を果たすものもあるが、発酵食品中の微生物についても真菌に関連する研究は数が少ない<ref>{{Cite journal|last=Filippis|first=Francesca De|last2=Parente|first2=Eugenio|last3=Ercolini|first3=Danilo|date=2017|title=Metagenomics insights into food fermentations|url=https://sfamjournals.onlinelibrary.wiley.com/doi/abs/10.1111/1751-7915.12421|journal=Microbial Biotechnology|volume=10|issue=1|pages=91-102|language=en|doi=10.1111/1751-7915.12421|issn=1751-7915|pmid=27709807|pmc=PMC5270737}}</ref>。また、食品中の微生物は食品衛生の観点からも注目されており、例えば牛乳中の腐敗菌や病原細菌、野菜の表面に付着した病原細菌などが調べられている<ref name=":6" />。 |
|||
== 歴史 == |
|||
[[ファイル:Illumina MiSeq sequencer.jpg|左|サムネイル|イルミナ社製のDNAシーケンサーであるMiSeq。微生物叢解析に用いられる次世代シーケンサーの代表例である。]] |
|||
古典的には腸内細菌叢をはじめとする微生物叢の研究には分離培養法を基礎とした手法が用いられてきた。しかしながら、今日において実験室で分離培養が可能な細菌は集団中の極一部に過ぎないことが知られており、分離培養に頼った手法で微生物叢の全体像を把握することは困難である<ref name=":4">{{Cite journal|last=Amann|first=R I|last2=Ludwig|first2=W|last3=Schleifer|first3=K H|date=1995-03|title=Phylogenetic identification and in situ detection of individual microbial cells without cultivation.|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC239358/|journal=Microbiological Reviews|volume=59|issue=1|pages=143-169|issn=0146-0749|pmid=7535888|pmc=PMC239358}}</ref><ref name=":5">{{Cite journal|last=NIH HMP Working Group|last2=Peterson|first2=Jane|last3=Garges|first3=Susan|last4=Giovanni|first4=Maria|last5=McInnes|first5=Pamela|last6=Wang|first6=Lu|last7=Schloss|first7=Jeffery A.|last8=Bonazzi|first8=Vivien|last9=McEwen|first9=Jean E.|date=2009-12|title=The NIH Human Microbiome Project|url=https://www.ncbi.nlm.nih.gov/pubmed/19819907|journal=Genome Research|volume=19|issue=12|pages=2317-2323|doi=10.1101/gr.096651.109|issn=1549-5469|pmid=19819907|pmc=2792171}}</ref><ref>{{Cite journal|last=SAKUDA|first=SHOHEI|date=2002|url=https://doi.org/10.1271/kagakutoseibutsu1962.40.600|journal=Kagaku To Seibutsu|volume=40|issue=9|pages=600-605|doi=10.1271/kagakutoseibutsu1962.40.600|issn=0453-073X}}</ref><ref>{{Cite journal|author=平山 和宏|year=2014|title=シリーズ 腸内細菌叢 1 腸内細菌叢の基礎|url=https://www.eiken.co.jp/uploads/modern_media/literature/MM1410_03.pdf|journal=モダンメディア|volume=60|page=}}</ref>。 |
|||
1977年、[[カール・ウーズ]]と[[ジョージ・E・フォックス]]は16S rRNA遺伝子の配列に基づく系統分類の手法を提示する<ref>{{Cite journal|last=Woese|first=Carl R.|last2=Fox|first2=George E.|date=1977-11-01|title=Phylogenetic structure of the prokaryotic domain: The primary kingdoms|url=https://www.pnas.org/content/74/11/5088|journal=Proceedings of the National Academy of Sciences|volume=74|issue=11|pages=5088-5090|language=en|doi=10.1073/pnas.74.11.5088|issn=0027-8424|pmid=270744|pmc=PMC432104}}</ref><ref name=":7">{{Cite journal|last=Byrd|first=Allyson L.|last2=Belkaid|first2=Yasmine|last3=Segre|first3=Julia A.|date=2018-03|title=The human skin microbiome|url=http://www.nature.com/articles/nrmicro.2017.157|journal=Nature Reviews Microbiology|volume=16|issue=3|pages=143-155|language=en|doi=10.1038/nrmicro.2017.157|issn=1740-1526}}</ref>。 |
|||
さらに1990年には、当時開発されたPCR法を用いて、キャサリン・G・フィールドらのグループが16S rRNAを増幅し、分離培養を介さずに海洋の微生物叢を構成する細菌の分類を試みる<ref name=":4" /><ref>{{Cite journal|last=Giovannoni|first=Stephen J.|last2=Britschgi|first2=Theresa B.|last3=Moyer|first3=Craig L.|last4=Field|first4=Katharine G.|date=1990-05|title=Genetic diversity in Sargasso Sea bacterioplankton|url=http://www.nature.com/articles/345060a0|journal=Nature|volume=345|issue=6270|pages=60-63|language=en|doi=10.1038/345060a0|issn=0028-0836}}</ref><ref name=":6">{{Cite journal|last=Cao|first=Yu|last2=Fanning|first2=Séamus|last3=Proos|first3=Sinéad|last4=Jordan|first4=Kieran|last5=Srikumar|first5=Shabarinath|date=2017-09-21|title=A Review on the Applications of Next Generation Sequencing Technologies as Applied to Food-Related Microbiome Studies|url=http://journal.frontiersin.org/article/10.3389/fmicb.2017.01829/full|journal=Frontiers in Microbiology|volume=8|pages=1829|doi=10.3389/fmicb.2017.01829|issn=1664-302X|pmid=29033905|pmc=PMC5627019}}</ref>。 |
|||
1990年代における微生物叢解析の主な手法は、遺伝情報を含んだDNA配列を大腸菌に導入する必要があるクローニングを前提とした手法であった<ref name=":4" />。 |
|||
メタゲノムの語が提唱されたのは1998年である<ref name=":8">{{Cite journal|last=YAMADA|first=Takuji|date=2013|title=Human Gut Metagenomic Analysis toward Clinical Studies|url=https://doi.org/10.1271/kagakutoseibutsu.51.802|journal=KAGAKU TO SEIBUTSU|volume=51|issue=12|pages=802-808|doi=10.1271/kagakutoseibutsu.51.802|issn=0453-073X}}</ref>。また、マイクロバイオームという概念を初めて提唱したのはノーベル生理学・医学賞を受賞した[[ジョシュア・レーダーバーグ]]とされており、これは2001年のことであった<ref name=":5" />。 |
|||
この頃までの微生物叢解析は古典的なDNAシークエンシング法であるサンガー法に依存していたため、出力されるデータ量に限りがあり、希少な種の遺伝情報を見過ごしてしまう可能性があった。この課題を解決したのが2010頃からの次世代シーケンサーの登場である。454をはじめとした第二世代シーケンサーとも呼ばれるDNAシーケンサーはサンガー法に比べ、圧倒的に多数の配列を同時に解析することができる。このDNAシーケンサーの技術革新により、より網羅的に微生物叢を解析することが可能となった。<ref name=":6" /><ref name=":8" /> |
|||
これに伴って研究の規模も巨大化しており、例えば2006年に公表された初期のメタゲノム解析は、サンガー法による2人の被験者の腸内細菌を対象としたものであったが、2016年に公表された研究では、[[イルミナ]]社製の次世代シーケンサーが用いられ、解析対象者の数は1135人に及ぶ<ref name=":2" /><ref>{{Cite journal|last=Gill|first=S. R.|last2=Pop|first2=M.|last3=DeBoy|first3=R. T.|last4=Eckburg|first4=P. B.|last5=Turnbaugh|first5=P. J.|last6=Samuel|first6=B. S.|last7=Gordon|first7=J. I.|last8=Relman|first8=D. A.|last9=Fraser-Liggett|first9=C. M.|date=2006-06-02|title=Metagenomic Analysis of the Human Distal Gut Microbiome|url=https://www.sciencemag.org/lookup/doi/10.1126/science.1124234|journal=Science|volume=312|issue=5778|pages=1355-1359|language=en|doi=10.1126/science.1124234|issn=0036-8075|pmid=16741115|pmc=PMC3027896}}</ref><ref>{{Cite journal|last=Zhernakova|first=Alexandra|last2=Kurilshikov|first2=Alexander|last3=Bonder|first3=Marc Jan|last4=Tigchelaar|first4=Ettje F.|last5=Schirmer|first5=Melanie|last6=Vatanen|first6=Tommi|last7=Mujagic|first7=Zlatan|last8=Vila|first8=Arnau Vich|last9=Falony|first9=Gwen|date=2016-04-29|title=Population-based metagenomics analysis reveals markers for gut microbiome composition and diversity|url=https://www.sciencemag.org/lookup/doi/10.1126/science.aad3369|journal=Science|volume=352|issue=6285|pages=565-569|language=en|doi=10.1126/science.aad3369|issn=0036-8075|pmid=27126040|pmc=PMC5240844}}</ref>。 |
|||
== 出典 == |
|||
{{Reflist|30em}} |
|||
==出典== |
|||
{{Reflist}} |
|||
{{デフォルトソート:さいきんそう}} |
{{デフォルトソート:さいきんそう}} |
||
2020年8月31日 (月) 01:55時点における版
微生物叢(びせいぶつそう、英: microbiota 英語発音: [ˌmaɪkɹoʊbaɪˈoʊtə])とは生態系における生きた微生物の集合のことであり、それらの遺伝情報を含意してマイクロバイオーム(英: microbiome 英語発音: [ˌmaɪkɹoʊbaɪˈoʊm])と呼ばれることもある。微生物叢は細菌、古細菌、真菌、寄生虫、ウイルスによって構成されており、この構成成分の組成構造は微生物叢が定着する環境ごとに異なっている。微生物叢はヒトを含めた動物の体に定着し、植物と共生、また海中から地下鉄の車内まで様々な環境に存在している。
ヒトの体にも微生物は定着しており、ヒトの微生物叢はヒトの健康状態と密接に関連している。そのため、特に腸内細菌は医学的な観点からも古くから研究されてきた。古典的には分離培養に依存した研究が行われていたが、16S rRNA遺伝子の配列に基づく系統分類法が提唱されてからは、分離培養を伴わない方法により未培養の微生物を含めた解析が行われるようになった。近年のDNAシークエンス技術の発展に伴い、微生物叢の研究は急速に進展、様々な疾患との関連性が明らかにされている。
定義と語源

微生物叢は生きた微生物集団の全体であり、また微生物集団が有する遺伝情報の全体を指してマイクロバイオーム (microbiome) と呼ばれることもある[1]。従来は微生物叢を意味する用語として、生態学において叢(くさむら、多くのものが集まっている)を意味する用語であるフローラの語が用いられてきたが、マイクロバイオーム解析の興隆と共に微生物叢 (microbiota) が支配的に用いられるようになった[1][2]。また、微生物叢研究はメタゲノム解析と呼ばれる解析技術によって発展してきた。メタゲノムとはギリシャ語で「高次」や「超越」を意味する「メタ」と、すべての遺伝子全体を意味する「ゲノム」を組み合わせた造語である。メタゲノム解析においては微生物群集の遺伝子全体を、DNAの混合物として培養を行わずに網羅的に解析する[3][4][5]。微生物が細菌、古細菌、真菌、蠕虫などの寄生虫、及びウイルスを内包するように、微生物叢もまた細菌をはじめとした様々な微生物によって構成される。一方で、微生物叢の研究の多くは腸内細菌をはじめとした細菌に焦点を当てており[5]、マイクロバイオームが常在細菌と同義的に用いられることもある[6]。ヒト微生物叢の遺伝情報の規模はヒトそのものの遺伝情報の規模よりも大きく、それ故に「第二のゲノム」と称されることもある[7][8]。
微生物叢の構成要素とその解析手法
細菌叢
細菌叢は微生物集団が有する遺伝情報の全体がマイクロバイオームと呼ばれるように、細菌集団が有する遺伝情報の全体をバクテリオーム (bacteriome) と呼ぶ。先述の通り、微生物叢を構成する要素の中でも、細菌の成分は特に重点を置かれて研究が進められてきた[5]。

細菌叢の組成を明らかにするためには、様々な生物で保存されており、適度に系統間では配列が異なる16S rRNA遺伝子のDNA配列をマーカー遺伝子として解析し、その存在比から細菌叢を構成する菌種の特定や組成を推定することが一般に行われる。また、その手法のことをメタ16S解析と呼ぶ[9]。この手法は比較的簡単、安価に行える、真正細菌だけでなく古細菌も同時に評価できるといった利点をもつ。ただし、PCRによりDNA配列のコピー数を増幅する作業が必要であり、この過程で特定の分類群に対してその組成を過大/過少に評価してしまうようなバイアスが生じる[5]。また、古くから行われてきた手法であり、データベースに登録された既存のデータや、データ解析ツールが充実しているのもこの手法である[10]。
一方で、全メタゲノム解析は試料に含まれる全てのDNA配列を解析する手法であり、微生物叢の遺伝情報を詳細に解析できる上、細菌のみならず真菌やDNAウイルスについても同時に評価できるという利点を持つ。しかしながら比較的高価で複雑な解析が必要であり、一般性には劣る[5][10]。
また、メタトランスクリプトーム解析は試料に含まれる全RNAを解析するもので、死んだ細菌でも安定しているDNAを解析するメタ16S解析や全メタゲノム解析と異なり、原則的に生きている細菌の遺伝情報だけを解析できる。ただし、上記の手法に比べるとrRNAの除去が必要など、実験系が複雑であり、解析により多額の費用がかかる[10]。
真菌叢
カビや酵母といった真菌もまた微生物叢の構成要素として注目されている[5]。真菌の研究は19世紀から行われてきたが、環境中の真菌全体を捉える真菌叢の研究の歴史は浅く、mycobiologyとmicrobiomeを組み合わせた造語であるmycobiomeの語が提案されたのは2010年のことである[11]。また、真菌叢解析に関する報告は細菌叢解析に関するものに比べると格段に少ない。しかしながら、解析の手法に大きな差はない[9]。細菌叢の解析には16S rRNA遺伝子の配列がマーカーとして利用されるが、真菌叢の解析においてはリボソームRNA遺伝子を隔てる内部転写スペーサー (internal transcribed spacer, ITS) 領域や、細菌の16S rRNA遺伝子に相当する18S rRNA遺伝子がマーカー遺伝子として用いられる。ただし、真菌叢の解析はデータベースの不足から細菌叢の解析と比べ困難である。ヒトの身体の場合、粘膜においてはカンジダ属が優位だが、皮膚ではマラセチア属が優占する[5]。
ウイルス叢
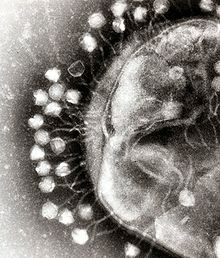
他の微生物と同様にウイルスもまた人体に普遍的に常在しており、DNAウイルスやRNAウイルスを含むすべてのウイルスの集合をviromeと呼ぶ。ウイルスは細菌や真菌と異なり、全てのウイルスで共通して存在するような保存配列を持たない。そのため、ウイルス叢の解析においてはしばしば試料に含まれる全ての遺伝情報を解析するメタゲノム解析が用いられる。また、人体に生息するDNAウイルスの多くは、常在細菌に感染しているバクテリオファージであり、ウイルス叢の研究は細菌叢との関連で扱われることが多い[5]。ただし、ウイルスのゲノムは一般に細菌や哺乳類のゲノムに比べ小さく、メタゲノム解析で得られるウイルスDNA配列はメタゲノム全体の小さな割合を占めるに過ぎない。また、ファージのDNA配列は溶原化と呼ばれる過程を経て、細菌のゲノムに取り込まれて存在していることがあり、配列情報だけではウイルス粒子として存在する配列と細菌ゲノムに取り込まれた配列とを区別できない。そのため、厳密にウイルス粒子として存在するウイルスの遺伝情報を定量的に評価するためには、事前に細菌の菌体より孔の目が細かい膜を用いたろ過、ウイルス粒子外のDNAを分解する酵素処理、遠心分離による分画などを行うことで、ウイルス粒子内のDNAを抽出する手法が採用されることがある[12][13]。ファージは宿主となる細菌を殺したり、新しい遺伝子を付与することで、細菌叢に影響を及ぼしていると考えられている[14]。環境中にもウイルスは存在しており、最初期のウイルス叢研究は海水中のウイルス叢を解析したものであった[15][16]。
宿主や環境と微生物叢
ヒトと微生物叢

腸内をはじめヒトの体には微生物が定着している。大腸には特に多数の細菌が生息しており、重量は体重70kgの成人男性で0.2kgに過ぎないが、細胞数では約40兆に及ぶと推定されている。この数は個人の全細胞の数を超える[18]。ヒトの微生物叢はヒトの疾病との関連性から重点的に研究が進められてきた。その中でも腸内細菌叢に関する研究が特に焦点を当てられてきており、腸管の走行に沿って腸内細菌叢の構造が変化することや、様々な疾病との関連が明らかにされている。同様に、口腔、皮膚、膣などの微生物叢も疾患との関連などから研究されてきた[5]。また、ヒトの微生物叢の大規模な調査として、アメリカのHuman Microbiome ProjectやヨーロッパのMetaHITなどの国家規模のプロジェクトが実施されている[19][20]。
ヒトの微生物叢は腸管、口腔、皮膚、膣といった部位ごとに、構成する細菌種が異なり、例えば異なるヒトの腸管の微生物叢を比べた場合と、同一のヒトの腸管の微生物叢と口腔の微生物叢を比較した場合、前者の方が互いに類似性が高い[21][22]。
腸管の微生物叢
腸管の微生物叢については特に3つのエンテロタイプと呼ばれる微生物叢のグループが提唱されている。3つのエンテロタイプはそれぞれに特有な細菌の系統によって特徴付けることができ、これらの特徴的なグループは地域に依存せずに存在する[23][24]。
近年の研究成果から疾患と細菌叢の関係が明らかにされてきた。例えば肥満とそれに伴う2型糖尿病のような生活習慣病は、ヒトの遺伝情報だけではなく、腸内細菌叢を構成する細菌種の割合とも関係していることが疫学調査や動物実験から明らかにされた[25][26][27]。
環境が清潔だとアレルギー性疾患に罹患しやすいとする衛生仮説も微生物叢との関連から説明され得る[5]。経済的豊かな富裕国では病原性のない、または病原性の弱い寄生虫や真菌、乳酸菌といった常在性の微生物に感染する機会が失われている。一方でこのような微生物は免疫の過剰応答を抑える制御性T細胞の誘導を活性化する働きがあり、それ故に富裕国では炎症性腸疾患などのアレルギー性疾患が増加しているとするものである[28]。実際に様々な研究が炎症性腸疾患と微生物叢の関連性を示しており、細菌叢の多様性(α多様性)が失われて特定の菌種が増加することなどの変化が起きると考えられているが、因果関係の証明には至っていない[29]。
口腔の微生物叢
口腔にはおよそ700種程の細菌が生息すると推定されている。レンサ球菌属に代表される一部の細菌は口腔の全域に存在するが、特定の部位にのみ生息する細菌もあり、例えばRothia属の細菌は舌や歯の表面にしかいない。歯はヒトの体で唯一生理的に表皮の脱落が生じない部位であり、バイオフィルムの形成が行われるなど、微生物にとって絶好の生息地となる。また、他にも虫歯の治療のための歯冠やインプラントなどの表面も同様にバイオフィルム形成に影響し、口腔微生物叢の構成に変化を与えやすい[30][31]。
人類の歴史とともに食生活は変化し、それに伴って口腔微生物叢も変化してきたと考えられている。例えば耕作により人類は精製糖を食生活に取り入れたが、Streptococcus mutansは増加した酸化ストレスへの防御機構と自ら産生する酸性の代謝産物への抵抗性を獲得し、他の細菌に優占するようになったとされる[30]。
虫歯や歯周炎に代表される口腔の疾患は特定の細菌が原因となるのではなく、複数の常在細菌の集団が特定の条件で引き起こすと考えられている[31]。また、口腔の疾患に関連した細菌は、数は少ないながらも常在している。そのため、口腔の疾患は病原体が新規に感染するのではなく、口腔微生物叢におけるバランスが破綻することによって引き起こされるという説が現在は受け入れられている[30]。
皮膚の微生物叢
腸管と同様に皮膚もまた独自の微生物叢を構成しており、皮膚の微生物叢においてはプロピオニバクテリウム属、コリネバクテリウム属、ストレプトコッカス属の細菌とそれに感染するファージ、マラセチアなどの真菌、ポリオーマウイルスが主体となっている[32]。健常者の皮膚微生物叢は黄色ブドウ球菌の増殖を抑制する働きを持つが、アトピー性皮膚炎の患者においては皮膚微生物叢が破綻して黄色ブドウ球菌が増殖している。また、ニキビは皮膚微生物叢で最も比率の大きい種であるアクネ菌との関連が指摘されている。アクネ菌は健常な皮膚における常在細菌だが、ニキビ患部においては特定の系統が増加している[17]。
膣の微生物叢

膣微生物叢は偏った構造を持っており、構成種のほとんどがラクトバシラス属に属する細菌である。一方でラクトバシラス属の中では様々な種の細菌が存在しており、個人間ではラクトバシラス属の多様性が大きく異なる。また、膣微生物叢の組成はpHの影響を受け、pHが高くなるとラクトバシラス属の減少が認められる[22]。ラクトバシラス属は乳酸菌を産生することでpH3.5-4.5の酸性環境を整えており、これが膣を有害な病原体から守ると考えられている[33]。細菌性膣炎は膣の疾患で、悪臭を伴う、白色粘稠の分泌物が症状として認められる。細菌性膣炎では、pHが上昇し、ラクトバシラス属が減少する一方で、Gardnerella vaginalisなどラクトバシラス属以外の細菌が増加することが知られる[34]。
ヒトの微生物叢の由来と定着
ヒトに定着している微生物はどこからやってくるのか。新生児の微生物叢は母体に由来しているようである。新生児の細菌叢と母体の細菌叢を比較した調査によると、新生児の細菌叢は出産の形態に影響を受ける。自然分娩の場合は母体の膣の細菌叢が新生児に定着し、ラクトバシラス属菌が優占種となる。一方で帝王切開の場合は母体の細菌叢が定着し、プロピオニバクテリウム属菌をはじめとした皮膚の常在細菌が優占種となる[35]。分娩形態の違いにより生じる新生児における微生物叢の違いは12-24ヶ月齢までに徐々に消えていく[36]。分娩前の胎児が微生物叢を持つかについては議論があった。胎児が無菌的であるか否かについては150年前から議論されていたが、20世期の後半になって一旦は胎児は無菌であり、出産中とその後に微生物叢を獲得するという説が定説となる。しかしながら、近代的なDNAシークエンシング技術の開発によって、従来無菌的であると考えられていた羊水、胎盤、臍帯血、胎便からも細菌が検出されたことから、再び胎児の子宮内における微生物叢の獲得が主張されたきた[1][37]。もっともDNAの抽出試薬も細菌DNAに汚染されているなどの理由から、試料から得られるDNAの量が少ない場合は、試料に由来しない細菌DNAを検出してしまう可能性があるなど、実験系に制限があることが知られる。そのため、子宮内における微生物の検出には確定的な結論は出ていない[36]。実際、子宮内における微生物の検出には否定的な見解が示されている。537人の妊婦を対象とした研究によると、妊娠中の胎盤は基本的に無菌的であると考えられ、唯一の例外は約5%の妊婦でB群レンサ球菌が検出されたことのみであった[38]。
抗生物質は新生児の微生物叢に影響を及ぼし、新生児への持続的投与は喘息、2型糖尿病、炎症性腸疾患、乳アレルギーなどの疾患と関連する可能性がある。もっとも、否定的見解もしめされており、また、相関関係は必ずしも因果関係を意味しない。食事もまた微生物叢に影響を与える。母乳栄養は粉ミルクに比べ、新生児と母体の双方に健康上の利点があるとされるが、母乳に分泌される免疫グロブリンA、ラクトフェリン、ディフェンシンが少なからずこれに寄与すると考えられる[36]。
ヒト以外の動物と微生物叢
ヒトと同様に様々な動物が微生物と共生関係にあり、固有の微生物叢を持つ。微生物叢はそれを保持する動物の行動によって構成が変化し、また微生物叢が宿主となる動物の行動に影響を与えるとされる[39]。一方でアリなどの一部の動物は、病的な状態や一過性に微生物が寄生することを除くと、共生関係にある微生物叢が存在しない場合もあると指摘する研究もある[40]。
一般に動物の腸内細菌叢は食性によって変わる。レッサーパンダとジャイアントパンダはその例外であり、これらの動物は草食動物であるが、その腸内細菌叢はむしろ肉食動物のものである。これはパンダが最近になって食性を肉食から草食へと変化させたことを反映させているのかもしれない[41]。
ウシに代表される反芻動物は、胃が4つの部屋に分画されており、食道から直接つながる第一胃は食物の発酵槽として働く。草食動物であるウシは草本を栄養源として利用するが、一般に植物の葉は果実や動物の肉と比べて栄養の利用効率が低い。これは植物の葉がセルロースに代表される不溶性の多糖類から構成されるためであるが、反芻動物はこの不溶性の多糖類を第一胃の微生物による発酵で分解し、最終生産物として得られる酢酸、酪酸、プロピオン酸などの短鎖脂肪酸(揮発性脂肪酸とも呼ばれる)を吸収する。反芻動物はこの短鎖脂肪酸を材料に糖新生、脂肪新生という過程を経て糖や脂肪を合成している[41]。反芻動物の飼料利用効率は農業において重要であり、第一胃の微生物叢と飼料利用効率の相関が調査されている。それによると、ウシの飼料利用効率は第一胃にフィルミクテスが多い場合に高いとされている[42]。
細菌叢や特定の細菌が、それを保持する宿主に及ぼす生理作用を明らかにするために、ノトバイオート技術が用いられる。ヒトの細菌叢がヒトの健康に及ぼす影響を明らかにするためには、ヒトそのものを研究材料とすることがもっとも直接的な方法だが、遺伝的、環境的な背景を揃えた実験群を用意することは困難であり、また、健康を害するおそれのある処置を伴う実験は倫理的に行うことができない。そのため、ヒトの腸内細菌の研究であっても実験動物を用いた実験が必要となる。既知の細菌のみが腸内などに定着しているノトバイオート動物の作製においては、細菌の株やその混合物を何の微生物も定着していない無菌動物に接種する。さらに、細菌を移植されたノトバイオート動物の病態や健康状態の変化を観察することで、移植した細菌叢が宿主に与える生理作用を調べる。現在広く用いられる無菌動物はマウスとラットだが、無菌動物を用いた初期の研究ではモルモットが多く用いられた。他にもウサギ、ブタ、ヤギ、ヒツジ、ウシ、ウマ、イヌ、ニワトリなどの動物でも無菌化が行われている[9]。
植物と微生物叢

様々な栄養素を提供する植物は微生物にとって魅力的な宿主である。植物に寄生する微生物はエピファイト(植物の表面に存在する微生物)またはエンドファイト(植物の組織内に存在する微生物)として存在している[44][45]。卵菌と真菌は収斂進化の果てに類似した形態を持つようになり、生態学的ニッチを共有するようになった。これらの生物は菌糸を持っており、その脚を宿主の細胞へと浸透させる。共生的関係において植物は共生真菌と物質交換を行っており、ヘキソースの代わりに無機リン酸を得ている。この共生関係は古代から続いていると考えられており、これが植物の地上進出を助けたと推測されている[46][47]。植物成長促進根圏細菌(plant growth-promoting rhizobacteria:PGPR)は植物の成長を促進する働きを持つ根圏微生物で、窒素固定、リンなどの無機物の可溶化、植物ホルモンの合成、無機物の取り込み、病原体からの防御といった植物に必須な機能を提供する[48][49]。PGPRは生態学的ニッチや基質の獲得を病原体と競合したり、アレロケミカルを産生したり、全身的な抵抗性誘導 (induced systemic resistance: ISR) を引き起こすことで、植物を病原体から守る[50][51]。

環境と微生物叢
2018年に発表された研究によると、地球上にはおよそ550Gtの炭素が生体物質(バイオマス)として存在し、70Gtのバイオマスを占める細菌は450Gtを占める植物に次いでいる。真菌、古細菌、原生生物もそれぞれ12Gt、7Gt、4Gtのバイオマスを占めるが、ヒトを含めた動物のそれは2Gtに過ぎない[52]。
土壌は一様ではなく、pHや塩分濃度、酸素濃度などの勾配が存在し、土壌微生物叢は土壌環境によって構成を変化させる。土壌の微生物叢では細菌と真菌が多数を占め、その比率は他の成分である古細菌、ウイルス、原生生物の100倍から10000倍に及ぶ[53]。
建造環境は人工的に造られた環境の事をいい、建造物や交通機関を含む全ての人工的な環境を言う。建造環境は地球上の他の環境と比較して微生物の生息には適さず、選択圧により一部の微生物しか生息しないため、自然環境と比べると独特の微生物群集を保持する。建造環境の微生物は主にヒトの皮膚や口腔微生物叢に由来すると考えられているが、一方で農村においては動物由来の微生物などより多様な微生物が生息する[54]。コーネル大学のグループはニューヨークの地下鉄の駅構内と地下鉄車両の車内を綿棒でぬぐい、地下鉄の微生物叢の調査を行った。およそ半分の配列は未知の配列であり、残りのほとんどは細菌のものであった。ニューヨークの地下鉄は世界でも最大規模であり、多数のヒトが利用するにも関わらず、ヒトのDNA配列は0.2%を占めるに過ぎない[55]。
食品と微生物叢
食品の発酵と微生物群集の関係性については、チーズを含めた乳製品や酒類をはじめとした多数の食品・飲料で調査がなされてきた。発酵に影響を及ぼす外的要因としてはpH、水分活性、塩濃度、温度等が知られる。発酵食品の中には真菌が重要な役割を果たすものもあるが、発酵食品中の微生物についても真菌に関連する研究は数が少ない[56]。また、食品中の微生物は食品衛生の観点からも注目されており、例えば牛乳中の腐敗菌や病原細菌、野菜の表面に付着した病原細菌などが調べられている[57]。
歴史

古典的には腸内細菌叢をはじめとする微生物叢の研究には分離培養法を基礎とした手法が用いられてきた。しかしながら、今日において実験室で分離培養が可能な細菌は集団中の極一部に過ぎないことが知られており、分離培養に頼った手法で微生物叢の全体像を把握することは困難である[58][19][59][60]。
1977年、カール・ウーズとジョージ・E・フォックスは16S rRNA遺伝子の配列に基づく系統分類の手法を提示する[61][17]。
さらに1990年には、当時開発されたPCR法を用いて、キャサリン・G・フィールドらのグループが16S rRNAを増幅し、分離培養を介さずに海洋の微生物叢を構成する細菌の分類を試みる[58][62][57]。
1990年代における微生物叢解析の主な手法は、遺伝情報を含んだDNA配列を大腸菌に導入する必要があるクローニングを前提とした手法であった[58]。
メタゲノムの語が提唱されたのは1998年である[63]。また、マイクロバイオームという概念を初めて提唱したのはノーベル生理学・医学賞を受賞したジョシュア・レーダーバーグとされており、これは2001年のことであった[19]。
この頃までの微生物叢解析は古典的なDNAシークエンシング法であるサンガー法に依存していたため、出力されるデータ量に限りがあり、希少な種の遺伝情報を見過ごしてしまう可能性があった。この課題を解決したのが2010頃からの次世代シーケンサーの登場である。454をはじめとした第二世代シーケンサーとも呼ばれるDNAシーケンサーはサンガー法に比べ、圧倒的に多数の配列を同時に解析することができる。このDNAシーケンサーの技術革新により、より網羅的に微生物叢を解析することが可能となった。[57][63]
これに伴って研究の規模も巨大化しており、例えば2006年に公表された初期のメタゲノム解析は、サンガー法による2人の被験者の腸内細菌を対象としたものであったが、2016年に公表された研究では、イルミナ社製の次世代シーケンサーが用いられ、解析対象者の数は1135人に及ぶ[9][64][65]。
出典
- ^ a b c 実験医学別冊 もっとよくわかる!シリーズ もっとよくわかる!腸内細菌叢 健康と疾患を司る“もう1つの臓器”. 福田真嗣. 羊土社. ISBN 978-4-7581-2206-1. OCLC 1122630567
- ^ 本間 央之 (2014). “医療イノベーションに向けた 腸管微生物叢研究の展開 ―微生物叢移植とその発展型を巡る研究開発と実用化の動向―”. 科学技術動向研究 (146).
- ^ Inoue, Ryo (2019-03-14). “ABCs for analysis of gut microbiota”. Japanese Journal of Lactic Acid Bacteria 30 (1): 27-31. doi:10.4109/jslab.30.27. ISSN 1343-327X.
- ^ Kusumoto, Ken-Ichi (2011). “Metagenomic Analysis”. Nippon Shokuhin Kagaku Kogaku Kaishi 58 (3): 136-136. doi:10.3136/nskkk.58.136. ISSN 1341-027X.
- ^ a b c d e f g h i j Rowan-Nash, Aislinn D.; Korry, Benjamin J.; Mylonakis, Eleftherios; Belenky, Peter (2019-01-09). “Cross-Domain and Viral Interactions in the Microbiome” (英語). Microbiology and Molecular Biology Reviews 83 (1): e00044-18, /mmbr/83/1/e00044-18.atom. doi:10.1128/MMBR.00044-18. ISSN 1092-2172. PMC PMC6383444. PMID 30626617.
- ^ Moyes, David L.; Naglik, Julian R. (2012-06-14). “The Mycobiome: Influencing IBD Severity” (English). Cell Host & Microbe 11 (6): 551-552. doi:10.1016/j.chom.2012.05.009. ISSN 1931-3128. PMID 22704612.
- ^ Zhao, Liping (2010-06). “The tale of our other genome” (英語). Nature 465 (7300): 879-880. doi:10.1038/465879a. ISSN 1476-4687.
- ^ Grice, Elizabeth A.; Segre, Julia A. (2012). “The human microbiome: our second genome”. Annual Review of Genomics and Human Genetics 13: 151-170. doi:10.1146/annurev-genom-090711-163814. ISSN 1545-293X. PMC 3518434. PMID 22703178.
- ^ a b c d 今すぐ始める! メタゲノム解析 実験プロトコール ヒト常在細菌叢から環境メタゲノムまでサンプル調製と解析のコツ. 服部 正平. 羊土社. (2016). ISBN 978-4-7581-0197-4. OCLC 1089711913
- ^ a b c Knight, Rob; Vrbanac, Alison; Taylor, Bryn C.; Aksenov, Alexander; Callewaert, Chris; Debelius, Justine; Gonzalez, Antonio; Kosciolek, Tomasz et al. (07 2018). “Best practices for analysing microbiomes”. Nature Reviews. Microbiology 16 (7): 410-422. doi:10.1038/s41579-018-0029-9. ISSN 1740-1534. PMID 29795328.
- ^ Cui, Lijia; Morris, Alison; Ghedin, Elodie (2013). “The human mycobiome in health and disease”. Genome Medicine 5 (7): 63. doi:10.1186/gm467. ISSN 1756-994X. PMC 3978422. PMID 23899327.
- ^ Mohiuddin, Mohammad; Schellhorn, Herb (2015). “Spatial and temporal dynamics of virus occurrence in two freshwater lakes captured through metagenomic analysis” (English). Frontiers in Microbiology 6. doi:10.3389/fmicb.2015.00960. ISSN 1664-302X.
- ^ Kleiner, Manuel; Hooper, Lora V.; Duerkop, Breck A. (2015-01-22). “Evaluation of methods to purify virus-like particles for metagenomic sequencing of intestinal viromes” (英語). BMC Genomics 16 (1): 7. doi:10.1186/s12864-014-1207-4. ISSN 1471-2164. PMC PMC4308010. PMID 25608871.
- ^ Haynes, Matthew; Rohwer, Forest (2011). “The Human Virome”. In Nelson, Karen E. (英語). Metagenomics of the Human Body. New York, NY: Springer. pp. 63-77. doi:10.1007/978-1-4419-7089-3_4. ISBN 978-1-4419-7089-3. PMC PMC7122492
- ^ Wylie, Kristine M.; Weinstock, George M.; Storch, Gregory A. (2012-10-01). “Emerging view of the human virome” (英語). Translational Research 160 (4): 283-290. doi:10.1016/j.trsl.2012.03.006. ISSN 1931-5244.
- ^ Breitbart, Mya; Salamon, Peter; Andresen, Bjarne; Mahaffy, Joseph M.; Segall, Anca M.; Mead, David; Azam, Farooq; Rohwer, Forest (2002-10-29). “Genomic analysis of uncultured marine viral communities”. Proceedings of the National Academy of Sciences of the United States of America 99 (22): 14250-14255. doi:10.1073/pnas.202488399. ISSN 0027-8424. PMC PMC137870. PMID 12384570.
- ^ a b c Byrd, Allyson L.; Belkaid, Yasmine; Segre, Julia A. (2018-03). “The human skin microbiome” (英語). Nature Reviews Microbiology 16 (3): 143-155. doi:10.1038/nrmicro.2017.157. ISSN 1740-1526.
- ^ Sender, Ron; Fuchs, Shai; Milo, Ron (2016-08-19). “Revised Estimates for the Number of Human and Bacteria Cells in the Body” (英語). PLOS Biology 14 (8): e1002533. doi:10.1371/journal.pbio.1002533. ISSN 1545-7885. PMC PMC4991899. PMID 27541692.
- ^ a b c NIH HMP Working Group; Peterson, Jane; Garges, Susan; Giovanni, Maria; McInnes, Pamela; Wang, Lu; Schloss, Jeffery A.; Bonazzi, Vivien et al. (2009-12). “The NIH Human Microbiome Project”. Genome Research 19 (12): 2317-2323. doi:10.1101/gr.096651.109. ISSN 1549-5469. PMC 2792171. PMID 19819907.
- ^ Qin, Junjie; Li, Ruiqiang; Raes, Jeroen; Arumugam, Manimozhiyan; Burgdorf, Kristoffer Solvsten; Manichanh, Chaysavanh; Nielsen, Trine; Pons, Nicolas et al. (2010-03). “A human gut microbial gene catalogue established by metagenomic sequencing” (英語). Nature 464 (7285): 59-65. doi:10.1038/nature08821. ISSN 1476-4687.
- ^ Costello, Elizabeth K.; Lauber, Christian L.; Hamady, Micah; Fierer, Noah; Gordon, Jeffrey I.; Knight, Rob (2009-12-18). “Bacterial Community Variation in Human Body Habitats Across Space and Time” (英語). Science 326 (5960): 1694-1697. doi:10.1126/science.1177486. ISSN 0036-8075. PMID 19892944.
- ^ a b The Human Microbiome Project Consortium (2012-06). “Structure, function and diversity of the healthy human microbiome” (英語). Nature 486 (7402): 207-214. doi:10.1038/nature11234. ISSN 0028-0836. PMC PMC3564958. PMID 22699609.
- ^ Arumugam, Manimozhiyan; Raes, Jeroen; Pelletier, Eric; Le Paslier, Denis; Yamada, Takuji; Mende, Daniel R.; Fernandes, Gabriel R.; Tap, Julien et al. (2011-05-12). “Enterotypes of the human gut microbiome”. Nature 473 (7346): 174-180. doi:10.1038/nature09944. ISSN 1476-4687. PMC 3728647. PMID 21508958.
- ^ 安藤朗『新たな臓器としての腸内細菌叢』一般財団法人 日本消化器病学会、2015年。doi:10.11405/nisshoshi.112.1939。2020年8月2日閲覧。
- ^ Qin, Junjie; Li, Yingrui; Cai, Zhiming; Li, Shenghui; Zhu, Jianfeng; Zhang, Fan; Liang, Suisha; Zhang, Wenwei et al. (2012-10). “A metagenome-wide association study of gut microbiota in type 2 diabetes” (英語). Nature 490 (7418): 55-60. doi:10.1038/nature11450. ISSN 1476-4687.
- ^ Larsen, Nadja; Vogensen, Finn K.; Berg, Frans W. J. van den; Nielsen, Dennis Sandris; Andreasen, Anne Sofie; Pedersen, Bente K.; Al-Soud, Waleed Abu; Sørensen, Søren J. et al. (2010-02-05). “Gut Microbiota in Human Adults with Type 2 Diabetes Differs from Non-Diabetic Adults” (英語). PLOS ONE 5 (2): e9085. doi:10.1371/journal.pone.0009085. ISSN 1932-6203. PMC PMC2816710. PMID 20140211.
- ^ Ussar, Siegfried; Griffin, Nicholas W.; Bezy, Olivier; Fujisaka, Shiho; Vienberg, Sara; Softic, Samir; Deng, Luxue; Bry, Lynn et al. (2015-09-01). “Interactions between Gut Microbiota, Host Genetics and Diet Modulate the Predisposition to Obesity and Metabolic Syndrome”. Cell Metabolism 22 (3): 516-530. doi:10.1016/j.cmet.2015.07.007. ISSN 1932-7420. PMC 4570502. PMID 26299453.
- ^ Rook, G. a. W.; Brunet, L. R. (2005-03). “Microbes, immunoregulation, and the gut”. Gut 54 (3): 317-320. doi:10.1136/gut.2004.053785. ISSN 0017-5749. PMC 1774411. PMID 15710972.
- ^ Lane, Erin R.; Zisman, Timothy L.; Suskind, David L. (2017). “The microbiota in inflammatory bowel disease: current and therapeutic insights”. Journal of Inflammation Research 10: 63-73. doi:10.2147/JIR.S116088. ISSN 1178-7031. PMC 5473501. PMID 28652796.
- ^ a b c Kilian, M.; Chapple, I. L. C.; Hannig, M.; Marsh, P. D.; Meuric, V.; Pedersen, A. M. L.; Tonetti, M. S.; Wade, W. G. et al. (2016-11). “The oral microbiome - an update for oral healthcare professionals” (英語). British Dental Journal 221 (10): 657-666. doi:10.1038/sj.bdj.2016.865. ISSN 1476-5373.
- ^ a b Krishnan, K; Chen, T; Paster, Bj (2017-04). “A practical guide to the oral microbiome and its relation to health and disease” (英語). Oral Diseases 23 (3): 276-286. doi:10.1111/odi.12509. PMC PMC5122475. PMID 27219464.
- ^ NISC Comparative Sequencing Program; Oh, Julia; Byrd, Allyson L.; Deming, Clay; Conlan, Sean; Kong, Heidi H.; Segre, Julia A. (2014-10). “Biogeography and individuality shape function in the human skin metagenome” (英語). Nature 514 (7520): 59-64. doi:10.1038/nature13786. ISSN 0028-0836. PMC PMC4185404. PMID 25279917.
- ^ Ma, Bing; Forney, Larry J.; Ravel, Jacques (2012). “Vaginal microbiome: rethinking health and disease”. Annual Review of Microbiology 66: 371-389. doi:10.1146/annurev-micro-092611-150157. ISSN 1545-3251. PMC 3780402. PMID 22746335.
- ^ Kaambo, Evelyn; Africa, Charlene; Chambuso, Ramadhani; Passmore, Jo-Ann Shelley (2018). “Vaginal Microbiomes Associated With Aerobic Vaginitis and Bacterial Vaginosis” (English). Frontiers in Public Health 6. doi:10.3389/fpubh.2018.00078. ISSN 2296-2565.
- ^ Dominguez-Bello, Maria G.; Costello, Elizabeth K.; Contreras, Monica; Magris, Magda; Hidalgo, Glida; Fierer, Noah; Knight, Rob (2010-06-29). “Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns” (英語). Proceedings of the National Academy of Sciences 107 (26): 11971-11975. doi:10.1073/pnas.1002601107. ISSN 0027-8424. PMID 20566857.
- ^ a b c Tamburini, Sabrina; Shen, Nan; Wu, Han Chih; Clemente, Jose C (2016-07). “The microbiome in early life: implications for health outcomes” (英語). Nature Medicine 22 (7): 713-722. doi:10.1038/nm.4142. ISSN 1078-8956.
- ^ Perez-Muñoz, Maria Elisa; Arrieta, Marie-Claire; Ramer-Tait, Amanda E.; Walter, Jens (2017-04-28). “A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome” (英語). Microbiome 5 (1): 48. doi:10.1186/s40168-017-0268-4. ISSN 2049-2618. PMC PMC5410102. PMID 28454555.
- ^ de Goffau, Marcus C.; Lager, Susanne; Sovio, Ulla; Gaccioli, Francesca; Cook, Emma; Peacock, Sharon J.; Parkhill, Julian; Charnock-Jones, D. Stephen et al. (2019-07-10). “Human placenta has no microbiome but can harbour potential pathogens”. Nature 572 (7769): 329-334. doi:10.1038/s41586-019-1451-5. ISSN 0028-0836. PMC 6697540. PMID 31367035.
- ^ Ezenwa, V. O.; Gerardo, N. M.; Inouye, D. W.; Medina, M.; Xavier, J. B. (2012-10-12). “Animal Behavior and the Microbiome” (英語). Science 338 (6104): 198-199. doi:10.1126/science.1227412. ISSN 0036-8075.
- ^ Hammer, Tobin J.; Sanders, Jon G.; Fierer, Noah (2019-05-01). “Not all animals need a microbiome” (英語). FEMS Microbiology Letters 366 (10). doi:10.1093/femsle/fnz117. ISSN 0378-1097.
- ^ a b Karasov, William H.; Douglas, Angela E. (2013-4). “Comparative Digestive Physiology”. Comprehensive Physiology 3 (2): 741-783. doi:10.1002/cphy.c110054. ISSN 2040-4603. PMC 4458075. PMID 23720328.
- ^ Myer, Phillip R. (2019-06-25). “Bovine Genome-Microbiome Interactions: Metagenomic Frontier for the Selection of Efficient Productivity in Cattle Systems” (英語). mSystems 4 (3). doi:10.1128/mSystems.00103-19. ISSN 2379-5077. PMID 31219789.
- ^ Hassani, M.A., Durán, P. and Hacquard, S. (2018) "Microbial interactions within the plant holobiont". Microbiome, 6(1): 58. doi:10.1186/s40168-018-0445-0.
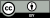 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ^ Berlec, Aleš (2012-09-01). “Novel techniques and findings in the study of plant microbiota: Search for plant probiotics”. Plant Science 193-194: 96-102. doi:10.1016/j.plantsci.2012.05.010. PMID 22794922.
- ^ Whipps, J.m.; Hand, P.; Pink, D.; Bending, G.d. (2008-12-01). “Phyllosphere microbiology with special reference to diversity and plant genotype” (英語). Journal of Applied Microbiology 105 (6): 1744-1755. doi:10.1111/j.1365-2672.2008.03906.x. ISSN 1365-2672. PMID 19120625.
- ^ “Four hundred-million-year-old vesicular arbuscular mycorrhizae”. Proc. Natl. Acad. Sci. USA 91 (25): 11841-3. (1994). Bibcode: 1994PNAS...9111841R. doi:10.1073/pnas.91.25.11841. PMC 45331. PMID 11607500.
- ^ “Common themes in nutrient acquisition by plant symbiotic microbes, described by the Gene Ontology”. BMC Microbiology 9(Suppl 1): S6. (2009). doi:10.1186/1471-2180-9-S1-S6. PMC 2654666. PMID 19278554.
- ^ Kloepper, J. W (1993). “Plant growth-promoting rhizobacteria as biological control agents”. In Metting, F. B. Jr. Soil microbial ecology: applications in agricultural and environmental management. New York: Marcel Dekker Inc. pp. 255-274. ISBN 978-0-8247-8737-0
- ^ Bloemberg, G. V.; Lugtenberg, B. J. J. (2001). “Molecular basis of plant growth promotion and biocontrol by rhizobacteria”. Current Opinion in Plant Biology 4 (4): 343-350. doi:10.1016/S1369-5266(00)00183-7. PMID 11418345.
- ^ “Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects”. Appl Environ Microbiol 71 (9): 4951-9. (2005). doi:10.1128/AEM.71.9.4951-4959.2005. PMC 1214602. PMID 16151072.
- ^ 百町満朗「生物防除研究の現状と展望」『日本植物病理學會報』第79巻第3号、日本植物病理學會、2013年8月、123-127頁、doi:10.3186/jjphytopath.79.123、ISSN 00319473、NAID 10031191400。
- ^ Bar-On, Yinon M.; Phillips, Rob; Milo, Ron (2018-05-21). “The biomass distribution on Earth” (英語). Proceedings of the National Academy of Sciences 115 (25): 6506-6511. doi:10.1073/pnas.1711842115. ISSN 0027-8424.
- ^ Fierer, Noah (2017-10). “Embracing the unknown: disentangling the complexities of the soil microbiome” (英語). Nature Reviews Microbiology 15 (10): 579-590. doi:10.1038/nrmicro.2017.87. ISSN 1740-1526.
- ^ Gilbert, Jack A.; Stephens, Brent (2018-11). “Microbiology of the built environment” (英語). Nature Reviews Microbiology 16 (11): 661-670. doi:10.1038/s41579-018-0065-5. ISSN 1740-1526.
- ^ Afshinnekoo, Ebrahim; Meydan, Cem; Chowdhury, Shanin; Jaroudi, Dyala; Boyer, Collin; Bernstein, Nick; Maritz, Julia M.; Reeves, Darryl et al. (2015-07-29). “Geospatial Resolution of Human and Bacterial Diversity with City-Scale Metagenomics” (英語). Cell Systems 1 (1): 72-87. doi:10.1016/j.cels.2015.01.001. ISSN 2405-4712.
- ^ Filippis, Francesca De; Parente, Eugenio; Ercolini, Danilo (2017). “Metagenomics insights into food fermentations” (英語). Microbial Biotechnology 10 (1): 91-102. doi:10.1111/1751-7915.12421. ISSN 1751-7915. PMC PMC5270737. PMID 27709807.
- ^ a b c Cao, Yu; Fanning, Séamus; Proos, Sinéad; Jordan, Kieran; Srikumar, Shabarinath (2017-09-21). “A Review on the Applications of Next Generation Sequencing Technologies as Applied to Food-Related Microbiome Studies”. Frontiers in Microbiology 8: 1829. doi:10.3389/fmicb.2017.01829. ISSN 1664-302X. PMC PMC5627019. PMID 29033905.
- ^ a b c Amann, R I; Ludwig, W; Schleifer, K H (1995-03). “Phylogenetic identification and in situ detection of individual microbial cells without cultivation.”. Microbiological Reviews 59 (1): 143-169. ISSN 0146-0749. PMC PMC239358. PMID 7535888.
- ^ SAKUDA, SHOHEI (2002). Kagaku To Seibutsu 40 (9): 600-605. doi:10.1271/kagakutoseibutsu1962.40.600. ISSN 0453-073X. https://doi.org/10.1271/kagakutoseibutsu1962.40.600.
- ^ 平山 和宏 (2014). “シリーズ 腸内細菌叢 1 腸内細菌叢の基礎”. モダンメディア 60.
- ^ Woese, Carl R.; Fox, George E. (1977-11-01). “Phylogenetic structure of the prokaryotic domain: The primary kingdoms” (英語). Proceedings of the National Academy of Sciences 74 (11): 5088-5090. doi:10.1073/pnas.74.11.5088. ISSN 0027-8424. PMC PMC432104. PMID 270744.
- ^ Giovannoni, Stephen J.; Britschgi, Theresa B.; Moyer, Craig L.; Field, Katharine G. (1990-05). “Genetic diversity in Sargasso Sea bacterioplankton” (英語). Nature 345 (6270): 60-63. doi:10.1038/345060a0. ISSN 0028-0836.
- ^ a b YAMADA, Takuji (2013). “Human Gut Metagenomic Analysis toward Clinical Studies”. KAGAKU TO SEIBUTSU 51 (12): 802-808. doi:10.1271/kagakutoseibutsu.51.802. ISSN 0453-073X.
- ^ Gill, S. R.; Pop, M.; DeBoy, R. T.; Eckburg, P. B.; Turnbaugh, P. J.; Samuel, B. S.; Gordon, J. I.; Relman, D. A. et al. (2006-06-02). “Metagenomic Analysis of the Human Distal Gut Microbiome” (英語). Science 312 (5778): 1355-1359. doi:10.1126/science.1124234. ISSN 0036-8075. PMC PMC3027896. PMID 16741115.
- ^ Zhernakova, Alexandra; Kurilshikov, Alexander; Bonder, Marc Jan; Tigchelaar, Ettje F.; Schirmer, Melanie; Vatanen, Tommi; Mujagic, Zlatan; Vila, Arnau Vich et al. (2016-04-29). “Population-based metagenomics analysis reveals markers for gut microbiome composition and diversity” (英語). Science 352 (6285): 565-569. doi:10.1126/science.aad3369. ISSN 0036-8075. PMC PMC5240844. PMID 27126040.
