「第1族元素」の版間の差分
Luckas-bot (会話 | 投稿記録) m r2.7.1) (ロボットによる 追加: an:Metal alcalín |
m 外部リンクの修正 http:// -> https:// (www.mindat.org) (Botによる編集) |
||
| (40人の利用者による、間の63版が非表示) | |||
| 28行目: | 28行目: | ||
|} |
|} |
||
'''第1族元素'''(だいいちぞくげんそ)とは、[[周期表]]において第1族に属する[[元素]]。[[水素]]・[[リチウム]]・[[ナトリウム]]・[[カリウム]]・[[ルビジウム]]・[[セシウム]]・[[フランシウム]]が |
'''第1族元素'''(だいいちぞくげんそ)とは、[[周期表]]において第1族に属する[[元素]]。[[水素]]・[[リチウム]]・[[ナトリウム]]・[[カリウム]]・[[ルビジウム]]・[[セシウム]]・[[フランシウム]]が属する。周期表の一番左側に位置する元素群で、[[価電子]]は[[最外殻]]のs軌道にある[[電子]]である。s軌道は1電子のみが占有する。 |
||
水素を除いた第1族元素は'''アルカリ金属'''と総称されており、[[常温]]で水と激しく反応する[[金属]]で、その水酸化物が[[強アルカリ]]性を示す、という共通特性がある<ref>コトバンク「[https://kotobank.jp/word/%E3%82%A2%E3%83%AB%E3%82%AB%E3%83%AA%E9%87%91%E5%B1%9E-28165 アルカリ金属]」の解説より</ref>。本項ではこのアルカリ金属を中心に記述し、水素に関しては[[水素|個別記事]]にて詳しく述べる。 |
|||
[[周期表]]の一番左側に位置する[[元素]]群で、[[価電子]]は[[最外殻]]のs軌道にある[[電子]]である。s軌道は1電子のみが占有する。 |
|||
==アルカリ金属== |
==アルカリ金属== |
||
第1族元素に属する元素の多くは、歴史的に物質的性質に基づく古い分類名称である「アルカリ金属」と呼ばれている。 |
|||
第1族元素の中において、元素の持つ化学的性質の共通部分について与えられた名称がアルカリ金属である。言い換えると周期表の族は[[電子構造]]の共通性に着目した区分であるため(他の元素族でも同様であるが)同じ族の元素であっても完全な共通性が存在するわけではない。[[典型元素]]の単体においては周期が小さいほど共有結合性が強く、周期が大きいほど金属結合性が強い。この典型元素の性質は第1族元素においては水素のみが共有結合性を示し他は金属結合性を示すといったあらわれ方をしている<ref>水素も「超高圧下では高温でも固体となり、金属的な物性を示す」と理論的には示されているように、金属であるか非金属であるかは、元素の性質だけでなく物質の構造にも依存する。</ref>。 |
|||
物質元素の[[単体]]を探索する過程で金属としての性質が共通に見出されたもののうち、その後の分類の着目点に化学的性質が加わり、他元素と結合しやすい化学的性質をもつものから「アルカリ金属」が分類された。さらに[[電子構造]]の違いによる族の分類で、第1族元素に分類する過程で水素にもアルカリ金属との共通性が見出された。一方で、[[典型元素]]の単体においては周期が小さいほど共有結合性が強く、周期が大きいほど金属結合性が強くなる傾向があるが、第1族元素では水素のみが共有結合を示すという顕著な違いがある。ただし、周期表の理解においてここまでの厳密な分類は必要ではなく、共通性の存在と歴史的背景から第1族元素とアルカリ金属が同列に扱われることがある。 |
|||
第1族元素に属する元素の多くが化学的性質に基づく分類である「アルカリ金属」に属する為、第1族元素をアルカリ金属と言い換えることはかなり歴史的にも古くからおこなわれてきた。その為、広義には第1族元素とアルカリ金属とは同等とみなされることが多い。しかし、分類の着目点が電子構造の違いか代表的な化学的共通性質かという違いがあるため、厳密には第1族元素の区分とアルカリ金属の区分とは合致しない。とは言え水素とアルカリ金属とで共通の化学的性質や物理的性質が存在し、全く別の集団であるということでもない。 |
|||
400-500 [[パスカル (単位)#倍量・分量単位|GPa]] という非常な高圧下では水素も金属の性質を持つという理論があり、[[天文物理学]]の観測では[[土星]]や[[木星]]には[[重力]]による[[縮退]]で[[相転移]]を起こした[[金属水素]]が大量に存在する可能性が示唆されている。地球においても高圧実験によりその存在を確かめようとする努力が続けられているが、いまだ確認に至っていない。これまで研究では金属水素は電子の[[バンドギャップ]]が非常に小さいものの完全にはゼロにならない可能性が報告され、[[伝導電子]]にはわずかな制約が生じ完全なアルカリ金属にはならないとされている。 |
|||
===歴史=== |
|||
[[File:Petalite.jpg|thumb|200px|alt=A sample of petalite|[[ペタライト]]、リチウムが最初に |
|||
単離されたリチウム鉱物]] |
|||
ナトリウムの化合物は古代から知られていた。一般に塩と呼ばれる[[塩化ナトリウム]]は人間の活動において重要な物であり、給料すなわちサラリーの語源はラテン語の「サラリウム(salarium)」で「塩のお金」を意味し、ローマ帝国では兵士に給金として塩が支給されていたという<ref>MSNニュース「[https://www.msn.com/ja-jp/money/news/%E3%83%9B%E3%83%B3%E3%83%88%E3%81%AB%E4%BD%BF%E3%82%8F%E3%82%8C%E3%81%A6%E3%81%84%E3%81%9F%E3%80%81%E4%B8%96%E3%81%AB%E3%82%82%E5%A5%87%E5%A6%99%E3%81%AA%E4%B8%96%E7%95%8C%E3%81%AE%E3%80%8C%E9%80%9A%E8%B2%A8%E3%80%8D8%E9%81%B8/ar-AAluCLT#page=1 ホントに使われていた、世にも奇妙な世界の「通貨」8選]」2016年12月16日</ref>。 |
|||
カリウムも古代から使用されていたが、ナトリウム塩と根本的に別の物質だとは近世まで理解されていなかった。1702年に[[ゲオルク・シュタール]]がナトリウム塩とカリウム塩の根本的な違いを示唆する実験的証拠を得て<ref name="1702Suspect">{{cite book|language = de |url= https://books.google.com/books?id=b-ATAAAAQAAJ&pg=PA167 |page= 167|title= Chymische Schriften|last1= Marggraf|first= Andreas Siegmund |year= 1761}}</ref>、1736年に[[アンリ=ルイ・デュアメル・デュ・モンソー]]がこの違いの証明に成功した<ref>{{cite journal |url= http://gallica.bnf.fr/ark:/12148/bpt6k3533j/f73.image.r=Memoires%20de%20l%27Academie%20royale%20des%20Sciences.langEN |journal= Mémoires de l'Académie Royale des Sciences |title= Sur la Base de Sel Marine |last= du Monceau|first= H. L. D. |pages= 65-68 |language= fr}}</ref>。当時は、カリウム化合物とナトリウム化合物の正確な化学組成も、元素としてのカリウムとナトリウムの正確な場所も分からなかったため、[[アントワーヌ・ラヴォアジエ]]はどちらも1789年の元素表に組み入れなかった<ref name="weeks">{{cite journal |doi= 10.1021/ed009p1035|title= The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium |year= 1932|last1= Weeks|first1= Mary Elvira|author-link1=Mary Elvira Weeks|journal= Journal of Chemical Education|volume= 9|issue= 6|page= 1035|bibcode= 1932JChEd...9.1035W}}</ref><ref name="disco">{{cite journal |jstor= 228541|pages= 247-258|last1= Siegfried|first1= R.|title= The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements|volume= 54|issue= 2|journal= Isis|year= 1963|doi= 10.1086/349704|pmid= 14147904|s2cid= 38152048}}</ref>。 |
|||
単体のカリウムは、1807年にイギリスで[[ハンフリー・デービー]]によって最初に単離されており、彼は[[ボルタ電池]]による溶融塩の電気分解を活用して[[水酸化カリウム]](KOH)から単離した。それ以前の塩類水溶液の電気分解はカリウムの極端な反応性のため失敗しており<!-- <ref name="Greenwood&Earnshaw" />{{rp|68}}--> 、カリウムは電気分解で単離された最初の金属となった<ref name=Enghag2004>{{cite book |last=Enghag|first=P.|year=2004|title=Encyclopedia of the elements|publisher=Wiley-VCH Weinheim|isbn=978-3-527-30666-4|chapter=11. Sodium and Potassium}}</ref>。同年後半、デービーは同じ技法で[[水酸化ナトリウム]](NaOH)からのナトリウム抽出を報告し、これらの元素が異なることを証明した<ref name="weeks" /><ref name="disco" /><ref name=Davy1807>{{cite journal |first=Humphry|last=Davy|title=On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies|pages=1-44|year=1808|volume=98|journal=Philosophical Transactions of the Royal Society of London|url=https://books.google.com/books?id=gpwEAAAAYAAJ&pg=PA57|doi=10.1098/rstl.1808.0001|doi-access=free}}</ref><ref name="200disco">{{cite journal |doi= 10.1134/S1061934807110160|title= History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)|year= 2007|last1= Shaposhnik|first1= V. A.|journal= Journal of Analytical Chemistry|volume= 62|issue= 11|pages= 1100-1102|s2cid= 96141217}}</ref>。 |
|||
[[File:Johann Wolfgang Döbereiner.jpg|thumb|upright|[[ヨハン・デーベライナー]]は、現在アルカリ金属と通称される物質間の類似点に最初に気付いた人物の1人]] |
|||
[[ペタライト]](LiAlSi<sub>4</sub>O <sub>10</sub>)は、1800年にブラジル人化学者[[ジョゼ・ボニファチオ・デ・アンドラダ]]によってスウェーデンの鉱山で発見された<ref name=mindat>{{cite web |url=https://www.mindat.org/min-3171.html |title=Petalite: Petalite mineral information and data |last1=Ralph |first1=Jolyon |last2=Chau |first2=Ida |date=24 August 2011 |access-date=27 November 2011}}</ref><ref name=webelementshistory>{{cite web |url=http://www.webelements.com/lithium/history.html|title=WebElements Periodic Table of the Elements {{pipe}} Lithium {{pipe}} historical information |last=Winter |first=Mark |access-date=27 November 2011}}</ref><ref name=discovery>{{cite book |title=Discovery of the Elements |last=Weeks |first=Mary|year=2003 |page=124 |publisher=Kessinger Publishing |location=Whitefish, Montana, United States |isbn=978-0-7661-3872-8 |url=https://books.google.com/books?id=SJIk9BPdNWcC|access-date=10 August 2009}}</ref>ただし、[[ヨアン・オーガスト・アルフェドソン]]<!-- (当時は化学者[[イェンス・ベルセリウス]]の研究室で働いていた)-->がペタライト鉱石の分析で新元素の存在を検出したのは1817年だった<ref name=uwis>{{cite web |url=http://genchem.chem.wisc.edu/lab/PTL/PTL/BIOS/arfwdson.htm |archive-url=https://web.archive.org/web/20080605152857/http://genchem.chem.wisc.edu/lab/PTL/PTL/BIOS/arfwdson.htm |archive-date=5 June 2008 |title=Johan Arfwedson |access-date=10 August 2009}}</ref><ref name=vanderkrogt>{{cite web |publisher= Elementymology & Elements Multidict|title= Lithium |first= Peter|last= van der Krogt|url= http://elements.vanderkrogt.net/element.php?sym=Li|access-date= 5 October 2010}}</ref>。この新元素がナトリウムやカリウムと同様の化合物を形成することに彼は注目し、その[[炭酸塩]]と[[水酸化物]]は他のアルカリ金属よりも水溶性が小さくアルカリ性が強かった<ref name=compounds>{{cite web |url=http://www.chemguide.co.uk/inorganic/group1/compounds.html|title=Compounds of the Group 1 Elements |access-date=10 August 2009 |last=Clark |first=Jim |year=2005 |work=chemguide}}</ref>。植物の灰から発見されたカリウムや、動物の血液中に豊富に含まれていることで知られていたナトリウムとは対照的に、固体で発見されたことを考慮して、[[イェンス・ベルセリウス]]は「石」という意味のギリシャ語λιθoςからこの未知の素材を「lithion/lithina」と命名、同素材の中にある金属を「リチウム」と名付けた<ref name=krebs>{{cite book |last= Krebs|first= Robert E.|year= 2006|title= The History and Use of Our Earth's Chemical Elements: A Reference Guide|publisher= Greenwood Press|location= Westport, Conn.|isbn= 978-0-313-33438-2}}</ref><ref name=webelementshistory /><ref name=vanderkrogt />。リチウム、ナトリウム、カリウムは、1850年に[[ヨハン・デーベライナー]]が同様の特性を持つと同族元素の三組にあたると指摘、これが周期性の(部分的な)発見となった<ref name="meta-synthesis2">{{cite web |url=http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?Button=pre-1900+Formulations |title=The Internet Database of Periodic Tables |last=Leach|first=Mark R. |date=1999–2012 |work=meta-synthesis.com |access-date=6 April 2012}}</ref>。 |
|||
[[File:Lepidolite-76774.jpg|thumb|upright|alt=A sample of lepidolite|[[レピドライト]]、 ルビジウムが最初に単離されたルビジウム鉱物]] |
|||
[[ロベルト・ブンゼン]]と[[グスタフ・キルヒホフ]]が1859年に発明した[[分光器]]を使って、初めて発見された元素がルビジウムとセシウムである<ref name="caesium">{{cite web |url=http://pubs.acs.org/cen/80th/print/cesium.html |title=C&EN: It's Elemental: The Periodic Table - Cesium |publisher=American Chemical Society|access-date=25 February 2010|last=Kaner|first=Richard|year= 2003}}</ref>。彼らが翌1860年に、ドイツの[[鉱泉水]]からセシウムを発見した。その翌年には、ドイツのハイデルベルクで鉱物[[レピドライト]]の中からルビジウムが発見された<ref name="BuKi1861">{{cite journal |title= Chemische Analyse durch Spectralbeobachtungen |pages= 337-381 |first1= G.|last1= Kirchhoff |first2= R.|last2= Bunsen|author-link1= Gustav Kirchhoff |author-link2 = Robert Bunsen|doi= 10.1002/andp.18611890702 |journal= Annalen der Physik und Chemie |volume= 189 |issue= 7|year= 1861 |bibcode=1861AnP...189..337K|url= http://archiv.ub.uni-heidelberg.de/volltextserver/15657/1/spektral.pdf |archive-url=https://ghostarchive.org/archive/20221009/http://archiv.ub.uni-heidelberg.de/volltextserver/15657/1/spektral.pdf |archive-date=2022-10-09 |url-status=live }}</ref>。ルビジウムおよびセシウムという命名は、それぞれ[[放出スペクトル]]の最も顕著な線にちなんだもので、ルビジウムは鮮やかな赤の線(ラテン語rubidus、濃い赤または明るい赤の意)、そしてセシウムは空色の線(ラテン語caesius、空色の意)である<ref name="Weeks">{{cite journal |title= The discovery of the elements. XIII. Some spectroscopic discoveries |pages= 1413?1434|last= Weeks|first= Mary Elvira |author-link=Mary Elvira Weeks|doi=10.1021/ed009p1413|journal= [[Journal of Chemical Education]] |volume= 9 |issue= 8 |year= 1932 |bibcode=1932JChEd...9.1413W}}</ref><ref>{{Cite OED|caesium|edition = 2nd}}</ref>。 |
|||
1865年頃、[[ジョン・ニューランズ]]は一連の論文を書き上げ、そこで彼は複数の元素を原子量増加順に並べ、8つ間隔で繰り返される同様の物理的・化学的特性を一覧にした。彼はその周期性を、8つ離れた音符が同様の音階機能を有する音楽の[[オクターヴ]]に例えた<ref>{{cite journal |title= On Relations Among the Equivalents |last=Newlands|first=John A. R. |journal= Chemical News |volume= 10 |pages= 94?95 |date= 20 August 1864 |url=http://web.lemoyne.edu/~GIUNTA/EA/NEWLANDSann.HTML |url-status=live |archive-url=https://web.archive.org/web/20110101073248/http://web.lemoyne.edu/~GIUNTA/EA/NEWLANDSann.HTML |archive-date=1 January 2011 |access-date=25 November 2013}}</ref><ref>{{cite journal |title= On the Law of Octaves |last=Newlands|first=John A. R. |journal= Chemical News |volume= 12 |page= 83 |date= 18 August 1865 |url=http://web.lemoyne.edu/~GIUNTA/EA/NEWLANDSann.HTML |url-status=live |archive-url=https://web.archive.org/web/20110101073248/http://web.lemoyne.edu/~GIUNTA/EA/NEWLANDSann.HTML |archive-date=1 January 2011 |access-date=25 November 2013}}</ref>。彼の表では、当時知られている全てのアルカリ金属(リチウムからセシウム)のほか、[[銅]]と[[銀]]と[[タリウム]]が1つの族にまとめらていれた。また彼の表では、水素を[[ハロゲン]](第17族元素)と一緒に置いていた<ref name="meta-synthesis2" />。 |
|||
[[File:Mendelejevs periodiska system 1871.png|thumb|upright=1|1871年に提唱された[[ドミトリ・メンデレーエフ]]の周期体系では、水素とアルカリ金属が第1族元素に置かれ、一緒に銅、銀、金も置かれていた。]] |
|||
1869年以降に[[ドミトリ・メンデレーエフ]]は、ナトリウム、カリウム、ルビジウム、セシウム、タリウムを含む族の一番上にリチウムを配置する周期表を提唱した<ref>{{cite journal |last=Mendelejew |first=Dimitri |year=1869 |title=Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente |journal=Zeitschrift für Chemie |pages=405-406 |language=de}}</ref>。2年後に彼は自分の表を改訂し、水素をリチウムの上の第1族に配置し、タリウムを[[第13族元素|ホウ素族]]に移した。この1871年版では、銅と銀と金が2か所に配置されており、1か所はIB族(現:[[第11族元素]])に、もう1か所はVIII族(現:[[第8族元素]]から第11族までを含む)に配置されていた<ref name="Jensen">{{cite journal |last1=Jensen |first1=William B.|author1-link=William B. Jensen |year=2003 |title=The Place of Zinc, Cadmium, and Mercury in the Periodic Table |journal=Journal of Chemical Education |volume=80 |issue=8 |pages=952-961 |publisher=[[American Chemical Society]] |doi=10.1021/ed080p952 |bibcode=2003JChEd..80..952J |url=http://www.che.uc.edu/jensen/W.%20B.%20Jensen/Reprints/091.%20Zn-Cd-Hg.pdf |access-date=2012-05-06 |url-status=dead |archive-url=https://web.archive.org/web/20100611152417/http://www.che.uc.edu/jensen/W.%20B.%20Jensen/Reprints/091.%20Zn-Cd-Hg.pdf |archive-date=11 June 2010}}</ref>。18列からなる周期表の導入後、IB族元素は現在の[[Dブロック元素]]の位置に移動し、アルカリ金属はIA族に残った。後の1988年に、この族の名が「第1族」に変更された。「アルカリ金属」という慣用名は、第1族元素の水酸化物が水に溶けたときに全て[[強アルカリ]]性であるという事実に由来している<ref name=rsc>{{cite web|url=http://www.rsc.org/chemsoc/visualelements/PAGES/data/intro_groupi_data.html |title=Visual Elements: Group 1 – The Alkali Metals |author=Royal Society of Chemistry |work=Visual Elements |publisher=Royal Society of Chemistry |access-date=13 January 2012 |url-status=dead |archive-url=https://web.archive.org/web/20120805145647/http://www.rsc.org/chemsoc/visualelements/PAGES/data/intro_groupi_data.html |archive-date=5 August 2012 |author-link=Royal Society of Chemistry }}</ref>。 |
|||
1939年に[[キュリー研究所 (パリ)]]の[[マルグリット・ペレー]]が[[アクチニウム]]227<!-- (これが220keVの崩壊エネルギーを持つと報告された)-->のサンプルを精製することでフランシウムを発見したが、その前に少なくとも4つの誤った発見や不完全な発見があった<ref name="fontani">{{cite conference |first= Marco |last= Fontani |title= The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do) |book-title= International Conference on the History of Chemistry |pages= 18 |date= 10 September 2005 |location= Lisbon|url= http://5ichc-portugal.ulusofona.pt/uploads/PaperLong-MarcoFontani.doc |archive-url= https://web.archive.org/web/20060224090117/http://5ichc-portugal.ulusofona.pt/uploads/PaperLong-MarcoFontani.doc |archive-date=24 February 2006|access-date= 8 April 2007}}</ref><ref>{{cite news |title= Education: Alabamine & Virginium|magazine=[[Time (magazine)|Time]] |date= 15 February 1932|url= http://www.time.com/time/magazine/article/0,9171,743159,00.html |archive-url= https://web.archive.org/web/20070930015028/http://www.time.com/time/magazine/article/0,9171,743159,00.html |url-status= dead |archive-date= 30 September 2007 |access-date= 1 April 2007|url-access=subscription }}</ref><ref>{{cite journal |last= MacPherson |first= H. G. |title= An Investigation of the Magneto-Optic Method of Chemical Analysis |journal= Physical Review |volume= 47 |issue= 4 |pages= 310-315 |publisher= American Physical Society|year=1934|doi= 10.1103/PhysRev.47.310|bibcode= 1935PhRv...47..310M}}</ref>。彼女は80keV未満のエネルギー準位の崩壊素粒子に着目。この崩壊活動がまだ未特定な崩壊生成物<!--(精製中に分離されたが、純粋なアクチニウム227から再び生じたもの)-->によって引き起こされた可能性がある、とペレーは考察した。様々な試験により、その未知の元素が<!--トリウム、ラジウム、鉛、ビスマス、またはタリウムである可能性が排除された。その新しい生成物は-->アルカリ金属の化学的性質(セシウム塩との共沈など)を示したことで、ペレーはそれをアクチニウム227の[[アルファ崩壊]]によって引き起こされた元素番号87の元素だと確信した<ref name="chemeducator">Adloff, Jean-Pierre; Kaufman, George B. (25 September 2005). [http://chemeducator.org/sbibs/s0010005/spapers/1050387gk.htm Francium (Atomic Number 87), the Last Discovered Natural Element] {{webarchive |url=https://web.archive.org/web/20130604212956/http://chemeducator.org/sbibs/s0010005/spapers/1050387gk.htm |date=4 June 2013 }}. ''The Chemical Educator'' '''10''' (5). Retrieved 26 March 2007.</ref>。 |
|||
:{{nuclide|actinium|227}} {{overunderset|→|α (1.38%)|21.77 y}} '''{{nuclide|francium|223}}''' {{overunderset|→|β<sup>-</sup>|22 min}} {{nuclide|radium|223}} {{overunderset|→|α|11.4 d}}{{nuclide|radon|219}} |
|||
周期表でフランシウムの下に存在する筈だとされている第1族元素が、元素番号119の仮名[[ウンウンエンニウム]](Uue)である<ref name="Uue">{{cite book |title= The Chemistry of the Actinide and Transactinide Elements |editor1-last= Morss|editor2-first= Norman M. |editor2-last= Edelstein |editor3-last= Fuger|editor3-first= Jean |last1= Hoffman|first1= Darleane C. |last2=Lee|first2=Diana M. |last3=Pershina|first3=Valeria |chapter= Transactinides and the future elements |publisher= Springer |year= 2006 |isbn= 978-1-4020-3555-5 |location= Dordrecht, The Netherlands |edition= 3rd }}</ref>{{rp|1729-1730}}。ウンウンエンニウム合成の試みは、1985年に米カリフォルニア州の重イオン線形加速器(superHILAC)で標的の[[アインスタイニウム]]254に[[カルシウム]]48イオンを衝突させる実験が初めて行われたが、同原子は確認されなかった<!-- leading to a limiting yield of 300 nb--><ref name="link">{{cite journal |title=Search for superheavy elements using <sup>48</sup>Ca + <sup>254</sup>Es<sup>g</sup> reaction|first1=R. W. |last1=Lougheed|first2=J. H.|last2=Landrum|first3=E. K.|last3=Hulet|first4=J. F.|last4=Wild|first5=R. J.|last5=Dougan|first6=A. D.|last6=Dougan|first7=H.|last7=Gäggeler|first8=M.|last8=Schädel|first9=K. J.|last9=Moody|first10=K. E.|last10=Gregorich|last11=Seaborg|journal=Physical Review C|year=1985|pages=1760-1763|volume=32|issue=5|bibcode= 1985PhRvC..32.1760L|doi=10.1103/PhysRevC.32.1760|pmid=9953034 |first11=G.}}</ref><ref name="vanderkrogt-uue">{{cite web |publisher= Elementymology & Elements Multidict|title= Ununennium |first= Peter|last= van der Krogt|url= http://elements.vanderkrogt.net/element.php?sym=Uue|access-date= 14 February 2011}}</ref>。 |
|||
:{{nuclide|einsteinium|254|link=y}} + {{nuclide|calcium|48|link=y}} → {{overunderset||302|119}}Uue* → 原子できず<ref group="注">*(アスタリスク)は、[[励起状態]]を表す。</ref> |
|||
アインスタイニウム254(これは質量が大きく、半減期が270日と比較的長く、超重元素の製造に適している)<ref>{{cite journal |last1=Schadel|first1=M.|last2=Brüchle|first2=W.|last3=Brügger|first3=M.|last4=Gäggeler|first4=H.|last5=Moody|first5=K.|last6=Schardt|first6=D.|last7=Sümmerer|first7=K.|last8=Hulet|first8=E.|last9=Dougan|first9=A.|last10=Dougan|title=Heavy isotope production by multinucleon transfer reactions with <sup>254</sup>Es|journal=Journal of the Less Common Metals|volume=122|pages=411-417|year=1986|doi=10.1016/0022-5088(86)90435-2|first10=R. J.|last11=Landrum|first11=J. H.|last12=Lougheed|first12=R. W.|last13=Wild|first13=J. F.|last14=O'Kelley|first14=G. D.|last15=Hahn|first15=R. L.|display-authors=9|url=https://zenodo.org/record/1253958}}</ref>を実験に充分なほど製造する作業も非常に困難であることを考えると、近い将来にこの反応がウンウンエンニウム元素を生じさせる可能性は極めて低い<ref name="link" />。アインスタイニウムは自然界で発見されておらず実験室で作られるのみであり、超重元素の効率的合成に必要な量よりも少ない量しか製造されていないためである。ただし、ウンウンエンニウムが拡張周期表で最初の[[第8周期元素]]に過ぎないことを考えると、近い将来に他の反応から発見される可能性があり、実際に[[日本]]で合成の試みが現在進行中である<ref name=Enyo>{{Cite news|url=https://www.chemistryworld.com/news/hunt-for-element-119-to-begin-this-year/3007977.article|title=Hunt for element 119 set to begin|newspaper=Chemistry World|date=12 September 2017|access-date=9 January 2018}}</ref><ref>マイナビニュース「[https://news.mynavi.jp/techplus/article/20220217-2274865/ JAEAなど、原子番号119以降の元素合成のカギとなるパラメータの決定に成功]」2022年2月17日</ref>。 2022年現在、第8周期元素はまだ発見されていないが、[[中性子ドリップライン]]の不安定性から最大で元素番号128辺りまでの第8周期元素が物理的に生成できる可能性がある<ref name=EB>{{cite encyclopedia |last=Seaborg|first=G. T.|url=https://www.britannica.com/EBchecked/topic/603220/transuranium-element|title=transuranium element (chemical element)|encyclopedia=Encyclop?dia Britannica|date=c. 2006|access-date=16 March 2010}}</ref><ref name="emsley">{{cite book |last=Emsley|first=John|title=Nature's Building Blocks: An A-Z Guide to the Elements|edition=New|year=2011|publisher=Oxford University Press|location=New York, NY|isbn=978-0-19-960563-7|page=593}}</ref>。これ以上に重い第1族元素合成の試みは行われておらず、その非常に大きな元素番号のため、生成するには現時点以上に強力かつ新たな技術手法が必要になる筈だとされている<ref name="Uue" />{{rp|1737-1739}}。 |
|||
== 性質 == |
== 性質 == |
||
通常アルカリ金属に分類されるリチウム、ナトリウム、カリウム、ルビジウム、セシウムは性質が非常に似通っている。ただしリチウムは直接窒素と反応するなど、一部の物性において他のアルカリ金属元素とは異なった性質を有している<ref name=CW250/>。 |
|||
また、還元性を持ち、水素を除いてその酸化数は常に+1となる。アルカリ金属においては原子番号が上がるほど化学反応性、密度は大きくなり、融点、沸点は下がるという性質を持つ。 |
|||
第1族元素に分類されている水素は他のアルカリ金属元素とは性質が著しく異なる。この違いは[[電子配置]]の閉殻構造の有無に起因する。アルカリ金属元素の場合、一価の陽イオンが生成すると閉殻構造の寄与により非常に安定化する。一方、水素の陽イオンであるプロトンはむき出しの正電荷であるため、電子を核から引き離すための[[イオン化エネルギー]]が非常に大きく、閉殻構造が無く安定化の寄与が存在しない。このようなs電子のふるまいの違いが、水素には共有結合性を与え、アルカリ金属元素には金属性を与えることになる。 |
|||
リチウムとその他のアルカリ金属元素の違いは、リチウムのイオン半径に起因している。リチウムはイオン半径が小さいため、電荷/イオン半径比が他のアルカリ金属元素と比較して著しく大きい。そのため、反応性や化合物の性質において、1価のアルカリ金属イオンよりもむしろ、同様に電荷/イオン半径比の大きい2価のアルカリ土類金属元素である[[マグネシウム]]イオンに類似した性質を示す<ref name=CW250/>。例えば、リチウムはマグネシウムと同様、窒素と直接反応して窒化物を形成するが、他のアルカリ金属元素は窒素に対して反応しない。また、リチウムの硫酸塩は、他のアルカリ金属の硫酸塩が[[ミョウバン]]を形成するのと対照的に、ミョウバンを形成しない<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 250-251頁。</ref>。 |
|||
両者の違いは[[電子配置]]の閉殻構造の有無に起因する。アルカリ金属元素の場合、一価の陽イオンが生成すると閉殻構造の寄与により非常に安定化する。一方、水素の陽イオンであるプロトンはむき出しの正電荷である為、電子を核から引き放なす為の[[イオン化エネルギー]]が非常に大きく、閉殻構造が無いため安定化の寄与が存在しない。このs電子の振る舞いの違いが水素では共有化合物としての性質を与え、アルカリ金属元素には金属としての性質を与えている。 |
|||
第1族元素は、[[仕事関数]]が小さく、[[原子半径]]が大きいという特徴がある。 |
|||
{| class="wikitable" |
{| class="wikitable" |
||
! !! [[水素]]<br />'''<sub>1</sub>H''' !! [[リチウム]]<br />'''<sub>3</sub>Li''' !! [[ナトリウム]]<br />'''<sub>11</sub>Na''' !! [[カリウム]]<br />'''<sub>19</sub>K''' !! [[ルビジウム]]<br />'''<sub>37</sub>Rb''' !! [[セシウム]]<br />'''<sub>55</sub>Cs''' |
! !! [[水素]]<br />'''<sub>1</sub>H''' !! [[リチウム]]<br />'''<sub>3</sub>Li''' !! [[ナトリウム]]<br />'''<sub>11</sub>Na''' !! [[カリウム]]<br />'''<sub>19</sub>K''' !! [[ルビジウム]]<br />'''<sub>37</sub>Rb''' !! [[セシウム]]<br />'''<sub>55</sub>Cs''' !! [[フランシウム]]<br />'''<sub>87</sub>Fr''' |
||
|- |
|- |
||
|[[電子配置]] || 1s<sup>1</sup> || <nowiki>[He]</nowiki>2s<sup>1</sup> || <nowiki>[Ne]</nowiki>3s<sup>1</sup> || <nowiki>[Ar]</nowiki>4s<sup>1</sup> || <nowiki>[Kr]</nowiki>5s<sup>1</sup> || <nowiki>[Xe]</nowiki>6s<sup>1</sup> |
|[[電子配置]] || 1s<sup>1</sup> || <nowiki>[He]</nowiki>2s<sup>1</sup> || <nowiki>[Ne]</nowiki>3s<sup>1</sup> || <nowiki>[Ar]</nowiki>4s<sup>1</sup> || <nowiki>[Kr]</nowiki>5s<sup>1</sup> || <nowiki>[Xe]</nowiki>6s<sup>1</sup> || <nowiki>[Rn]</nowiki>7s<sup>1</sup> |
||
|- |
|- |
||
|第1イオン化エネルギー<br />(kJ·mol<sup>−1</sup>) || 1312 || 513.3 || 495.8 || 418.8 || 403.0 || 375.7 |
|第1イオン化エネルギー<br />(kJ·mol<sup>−1</sup>) || 1312 || 513.3 || 495.8 || 418.8 || 403.0 || 375.7 || 392.8 |
||
|- |
|- |
||
|電子付加エンタルピー<br />(kJ·mol<sup>−1</sup>) || − || − || − || − || 46.88 || 45.51 |
|電子付加エンタルピー<br />(kJ·mol<sup>−1</sup>) || − || − || − || − || 46.88 || 45.51 || − |
||
|- |
|- |
||
|電子親和力<br />(kJ·mol<sup>−1</sup>) || 72.77 || 59.63 || 52.87 || − || − || − |
|電子親和力<br />(kJ·mol<sup>−1</sup>) || 72.77 || 59.63 || 52.87 || − || − || − || − |
||
|- |
|- |
||
|電気陰性度<br />(Allred−Rochow) || 2.20 || 0.97 || 1.01 || 0.91 || 0.89 || 0.86 |
|電気陰性度<br />(Allred−Rochow) || 2.20 || 0.97 || 1.01 || 0.91 || 0.89 || 0.86 || − |
||
|- |
|- |
||
|イオン半径<br />(pm, M<sup>+</sup>) || −4 (2配位) || 73 (4配位)<br /> 90 (6配位) || 113 (4配位)<br /> 116 (6配位) || 152 (6配位)<br /> 165 (8配位) || 166 (6配位)<br /> 175 (8配位) || 181 (6配位)<br /> 202 (12配位) |
|イオン半径<br />(pm, M<sup>+</sup>) || −4 (2配位) || 73 (4配位)<br /> 90 (6配位) || 113 (4配位)<br /> 116 (6配位) || 152 (6配位)<br /> 165 (8配位) || 166 (6配位)<br /> 175 (8配位) || 181 (6配位)<br /> 202 (12配位) || − |
||
|- |
|- |
||
|共有結合半径<br />(pm) || 37 || 134 || 154 || 196 || 211 || 225 |
|共有結合半径<br />(pm) || 37 || 134 || 154 || 196 || 211 || 225 || 260 |
||
|- |
|- |
||
|van der Waals半径<br />(pm) || 120 || 182 || 227 || 275 || 244 || |
|van der Waals半径<br />(pm) || 120 || 182 || 227 || 275 || 244 || 343 || 348 |
||
|- |
|- |
||
|融点<br />(K) || 14.025 || 453.69 || 370.87 || 336.53 || 312.46 || 301.59 |
|融点<br />(K) || 14.025 || 453.69 || 370.87 || 336.53 || 312.46 || 301.59 || 300 |
||
|- |
|- |
||
|沸点<br />(K) || 20.268 || 1615 || 1156 || 1032 || 961 || 944 |
|沸点<br />(K) || 20.268 || 1615 || 1156 || 1032 || 961 || 944 || 950 |
||
|- |
|- |
||
|還元電位 ''E''<sup>0</sup> (V, M<sup>+</sup>/M) || 0 || −3.040 || −2.713 || −2.929 || −2.924 || −2.923 |
|還元電位 ''E''<sup>0</sup> (V, M<sup>+</sup>/M) || 0 || −3.040 || −2.713 || −2.929 || −2.924 || −2.923 || − |
||
|} |
|} |
||
== 単体金属 == |
|||
[[Image:Alkalimetalle.jpg|thumb|320px|アルカリ金属単体のサンプル]] |
|||
アルカリ金属の単体は、すべて銀色の金属光沢を放つ金属である。電気伝導性および熱伝導性は、他の金属と同様極めて良好である。しかし、それ以外の性質は、他の金属と比べて特異的である。第一に、ほとんどの金属が高い融点を持つ中で、アルカリ金属は比較的融点が低く、かつ重い元素ほど低い。セシウムは常温より少しだけ高い29℃で融解する。ナトリウムはその高い熱伝導性と低い融点(98℃)が故に、原子炉の冷却材としても用いられる。また、アルカリ金属は他の金属と比べて非常に柔らかい[[金属]]である。リチウムはナイフで切断でき、カリウムはバターのように押しつぶすことができる。さらに特異な性質として、その密度の低さがあげられる。リチウム、ナトリウム、カリウムは比重が1以下で水に浮く。特にリチウムの密度は水の半分程度で、もし反応性と柔らかさにさえ目をつぶれば、船を造るのに最適な金属であろう。 |
|||
いずれも反応性は高く、周期表の周期が大きくなるほど、結晶エネルギー(解離エンタルピー)が低減するため、激しく反応する傾向が見られる。リチウムおよびナトリウムの単体金属を得るためには、これらの[[酸化還元電位]]がいずれも非常に低い(つまり非常に還元されにくい)が、溶融塩を電気分解することで生産することができる<ref>[[#千谷1959|千谷 (1959)]] 73-75頁。</ref>。([[水溶液]]だとH<sub>2</sub>Oが分解され[[水素]]が発生する)カリウム、ルビジウム、セシウムは低融点かつ気化しやすいため単純な電気分解による生産には適しておらず、カリウムは溶融させた塩化カリウムをナトリウム蒸気と反応させることで作られ、ルビジウムおよびセシウムはそれぞれの水酸化物を金属マグネシウムや金属カルシウムによって還元させることで得られる<ref name="CW252" /><ref>[[#千谷1959|千谷 (1959)]] 74、75頁。</ref>。代表的な工業生産法には、溶融した[[塩化ナトリウム]]に[[融点降下]]剤として[[塩化カルシウム]]を加え、それを電気分解することで金属ナトリウムを得る[[ダウンズ法]]がある<ref>{{Citation| last = JAKES CLOYD DOWNS| title = ELECTROLYTIC PROCESS AND CELL, Patent 1501756| accessdate = 2011-6-2| date = 1924-07-15| url = http://www.freepatentsonline.com/1501756.pdf}}</ref>。このアルカリ金属元素の強い還元性は他にも、有機化学の分野における[[バーチ還元]] (Bürch reduction) などに利用される。 |
|||
以下では、主にアルカリ金属の性質について述べる。水素の性質については、記事 [[水素]] で詳しく述べる。 |
|||
いずれのアルカリ金属元素単体も水、あるいは空気中の酸素と反応する為に、それらを避けるために[[鉱油|ミネラルオイル]]の中に保存される。オイルを拭って放置すると自然発火することもあるので取り扱いは考慮する必要がある([[危険物#第3類|危険物3類]])。アルカリ金属の反応性の高さは原子量の大きいものほど高い傾向があるが、窒素との反応に関しては例外的にリチウムのみが直接的な反応によって[[窒化リチウム]] (Li<sub>3</sub>N)を生成する<ref name="CW250" />。[[水]]やアルコールなど[[溶媒|プロトン溶媒]]とは水素ガスを発して反応し、生成する[[水酸化物]]や金属[[アルコキシド]]などは[[強塩基]]として利用される。アルカリ金属イオンは[[ハロゲン]]イオンなど種々の[[アニオン]]と水溶性の[[塩 (化学)|塩]]を作る。これは、アルカリ金属イオンが強く水和することの寄与が大きい。これらのアルカリ金属塩の溶解性はアルカリ金属イオンの挙動に強く影響される。例えば、[[クラウンエーテル]]や[[クリプタンド]]などはアルカリ金属イオンと包摂化合物を形成し、塩は有機溶媒に可溶となることが知られている。 |
|||
==単体金属== |
|||
[[Image:Alkalimetalle.jpg|thumb|320px|アルカリ金属単体のサンプル]] |
|||
アルカリ金属は、比較的融点も低く、比較的軟らかく軽い[[金属]]である。Li、Na、Kは比重が1以下で水に浮く。いずれも反応性は高く、周期表の周期が大きくなるほど、結晶エネルギー(解離エンタルピー)が低減するため、激しく反応する傾向が見られる。また、いずれも[[酸化還元電位]]が非常に低いため、塩を還元して単体金属とするには溶融塩を電気分解することで生産される。 |
|||
水とカリウムの反応は次の式であらわされる。 |
|||
いずれのアルカリ金属元素単体も水、あるいは空気中の酸素と反応する為に、それらを避けるために[[鉱油|ミネラルオイル]]の中に保存される。オイルを拭って放置すると自然発火することもあるので取り扱いは考慮する必要がある([[危険物#第3類|危険物3類]])。 |
|||
<chem>2K(s) + 2H_2O(l) -> 2KOH(aq) + H_2(g)</chem> |
|||
アルカリ金属元素は、いずれも[[炎色反応]]を示す。 |
|||
アルカリ金属は一般的の金属に比べて異常に高い反応性を持つため、超金属とも呼ばれる。特に水との反応は劇的であり、重い元素ほど高い反応性を示す。 |
|||
アルカリ金属元素は、いずれも[[炎色反応]]を示す<ref>[[#千谷1959|千谷 (1959)]] 82頁。</ref>。ナトリウムの発光はD線と呼ばれる波長589 nmの単色光であるため、単色光でないと測定ができない[[旋光度]]を測定するための光源に利用される<ref>[[#ブルース2009|ブルース (2009)]] 239頁。</ref>。このD線は、実際は1本の輝線ではなく、波長589.592 nmのD<sub>1</sub>線と波長588.995 nmのD<sub>2</sub>線の2本に分かれた双子線である。これは、ナトリウムの最外殻電子のスピンが2方向あるためであり、同様の理由によりナトリウム以外のアルカリ金属元素のスペクトルも双子線となる<ref>[[#千谷1959|千谷 (1959)]] 83頁。</ref>。[[セシウム]]のみは励起に必要な高温を得るために、酸水素炎で観察する必要がある。 |
|||
{| class="wikitable" style="text-align:center;" |
{| class="wikitable" style="text-align:center;" |
||
| 88行目: | 133行目: | ||
|} |
|} |
||
[[フランシウム]]は[[放射性同位体|放射性元素]]で天然からは産出されないが、核反応により少量合成されアルカリ金属としての物性を持つことが確認されている。余談だが、フランスの科学者ペレーがこのアルカリ金属を単離した際に、母国にちなんでフランシウムと名付けた。またガリウムはフランスを表すラテン語のガリアにちなんで名づけられており、フランスは二つの元素の命名の由来となっている。 |
|||
[[セシウム]]のみは励起に必要な高温を得るために、酸水素炎で観察する必要がある。 |
|||
アルカリ金属の単体は低温においてはいずれも[[体心立方格子]]の等軸晶系の結晶であるが、常温においてはカリウム、ルビジウム、セシウムは正方晶系の結晶となる<ref>[[#千谷1959|千谷 (1959)]] 83、84頁。</ref>。 |
|||
アルカリ金属の中でも[[リチウム]]は特異的である。たとえばリチウムのみが熱時に単体窒素 N<sub>2</sub> と直接反応して、リチウム窒化物を生成する。 |
|||
[[仕事関数]]が小さいという特長を活かして[[光電子増倍管]]の光電面材料にはアルカリ金属を主成分とした合金が利用され<ref>{{citation|title=光電子増倍管 構造・特性|url=http://www.kdenki.com/Datasheet/%95l%83z%83g/PMT_4-15.pdf|page=6|accessdate=2011-8-27}}</ref>、[[スーパーカミオカンデ]]で使用されたものではバイアルカリと呼ばれるSb-K-Cs合金が用いられている<ref>{{citation|title=光電子増倍管|url=http://www-sk.icrr.u-tokyo.ac.jp/sk/detector/pmt.html|accessdate=2011-8-27|publisher=Kamioka Observatory, ICRR, Univ. of Tokyo}}</ref>。 |
|||
また、[[フランシウム]]は[[放射性同位体|放射性元素]]で天然からは産出されないが、核反応により少量合成されアルカリ金属としての物性を持つことが確認されている。 |
|||
=== リチウム === |
|||
[[水]]やアルコールなど[[溶媒|プロトン溶媒]]とは水素ガスを発して反応し、生成する[[水酸化物]]や金属[[アルコキシド]]などは[[強塩基]]として利用される。 |
|||
この節の出典:<ref name=":0">{{Cite book|title=Muki kagaku.|url=https://www.worldcat.org/oclc/1022213386|publisher=東京化学同人|date=2009|isbn=978-4-8079-0684-0|oclc=1022213386|others=Rayner-Canham, Geoffrey., Overton, T. (Tina), Nishihara, hiroshi., Takagi, shigeru., Moriyama, hiroshi., 西原, 寛}}</ref> |
|||
すでに述べたように、リチウムは全金属中で最も低い密度を持つ。この軽さは航空産業や宇宙産業で用いる材料の素材として極めて有用である。例えば合金の一種であるLA 141(リチウム14%、アルミニウム1%、マグネシウム85%)の密度は1.35 g/cm{{sup|3}}であり、現在最も広く用いられている低密度金属の一つである。 |
|||
そして、アルカリ金属イオンは[[ハロゲン]]イオンなど種々の[[アニオン]]と水溶性の[[塩 (化学)|塩]]を作る。これは、アルカリ金属イオンが強く水和することの寄与が大きい。これらのアルカリ金属塩の溶解性はアルカリ金属イオンの挙動に強く影響される。例えば、[[クラウンエーテル]]や[[クリプタンド]]などはアルカリ金属イオンと包摂化合物を形成し、塩は有機溶媒に可溶となることが知られている。 |
|||
金属リチウムは銀色を呈するが、空気にさらすと速やかに酸素と反応して黒変する。窒素と反応する元素は周期表全体でみても元々少数であるが、リチウムはその中の唯一のアルカリ金属である。窒素分子の三重結合の結合エネルギーは945 kJ/molであり、これより安定な窒化物を与えるためには、生成物の格子エネルギーを十分に高める必要がある。アルカリ金属中では、最も高い電子密度を誇るリチウムのみがこの条件を満足することができる。 |
|||
また、アルカリ金属元素の単体はいずれも[[酸化還元電位]]が非常に低く、強い還元性を有する。このアルカリ金属元素の性質は、他の金属の塩化物から単体へと還元するときに利用されたり、有機化学の分野では[[バーチ還元]] (Bürch reduction) に利用される。 |
|||
<chem>6Li(s) + N_2(g) -> 2Li_3N(s)</chem> |
|||
[[仕事関数]]が小さいという特長を活かして[[カミオカンデ]]で使用された[[光電子増倍管]]の光電面に蒸着されている。 |
|||
このように生成された窒化リチウムは決して安定ではなく、水を加えるとアンモニアと水酸化物を生じる。 |
|||
== 水素化物 == |
|||
アルカリ金属は一般式 MH で表されるような1価の[[水素化物]]を形成する。これらの水素化物はイオン型水素化物であり、[[水素#ヒドリド|ヒドリド]]供与体として、[[塩基]]や[[還元剤]]として利用される。 |
|||
<chem>Li_3N(s) + 3H_2O(l)-> 3LiOH(aq) + NH_3(g)</chem> |
|||
== 酸化物 == |
|||
アルカリ金属は一般式 M<sub>2</sub>O で表される[[酸化物]]を形成する。空気中の[[酸素]]と直接反応するためアルカリ金属単体の切断面は、直後には金属光沢を示すものの、速やかに酸化物など(一部は水酸化物)に覆われて光沢を失う。 |
|||
液体リチウムは最も腐食性の高い物質と知られ、例えばリチウムをガラス容器の中で溶解させたときには、ガラスと反応して容器に穴をあけるほどである。さらに、リチウムはすべての元素のうち最も低い標準電極電位を示す。 |
|||
また、空気中で燃焼させるとリチウムでは主に酸化物を生成するが、主にナトリウムでは一般式 M<sub>2</sub>O<sub>2</sub> であらわされる[[無機過酸化物|金属過酸化物]]を形成し、カリウム以上の周期の元素の場合は一般式 MO<sub>2</sub> で表される[[超酸化物|金属超酸化物]]を形成することも知られている。 |
|||
=== ナトリウム<ref name=":0" /> === |
|||
酸化物は発熱を伴い水と激しく反応して水酸化物を生成し、過酸化物は激しく加水分解して[[過酸化水素]]あるいは酸素を発生する。超酸化物も水溶液中では次第に分解して酸素を発生する。 |
|||
ナトリウムは他のアルカリ金属と同様、非常に高い反応性を示すため、単体は天然には存在しない。しかしながら、金属ナトリウムは産業からの需要が最も大きい金属の一つである。金属ナトリウムは多くのナトリウム化合物の合成に用いられるが、最も有用な利用は他の希少金属の還元に使うことであろう。例えば金属チタンは四塩化チタンを金属ナトリウムで還元することで得られる。 |
|||
<chem>TiCl_4(l) + 4Na(s)->Ti(s) + 4NaCl(s)</chem> |
|||
生成系を水で洗い流せば金属チタンが残る。 |
|||
金属ナトリウムの別の使い方は、オクタン価を上げるためのガソリン添加剤の原料である。テトラエチル鉛(アンチノック剤)の製造に鉛-ナトリウム合金が使用される。 |
|||
<chem>4NaPb(s) + 4C_2H_5Cl(g) -> (C_2H_5)_4Pb(l) + 3Pb(s) + 4NaCl(s)</chem> |
|||
テトラエチル鉛は毒性が強く、また使用後の廃棄物によって鉛汚染を引き起こすため、各国で規制の流れがあるが、今もなお多くの国で使用されている。 |
|||
金属ナトリウムは塩化ナトリウムを適切に電気分解することで得られる(タウンズ法)。この方法では塩化カルシウムを添加して融点を引き下げた融解塩化ナトリウムを、陽極にグラファイト、陰極に鉄を用いて電気分解する。純粋な塩化ナトリウムの融点は800.4℃であるが、67%を塩化カルシウムに置き換えることで融点を580℃まで引き下げることができ、工業化の範疇となる。このようにして得られた液体金属ナトリウムは2%のカルシウムを含むが、110℃まで冷却するとカルシウム(融点842℃)は固化して沈んでしまい、ナトリウム(融点98℃)を純粋な形で得ることができる。 |
|||
=== カリウム<ref name=":0" /> === |
|||
天然のカリウムは放射性同位体であるカリウム40を0.012%含む。カリウム40にはβ壊変によってカルシウム40になる経路と電子捕獲によってアルゴン40になる経路の二つがある。カリウム40の約11%が後者の経路を通る。すでに固化したマグマの中でこの反応が起こると、発生したアルゴンは岩石に閉じ込められることとなる。これを用いた岩石の年代測定が広く行われている。 |
|||
金属カリウムの製法は他と比べてエレガントで面白い。金属カリウムはあまりにも反応性が高いため、電解槽で生成して集めるのは現実的な方法ではない。化学的に還元してやれば良い。すなわち850℃で液体金属ナトリウムと液体塩化カリウムを直接反応させる。 |
|||
<chem>Na(l) + KCl(l) -> NaCl(l) + K(g)</chem> |
|||
イオン化傾向系列でカリウムはナトリウムの左にくる為、通常この可逆反応はあまり右に進まない。しかしこの温度ではカリウムは気体となるので、反応で生じたカリウムガスを系外に吸い出し続ければ、ルシャトリエの原理により反応を無理やり右向きに進行させることができる。 |
|||
== 化合物 == |
|||
=== 水素化物 === |
|||
乾燥条件下においてアルカリ金属を水素気流下で加熱することによって、アルカリ金属は一般式 MH で表されるような1価の[[水素化物]]を形成するが、これらは[[水素化リチウム]]を除き不安定であり<ref>[[#千谷1959|千谷 (1959)]] 81、87頁。</ref>、成分元素単体に乖離しやすい。また水の存在下では容易に[[加水分解]]を受けてアルカリ金属水酸化物と水素に分解する。これらの水素化物は塩化ナトリウム型構造を取るイオン型水素化物であり<ref name="belllott290">[[第1族元素#ベルロット1968|ベル、ロット (1968)]] 290頁。</ref>、[[水素#ヒドリド|ヒドリド]]供与体として、[[塩基]]や[[還元剤]]として利用される。また、[[水素化ホウ素ナトリウム]]や[[水素化アルミニウムリチウム]]などの三元化合物も形成される<ref name=belllott290/>。 |
|||
=== 酸化物 === |
|||
アルカリ金属は、一般式 M<sub>2</sub>O で表される[[酸化物]]を形成する。空気中の[[酸素]]と直接反応するため、新鮮なアルカリ金属単体の切断面は金属光沢を示すものの、速やかに酸化物など(一部は水酸化物)に覆われて光沢を失う。 |
|||
また、空気中で燃焼させるとリチウムでは主に酸化物を生成するが、ナトリウムでは主に一般式 M<sub>2</sub>O<sub>2</sub> であらわされる[[無機過酸化物|金属過酸化物]]を形成し、カリウム以上の周期の元素の場合は一般式 MO<sub>2</sub> で表される[[超酸化物|金属超酸化物]]も形成することが知られている。これはイオン半径の大きな陽イオンほど、格子エネルギー効果によって対となる大きな陰イオンを安定化させることができ、不安定な過酸化物イオンや超酸化物イオンとでも安定な化合物が形成できるためである<ref name=CW255>[[#CW1987|コットン、ウィルキンソン (1987)]] 255頁。</ref>。一方、[[過酸化リチウム]]を形成するためには金属リチウムを過酸化水素と反応させる必要があり<ref>[[#千谷1959|千谷 (1959)]] 90頁。</ref>、[[超酸化ナトリウム]]を形成するためには高温高圧の条件が必要となる<ref name="belllott291">[[#ベルロット1968|ベル、ロット (1968)]] 291頁。</ref>。アルカリ金属元素の超酸化物は全て[[常磁性体]]であり、歪んだ塩化ナトリウム型構造を取る<ref name="belllott291" />。また、アルカリ金属の[[水酸化物]]と[[オゾン]]との反応によって[[オゾン化物]]が形成される<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 496頁。</ref>。このオゾン化物の安定性もまた、対となる陽イオンのイオン半径の大きさに比例する<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 497頁。</ref>。 |
|||
アルカリ金属は[[電気陰性度]]が低く電気的に非常に陽性であるため、酸化物は発熱を伴い水と激しく反応して水酸化物を生成し、過酸化物は激しく加水分解して[[過酸化水素]]あるいは酸素を発生させ、超酸化物も水溶液中では次第に分解して酸素を発生する<ref name=CW255/>。 |
|||
アルカリ金属に限定しない酸化物の一般的性質については、[[酸素]]・[[酸化物]]それぞれの項目を参照のこと。 |
アルカリ金属に限定しない酸化物の一般的性質については、[[酸素]]・[[酸化物]]それぞれの項目を参照のこと。 |
||
== |
=== 水酸化物 === |
||
アルカリ金属は、一般式MOHで表される[[水酸化物]]を形成する。低融点な無色の結晶であり、融点付近の350{{℃}}から400{{℃}}で昇華する<ref name="名前なし-1">[[#CW1987|コットン、ウィルキンソン (1987)]] 256頁。</ref>。[[水酸化リチウム]]を除いて全て[[潮解性]]を有し、水やアルコールには発熱しながら容易に溶解する<ref name=chitani9394>[[#千谷1959|千谷 (1959)]] 93、94頁。</ref>。アルカリ金属の水酸化物の水溶液では、アルカリ金属イオンと水酸化物イオンにほぼ完全に電離しているため非常に強い塩基性を示す<ref name=chitani93>[[#千谷1959|千谷 (1959)]] 93頁。</ref>。気体状態においては(MOH)<sub>2</sub>で表される[[二量体]]を形成し、気体状態における塩基性の強さはアルカリ金属の原子量が大きくなるほど塩基性が強くなるが、溶液中における塩基性の強さは[[溶媒効果]]などの影響を受けるためこの限りではない<ref name="名前なし-1"/>。また非常に強い腐食性を有し、溶融状態においては[[白金]]すらも侵食する<ref name=chitani9394/>。空気中の[[二酸化炭素]]を吸収して[[炭酸塩]]を形成しやすく<ref>[[#櫻井鈴木中尾2003|櫻井、鈴木、中尾(2005)]] 25頁。</ref>、市販の水酸化物はわずかに炭酸塩を含んでいる。例えば、[[日本産業規格]](JIS)において[[試薬]]の水酸化ナトリウムや水酸化カリウムでは炭酸塩の含量が1.0 %以下でなければならないと規定されている<ref>日本産業規格 [https://www.jisc.go.jp/app/jis/general/GnrJISNumberNameSearchList?show&jisStdNo=K8576 JIS K 8576], [https://www.jisc.go.jp/app/jis/general/GnrJISNumberNameSearchList?show&jisStdNo=K8574 JIS K 8574]</ref>。 |
|||
一般に、アルカリ金属の[[ハロゲン]]化物は常温で固体であり、[[フッ化リチウム]] (LiF) を例外としていずれも水溶性が高い塩である。上記で述べられているように、塩の水溶性に大きく関与する要因として、アルカリ金属イオンの水和で得られるエネルギーとイオン結晶格子の切断にともない失われるエネルギーとの収支の損得が挙げられる(記事 [[溶液]]・[[溶解]] に詳しい)。フッ化リチウムの水溶性が低い(25 ℃ にて、0.13 g/100 mL)ことについては、フッ化物イオン (F<sup>−</sup>) もリチウムイオン (Li<sup>+</sup>) も[[イオン半径]]が同程度に小さいためにフッ化リチウムの結晶格子は小さく強い結合から成る一方、フッ化リチウムの結晶が溶解してイオンが水和を受ける際の水和エネルギーは大きいものの[[格子エネルギー]]を打ち消す程ではない事による。 |
|||
アルカリ金属の水酸化物は、工業的には対応するアルカリ金属の塩化物の[[電気分解]]や、アルカリ金属の炭酸塩または硫酸塩とアルカリ土類金属の水酸化物とを[[複分解]]させることによって得られる<ref>[[#千谷1959|千谷 (1959)]] 93頁。</ref>。ナトリウムおよびカリウムでは前者の電解法が、ルビジウムおよびセシウムでは後者の複分解法が主に用いられている<ref>[[#千谷1959|千谷 (1959)]] 94頁。</ref>。アルカリ金属の水酸化物の中でも[[水酸化ナトリウム]]は安価なアルカリ源他様々な用途に用いられる工業的に非常に重要な物質であり、日本において2010年度で年間902,178トンもの量が消費されている<ref>{{citation|url=http://www.meti.go.jp/statistics/tyo/seidou/result/ichiran/02_kagaku.html|title=化学工業統計 2010年度年報|publisher=経済産業省|accessdate=2011-6-2}}</ref>。 |
|||
=== ハロゲン化物 === |
|||
一般に、アルカリ金属の[[ハロゲン]]化物は常温で固体であり、[[フッ化リチウム]] (LiF、溶解度は水100gに対して0.27g(18{{℃}}))<ref name=chitani102/>や[[フッ化ナトリウム]] (NaF、溶解度は水100gに対して4g(0{{℃}}))<ref>[[#千谷1959|千谷 (1959)]] 103頁。</ref>などの例外はあるものの、ほぼ全て水溶性が高い塩である。上記で述べられているように、塩の水溶性に大きく関与する要因として、アルカリ金属イオンの水和で得られるエネルギーとイオン結晶格子の切断にともない失われるエネルギーとの収支の損得が挙げられる(記事 [[溶液]]・[[溶解]] に詳しい)。フッ化リチウムの水溶性が低い(25 ℃ にて、0.13 g/100 mL)ことについては、フッ化物イオン (F<sup>−</sup>) もリチウムイオン (Li<sup>+</sup>) も[[イオン半径]]が同程度に小さいためにフッ化リチウムの結晶格子は小さく強い結合から成る一方、フッ化リチウムの結晶が溶解してイオンが水和を受ける際の水和エネルギーは大きいものの[[格子エネルギー]]を打ち消す程ではない事による<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 257頁。</ref>。 |
|||
{| class="wikitable" style="float:left; text-align:center;" |
{| class="wikitable" style="float:left; text-align:center;" |
||
!style="width:7em;"|物質 |
!style="width:7em;"|物質 |
||
!style="width:9em;"|格子エネルギー<br /><math>U</math> |
!style="width:9em;"|格子エネルギー<br /><math>U</math> |
||
!style="width:12em;"|水和エンタルピー変化<br /><math>\ |
!style="width:12em;"|水和エンタルピー変化<br /><math>\Delta_{\mathrm{hyd}} H</math> |
||
!style="width:12em;"|溶解エンタルピー変化<br /><math>\ |
!style="width:12em;"|溶解エンタルピー変化<br /><math>\Delta_{\mathrm{sol}} H</math> |
||
!style="width:12em;"|溶解エントロピー変化<br /><math>\ |
!style="width:12em;"|溶解エントロピー変化<br /><math>\Delta_{\mathrm{sol}} S</math> |
||
!style="width:16em;"|溶解ギブス自由エネルギー変化<br /><math>\ |
!style="width:16em;"|溶解ギブス自由エネルギー変化<br /><math>\Delta_{\mathrm{sol}} G</math> |
||
|- |
|- |
||
| [[フッ化リチウム]] |
| [[フッ化リチウム]] |
||
| 130行目: | 212行目: | ||
{{-}} |
{{-}} |
||
アルカリ金属のハロゲン化物の水溶液の [[水素イオン指数|pH]] は中性に近いことが多いが、フッ化物やヨウ化物の中には微弱な塩基性を示すものがある(例:飽和 NaF 水溶液で、pH 7.4)。これは[[フッ化水素]]が弱酸でありフッ化物イオンが僅かに[[加水分解]]すること、また[[ヨウ化水素]]は[[強酸]]であるものの、[[ヨウ化物]]イオンが酸化されやすく極一部が[[次亜ヨウ素酸]]塩などに変化していることによる。 |
アルカリ金属のハロゲン化物の水溶液の [[水素イオン指数|pH]] は中性に近いことが多いが、フッ化物やヨウ化物の中には微弱な塩基性を示すものがある(例:飽和 NaF 水溶液で、pH 7.4)。これは[[フッ化水素]]が弱酸でありフッ化物イオンが僅かに[[加水分解]]すること、また[[ヨウ化水素]]は[[強酸]]であるものの、[[ヨウ化物]]イオンが酸化されやすく極一部が[[次亜ヨウ素酸]]塩などに変化していることによる。アルカリ金属のハロゲン化物の熱的な安定性は、アルカリ金属側の原子番号が大きいほど安定であり、またハロゲン側の原子番号が小さいほど安定である<ref>[[#ベルロット1968|ベル、ロット (1968)]] 292頁。</ref>。 |
||
一連のハロゲン化物の中で、地球上に最も広く存在するものが[[塩化ナトリウム]] (NaCl) である。 |
一連のハロゲン化物の中で、地球上に最も広く存在するものが[[塩化ナトリウム]] (NaCl) である。 |
||
== |
==== 構造 ==== |
||
[[File:Action potential ion sizes.svg|thumb|right|200px|アルカリ金属イオンと塩素イオンのイオン半径]] |
|||
アルカリ金属元素のハロゲン化物はいずれも単純な[[立方晶|等軸晶系]]を取る<ref>[[#千谷1959|千谷 (1959)]] 100頁。</ref>。リチウム、ナトリウム、カリウムおよびルビジウムのハロゲン化物は通常6配位の「塩化ナトリウム型構造」と呼ばれる最密充填構造である[[面心立方格子]]を取り、フッ化セシウム以外のハロゲン化セシウムは8配位の「塩化セシウム型構造」と呼ばれる最密充填構造ではない[[体心立方格子]]を取る<ref>[[#千谷1959|千谷 (1959)]] 101-102頁。</ref>。しかし、[[塩化ルビジウム]]は低温では塩化セシウム型構造を優先的に形成することが知られており<ref name="Pyper">{{cite journal |author=Pyper, N.C.; Kirkland, A. I.; Harding, J. H. |title=Cohesion and polymorphism in solid rubidium chloride |journal=Journal of Physics: Condensed Matter |volume=18 |pages=683–702 |year=2006 |url=http://www.iop.org/EJ/abstract/0953-8984/18/2/023 |doi=10.1088/0953-8984/18/2/023 }}</ref>、また[[塩化セシウム]]は445{{℃}}で塩化ナトリウム型構造へと[[相転移]]する<ref name=chitani102>[[#千谷1959|千谷 (1959)]] 102頁。</ref>。このようなハロゲン化物の構造の違いはアルカリ金属元素とハロゲン化物イオンのイオン半径比によるものであり、イオン半径比 (r<sup>+</sup>/r<sup>-</sup>)0.72を境に構造の変化が起こる<ref name=basic132>[[#櫻井鈴木中尾2003|櫻井、鈴木、中尾(2005)]] 132頁。</ref>。これは、イオン結晶が配位数の多さおよび陽イオンと陰イオン同士の充填率の高さによって安定化する性質に由来しており、[[剛体|剛体球]]近似による理論計算から、陽イオンと陰イオンのイオン半径比が小さい(陽イオンのイオン半径が小さい)と少ない配位数で密に詰まる方が安定であり、陽イオンと陰イオンのイオン半径比が大きい(陽イオンのイオン半径が大きい)と多い配位数で最密充填を取らない方が安定となるためである<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 14-15頁。</ref>。 |
|||
== 合金 == |
|||
アルカリ金属は[[水銀]]と反応して[[アマルガム]]を形成する<ref name=CW253>[[#CW1987|コットン、ウィルキンソン (1987)]] 253頁。</ref>。ナトリウムのアマルガムは、高純度な水酸化ナトリウムを製造するための水銀法とよばれる手法において用いられる<ref>[[#足立岩倉馬場2004|足立、岩倉、馬場 (2004)]] 31頁。</ref>。また、ナトリウムアマルガム電極として、通常の電極を用いることができないアルカリ金属の電極反応などにも利用される<ref>[[#小出2003|小出 (2003)]] 136頁。</ref>。ナトリウムアマルガムは、ナトリウムの割合を増やせば固体、減らせば液体となる性質があり強力な還元剤としても用いられる<ref name=CW253/>。 |
|||
リチウム以外のアルカリ金属元素は、溶融させることでそれぞれ任意の割合で混合して合金を与えるが、リチウムはナトリウムとは380{{℃}}以上の条件で合金を作ることができるものの、それ以外のアルカリ金属元素とは合金を作ることができない<ref name=CW250>[[#CW1987|コットン、ウィルキンソン (1987)]] 250頁。</ref>。アルカリ金属同士の合金で重要なものは[[ナトリウムカリウム合金]]であり、カリウム含有率77.2 %のもので融点が-12.3{{℃}}と常温で液体な低融点合金である<ref name=CW252>[[#CW1987|コットン、ウィルキンソン (1987)]] 252頁。</ref>。その高い比熱によって核反応における熱媒体としての利用が検討されていたが、より安全な溶融ナトリウムへと移りこの用途では現在用いられていない<ref name=CW252/>。また、[[モル濃度]]で41%のセシウム、47%のカリウム、12%のナトリウムからなる合金は、すべての合金の中で最低の融点 (−78 {{℃}}) を持つ<ref name="autogenerated1">{{cite web|url=http://pubs.acs.org/cen/80th/print/cesium.html |title=C&EN: It's Elemental: The Periodic Table – Cesium |publisher=American Chemical Society|accessdate=2010-02-25|author=Kaner, Richard|year = 2003}}</ref><ref>{{cite web|url=http://symp15.nist.gov/pdf/p564.pdf|format=PDF|title=Density of melts of alkali metals and their Na-K-Cs and Na-K-Rb ternary systems|author=Taova, T. M. ''et al.''|work=Fifteenth symposium on thermophysical properties, Boulder, CO, USA|date=June 22, 2003|accessdate=2010-09-26}}</ref> |
|||
==脚注== |
|||
{{脚注ヘルプ}} |
{{脚注ヘルプ}} |
||
=== 注釈 === |
|||
{{Reflist}} |
|||
{{Notelist2}} |
|||
=== 出典 === |
|||
{{Reflist|2}} |
|||
== 参考文献 == |
|||
* {{Cite book|和書|author=F.A. コットン, G. ウィルキンソン|others=中原 勝儼|title=コットン・ウィルキンソン無機化学(上)|publisher=培風館|year=1987|edition=原書第4版|isbn=4563041920|ref=CW1987}} |
|||
* {{Cite book|和書|author=足立吟也、岩倉千秋、馬場 章夫|year=2004|title=新しい工業化学-環境との調和をめざして|ref=足立岩倉馬場2004|isbn=4759809554}} |
|||
* {{Cite book|和書|author=小出直之|year=2003|title=ビギナーズ化学|publisher=化学同人|ref=小出2003|isbn=4759808779}} |
|||
* {{Cite book|和書|author=櫻井武、鈴木晋一郎、中尾安男|year=2003|title=ベーシック無機化学|publisher=化学同人|ref=櫻井鈴木中尾2003|isbn=4759809031}} |
|||
* {{Cite book|和書|author=千谷利三|year=1959|title=新版 無機化学(上巻)|publisher=産業図書|ref=千谷1959}} |
|||
* {{Cite book|和書|author=C.F.ベル、K.A.K.ロット|other=奥野久輝ほか|year=1968|edition=第2版|title=ベル・ロット無機化学-その現代的理解のために|publisher=東京化学同人|ref=ベルロット1968}} |
|||
* {{Cite book|和書|author=P.Y.ブルース|others=大船泰史ほか|year=2009|edition=第5版|title=ブルース有機化学(上)|publisher=化学同人|ref=ブルース2009|isbn=4759811680}} |
|||
== 関連項目 == |
== 関連項目 == |
||
*[[元素の族]] |
*[[元素の族]] |
||
*[[周期表]] |
*[[周期表]] |
||
{{ |
{{元素周期表}} |
||
[[Category:元素群|たい01そくけんそ]] |
|||
[[Category:周期表の族|#01]] |
|||
[[an:Metal alcalín]] |
|||
[[ar:فلز قلوي]] |
|||
[[ast:Alcalín]] |
|||
[[be:Шчолачныя металы]] |
|||
[[be-x-old:Лужныя мэталы]] |
|||
[[bg:Група 1 на периодичната система]] |
|||
[[bn:ক্ষার ধাতু]] |
|||
[[bs:Alkalni metali]] |
|||
[[ca:Metall alcalí]] |
|||
[[cs:Alkalické kovy]] |
|||
[[cv:Сĕлтĕ металсем]] |
|||
[[cy:Metel alcalïaidd]] |
|||
[[da:Alkalimetal]] |
|||
[[de:Alkalimetalle]] |
|||
[[el:Αλκάλια]] |
|||
[[en:Alkali metal]] |
|||
[[eo:Alkala metalo]] |
|||
[[es:Alcalino]] |
|||
[[et:Leelismetallid]] |
|||
[[eu:Metal alkalino]] |
|||
[[fa:فلزهای قلیایی]] |
|||
[[fi:Alkalimetalli]] |
|||
[[fr:Métal alcalin]] |
|||
[[gl:Alcalino]] |
|||
[[he:מתכת אלקלית]] |
|||
[[hif:Alkali dhaatu]] |
|||
[[hr:Alkalijski metali]] |
|||
[[ht:Metal alkalen]] |
|||
[[hu:Alkálifémek]] |
|||
[[hy:Ալկալիական մետաղներ]] |
|||
[[id:Logam alkali]] |
|||
[[is:Alkalímálmur]] |
|||
[[it:Metalli alcalini]] |
|||
[[jv:Logam alkali]] |
|||
[[ka:ტუტე ლითონები]] |
|||
[[ko:알칼리 금속]] |
|||
[[ksh:Alkalimetall]] |
|||
[[la:Metalla alcalica]] |
|||
[[lmo:Metai alcalitt]] |
|||
[[lt:Šarminiai metalai]] |
|||
[[lv:Sārmu metāli]] |
|||
[[mk:Алкален метал]] |
|||
[[ml:ക്ഷാരലോഹങ്ങൾ]] |
|||
[[mr:अल्कली धातू]] |
|||
[[ms:Logam alkali]] |
|||
[[nds:Alkalimetall]] |
|||
[[nl:Alkalimetaal]] |
|||
[[nn:Alkalimetall]] |
|||
[[no:Alkalimetall]] |
|||
[[pl:Litowce]] |
|||
[[pt:Metal alcalino]] |
|||
[[qu:Alkali q'illay]] |
|||
[[ro:Metal alcalin]] |
|||
[[ru:Щелочные металлы]] |
|||
[[sah:Алкали метал]] |
|||
[[sh:Alkalni metali]] |
|||
[[simple:Alkali metal]] |
|||
[[sk:Alkalický kov]] |
|||
[[sl:Alkalijska kovina]] |
|||
[[sq:Metalet alkaline]] |
|||
[[sr:Алкални метали]] |
|||
[[su:Logam alkali]] |
|||
[[sv:Alkalimetall]] |
|||
[[sw:Metali alikali]] |
|||
[[ta:கார மாழைகள்]] |
|||
[[te:క్షార లోహము]] |
|||
[[th:โลหะแอลคาไล]] |
|||
[[tr:Alkali metal]] |
|||
[[tt:Селтеле металлар]] |
|||
[[uk:Лужні метали]] |
|||
[[vi:Kim loại kiềm]] |
|||
[[zh:碱金属]] |
|||
[[zh-yue:鹼金屬]] |
|||
2024年11月3日 (日) 12:56時点における最新版
| ← 1族 → | |
| 周期 | |
| 1 | 1 H |
| 2 | 3 Li |
| 3 | 11 Na |
| 4 | 19 K |
| 5 | 37 Rb |
| 6 | 55 Cs |
| 7 | 87 Fr |
第1族元素(だいいちぞくげんそ)とは、周期表において第1族に属する元素。水素・リチウム・ナトリウム・カリウム・ルビジウム・セシウム・フランシウムが属する。周期表の一番左側に位置する元素群で、価電子は最外殻のs軌道にある電子である。s軌道は1電子のみが占有する。
水素を除いた第1族元素はアルカリ金属と総称されており、常温で水と激しく反応する金属で、その水酸化物が強アルカリ性を示す、という共通特性がある[1]。本項ではこのアルカリ金属を中心に記述し、水素に関しては個別記事にて詳しく述べる。
アルカリ金属
[編集]第1族元素に属する元素の多くは、歴史的に物質的性質に基づく古い分類名称である「アルカリ金属」と呼ばれている。
物質元素の単体を探索する過程で金属としての性質が共通に見出されたもののうち、その後の分類の着目点に化学的性質が加わり、他元素と結合しやすい化学的性質をもつものから「アルカリ金属」が分類された。さらに電子構造の違いによる族の分類で、第1族元素に分類する過程で水素にもアルカリ金属との共通性が見出された。一方で、典型元素の単体においては周期が小さいほど共有結合性が強く、周期が大きいほど金属結合性が強くなる傾向があるが、第1族元素では水素のみが共有結合を示すという顕著な違いがある。ただし、周期表の理解においてここまでの厳密な分類は必要ではなく、共通性の存在と歴史的背景から第1族元素とアルカリ金属が同列に扱われることがある。
400-500 GPa という非常な高圧下では水素も金属の性質を持つという理論があり、天文物理学の観測では土星や木星には重力による縮退で相転移を起こした金属水素が大量に存在する可能性が示唆されている。地球においても高圧実験によりその存在を確かめようとする努力が続けられているが、いまだ確認に至っていない。これまで研究では金属水素は電子のバンドギャップが非常に小さいものの完全にはゼロにならない可能性が報告され、伝導電子にはわずかな制約が生じ完全なアルカリ金属にはならないとされている。
歴史
[編集]
ナトリウムの化合物は古代から知られていた。一般に塩と呼ばれる塩化ナトリウムは人間の活動において重要な物であり、給料すなわちサラリーの語源はラテン語の「サラリウム(salarium)」で「塩のお金」を意味し、ローマ帝国では兵士に給金として塩が支給されていたという[2]。
カリウムも古代から使用されていたが、ナトリウム塩と根本的に別の物質だとは近世まで理解されていなかった。1702年にゲオルク・シュタールがナトリウム塩とカリウム塩の根本的な違いを示唆する実験的証拠を得て[3]、1736年にアンリ=ルイ・デュアメル・デュ・モンソーがこの違いの証明に成功した[4]。当時は、カリウム化合物とナトリウム化合物の正確な化学組成も、元素としてのカリウムとナトリウムの正確な場所も分からなかったため、アントワーヌ・ラヴォアジエはどちらも1789年の元素表に組み入れなかった[5][6]。
単体のカリウムは、1807年にイギリスでハンフリー・デービーによって最初に単離されており、彼はボルタ電池による溶融塩の電気分解を活用して水酸化カリウム(KOH)から単離した。それ以前の塩類水溶液の電気分解はカリウムの極端な反応性のため失敗しており 、カリウムは電気分解で単離された最初の金属となった[7]。同年後半、デービーは同じ技法で水酸化ナトリウム(NaOH)からのナトリウム抽出を報告し、これらの元素が異なることを証明した[5][6][8][9]。

ペタライト(LiAlSi4O 10)は、1800年にブラジル人化学者ジョゼ・ボニファチオ・デ・アンドラダによってスウェーデンの鉱山で発見された[10][11][12]ただし、ヨアン・オーガスト・アルフェドソンがペタライト鉱石の分析で新元素の存在を検出したのは1817年だった[13][14]。この新元素がナトリウムやカリウムと同様の化合物を形成することに彼は注目し、その炭酸塩と水酸化物は他のアルカリ金属よりも水溶性が小さくアルカリ性が強かった[15]。植物の灰から発見されたカリウムや、動物の血液中に豊富に含まれていることで知られていたナトリウムとは対照的に、固体で発見されたことを考慮して、イェンス・ベルセリウスは「石」という意味のギリシャ語λιθoςからこの未知の素材を「lithion/lithina」と命名、同素材の中にある金属を「リチウム」と名付けた[16][11][14]。リチウム、ナトリウム、カリウムは、1850年にヨハン・デーベライナーが同様の特性を持つと同族元素の三組にあたると指摘、これが周期性の(部分的な)発見となった[17]。

ロベルト・ブンゼンとグスタフ・キルヒホフが1859年に発明した分光器を使って、初めて発見された元素がルビジウムとセシウムである[18]。彼らが翌1860年に、ドイツの鉱泉水からセシウムを発見した。その翌年には、ドイツのハイデルベルクで鉱物レピドライトの中からルビジウムが発見された[19]。ルビジウムおよびセシウムという命名は、それぞれ放出スペクトルの最も顕著な線にちなんだもので、ルビジウムは鮮やかな赤の線(ラテン語rubidus、濃い赤または明るい赤の意)、そしてセシウムは空色の線(ラテン語caesius、空色の意)である[20][21]。
1865年頃、ジョン・ニューランズは一連の論文を書き上げ、そこで彼は複数の元素を原子量増加順に並べ、8つ間隔で繰り返される同様の物理的・化学的特性を一覧にした。彼はその周期性を、8つ離れた音符が同様の音階機能を有する音楽のオクターヴに例えた[22][23]。彼の表では、当時知られている全てのアルカリ金属(リチウムからセシウム)のほか、銅と銀とタリウムが1つの族にまとめらていれた。また彼の表では、水素をハロゲン(第17族元素)と一緒に置いていた[17]。

1869年以降にドミトリ・メンデレーエフは、ナトリウム、カリウム、ルビジウム、セシウム、タリウムを含む族の一番上にリチウムを配置する周期表を提唱した[24]。2年後に彼は自分の表を改訂し、水素をリチウムの上の第1族に配置し、タリウムをホウ素族に移した。この1871年版では、銅と銀と金が2か所に配置されており、1か所はIB族(現:第11族元素)に、もう1か所はVIII族(現:第8族元素から第11族までを含む)に配置されていた[25]。18列からなる周期表の導入後、IB族元素は現在のDブロック元素の位置に移動し、アルカリ金属はIA族に残った。後の1988年に、この族の名が「第1族」に変更された。「アルカリ金属」という慣用名は、第1族元素の水酸化物が水に溶けたときに全て強アルカリ性であるという事実に由来している[26]。
1939年にキュリー研究所 (パリ)のマルグリット・ペレーがアクチニウム227のサンプルを精製することでフランシウムを発見したが、その前に少なくとも4つの誤った発見や不完全な発見があった[27][28][29]。彼女は80keV未満のエネルギー準位の崩壊素粒子に着目。この崩壊活動がまだ未特定な崩壊生成物によって引き起こされた可能性がある、とペレーは考察した。様々な試験により、その未知の元素がアルカリ金属の化学的性質(セシウム塩との共沈など)を示したことで、ペレーはそれをアクチニウム227のアルファ崩壊によって引き起こされた元素番号87の元素だと確信した[30]。
- 227
89Ac 223
87Fr 223
88Ra 219
86Rn
周期表でフランシウムの下に存在する筈だとされている第1族元素が、元素番号119の仮名ウンウンエンニウム(Uue)である[31]:1729-1730。ウンウンエンニウム合成の試みは、1985年に米カリフォルニア州の重イオン線形加速器(superHILAC)で標的のアインスタイニウム254にカルシウム48イオンを衝突させる実験が初めて行われたが、同原子は確認されなかった[32][33]。
- 254
99Es + 48
20Ca → Uue* → 原子できず[注 1]
アインスタイニウム254(これは質量が大きく、半減期が270日と比較的長く、超重元素の製造に適している)[34]を実験に充分なほど製造する作業も非常に困難であることを考えると、近い将来にこの反応がウンウンエンニウム元素を生じさせる可能性は極めて低い[32]。アインスタイニウムは自然界で発見されておらず実験室で作られるのみであり、超重元素の効率的合成に必要な量よりも少ない量しか製造されていないためである。ただし、ウンウンエンニウムが拡張周期表で最初の第8周期元素に過ぎないことを考えると、近い将来に他の反応から発見される可能性があり、実際に日本で合成の試みが現在進行中である[35][36]。 2022年現在、第8周期元素はまだ発見されていないが、中性子ドリップラインの不安定性から最大で元素番号128辺りまでの第8周期元素が物理的に生成できる可能性がある[37][38]。これ以上に重い第1族元素合成の試みは行われておらず、その非常に大きな元素番号のため、生成するには現時点以上に強力かつ新たな技術手法が必要になる筈だとされている[31]:1737-1739。
性質
[編集]通常アルカリ金属に分類されるリチウム、ナトリウム、カリウム、ルビジウム、セシウムは性質が非常に似通っている。ただしリチウムは直接窒素と反応するなど、一部の物性において他のアルカリ金属元素とは異なった性質を有している[39]。
また、還元性を持ち、水素を除いてその酸化数は常に+1となる。アルカリ金属においては原子番号が上がるほど化学反応性、密度は大きくなり、融点、沸点は下がるという性質を持つ。
第1族元素に分類されている水素は他のアルカリ金属元素とは性質が著しく異なる。この違いは電子配置の閉殻構造の有無に起因する。アルカリ金属元素の場合、一価の陽イオンが生成すると閉殻構造の寄与により非常に安定化する。一方、水素の陽イオンであるプロトンはむき出しの正電荷であるため、電子を核から引き離すためのイオン化エネルギーが非常に大きく、閉殻構造が無く安定化の寄与が存在しない。このようなs電子のふるまいの違いが、水素には共有結合性を与え、アルカリ金属元素には金属性を与えることになる。
リチウムとその他のアルカリ金属元素の違いは、リチウムのイオン半径に起因している。リチウムはイオン半径が小さいため、電荷/イオン半径比が他のアルカリ金属元素と比較して著しく大きい。そのため、反応性や化合物の性質において、1価のアルカリ金属イオンよりもむしろ、同様に電荷/イオン半径比の大きい2価のアルカリ土類金属元素であるマグネシウムイオンに類似した性質を示す[39]。例えば、リチウムはマグネシウムと同様、窒素と直接反応して窒化物を形成するが、他のアルカリ金属元素は窒素に対して反応しない。また、リチウムの硫酸塩は、他のアルカリ金属の硫酸塩がミョウバンを形成するのと対照的に、ミョウバンを形成しない[40]。
第1族元素は、仕事関数が小さく、原子半径が大きいという特徴がある。
| 水素 1H |
リチウム 3Li |
ナトリウム 11Na |
カリウム 19K |
ルビジウム 37Rb |
セシウム 55Cs |
フランシウム 87Fr | |
|---|---|---|---|---|---|---|---|
| 電子配置 | 1s1 | [He]2s1 | [Ne]3s1 | [Ar]4s1 | [Kr]5s1 | [Xe]6s1 | [Rn]7s1 |
| 第1イオン化エネルギー (kJ·mol−1) |
1312 | 513.3 | 495.8 | 418.8 | 403.0 | 375.7 | 392.8 |
| 電子付加エンタルピー (kJ·mol−1) |
− | − | − | − | 46.88 | 45.51 | − |
| 電子親和力 (kJ·mol−1) |
72.77 | 59.63 | 52.87 | − | − | − | − |
| 電気陰性度 (Allred−Rochow) |
2.20 | 0.97 | 1.01 | 0.91 | 0.89 | 0.86 | − |
| イオン半径 (pm, M+) |
−4 (2配位) | 73 (4配位) 90 (6配位) |
113 (4配位) 116 (6配位) |
152 (6配位) 165 (8配位) |
166 (6配位) 175 (8配位) |
181 (6配位) 202 (12配位) |
− |
| 共有結合半径 (pm) |
37 | 134 | 154 | 196 | 211 | 225 | 260 |
| van der Waals半径 (pm) |
120 | 182 | 227 | 275 | 244 | 343 | 348 |
| 融点 (K) |
14.025 | 453.69 | 370.87 | 336.53 | 312.46 | 301.59 | 300 |
| 沸点 (K) |
20.268 | 1615 | 1156 | 1032 | 961 | 944 | 950 |
| 還元電位 E0 (V, M+/M) | 0 | −3.040 | −2.713 | −2.929 | −2.924 | −2.923 | − |
単体金属
[編集]
アルカリ金属の単体は、すべて銀色の金属光沢を放つ金属である。電気伝導性および熱伝導性は、他の金属と同様極めて良好である。しかし、それ以外の性質は、他の金属と比べて特異的である。第一に、ほとんどの金属が高い融点を持つ中で、アルカリ金属は比較的融点が低く、かつ重い元素ほど低い。セシウムは常温より少しだけ高い29℃で融解する。ナトリウムはその高い熱伝導性と低い融点(98℃)が故に、原子炉の冷却材としても用いられる。また、アルカリ金属は他の金属と比べて非常に柔らかい金属である。リチウムはナイフで切断でき、カリウムはバターのように押しつぶすことができる。さらに特異な性質として、その密度の低さがあげられる。リチウム、ナトリウム、カリウムは比重が1以下で水に浮く。特にリチウムの密度は水の半分程度で、もし反応性と柔らかさにさえ目をつぶれば、船を造るのに最適な金属であろう。
いずれも反応性は高く、周期表の周期が大きくなるほど、結晶エネルギー(解離エンタルピー)が低減するため、激しく反応する傾向が見られる。リチウムおよびナトリウムの単体金属を得るためには、これらの酸化還元電位がいずれも非常に低い(つまり非常に還元されにくい)が、溶融塩を電気分解することで生産することができる[41]。(水溶液だとH2Oが分解され水素が発生する)カリウム、ルビジウム、セシウムは低融点かつ気化しやすいため単純な電気分解による生産には適しておらず、カリウムは溶融させた塩化カリウムをナトリウム蒸気と反応させることで作られ、ルビジウムおよびセシウムはそれぞれの水酸化物を金属マグネシウムや金属カルシウムによって還元させることで得られる[42][43]。代表的な工業生産法には、溶融した塩化ナトリウムに融点降下剤として塩化カルシウムを加え、それを電気分解することで金属ナトリウムを得るダウンズ法がある[44]。このアルカリ金属元素の強い還元性は他にも、有機化学の分野におけるバーチ還元 (Bürch reduction) などに利用される。
いずれのアルカリ金属元素単体も水、あるいは空気中の酸素と反応する為に、それらを避けるためにミネラルオイルの中に保存される。オイルを拭って放置すると自然発火することもあるので取り扱いは考慮する必要がある(危険物3類)。アルカリ金属の反応性の高さは原子量の大きいものほど高い傾向があるが、窒素との反応に関しては例外的にリチウムのみが直接的な反応によって窒化リチウム (Li3N)を生成する[39]。水やアルコールなどプロトン溶媒とは水素ガスを発して反応し、生成する水酸化物や金属アルコキシドなどは強塩基として利用される。アルカリ金属イオンはハロゲンイオンなど種々のアニオンと水溶性の塩を作る。これは、アルカリ金属イオンが強く水和することの寄与が大きい。これらのアルカリ金属塩の溶解性はアルカリ金属イオンの挙動に強く影響される。例えば、クラウンエーテルやクリプタンドなどはアルカリ金属イオンと包摂化合物を形成し、塩は有機溶媒に可溶となることが知られている。
水とカリウムの反応は次の式であらわされる。
アルカリ金属は一般的の金属に比べて異常に高い反応性を持つため、超金属とも呼ばれる。特に水との反応は劇的であり、重い元素ほど高い反応性を示す。
アルカリ金属元素は、いずれも炎色反応を示す[45]。ナトリウムの発光はD線と呼ばれる波長589 nmの単色光であるため、単色光でないと測定ができない旋光度を測定するための光源に利用される[46]。このD線は、実際は1本の輝線ではなく、波長589.592 nmのD1線と波長588.995 nmのD2線の2本に分かれた双子線である。これは、ナトリウムの最外殻電子のスピンが2方向あるためであり、同様の理由によりナトリウム以外のアルカリ金属元素のスペクトルも双子線となる[47]。セシウムのみは励起に必要な高温を得るために、酸水素炎で観察する必要がある。
| リチウム | ナトリウム | カリウム | ルビジウム | セシウム | フランシウム |
|---|---|---|---|---|---|
| 深紅色 | 黄色 | 紫色 | 深赤色 | 青紫色 | 未確認 |
フランシウムは放射性元素で天然からは産出されないが、核反応により少量合成されアルカリ金属としての物性を持つことが確認されている。余談だが、フランスの科学者ペレーがこのアルカリ金属を単離した際に、母国にちなんでフランシウムと名付けた。またガリウムはフランスを表すラテン語のガリアにちなんで名づけられており、フランスは二つの元素の命名の由来となっている。
アルカリ金属の単体は低温においてはいずれも体心立方格子の等軸晶系の結晶であるが、常温においてはカリウム、ルビジウム、セシウムは正方晶系の結晶となる[48]。
仕事関数が小さいという特長を活かして光電子増倍管の光電面材料にはアルカリ金属を主成分とした合金が利用され[49]、スーパーカミオカンデで使用されたものではバイアルカリと呼ばれるSb-K-Cs合金が用いられている[50]。
リチウム
[編集]この節の出典:[51]
すでに述べたように、リチウムは全金属中で最も低い密度を持つ。この軽さは航空産業や宇宙産業で用いる材料の素材として極めて有用である。例えば合金の一種であるLA 141(リチウム14%、アルミニウム1%、マグネシウム85%)の密度は1.35 g/cm3であり、現在最も広く用いられている低密度金属の一つである。
金属リチウムは銀色を呈するが、空気にさらすと速やかに酸素と反応して黒変する。窒素と反応する元素は周期表全体でみても元々少数であるが、リチウムはその中の唯一のアルカリ金属である。窒素分子の三重結合の結合エネルギーは945 kJ/molであり、これより安定な窒化物を与えるためには、生成物の格子エネルギーを十分に高める必要がある。アルカリ金属中では、最も高い電子密度を誇るリチウムのみがこの条件を満足することができる。
このように生成された窒化リチウムは決して安定ではなく、水を加えるとアンモニアと水酸化物を生じる。
液体リチウムは最も腐食性の高い物質と知られ、例えばリチウムをガラス容器の中で溶解させたときには、ガラスと反応して容器に穴をあけるほどである。さらに、リチウムはすべての元素のうち最も低い標準電極電位を示す。
ナトリウムは他のアルカリ金属と同様、非常に高い反応性を示すため、単体は天然には存在しない。しかしながら、金属ナトリウムは産業からの需要が最も大きい金属の一つである。金属ナトリウムは多くのナトリウム化合物の合成に用いられるが、最も有用な利用は他の希少金属の還元に使うことであろう。例えば金属チタンは四塩化チタンを金属ナトリウムで還元することで得られる。
生成系を水で洗い流せば金属チタンが残る。
金属ナトリウムの別の使い方は、オクタン価を上げるためのガソリン添加剤の原料である。テトラエチル鉛(アンチノック剤)の製造に鉛-ナトリウム合金が使用される。
テトラエチル鉛は毒性が強く、また使用後の廃棄物によって鉛汚染を引き起こすため、各国で規制の流れがあるが、今もなお多くの国で使用されている。
金属ナトリウムは塩化ナトリウムを適切に電気分解することで得られる(タウンズ法)。この方法では塩化カルシウムを添加して融点を引き下げた融解塩化ナトリウムを、陽極にグラファイト、陰極に鉄を用いて電気分解する。純粋な塩化ナトリウムの融点は800.4℃であるが、67%を塩化カルシウムに置き換えることで融点を580℃まで引き下げることができ、工業化の範疇となる。このようにして得られた液体金属ナトリウムは2%のカルシウムを含むが、110℃まで冷却するとカルシウム(融点842℃)は固化して沈んでしまい、ナトリウム(融点98℃)を純粋な形で得ることができる。
天然のカリウムは放射性同位体であるカリウム40を0.012%含む。カリウム40にはβ壊変によってカルシウム40になる経路と電子捕獲によってアルゴン40になる経路の二つがある。カリウム40の約11%が後者の経路を通る。すでに固化したマグマの中でこの反応が起こると、発生したアルゴンは岩石に閉じ込められることとなる。これを用いた岩石の年代測定が広く行われている。
金属カリウムの製法は他と比べてエレガントで面白い。金属カリウムはあまりにも反応性が高いため、電解槽で生成して集めるのは現実的な方法ではない。化学的に還元してやれば良い。すなわち850℃で液体金属ナトリウムと液体塩化カリウムを直接反応させる。
イオン化傾向系列でカリウムはナトリウムの左にくる為、通常この可逆反応はあまり右に進まない。しかしこの温度ではカリウムは気体となるので、反応で生じたカリウムガスを系外に吸い出し続ければ、ルシャトリエの原理により反応を無理やり右向きに進行させることができる。
化合物
[編集]水素化物
[編集]乾燥条件下においてアルカリ金属を水素気流下で加熱することによって、アルカリ金属は一般式 MH で表されるような1価の水素化物を形成するが、これらは水素化リチウムを除き不安定であり[52]、成分元素単体に乖離しやすい。また水の存在下では容易に加水分解を受けてアルカリ金属水酸化物と水素に分解する。これらの水素化物は塩化ナトリウム型構造を取るイオン型水素化物であり[53]、ヒドリド供与体として、塩基や還元剤として利用される。また、水素化ホウ素ナトリウムや水素化アルミニウムリチウムなどの三元化合物も形成される[53]。
酸化物
[編集]アルカリ金属は、一般式 M2O で表される酸化物を形成する。空気中の酸素と直接反応するため、新鮮なアルカリ金属単体の切断面は金属光沢を示すものの、速やかに酸化物など(一部は水酸化物)に覆われて光沢を失う。
また、空気中で燃焼させるとリチウムでは主に酸化物を生成するが、ナトリウムでは主に一般式 M2O2 であらわされる金属過酸化物を形成し、カリウム以上の周期の元素の場合は一般式 MO2 で表される金属超酸化物も形成することが知られている。これはイオン半径の大きな陽イオンほど、格子エネルギー効果によって対となる大きな陰イオンを安定化させることができ、不安定な過酸化物イオンや超酸化物イオンとでも安定な化合物が形成できるためである[54]。一方、過酸化リチウムを形成するためには金属リチウムを過酸化水素と反応させる必要があり[55]、超酸化ナトリウムを形成するためには高温高圧の条件が必要となる[56]。アルカリ金属元素の超酸化物は全て常磁性体であり、歪んだ塩化ナトリウム型構造を取る[56]。また、アルカリ金属の水酸化物とオゾンとの反応によってオゾン化物が形成される[57]。このオゾン化物の安定性もまた、対となる陽イオンのイオン半径の大きさに比例する[58]。
アルカリ金属は電気陰性度が低く電気的に非常に陽性であるため、酸化物は発熱を伴い水と激しく反応して水酸化物を生成し、過酸化物は激しく加水分解して過酸化水素あるいは酸素を発生させ、超酸化物も水溶液中では次第に分解して酸素を発生する[54]。
アルカリ金属に限定しない酸化物の一般的性質については、酸素・酸化物それぞれの項目を参照のこと。
水酸化物
[編集]アルカリ金属は、一般式MOHで表される水酸化物を形成する。低融点な無色の結晶であり、融点付近の350°Cから400°Cで昇華する[59]。水酸化リチウムを除いて全て潮解性を有し、水やアルコールには発熱しながら容易に溶解する[60]。アルカリ金属の水酸化物の水溶液では、アルカリ金属イオンと水酸化物イオンにほぼ完全に電離しているため非常に強い塩基性を示す[61]。気体状態においては(MOH)2で表される二量体を形成し、気体状態における塩基性の強さはアルカリ金属の原子量が大きくなるほど塩基性が強くなるが、溶液中における塩基性の強さは溶媒効果などの影響を受けるためこの限りではない[59]。また非常に強い腐食性を有し、溶融状態においては白金すらも侵食する[60]。空気中の二酸化炭素を吸収して炭酸塩を形成しやすく[62]、市販の水酸化物はわずかに炭酸塩を含んでいる。例えば、日本産業規格(JIS)において試薬の水酸化ナトリウムや水酸化カリウムでは炭酸塩の含量が1.0 %以下でなければならないと規定されている[63]。
アルカリ金属の水酸化物は、工業的には対応するアルカリ金属の塩化物の電気分解や、アルカリ金属の炭酸塩または硫酸塩とアルカリ土類金属の水酸化物とを複分解させることによって得られる[64]。ナトリウムおよびカリウムでは前者の電解法が、ルビジウムおよびセシウムでは後者の複分解法が主に用いられている[65]。アルカリ金属の水酸化物の中でも水酸化ナトリウムは安価なアルカリ源他様々な用途に用いられる工業的に非常に重要な物質であり、日本において2010年度で年間902,178トンもの量が消費されている[66]。
ハロゲン化物
[編集]一般に、アルカリ金属のハロゲン化物は常温で固体であり、フッ化リチウム (LiF、溶解度は水100gに対して0.27g(18°C))[67]やフッ化ナトリウム (NaF、溶解度は水100gに対して4g(0°C))[68]などの例外はあるものの、ほぼ全て水溶性が高い塩である。上記で述べられているように、塩の水溶性に大きく関与する要因として、アルカリ金属イオンの水和で得られるエネルギーとイオン結晶格子の切断にともない失われるエネルギーとの収支の損得が挙げられる(記事 溶液・溶解 に詳しい)。フッ化リチウムの水溶性が低い(25 ℃ にて、0.13 g/100 mL)ことについては、フッ化物イオン (F−) もリチウムイオン (Li+) もイオン半径が同程度に小さいためにフッ化リチウムの結晶格子は小さく強い結合から成る一方、フッ化リチウムの結晶が溶解してイオンが水和を受ける際の水和エネルギーは大きいものの格子エネルギーを打ち消す程ではない事による[69]。
| 物質 | 格子エネルギー |
水和エンタルピー変化 |
溶解エンタルピー変化 |
溶解エントロピー変化 |
溶解ギブス自由エネルギー変化 |
|---|---|---|---|---|---|
| フッ化リチウム | 1046.4 kJ mol−1 | −1041.5 kJ mol−1 | 4.8 kJ mol−1 | −36.1 J mol−1K−1 | 15.6 kJ mol−1 |
アルカリ金属のハロゲン化物の水溶液の pH は中性に近いことが多いが、フッ化物やヨウ化物の中には微弱な塩基性を示すものがある(例:飽和 NaF 水溶液で、pH 7.4)。これはフッ化水素が弱酸でありフッ化物イオンが僅かに加水分解すること、またヨウ化水素は強酸であるものの、ヨウ化物イオンが酸化されやすく極一部が次亜ヨウ素酸塩などに変化していることによる。アルカリ金属のハロゲン化物の熱的な安定性は、アルカリ金属側の原子番号が大きいほど安定であり、またハロゲン側の原子番号が小さいほど安定である[70]。
一連のハロゲン化物の中で、地球上に最も広く存在するものが塩化ナトリウム (NaCl) である。
構造
[編集]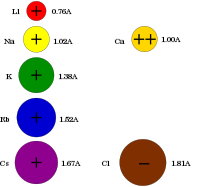
アルカリ金属元素のハロゲン化物はいずれも単純な等軸晶系を取る[71]。リチウム、ナトリウム、カリウムおよびルビジウムのハロゲン化物は通常6配位の「塩化ナトリウム型構造」と呼ばれる最密充填構造である面心立方格子を取り、フッ化セシウム以外のハロゲン化セシウムは8配位の「塩化セシウム型構造」と呼ばれる最密充填構造ではない体心立方格子を取る[72]。しかし、塩化ルビジウムは低温では塩化セシウム型構造を優先的に形成することが知られており[73]、また塩化セシウムは445°Cで塩化ナトリウム型構造へと相転移する[67]。このようなハロゲン化物の構造の違いはアルカリ金属元素とハロゲン化物イオンのイオン半径比によるものであり、イオン半径比 (r+/r-)0.72を境に構造の変化が起こる[74]。これは、イオン結晶が配位数の多さおよび陽イオンと陰イオン同士の充填率の高さによって安定化する性質に由来しており、剛体球近似による理論計算から、陽イオンと陰イオンのイオン半径比が小さい(陽イオンのイオン半径が小さい)と少ない配位数で密に詰まる方が安定であり、陽イオンと陰イオンのイオン半径比が大きい(陽イオンのイオン半径が大きい)と多い配位数で最密充填を取らない方が安定となるためである[75]。
合金
[編集]アルカリ金属は水銀と反応してアマルガムを形成する[76]。ナトリウムのアマルガムは、高純度な水酸化ナトリウムを製造するための水銀法とよばれる手法において用いられる[77]。また、ナトリウムアマルガム電極として、通常の電極を用いることができないアルカリ金属の電極反応などにも利用される[78]。ナトリウムアマルガムは、ナトリウムの割合を増やせば固体、減らせば液体となる性質があり強力な還元剤としても用いられる[76]。
リチウム以外のアルカリ金属元素は、溶融させることでそれぞれ任意の割合で混合して合金を与えるが、リチウムはナトリウムとは380°C以上の条件で合金を作ることができるものの、それ以外のアルカリ金属元素とは合金を作ることができない[39]。アルカリ金属同士の合金で重要なものはナトリウムカリウム合金であり、カリウム含有率77.2 %のもので融点が-12.3°Cと常温で液体な低融点合金である[42]。その高い比熱によって核反応における熱媒体としての利用が検討されていたが、より安全な溶融ナトリウムへと移りこの用途では現在用いられていない[42]。また、モル濃度で41%のセシウム、47%のカリウム、12%のナトリウムからなる合金は、すべての合金の中で最低の融点 (−78 °C) を持つ[79][80]
脚注
[編集]注釈
[編集]出典
[編集]- ^ コトバンク「アルカリ金属」の解説より
- ^ MSNニュース「ホントに使われていた、世にも奇妙な世界の「通貨」8選」2016年12月16日
- ^ Marggraf, Andreas Siegmund (1761) (ドイツ語). Chymische Schriften. p. 167
- ^ du Monceau, H. L. D.. “Sur la Base de Sel Marine” (フランス語). Mémoires de l'Académie Royale des Sciences: 65-68.
- ^ a b Weeks, Mary Elvira (1932). “The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium”. Journal of Chemical Education 9 (6): 1035. Bibcode: 1932JChEd...9.1035W. doi:10.1021/ed009p1035.
- ^ a b Siegfried, R. (1963). “The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements”. Isis 54 (2): 247-258. doi:10.1086/349704. JSTOR 228541. PMID 14147904.
- ^ Enghag, P. (2004). “11. Sodium and Potassium”. Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 978-3-527-30666-4
- ^ Davy, Humphry (1808). “On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies”. Philosophical Transactions of the Royal Society of London 98: 1-44. doi:10.1098/rstl.1808.0001.
- ^ Shaposhnik, V. A. (2007). “History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)”. Journal of Analytical Chemistry 62 (11): 1100-1102. doi:10.1134/S1061934807110160.
- ^ “Petalite: Petalite mineral information and data” (24 August 2011). 27 November 2011閲覧。
- ^ a b Winter, Mark. “WebElements Periodic Table of the Elements | Lithium | historical information”. 27 November 2011閲覧。
- ^ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. p. 124. ISBN 978-0-7661-3872-8 10 August 2009閲覧。
- ^ “Johan Arfwedson”. 5 June 2008時点のオリジナルよりアーカイブ。10 August 2009閲覧。
- ^ a b van der Krogt, Peter. “Lithium”. Elementymology & Elements Multidict. 5 October 2010閲覧。
- ^ Clark, Jim (2005年). “Compounds of the Group 1 Elements”. chemguide. 10 August 2009閲覧。
- ^ Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 978-0-313-33438-2
- ^ a b Leach, Mark R. (1999–2012). “The Internet Database of Periodic Tables”. meta-synthesis.com. 6 April 2012閲覧。
- ^ Kaner, Richard (2003年). “C&EN: It's Elemental: The Periodic Table - Cesium”. American Chemical Society. 25 February 2010閲覧。
- ^ Kirchhoff, G.; Bunsen, R. (1861). “Chemische Analyse durch Spectralbeobachtungen”. Annalen der Physik und Chemie 189 (7): 337-381. Bibcode: 1861AnP...189..337K. doi:10.1002/andp.18611890702. オリジナルの2022-10-09時点におけるアーカイブ。.
- ^ Weeks, Mary Elvira (1932). “The discovery of the elements. XIII. Some spectroscopic discoveries”. Journal of Chemical Education 9 (8): 1413?1434. Bibcode: 1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ^ "caesium". Oxford English Dictionary (2nd ed.). Oxford University Press. September 2005. (要購読、またはイギリス公立図書館への会員加入。)
- ^ Newlands, John A. R. (20 August 1864). “On Relations Among the Equivalents”. Chemical News 10: 94?95. オリジナルの1 January 2011時点におけるアーカイブ。 25 November 2013閲覧。.
- ^ Newlands, John A. R. (18 August 1865). “On the Law of Octaves”. Chemical News 12: 83. オリジナルの1 January 2011時点におけるアーカイブ。 25 November 2013閲覧。.
- ^ Mendelejew, Dimitri (1869). “Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente” (ドイツ語). Zeitschrift für Chemie: 405-406.
- ^ Jensen, William B. (2003). “The Place of Zinc, Cadmium, and Mercury in the Periodic Table”. Journal of Chemical Education (American Chemical Society) 80 (8): 952-961. Bibcode: 2003JChEd..80..952J. doi:10.1021/ed080p952. オリジナルの11 June 2010時点におけるアーカイブ。 2012年5月6日閲覧。.
- ^ Royal Society of Chemistry. “Visual Elements: Group 1 – The Alkali Metals”. Visual Elements. Royal Society of Chemistry. 5 August 2012時点のオリジナルよりアーカイブ。13 January 2012閲覧。
- ^ Fontani, Marco (10 September 2005). "The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do)". International Conference on the History of Chemistry. Lisbon. p. 18. 2006年2月24日時点のオリジナルよりアーカイブ。2007年4月8日閲覧。
- ^ “Education: Alabamine & Virginium”. Time. (15 February 1932). オリジナルの30 September 2007時点におけるアーカイブ。 1 April 2007閲覧。
- ^ MacPherson, H. G. (1934). “An Investigation of the Magneto-Optic Method of Chemical Analysis”. Physical Review (American Physical Society) 47 (4): 310-315. Bibcode: 1935PhRv...47..310M. doi:10.1103/PhysRev.47.310.
- ^ Adloff, Jean-Pierre; Kaufman, George B. (25 September 2005). Francium (Atomic Number 87), the Last Discovered Natural Element Archived 4 June 2013 at the Wayback Machine.. The Chemical Educator 10 (5). Retrieved 26 March 2007.
- ^ a b Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). “Transactinides and the future elements”. In Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5
- ^ a b Lougheed, R. W.; Landrum, J. H.; Hulet, E. K.; Wild, J. F.; Dougan, R. J.; Dougan, A. D.; Gäggeler, H.; Schädel, M. et al. (1985). “Search for superheavy elements using 48Ca + 254Esg reaction”. Physical Review C 32 (5): 1760-1763. Bibcode: 1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760. PMID 9953034.
- ^ van der Krogt, Peter. “Ununennium”. Elementymology & Elements Multidict. 14 February 2011閲覧。
- ^ Schadel, M.; Brüchle, W.; Brügger, M.; Gäggeler, H.; Moody, K.; Schardt, D.; Sümmerer, K.; Hulet, E. et al. (1986). “Heavy isotope production by multinucleon transfer reactions with 254Es”. Journal of the Less Common Metals 122: 411-417. doi:10.1016/0022-5088(86)90435-2.
- ^ “Hunt for element 119 set to begin”. Chemistry World. (12 September 2017) 9 January 2018閲覧。
- ^ マイナビニュース「JAEAなど、原子番号119以降の元素合成のカギとなるパラメータの決定に成功」2022年2月17日
- ^ Seaborg, G. T. (c. 2006). "transuranium element (chemical element)". Encyclop?dia Britannica. 2010年3月16日閲覧。
- ^ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). New York, NY: Oxford University Press. p. 593. ISBN 978-0-19-960563-7
- ^ a b c d コットン、ウィルキンソン (1987) 250頁。
- ^ コットン、ウィルキンソン (1987) 250-251頁。
- ^ 千谷 (1959) 73-75頁。
- ^ a b c コットン、ウィルキンソン (1987) 252頁。
- ^ 千谷 (1959) 74、75頁。
- ^ JAKES CLOYD DOWNS (1924-07-15), ELECTROLYTIC PROCESS AND CELL, Patent 1501756 2011年6月2日閲覧。
- ^ 千谷 (1959) 82頁。
- ^ ブルース (2009) 239頁。
- ^ 千谷 (1959) 83頁。
- ^ 千谷 (1959) 83、84頁。
- ^ 光電子増倍管 構造・特性, p. 6 2011年8月27日閲覧。
- ^ 光電子増倍管, Kamioka Observatory, ICRR, Univ. of Tokyo 2011年8月27日閲覧。
- ^ a b c Muki kagaku.. Rayner-Canham, Geoffrey., Overton, T. (Tina), Nishihara, hiroshi., Takagi, shigeru., Moriyama, hiroshi., 西原, 寛. 東京化学同人. (2009). ISBN 978-4-8079-0684-0. OCLC 1022213386
- ^ 千谷 (1959) 81、87頁。
- ^ a b ベル、ロット (1968) 290頁。
- ^ a b コットン、ウィルキンソン (1987) 255頁。
- ^ 千谷 (1959) 90頁。
- ^ a b ベル、ロット (1968) 291頁。
- ^ コットン、ウィルキンソン (1987) 496頁。
- ^ コットン、ウィルキンソン (1987) 497頁。
- ^ a b コットン、ウィルキンソン (1987) 256頁。
- ^ a b 千谷 (1959) 93、94頁。
- ^ 千谷 (1959) 93頁。
- ^ 櫻井、鈴木、中尾(2005) 25頁。
- ^ 日本産業規格 JIS K 8576, JIS K 8574
- ^ 千谷 (1959) 93頁。
- ^ 千谷 (1959) 94頁。
- ^ 化学工業統計 2010年度年報, 経済産業省 2011年6月2日閲覧。
- ^ a b 千谷 (1959) 102頁。
- ^ 千谷 (1959) 103頁。
- ^ コットン、ウィルキンソン (1987) 257頁。
- ^ ベル、ロット (1968) 292頁。
- ^ 千谷 (1959) 100頁。
- ^ 千谷 (1959) 101-102頁。
- ^ Pyper, N.C.; Kirkland, A. I.; Harding, J. H. (2006). “Cohesion and polymorphism in solid rubidium chloride”. Journal of Physics: Condensed Matter 18: 683–702. doi:10.1088/0953-8984/18/2/023.
- ^ 櫻井、鈴木、中尾(2005) 132頁。
- ^ コットン、ウィルキンソン (1987) 14-15頁。
- ^ a b コットン、ウィルキンソン (1987) 253頁。
- ^ 足立、岩倉、馬場 (2004) 31頁。
- ^ 小出 (2003) 136頁。
- ^ Kaner, Richard (2003年). “C&EN: It's Elemental: The Periodic Table – Cesium”. American Chemical Society. 2010年2月25日閲覧。
- ^ Taova, T. M. et al. (June 22, 2003). “Density of melts of alkali metals and their Na-K-Cs and Na-K-Rb ternary systems” (PDF). Fifteenth symposium on thermophysical properties, Boulder, CO, USA. 2010年9月26日閲覧。
参考文献
[編集]- F.A. コットン, G. ウィルキンソン『コットン・ウィルキンソン無機化学(上)』中原 勝儼(原書第4版)、培風館、1987年。ISBN 4563041920。
- 足立吟也、岩倉千秋、馬場 章夫『新しい工業化学-環境との調和をめざして』2004年。ISBN 4759809554。
- 小出直之『ビギナーズ化学』化学同人、2003年。ISBN 4759808779。
- 櫻井武、鈴木晋一郎、中尾安男『ベーシック無機化学』化学同人、2003年。ISBN 4759809031。
- 千谷利三『新版 無機化学(上巻)』産業図書、1959年。
- C.F.ベル、K.A.K.ロット『ベル・ロット無機化学-その現代的理解のために』(第2版)東京化学同人、1968年。
- P.Y.ブルース『ブルース有機化学(上)』大船泰史ほか(第5版)、化学同人、2009年。ISBN 4759811680。











