「炭素」の版間の差分
m r2.7.1) (ロボットによる 変更: zh-min-nan:Thoàⁿ-sò͘ |
Anaka Satamiya (会話 | 投稿記録) m Cite webにおける引数修正・アーカイブ追加もしくはテンプレート変更 |
||
| (89人の利用者による、間の154版が非表示) | |||
| 1行目: | 1行目: | ||
{{元素 |
{{元素 |
||
|name=carbon |
|name=carbon |
||
|japanese name=炭素 |
|||
|number=6 |
|number=6 |
||
|symbol=C |
|symbol=C |
||
| 8行目: | 9行目: | ||
|above=- |
|above=- |
||
|below=[[ケイ素|Si]] |
|below=[[ケイ素|Si]] |
||
|series= |
|series=非金属元素 |
||
|group=14 |
|group=14 |
||
|period=2 |
|period=2 |
||
|block=p |
|block=p |
||
|crystal structure= |
|crystal structure= |
||
|appearance=透明 |
|appearance=透明(ダイヤモンド)、黒色(グラファイト) |
||
|image name=Diamond |
|image name=Diamond-and-graphite-with-scale.jpg |
||
|atomic mass=12.0107 |
|atomic mass=12.0107 |
||
|electron configuration= |
|electron configuration=[[[ヘリウム|He]]] 2s{{sup|2}} 2p{{sup|2}}{{sfn|桜井|1997|p=49}} |
||
|electrons per shell=2,4 |
|electrons per shell=2, 4 |
||
|phase=固体 |
|phase=固体 |
||
|density gpcm3nrt=非結晶質 |
|density gpcm3nrt=非結晶質<ref name="CRC">''Chemical Rubber Company Handbook of Chemistry and Physics'', 59th Edition, CRC Press, Inc, 1979</ref> 1.8–2.1 |
||
|density gpcm3nrt 2=グラファイト |
|density gpcm3nrt 2=グラファイト:2.260{{sfn|桜井|1997|p=49}} |
||
|density gpcm3nrt 3=ダイヤモンド |
|density gpcm3nrt 3=ダイヤモンド:3.513{{sfn|桜井|1997|p=49}} |
||
|sublimation point K=3915 |
|sublimation point K=3915 |
||
|sublimation point C=3642 |
|sublimation point C=3642 |
||
| 27行目: | 28行目: | ||
|triple point K=4600 |
|triple point K=4600 |
||
|triple point kPa=10800<ref name=triple2>{{cite journal|doi=10.1016/0008-6223(76)90010-5|title=Graphite-liquid-vapor triple point pressure and the density of liquid carbon☆☆☆|year=1976|author=Haaland, D|journal=Carbon|volume=14|pages=357 }}</ref><ref name=triple3>{{cite journal|doi=10.1016/j.carbon.2004.12.027|title=Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)|year=2005|author=Savvatimskiy, A|journal=Carbon|volume=43|pages=1115}}</ref> |
|triple point kPa=10800<ref name=triple2>{{cite journal|doi=10.1016/0008-6223(76)90010-5|title=Graphite-liquid-vapor triple point pressure and the density of liquid carbon☆☆☆|year=1976|author=Haaland, D|journal=Carbon|volume=14|pages=357 }}</ref><ref name=triple3>{{cite journal|doi=10.1016/j.carbon.2004.12.027|title=Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)|year=2005|author=Savvatimskiy, A|journal=Carbon|volume=43|pages=1115}}</ref> |
||
|heat fusion= |
|heat fusion=117(グラファイト) |
||
|heat capacity=8. |
|heat capacity=8.517(グラファイト)<br />6.155(ダイヤモンド) |
||
|electronegativity=2.55 |
|electronegativity=2.55 |
||
|number of ionization energies=3 |
|number of ionization energies=3 |
||
| 36行目: | 37行目: | ||
|atomic radius= |
|atomic radius= |
||
|atomic radius calculated= |
|atomic radius calculated= |
||
|covalent radius=77(sp |
|covalent radius=77 (sp{{sup|3}}), 73 (sp{{sup|2}}), 69 (sp) |
||
|Van der Waals radius=170 |
|Van der Waals radius=170 |
||
|oxidation states='''4''' |
|oxidation states=3, '''4'''<ref>{{citeweb|url=http://bernath.uwaterloo.ca/media/36.pdf |format=PDF|title=Fourier Transform Spectroscopy of the System of CP|accessdate=2011-03-27|language=英語}}</ref>, 2, 1 <ref>{{citeweb|url=http://bernath.uwaterloo.ca/media/42.pdf |format=PDF|title=Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical|accessdate=2011-03-27|language=英語}}</ref>, [[ホルムアルデヒド|0]], [[カーバイド|−1]], [[メタノール|−2]], [[エタン|−3]], '''−4'''<ref>{{citeweb|url=http://www.webelements.com/webelements/elements/text/C/comp.html|title=Carbon: Binary compounds| publisher=WebElements |accessdate=2011-03-27|language=英語}}</ref> |
||
|magnetic ordering=[[反磁性]]<ref> |
|magnetic ordering=[[反磁性]]<ref>{{citeweb|url= http://www-d0.fnal.gov/hardware/cal/lvps_info/engineering/elementmagn.pdf |format=PDF|title= Magnetic susceptibility of the elements and inorganic compounds | publisher= Handbook of Chemistry and Physics 81st edition, CRC press |accessdate=2011-03-27|language=英語}}</ref> |
||
|electrical resistivity= |
|electrical resistivity= |
||
|electrical resistivity at 0= |
|electrical resistivity at 0= |
||
|electrical resistivity at 20= |
|electrical resistivity at 20= |
||
|thermal conductivity=119- |
|thermal conductivity=119-165(グラファイト)<br />900-2300(ダイヤモンド) |
||
|thermal conductivity 2= |
|thermal conductivity 2= |
||
|thermal diffusivity= |
|thermal diffusivity= |
||
|thermal expansion= |
|thermal expansion= |
||
|thermal expansion at 25=0. |
|thermal expansion at 25=0.8(ダイヤモンド)<ref name=ioffe>{{citeweb|url= http://www.ioffe.ru/SVA/NSM/Semicond/Diamond |title=C-Diamond |accessdate=2011-03-27|language=英語}}</ref> |
||
|speed of sound= |
|speed of sound= |
||
|speed of sound rod at 20= |
|speed of sound rod at 20=18350(ダイヤモンド) |
||
|speed of sound rod at r.t.= |
|speed of sound rod at r.t.= |
||
|Tensile strength= |
|Tensile strength= |
||
|Young's modulus= |
|Young's modulus=1050(ダイヤモンド)<ref name=ioffe/> |
||
|Shear modulus= |
|Shear modulus=478(ダイヤモンド)<ref name=ioffe/> |
||
|Bulk modulus= |
|Bulk modulus=442(ダイヤモンド)<ref name=ioffe/> |
||
|Poisson ratio=0. |
|Poisson ratio=0.1(ダイヤモンド)<ref name=ioffe/> |
||
|Mohs hardness=1- |
|Mohs hardness=1-2(グラファイト)<br />10(ダイヤモンド) |
||
|CAS number=7440-44-0 |
|CAS number=7440-44-0{{sfn|化学工業日報|1996|pp=102-103|loc=【炭素化合物】}} |
||
|isotopes=[[炭素の同位体|15]] |
|isotopes=[[炭素の同位体|15]] |
||
{{Elementbox_isotopes_stable | mn=[[炭素12|12]] | sym=[[炭素12|C]] | na=98.9 |
{{Elementbox_isotopes_stable | mn=[[炭素12|12]] | sym=[[炭素12|C]] | na=98.9 %{{sfn|桜井|1997|p=49}}| n=6}} |
||
{{Elementbox_isotopes_stable | mn=[[炭素13|13]] | sym=[[炭素13|C]] | na=1.1% | n=7 |
{{Elementbox_isotopes_stable | mn=[[炭素13|13]] | sym=[[炭素13|C]] | na=1.1 %{{sfn|桜井|1997|p=49}} | n=7}} |
||
{{Elementbox_isotopes_decay | mn=[[炭素14|14]] | sym=[[炭素14|C]] | na= |
{{Elementbox_isotopes_decay | mn=[[炭素14|14]] | sym=[[炭素14|C]] | na=1.2×10{{sup|−8}} % | hl=5730 [[年|y]]{{sfn|桜井|1997|p=49}} | dm=[[β崩壊|β{{sup|−}}]] | de=0.156 | pn=14 | ps=[[窒素|N]]}} |
||
}} |
}} |
||
'''炭素'''(たんそ、 |
'''炭素'''(たんそ、{{lang-en-short|carbon}}、カーボン、{{lang-fr-short|carbone}}、{{lang-de-short|Kohlenstoff}})は、[[原子番号]]6の[[元素]]である<ref name="sato15">{{Cite book |和書 |author=佐藤健太郎|year=2013 |title=炭素文明論|page=15|publisher=新潮社 }}</ref>。[[元素記号]]は'''C'''<ref name="sato15" />。[[原子量]]は12.01。[[非金属元素]]、[[第14族元素]]、[[第2周期元素]]の一つ。 |
||
== 名称 == |
|||
[[有機物]]として全ての[[生物]]の構成材料となる。人体の乾燥重量の2/3は炭素である。これは[[蛋白質]]、[[脂質]]、[[炭水化物]]に含まれる原子の過半数が炭素であることによる。[[光合成]]や[[呼吸]]など生命活動全般で重要な役割を担う。また、[[石油]]・[[石炭]]・[[天然ガス]]などのエネルギー・原料として、あるいは[[二酸化炭素]]や[[メタン]]による[[地球温暖化]]問題など、人間の活動と密接に関わる元素である。 |
|||
フランス語の「{{lang|fr|carbone}}」は、1787年に[[フランス]]の化学者[[ルイ=ベルナール・ギトン・ド・モルボー|ギトン・ド・モルボー]]が「[[木炭]]」を指すラテン語carboから<ref>Shorter Oxford English Dictionary, Oxford University Press</ref>名づけた。英語のcarbonは、これが転じたものである{{sfn|桜井|1997|p=49}}。 |
|||
ドイツ語の「{{lang|de|Kohlenstoff}}」も「炭の物質」を意味する{{sfn|桜井|1997|p=49}}。 |
|||
日本語の「炭素」という語は、[[宇田川榕菴]]が著作『[[舎密開宗]]』にて用いたのがはじめとされる。 |
|||
== 特徴 == |
|||
[[単体]]・[[化合物]]両方においてきわめて多様な形状をとることができる。 |
|||
非金属の炭素には、4つの外殻電子と4つの空席がある。そのため、[[価電子]]数4<ref name=Newton2010 />と元素の中でももっとも多い4組の[[共有結合]]を持つことが可能であり、この特徴から多様な分子をつくる骨格となる<ref name=lanl/>{{sfn|桜井|1997|p=54}}。炭素がほかの元素と結びついて作る化合物の種類は約5,400万種にのぼる<ref name=Newton2010 />。 |
|||
[[融点]]や[[昇華 (化学)|昇華]]を起こす[[温度]]は全元素の中でもっとも高い。常圧下では融点を持たず、[[三重点]]は10.8±0.2[[メガ|M]][[パスカル (単位)|Pa]]、4,600±300[[ケルビン|K]]であり<ref name=triple2/><ref name=triple3/>、昇華は約3,900Kで起こる<ref name="triple">{{cite journal|journal = Nature|volume = 276|page= 695|year=1978|doi = 10.1038/276695a0|title = The controversial carbon solid−liquid−vapour triple point|first =A.|last = Greenville Whittaker}}</ref><ref>{{cite news|url = http://lbruno.home.cern.ch/lbruno/documents/Bibliography/LHC_Note_78.pdf |format=PDF|title =On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam| author = J.M. Zazula| year = 1997| accessdate=2011-03-27|language=英語|publisher = CERN}}</ref>。 |
|||
炭素原子同士の共有結合は非常に堅牢であり<ref name=Newton2010>{{Cite book| 和書|author=編集長:水谷仁|year=2010|title=[[ニュートン (雑誌)|ニュートン]]別冊周期表第2冊|publisher=[[ニュートンプレス]]|location= [[東京都]]|isbn=978-4-315-51876-4|pages=92-93|ref=ニュートン別2010}}</ref>、それがつくる単体において、自然物としてはもっとも硬いことで知られる[[ダイヤモンド]]からもっとも柔らかい部類に入る[[グラファイト]]まで、幅広い形態や[[同素体]]を持つ。 |
|||
== 歴史 == |
== 歴史 == |
||
炭素の単体は有機物を[[不完全燃焼]]すれば簡単に取り出せるため、[[先史時代|有史以前]]から知られていた{{sfn|桜井|1997|p=49}}<ref name=D2>{{cite web |url=http://chemistry.about.com/library/das/aa030303a.htm |title=Timeline of Element Discovery| accessdate=2011-03-27|language=英語}}</ref>。[[ダイヤモンド]]の存在も紀元前2500年ごろの[[古代中国]]では知られており、[[古代ローマ]]では今日と同様に木から[[木炭]]を得ていた。[[古代エジプト]]でも、[[粘土]]で密封した[[ピラミッド]]の中から空気を抜くために木を熱する方法が用いられた<ref name=ancient_China>{{cite news|url = http://news.bbc.co.uk/2/hi/science/nature/4555235.stm|title = Chinese made first use of diamond|publisher = BBC News|date= 17 May 2005| accessdate=2011-03-27|language=英語}}</ref><ref>{{cite web |url=http://elements.vanderkrogt.net/element.php?sym=C |title=Carbonium/Carbon at Elementymology & Elements Multidict |author= Peter van der Krogt |last=van der Krogt |first=Peter | accessdate=2011-03-27|language=英語}}</ref>。そのため、特定の元素発見者はいない{{sfn|桜井|1997|p=49}}。 |
|||
炭素の名は[[ラテン語]]の ''carbo''([[木炭]]の意)からきており、有機物を[[不完全燃焼]]すれば簡単に取り出せるため、有史以前から知られていた。[[ダイヤモンド]]も稀少で硬い石として知られていた。ヨーロッパでダイヤモンドが装飾品として使用されたのはカッティング技法が開発された中世以降である。<!-- エジプトでは紀元前から装飾品だった -->日本語の「炭素」という語は[[宇田川榕菴]]が著作『[[舎密開宗]]』にて用いたのがはじめとされる。[[20世紀]]後半以降は[[フラーレン]]をはじめとする多彩な形状の炭素が発見されている。 |
|||
[[File:Carl Wilhelm Scheele from Familj-Journalen1874.png|left|200px|thumb|[[カール・ヴィルヘルム・シェーレ]]]] |
|||
1722年、[[ルネ・レオミュール]]は鉄が[[鋼]]となるには何かしらの物質を吸収することを示したが、現在ではそれは炭素であることが明らかとなった<ref>{{cite book |author=R-A Ferchault de Réaumur |last=Ferchault de Réaumur |first=R-A |year=1722 |title=L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (English translation from 1956) |location=Paris, Chicago}}</ref>。1772年には[[アントワーヌ・ラヴォアジエ]]が燃焼によって水が生じず、重量あたり同じ比率の[[二酸化炭素]]を生じることを確かめ、ダイヤモンドが炭素の単体であることを証明した<ref name=Fred>{{cite web|author=Senese,Fred|date = 200-09-09|url = http://antoine.frostburg.edu/chem/senese/101/inorganic/faq/discovery-of-carbon.shtml|title=Who discovered carbon?|publisher=Frostburg State University| accessdate=2011-03-27|language=英語}}</ref>。1779年に[[カール・ヴィルヘルム・シェーレ]]は、[[グラファイト]]が従来考えられていたように[[鉛]]の一形態ではないと示し<ref name=Fred />、1786年に[[クロード・ルイ・ベルトレー]]、[[ガスパール・モンジュ]]、C.A.ヴァンデスモンドが炭素であることを明らかにした<ref>{{cite book|author=Federico Giolitti|year=1914 |
|||
|title=The Cementation of Iron and Steel|publisher=McGraw-Hill Book Company, inc.}}</ref>。彼らがこれを知らしめた際、この元素にcarboneという名をつけ、ラヴォアジエが1789年にまとめた元素のテキストに採録された<ref name=Fred />。 |
|||
同素体[[フラーレン]]が発見されたのは1985年であり<ref>{{cite journal|journal=Nature|volume=318|pages=162–163|year=1985|doi=10.1038/318162a0|title=C{{sub|60}}: Buckminsterfullerene|author=H. W. Kroto, J. R. Heath, S. C. O'Brien, R. F. Curl and R. E. Smalley}}</ref>、同じくナノ構造体としては[[バッキーボール]]や[[カーボンナノチューブ]]も見つかった<ref name="buckyballs">{{cite web|url=http://www.ch.ic.ac.uk/local/projects/unwin/Fullerenes.html|title=Fullerenes(An Overview)|author=Peter Unwin| accessdate=2011-03-27|language=英語}}</ref>。これらの発見は1996年[[ノーベル化学賞]]の授与対象となった{{sfn|桜井|1997|pp=51-52}}<ref>{{cite web |url=https://www.nobelprize.org/prizes/uncategorized/the-nobel-prize-in-chemistry-1996-1996/ |title=The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes" | accessdate=2011-03-27|language=英語}}</ref>。これらに触発された更なる同素体探査の結果、「[[ガラス状炭素]]」や、厳密には[[無定形]]ではないが名づけられた「[[無定形炭素]]」等の発見へつながった<ref name="glassy carbon">{{cite journal |author=PJF Harris |last=Harris |first=PJF |year=2004 |title=Fullerene-related structure of commercial glassy carbons |journal=Philosophical Magazine, 84, 3159–3167 |doi=10.1007/s10562-007-9125-6 |volume=116 |pages=122 |last2=Gallagher |first2=J. G. |last3=Hargreaves |first3=J. S. J. |last4=Harris |first4=P. J. F.}}</ref>。 |
|||
== 生成 == |
|||
炭素原子の生成には[[ヘリウム]]の原子核である[[アルファ粒子]]の3重衝突が必要となる。これには約1億度の熱が必要となるが、[[ビッグバン]]では宇宙がはじめに大きく膨張してすぐに急速に冷え、炭素は生成されなかったと考えられている{{sfn|青木|2004|pp=35-37|loc=第2章 ビッグバンと元素合成}}。しかし、その後形成された[[恒星]]内で[[トリプルアルファ反応]]による[[ヘリウム燃焼過程]]でエネルギーを放出しながら炭素が生成される{{sfn|青木|2004|pp=53-79|loc=第3章 星の中での元素合成}}。こうして作られた炭素は、主系列星の内部で[[水素]]がヘリウムになる[[CNOサイクル]]を媒介し、星のエネルギー放射に一役買っている{{sfn|尾崎|2010|pp=20-33|loc=第2章 太陽と太陽系、4-5節}}。 |
|||
== 分布 == |
|||
宇宙での存在比は水素、ヘリウム、[[酸素]]に次いで多い<ref name=BAE>{{cite web |url=https://www.daviddarling.info/encyclopedia/E/elbio.html|title=Biological Abundance of Elements|publisher = The Internet Encyclopedia of Science | accessdate=2011-03-27|language=英語}}</ref>。炭素は[[太陽]]や[[恒星]]、[[彗星]]のなかにも豊富に存在し、さまざまな[[惑星]]の[[大気]]にも含まれている。まれに[[隕石]]の中から微細なダイヤモンドが見つかることがあり、これは太陽系が[[原始惑星系円盤]]だったころ、またはそれ以前に[[超新星爆発]]時に生成されたものと考えられている<ref>{{cite book |author=Mark |last=Mark |year=1987 |title=Meteorite Craters |publisher=University of Arizona Press |isbn=0816509026}}</ref>。 |
|||
[[File:Carbon cycle-cute diagram.svg|thumb|200px|right|地球における二酸化炭素の循環図。黒数字はそれぞれの貯蔵量を、2004年推計量十億トン単位(GtC)で示す。紫数字は年間の移動量を表す。なお、炭酸塩や油母に蓄えられた7,000万GtC相当の炭素は含まれない]] |
|||
=== 地球 === |
|||
==== 元素分布 ==== |
|||
地球上でみると必ずしも割合的に非常にたくさん存在している元素というわけではない<ref name="sato15" />。地球の地表及び海洋の元素分布では炭素は重量比0.08%にすぎない<ref name="sato15" />(これは[[チタン]]や[[マンガン]]を下回る<ref>{{Cite book |和書 |author=佐藤健太郎|year=2013 |title=炭素文明論|pages=15-16|publisher=新潮社 }}</ref>)。ただ炭素は他の元素との結びつき方で、性質の異なる驚異的なほど多彩な化合物を作り出し、地球環境の中に存在している<ref name="sato16" />(後述)。 |
|||
[[地殻中の元素の存在度]]では15番目に多い炭素<ref name=BAE />の約9割が鉱物として存在し、中でも還元された形、すなわち炭素粒・[[石油]]・[[石炭]]・[[天然ガス]]中が4分の3以上を占める。4分の1が[[炭酸塩]]の[[岩石]]([[石灰岩]]、[[苦灰岩]] (CaMg(CO{{sub|3}}){{sub|2}})、[[結晶質石灰岩]]など)である。海洋など水に溶け込んだ炭酸も多く、その量は炭素量で36兆トン存在する。ついで[[生物圏]]に1兆9,000億トン、大気圏の[[二酸化炭素]]として8,100億トンがある。 |
|||
埋蔵石化燃料として石炭が9,000億トン、石油は1,500億トン、天然ガスが1,050億トンに加え、さらに[[シェールガス]]のような採掘しにくい形態で別に5,400億トンの存在が見込まれている<ref>{{cite web |url= http://www.newscientist.com/article/mg20627641.100-wonderfuel-welcome-to-the-age-of-unconventional-gas.html?full=true |title= Wonderfuel: Welcome to the age of unconventional gas, pp. 44–7|author= Helen Knight |publisher =[[New Scientist]] |date=12 June 2010| accessdate=2011-03-27|language=英語}}</ref>。これらとは別に、[[メタンハイドレート]]として極地に封じられ、これの炭素量はシベリアの永久凍土層だけでも1兆4,000億トンと見積もられる<ref>{{cite web |url= http://www.cosis.net/abstracts/EGU2008/01526/EGU2008-A-01526.pdf |format=PDF|title= Anomalies of methane in the atmosphere over the East Siberian shelf: Is there any sign of methane leakage from shallow shelf hydrates? 10|author= N. Shakhova, I. Semiletov, A. Salyuk, D. Kosmach |publisher=European Geosciences Union, General Assembly 2008, ''Geophysical Research Abstracts'' EGU2008-A-01526|date=2008| accessdate=2011-03-27|language=英語}}</ref>。 |
|||
==== 炭素循環 ==== |
|||
炭素は地球上で多様な状態を示している。炭素は地殻、海洋、生物圏、大気圏を循環しており、年間の移動量は約2,000億トンと見積もられている。 |
|||
{{main|炭素循環}} |
|||
惑星上では、ある元素がほかの元素に転換することは非常に稀である。したがって、地球に含まれる全炭素量はほぼ一定である。そのため、炭素を用いる過程はどこかでそれを獲得し、また放出することが必要となる。このような経路は、二酸化炭素の形で循環する体系を形成する。たとえば、植物は生育地の環境内で、呼吸によって二酸化炭素を放出する一方、光のエネルギーを用いて吸収した二酸化炭素から[[炭素固定|炭素を固定]]する[[カルヴィン回路]]を働かせ、植物組織を形成する。動物は植物を食べて炭素を吸収し、呼吸によって一部を排出する。このような短期的な循環だけでなく、より複雑な炭素循環も機能する。たとえば海洋は二酸化炭素を溶かし込み、枯れた植物や動物の死体は、バクテリアなどが消化しないと地中で石油や石炭などの形で炭素をとどめることもある。それらが化石燃料として利用されれば、燃焼によって再び炭素は放出される<ref>{{ cite journal|journal = Science|year = 2000|volume = 290|issue = 5490|pages = 291–296|doi = 10.1126/science.290.5490.291|title = The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System|author = P. Falkowski, R. J. Scholes, E. Boyle, J. Canadell, D. Canfield, J. Elser, N. Gruber, K. Hibbard, P. Högberg, S. Linder, F. T. Mackenzie, B. Moore III, T. Pedersen, Y. Rosenthal, S. Seitzinger, V. Smetacek, W. Steffen.|pmid = 11030643}}</ref>。 |
|||
[[File:Rough diamond.jpg|thumb|200px|right|天然ダイヤモンド結晶を含む鉱石]] |
|||
== |
==== 炭素化合物 ==== |
||
炭素の特性は他の元素と結びついて化合物を作る段階にある<ref name="sato16">{{Cite book |和書 |author=佐藤健太郎|year=2013 |title=炭素文明論|page=16|publisher=新潮社 }}</ref>。炭素は他の元素を束にしてもまったく歯が立たないほど多様な化合物の世界を作り出している<ref name="sato16" />。これまでに天然に発見されたものと化学者が人工的に作り出した化合物の数は7,000万を超えるといわれているが、その約8割は炭素化合物である<ref name="sato16" />。 |
|||
炭素原子の生成には[[ヘリウム]]の原子核である[[アルファ粒子]]の3重衝突が必要となる。これには約1億度の熱が必要となるが、[[ビッグバン]]では宇宙がはじめに大きく膨張してすぐに急速に冷え、炭素は生成されなかったと考えられている。そのかわり現在でも[[ヘルツシュプルング・ラッセル図|巨星]]内での[[トリプルアルファ反応]]によってヘリウムから炭素が生成されている。こうして作られた炭素は、重い主系列星の内部で水素がヘリウムになる[[CNOサイクル]]を媒介し、星のエネルギー放射に一役買っている。 |
|||
=== 生物 === |
|||
炭素は[[太陽]]や[[恒星]]、[[彗星]]のなかにも豊富に存在し、様々な[[惑星]]の[[大気]]にも含まれている。まれに[[隕石]]の中から微細なダイヤモンドが見つかることがありこれは太陽系が[[原始惑星系円盤]]だった頃、またはそれ以前に[[超新星爆発]]時に生成された物と考えられている。 |
|||
[[炭素-炭素結合]]で[[有機物]]の基本骨格をつくり、すべての[[生物]]の構成材料となる。[[人体]]を構成する元素の約18%が炭素といわれている<ref name="sato16" />。これは[[蛋白質]]、[[脂質]]、[[炭水化物]]に含まれる原子の過半数が炭素であることによる。[[光合成]]や[[呼吸]]など生命活動全般で重要な役割を担う。地表での炭素の重量比は0.08%にすぎないため、生命は自然界にあるわずかな炭素をかき集めてかろうじて成立している<ref name="sato16" /> |
|||
=== 鉱物 === |
|||
地球上では、化合物として[[大気]]・[[海]]・地中に広く存在する。約9割が地殻中に存在し、なかでも還元された形、すなわち炭素粒・[[石油]]・[[石炭]]・[[天然ガス]]が3/4以上を占める。1/4が[[炭酸塩]]の[[岩石]]([[石灰岩]]、[[苦灰岩]]<!-- (CaMg(CO<sub>3</sub>)<sub>2</sub>) -->、[[結晶質石灰岩]]など)である。地殻についで海洋に溶け込んだ炭酸が多い。3番目は陸棲生物の構成要素として、ついで大気圏の[[二酸化炭素]]、海棲生物である。炭素は地球上で多様な状態を示している。炭素は地殻、海洋、生物圏、大気圏を循環しており、年間の移動量は約2000億トンと見積もられている。<!-- 数値の一次的な出所がはっきりしない --> |
|||
[[石炭]]は商業的にも重要な炭素供給元であり、[[無煙炭]]では炭素含有率は92 - 98パーセントにまでなる<ref>{{cite book| title = Coal Mining Technology: Theory and Practice| author = R. Stefanenko| publisher = Society for Mining Metallurgy|year = 1983| isbn = 0895204045}}</ref>。これに石油や天然ガスなどを加えた炭素資源は、そのほとんどを燃料として利用している<ref>{{cite journal |first = James|last = Kasting |year=1998 |title=The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning |journal=Consequences: the Nature and Implication of Environmental Change|volume = 4|url = http://gcrio.org/CONSEQUENCES/vol4no1/carbcycle.html |issue = 1}}</ref>。 |
|||
天然の[[黒鉛]](石墨{{sfn|化学工業日報|1996|pp=102-103|loc=【炭素化合物】}}、グラファイト)は世界中に分布するが、産出が多い地域は[[中国]]、[[インド]]、[[ブラジル]]、[[北朝鮮]]である<ref>{{cite web |url= http://minerals.usgs.gov/minerals/pubs/commodity/graphite/myb1-2006-graph.pdf |format=PDF|title=Minerals Yearbook: Graphite, 2006 |publisher =USGS| accessdate=2011-03-27|language=英語}}</ref>。天然のダイヤモンドは歴史的に南インド産が有名だが<ref name=Catelle1>{{cite book|last = Catelle|first = W.R.|title = The Diamond|publisher = John Lane Company|year = 1911}} Page 159 discussion on Alluvial diamonds in India and elsewhere as well as earliest finds</ref>、18世紀に[[ブラジル]]で発見され<ref>{{cite book| page = 28| title = The Book Of Diamonds: Their Curious Lore, Properties, Tests And Synthetic Manufacture| author = J. W. Hershey| publisher = Kessinger Pub Co| isbn = 1417977159| year = 1940}}</ref>、その後[[南アフリカ]]でも採掘され<ref name=giasummer2007>{{cite journal| last = Janse|first= A. J. A.|title= Global Rough Diamond Production Since 1870|journal= Gems and Gemology|volume= XLIII |issue= Summer 2007| pages=98–119 |publisher=GIA|year=2007}}</ref>、現在の主要産出国には[[ロシア]]、[[ボツワナ]]、[[オーストラリア]]、[[コンゴ民主共和国]]が名を連ねる<ref>{{cite web|url = http://gnn.tv/videos/2/The_Diamond_Life|title = The Diamond Life|publisher = Guerrilla News Network|first = Stephen|last = Marshall |coauthors = Shore, Josh |archivedate = 2008-10-10|date = 2004-10-22 |archiveurl = https://web.archive.org/web/20080609101643/http://gnn.tv/videos/2/The_Diamond_Life <!-- Bot retrieved archive --> | accessdate=2011-03-27|language=英語}}</ref>。近年では[[カナダ]]、[[ジンバブエ]]、[[アンゴラ]]でも鉱山が開かれ<ref name = giasummer2007/>、[[アメリカ合衆国]]でも発見されている<ref name=DGemGLorenz>{{cite journal| last = Lorenz| first= V.|title=Argyle in Western Australia: The world's richest diamantiferous pipe; its past and future| journal=Gemmologie, Zeitschrift der Deutschen Gemmologischen Gesellschaft|volume=56 |issue=1/2| pages=35–40 |publisher = DGemG|year=2007}}</ref>。 |
|||
また[[単体]]としては、[[黒鉛]]が[[アメリカ合衆国|アメリカ]]の[[ニューヨーク州]]、[[テキサス州]]、[[ロシア]]、[[メキシコ]]、[[グリーンランド]]、[[インド]]などに豊富に存在する。一方、天然ダイヤモンドは「首」「パイプ」などと呼ばれる円筒形の鉱脈(貫入岩体)、川砂などから見つかる。主に[[アフリカ大陸]]の[[南アフリカ共和国|南アフリカ]]、[[ナミビア]]、[[ボツワナ]]、[[コンゴ共和国]]、[[シエラレオネ]]などで採掘されている。アフリカ以外では[[カナダ]]、ロシアの北極圏内、[[ブラジル]]や[[オーストラリア]]の北部や西部で採掘が行われている。 |
|||
== 同位体 == |
== 同位体 == |
||
{{main|炭素の同位体}} |
{{main|炭素の同位体}} |
||
炭素原子には3種類の[[同位体]]、 |
原子核に6つの陽子を含む炭素原子には、3種類の[[同位体]]、[[炭素12|{{sup|12}}C]](存在比98.93パーセント)、[[炭素13|{{sup|13}}C]](1.07パーセント)、[[炭素14|{{sup|14}}C]](微量)が[[自然界]]で存在し<ref name="isotopes"/>、それぞれがさまざまな学問分野で重要な位置を占める。 |
||
{{sup|12}}Cは[[1961年]]に[[IUPAC]]によって[[原子量]]の基準とすることが決定され<ref>{{cite web |url=http://www.bipm.org/en/si/base_units/ |title=Official SI Unit definitions | accessdate=2011-03-27|language=英語}}</ref>、[[アボガドロ定数]]などの基礎的な定数はこれによって算出された。なお、2019年に改訂された[[国際単位系|SI]]では[[アボガドロ定数]]を6.02214076×1023 毎モル(mol−1)と定義値とし、{{sup|12}}Cは用いなくなった。 |
|||
* <sup>13</sup>C は核[[スピン角運動量|スピン]]を持つため、[[核磁気共鳴]]分光法において重要な核種である。 |
|||
{{sup|13}}Cは核[[スピン角運動量|スピン]]を持つため、[[核磁気共鳴]]分光法において重要な核種である。 |
|||
* [[炭素14|<sup>14</sup>C]]は半減期 5715 年の[[放射性同位体]]である。成層圏において大気中の窒素と宇宙線(中性子)により常時生成されている。[[考古学]]や[[標本]]の分野で[[放射性炭素年代測定]]法に使用されているほか、[[生物学]]や[[医学]]の分野でも炭素14をマーカーにした多くの分析法が開発された。[[光合成]]の初期研究には当時の[[アメリカ原子力委員会]]から供給された炭素14が用いられている。ただし[[放射性物質]]である炭素14は取り扱いが難しいため、現在では[[放射能]]を持たない同位体元素である炭素13を用いた分析法も開発されている。 |
|||
{{sup|14}}Cは、地球上の存在比が100[[京 (数)|京]]分の1<ref name=Tom>{{cite web|last=Brown|first=Tom|date=March 1, 2006|url=http://www.llnl.gov/str/March06/Brown.html|title=Carbon Goes Full Circle in the Amazon|publisher=Lawrence Livermore National Laboratory| accessdate=2011-03-27|language=英語}}</ref>、大気中では1兆分の1程度でしかなく<ref name=Haya>{{Cite web|和書|url=https://web.archive.org/web/20111014003021/http://www.edu.gunma-u.ac.jp/~hayakawa/seminar/carbon.html |title=放射性炭素年代測定の原理と暦年代への換算|author=早川由紀夫|authorlink=早川由紀夫|publisher=[[群馬大学]]教育学部|accessdate=2011-03-27|language=日本語}}</ref>、泥土や有機物の中に含まれている<ref name=Tom />。[[半減期]]約5,730年の[[放射性同位体]]であり<ref name="isotopes">{{cite web|url=http://www.webelements.com/webelements/elements/text/C/isot.html|title=Carbon – Naturally occurring isotopes|publisher=WebElements Periodic Table| accessdate=2011-03-27|language=英語}}</ref>、[[ベータ崩壊]]を起こして[[窒素]]原子に変化する{{sfn|桜井|1997|p=50}}。しかし、成層圏において大気中の窒素と宇宙線(中性子)が反応して常時新たに生成されている{{sfn|桜井|1997|p=50}}<ref name=Bow>{{cite book |author=Bowman, S. |first=S. |last=Bowman |year=1990 |title=Interpreting the past: Radiocarbon dating |publisher=British Museum Press |isbn=0-7141-2047-2}}</ref>。そのため古い石や化石などの閉じた系では時間とともに存在比が低くなることが知られ<ref name=Bow />、[[考古学]]や[[標本]]の分野で4万年スケール、最大6万年の<ref name=Haya />時代判定を行う[[放射性炭素年代測定]]法に使用したり{{sfn|桜井|1997|p=50}}<ref>{{cite book |author=Libby WF |last=Libby |first=WF |year=1952 |title=Radiocarbon dating|publisher=Chicago University Press and references therein}}</ref><ref>{{cite web|last=Westgren|first=A.|year=1960|url=https://www.nobelprize.org/prizes/chemistry/1960/ceremony-speech/|title=The Nobel Prize in Chemistry 1960|publisher=Nobel Foundation| accessdate=2011-03-27|language=英語}}</ref>、過去の宇宙線強度が変化した様子を通じて[[太陽]]活動<ref name=masu>{{Cite web|和書|url=http://www.stelab.nagoya-u.ac.jp/~kmasuda/C14_km/C14_index.html |title=放射性炭素(C14)による過去の宇宙線強度と太陽活動の研究|author=増田公明|publisher=[[名古屋大学]]太陽地球観測研究所|accessdate=2011-03-27|language=日本語}}{{リンク切れ|date=2021年12月}}</ref>や地球磁場の変遷<ref name=Haya />を分析するために使われる。 |
|||
ほかにも、[[生物学]]や[[医学]]の分野でも{{sup|14}}Cをマーカーにした多くの分析法が開発された。[[光合成]]の初期研究には炭素14({{sup|14}}C)が用いられ、その後は効果的な[[肥料]]の開発にも同位体が使われる<ref>{{Cite journal|和書|author=植村福七 |title=ラジオ・アイソトープの産業利用とその影響-主として工業利用- |journal=香川大学経済論叢 |ISSN=0389-3030 |publisher=香川大学経済研究所 |year=1958 |month=sep |volume=31 |issue=3 |pages=1-44 |naid=120007011245 |url=http://id.nii.ac.jp/1731/00005153/}}</ref>。ただし[[放射性物質]]である炭素14は取り扱いが難しいため、現在では[[放射能]]を持たない同位体元素である炭素13({{sup|13}}C)を用いた分析法も開発されている。 |
|||
その他、炭素には半減期が非常に短い15種類の同位体が知られている。{{sup|8}}C は半減期 1.98739 × 10{{sup|-21}}秒で[[陽子放出]]や[[アルファ崩壊]]を起こす<ref>{{cite web |url=http://barwinski.net/isotopes/query_select.php |title=Use query for carbon-8 |accessdate=2007-12-21}}</ref>。{{sup|19}}Cは風変わりな[[中性子ハロー]]の状態で存在する<ref>{{cite web |url=http://www.sciencemag.org/cgi/content/full/286/5437/28?ck=nck |title=Beaming Into the Dark Corners of the Nuclear Kitchen | accessdate=2011-03-27|language=英語}}</ref>。 |
|||
== 単体の性質 == |
== 単体の性質 == |
||
=== 同素体 === |
=== 同素体 === |
||
[[ |
[[File:Carbon basic phase diagram.png|right|250px|thumb|炭素の状態図。0.001GPaはおよそ10気圧に相当する]] |
||
炭素は4本の共有結合 |
炭素は4本の共有結合ができ、結合の状態によって数種類の[[同素体]]を形成する<ref name="therm prop">{{cite web |url=http://invsee.asu.edu/nmodules/Carbonmod/point.html |title=World of Carbon – Interactive Nano-visulisation in Science &Engineering Edukation (IN-VSEE)| accessdate=2011-03-27|language=英語}}</ref>。炭素同士がsp{{sup|2}}[[混成軌道]]を形成し、[[正六角形]]の[[平面]]構造を取った膜が重なったものが[[グラファイト]]になる{{sfn|桜井|1997|p=50}}。2009年、グラファイトの基本構造である薄い[[グラフェン]]は非常に高い硬度を持つことが判明した<ref name=lee>{{cite journal| author = C. Lee| title = Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene| url = http://www.sciencemag.org/cgi/content/abstract/321/5887/385|journal = Science|volume = 321|year = 2008| page = 385| laysummary = http://www.aip.org/isns/reports/2008/027.html| pmid = 18635798| doi = 10.1126/science.1157996| last2 = Wei| first2 = X| last3 = Kysar| first3 = JW| last4 = Hone| first4 = J| issue = 5887}}</ref>。しかし、グラファイトから薄いグラフェンを経済的に剥ぎ取る技術は確立されておらず、事業性の確立は今後の開発を待つ必要がある<ref name="nypost">{{cite web|url = http://www.nypost.com/seven/08252008/news/regionalnews/toughest_stuff__known_to_man_125993.htm|title = Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator|first = Bill|last = Sanderson|publisher = nypost.com|date = 2008-08-25| accessdate=2011-03-27|language=英語}}</ref>。また、炭素がsp{{sup|3}}混成軌道を形成して[[正四面体]]の立体[[結晶構造]]を取った巨大分子となったものが[[ダイヤモンド]]となる{{sfn|桜井|1997|p=50}}。同じ炭素の同素体であるが、前者は[[電気伝導性]]が高く軟らかい、後者は絶縁体で硬いなど、まったく異なる性質を示す。ダイヤモンドが炭素の同素体であることを示したのは[[アントワーヌ・ラヴォアジエ|ラヴォアジエ]]である。実験内容は、密閉容器に納めたダイヤモンドを虫眼鏡により燃焼させると二酸化炭素だけが生成されるというものである。 |
||
木炭やススなどは結晶構造を持たない[[アモルファス]]状態であり「無定形炭素」と呼ばれる。この種類には、工業的に重要な[[炭素繊維]]や[[活性炭]]、[[コークス]]なども含まれる{{sfn|桜井|1997|p=52}}。 |
|||
以上3種は古くから知られていたが、20世紀後半以降、球状のグラフェンである[[フラーレン]]<ref name="buckyballs"/><ref name="nanotubes">{{cite book|editor=Ebbesen, TW |year=1997 |title=Carbon nanotubes—preparation and properties |publisher=CRC Press|location=Boca Raton, Florida|isbn=0849396026}}</ref>や多分野での開発が進んでいる[[カーボンナノチューブ]]<ref name="nanotubes2">{{cite journal |editor=MS Dresselhaus, G Dresselhaus, Ph Avouris |year=2001 |title=Carbon nanotubes: synthesis, structures, properties and applications |journal=Topics in Applied Physics |volume=80| isbn = 3540410864 |publisher=Springer |location=Berlin}}</ref>、[[カーボンナノバッド]]<ref name="nanobuds">{{cite journal |year=2007 |title=A novel hybrid carbon material |journal=Nature Nanotechnology |volume=2 |pages=156–161 |doi=10.1038/nnano.2007.37 |author=Nasibulin, Albert G. |pmid=18654245 |last2=Pikhitsa |first2=PV |last3=Jiang |first3=H |last4=Brown |first4=DP |last5=Krasheninnikov |first5=AV |last6=Anisimov |first6=AS |last7=Queipo |first7=P |last8=Moisala |first8=A |last9=Gonzalez |first9=D |issue=3}}</ref>、{{仮リンク|カーボンナノファイバー|en|Carbon nanofiber}}<ref>{{cite journal |year=2007 |title=Investigations of NanoBud formation |journal=Chemical Physics Letters |volume=446 |pages=109–114 |doi=10.1016/j.cplett.2007.08.050 |author=Nasibulin, A |last2=Anisimov |first2=Anton S. |last3=Pikhitsa |first3=Peter V. |last4=Jiang |first4=Hua |last5=Brown |first5=David P. |last6=Choi |first6=Mansoo |last7=Kauppinen |first7=Esko I.}}</ref><ref>{{cite journal |year=2004 |title=Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C{{sub|2}}H{{sub|6}}/H{{sub|2}} over nickel catalyst |journal=Applied Catalysis A |volume=274 |pages=1–8 |doi=10.1016/j.apcata.2004.04.008 |author=Vieira, R}}</ref>などや、[[ロンズデーライト]]<ref name="lonsdaletite">{{cite journal |year=1967 |title=Lonsdaleite, a new hexagonal polymorph of diamond |journal=Nature |volume=214 |pages=587–589 |doi=10.1038/214587a0 |first = Frondel|last = Clifford |last2=Marvin |first2=Ursula B.}}</ref>や[[ガラス状炭素]]<ref name="glassy carbon"/>、[[カーボンナノフォーム]]<ref>{{cite journal |year=1999 |title=Structural analysis of a carbon foam formed by high pulse-rate laser ablation |journal=Applied Physics A-Materials Science & Processing |volume=69 |pages=S755–S758 |doi=10.1007/s003390051522 |author=Rode, A.V. |last2=Hyde |first2=S.T. |last3=Gamaly |first3=E.G. |last4=Elliman |first4=R.G. |last5=McKenzie |first5=D.R. |last6=Bulcock |first6=S.}}</ref>、[[カルビン]]<ref name="LAC">Carbyne and Carbynoid Structures Series: Physics and Chemistry of Materials with Low-Dimensional Structures, Vol. 21 Heimann, R.B.; Evsyukov, S.E.; Kavan, L. (Eds.) 1999, 452 p., ISBN 0-7923-5323-4</ref>などの複雑な構造を持つ炭素の同素体が多数発見されている。 |
|||
以上3種は古くから知られていたが、20世紀後半以降、[[フラーレン]]や多分野での開発が進んでいる[[カーボンナノチューブ]]などの複雑な構造を持つ炭素の同素体が多数発見され、[[ナノテクノロジー]]の分野で有用な物質と考えられている。 |
|||
{| style="background-color: transparent" |
{| style="background-color: transparent" |
||
|[[ファイル:Eight Allotropes of Carbon.png|270px|right|炭素の同素体(説明は右記参照)]] |
|[[ファイル:Eight Allotropes of Carbon.png|270px|right|炭素の同素体(説明は右記参照)]] |
||
|style="padding-left:1em"| |
|style="padding-left:1em"| |
||
; a. [[ダイヤモンド]] |
; a. [[ダイヤモンド]] |
||
: 立方晶系の結晶。産出量は少ないが産業的に利用可能な程度には豊富。宝石として、また工業用のカッターなどに利用。現在では[[ |
: 立方晶系の結晶。産出量は少ないが産業的に利用可能な程度には豊富。宝石として、また工業用のカッターなどに利用。現在では[[合成ダイヤモンド]]の開発技術も確立され、実用化されている。 |
||
; b. [[グラファイト]](黒鉛) |
; b. [[グラファイト]](黒鉛、石墨) |
||
: 六方晶系の結晶。板状の |
: 六方晶系の結晶であり、炭素の結晶としてはもっとも一般的。板状のグラフェンが多数重なった構造で、平面同士の結びつきは弱く剥がれやすい<ref name=Newton2010 />。日常的なものとしては鉛筆の芯などに用いられる<ref name=Newton2010 />。 |
||
; c. [[ロンズデーライト]](六方晶ダイヤモンド) |
; c. [[ロンズデーライト]](六方晶ダイヤモンド) |
||
: 六方晶系の結晶。隕石中に |
: 六方晶系の結晶。隕石中にきわめて稀に見られる。今のところ非常に小さな結晶しか発見されていない。純粋なものはダイヤモンドに近い硬度をもつと推測される<ref name="lonsdaletite"/>。 |
||
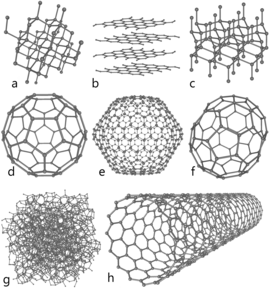
; d,e,f. [[フラーレン]] |
; d, e, f. [[フラーレン]] |
||
: 炭素原子からなる[[クラスター (物質科学)|クラスター]]の総称。天然には |
: 炭素原子からなる[[クラスター (物質科学)|クラスター]]の総称。天然にはきわめて稀に存在するとみられる。図dはいわゆるサッカーボール型のC{{sub|60}}で「[[バックミンスターフラーレン]]」と呼ばれる<ref name="buckyballs"/>。図eはC{{sub|540}}で、図f はC{{sub|70}}である。 |
||
; g. 無定形炭素 |
; g. 無定形炭素 |
||
: |
: (a)と(b)の2種の構造が混在した状態([[アモルファス|非晶質]])。[[木炭]]や[[活性炭]]などの一般的な[[炭]]は、これに不純物が含まれたものである。 |
||
; h. [[カーボンナノチューブ]] |
; h. [[カーボンナノチューブ]] |
||
: |
: グラフェンが[[円筒]]状に巻かれた構造のもの<ref name="nanotubes"/><ref name="nanotubes2"/>。同じ重量の鋼鉄と比較すると、80倍の強度を持ちながら60度ほどの屈曲にも耐える弾力性を持つ<ref name=Newton2010 />。1層のものから多層構造を持つものがある。これに近いものとして、筒の一方が閉じた角状のものを'''[[カーボンナノホーン]]'''と呼ぶ。 |
||
|} |
|} |
||
[[File:Mechanical pencil lead spilling out 051907.jpg|thumb|right|200px|シャープペンシルの芯。グラファイトから製造される]] |
|||
[[File:Kohlenstofffasermatte.jpg|thumb|right|200px|炭素繊維。アモルファス炭素の使用例]] |
|||
=== 生産と用途 === |
=== 生産と用途 === |
||
炭素の単体は形状によってさまざまな分野で使用されている。アモルファス炭素としては[[カーボンブラック]]や[[活性炭]]が大量に生産されており、黒色[[顔料]]([[インク]]、[[コピートナー]]、[[墨汁]]など)やゴム製品への混錬剤、石油の[[脱硫]]などの[[吸着剤]]をはじめ、きわめて幅広い用途に用いられている。カーボンブラックの平成22年(2010年)度日本国内生産量は72万3,159トンである<ref>{{cite journal| author = | title =2010年生産量3年ぶりプラスに カーボンブラック| url = http://www.kagakukogyonippo.com/headline/2011/02/15-533.html|date = 2011-02-15|publisher=[[化学工業日報]]|accessdate=2011-03-27|language=日本語}}</ref>。 |
|||
炭素の単体は形状によって様々な分野で使用されている。 |
|||
天然のほか、コークスの成形焼結などでも製造される{{sfn|化学工業日報|1996|p=1592|loc=【黒鉛・人造黒鉛】}}黒鉛は、[[電池]]などの[[電極]]剤や[[鉛筆]]の芯、[[るつぼ]]、[[塗料]]などに使われる{{sfn|化学工業日報|1996|pp=102-103|loc=【炭素化合物】}}ほか、黒鉛を成形した黒鉛ブロックは[[黒鉛減速沸騰軽水圧力管型原子炉]]「[[RBMK-1000]]」や[[マグノックス炉|コールダーホール型]]をはじめとした[[黒鉛炉]]という[[原子炉]]の[[炉心]]を構成しており、[[中性子]]の速度を下げる[[減速材]]として機能している<ref>{{Cite web|和書|url=http://www.enecho.meti.go.jp/genshi-az/keyword/keyword_ka.html |title=【黒鉛】 原子力用語集 カ行|publisher=[[経済産業省]]資源エネルギー庁|accessdate=2011-03-27}}</ref><ref>{{Cite web|和書|url=http://www.aec.go.jp/jicst/NC/about/hakusho/wp1959/sb202.htm |title=各国原子炉開発の動向|publisher=[[内閣府]]原子力委員会|accessdate=2011-03-27|language=日本語}}</ref>。 |
|||
黒鉛から人工ダイヤモンドを作る技術は1880年ごろから取り組まれ、昭和28年(1953年)ごろには3000℃、13万気圧下で実現し、年間1億[[カラット]]以上が生産されている{{sfn|桜井|1997|p=50}}。ダイヤモンドは宝飾用のほかカッターや[[研磨材]]また[[電極]]としても利用されている{{sfn|桜井|1997|pp=50-51}}。さらには次世代型[[半導体]]としても研究されている<ref>{{Cite web|和書|url=http://www.jst.go.jp/kisoken/seika/zensen/04ookushi/index.html |title=「夢」ではなくなったダイヤモンド半導体|author=大串秀世|publisher=独立行政法人科学技術振興機構|accessdate=2011-03-27|language=日本語}}</ref>。 |
|||
アモルファス炭素としては[[カーボンブラック]]や[[活性炭]]が大量に生産されており、黒色[[顔料]]([[インク]]、[[コピートナー]]、[[墨汁]]など)やゴム製品への混錬剤、石油の[[脱硫]]などの[[吸着剤]]をはじめ、極めて幅広い用途に用いられている。カーボンブラックの2004年度日本国内生産量は804,355t、工業消費量は456tである。 |
|||
[[アクリロニトリル]]を無酸素状態で[[熱分解]]し製造する炭素繊維は、軽くて強度や弾力に優れることから、[[船舶]]および[[航空機]]・[[宇宙船]]から[[スポーツ]]用具まで幅広い用途において[[金属]]を代替する素材として使用されている{{sfn|桜井|1997|p=52}}。活性炭は[[ヤシ]]の殻を蒸し焼きにする方法に加え、廃[[タイヤ]]から製造する方法も開発された。前者は[[冷蔵庫]]などの[[脱臭剤]]でよく使われ、後者は吸着力を利用した河川浄化など土木分野での利用が検討されている{{sfn|桜井|1997|p=52}}。 |
|||
黒鉛は[[電池]]等の[[電極]]剤や[[鉛筆]]の芯に使われるほか、黒鉛を成形した黒鉛ブロックは[[黒鉛減速沸騰軽水圧力管型原子炉]]「[[RBMK-1000]]」や[[マグノックス炉|コールダーホール型]]をはじめとした[[黒鉛炉]]という[[原子炉]]の[[炉心]]を構成しており、[[中性子]]の速度を下げる[[減速材]]として機能している。 |
|||
[[石炭]]から作られるコークスは構成要素のほとんどが炭素であり、[[燃料]]や[[製鉄]]に使用されている。平成18年(2006年)度世界生産量は4億7,800万トンであり、その半分以上を[[中国]]が占めた<ref>{{Cite web|和書|url=https://web.archive.org/web/20120220203258/http://www.stat.go.jp/data/sekai/05.htm |title=統計データ 第5章 鉱工業9 工業生産量‐化学・石油・セメント[統計表]|publisher=[[総務省]]|accessdate=2011-03-27|language=日本語}}{{リンク切れ|date=2017年9月}}</ref>。油を燃やして得られる[[タイヤ]]着色などに使われる一般的な[[カーボンブラック]]{{sfn|化学工業日報|1996|pp=1067-1069|loc=【カーボンブラック】}}は水素を0.3 - 0.8パーセント程度含むが、[[アセチレン]]を熱分解または[[爆発]]させて製造する[[アセチレンブラック]]は水素含有率0.04パーセントと低く鎖状構造を作りやすい。そのため、[[導電性]]が要求される素材に用いられる{{sfn|化学工業日報|1996|pp=102-103|loc=【炭素化合物】}}。 |
|||
ダイヤモンドは宝飾用のほかカッターや[[研磨材]]として利用されている。ポリマーを[[熱分解]]して作製する[[炭素繊維]]は軽くて強度が高いことから、[[航空機]]や[[ゴルフ]]クラブ[[シャフト]]など[[金属]]にかわる素材として使用されている。また、[[石炭]]から作られる[[コークス]]は構成要素のほとんどが炭素であり、[[燃料]]や[[製鉄]]に使用されている。 |
|||
== 化合物 == |
== 化合物 == |
||
[[File:Polyethylene-3D-vdW.png|thumb|right|200px|[[ポリエチレン]]。炭素は長鎖状に結合し、[[高分子]]を作ることができる]] |
|||
炭素は多様な化合物を作ることができるため、これまで報告されているものは1000万種をはるかに超える。[[二酸化炭素]]や[[一酸化炭素]]、[[炭酸]]、[[炭化物]]等を除き、炭素の化合物は'''[[有機化合物]]'''(有機物)と呼ばれ、生命活動で生産されるほか、[[有機化学]]によって人工的にも多くの物質が生み出されている。 |
|||
炭素は多様な[[炭素化合物|化合物]]を作ることができるため、これまで報告されているものは1,000万種をはるかに超える<ref name=lanl>{{cite web|author=Chemistry Operations|date=December 15, 2003|url=http://periodic.lanl.gov/elements/6.html|title=Carbon|publisher=Los Alamos National Laboratory| accessdate=2011-03-27|language=英語}}</ref>。[[二酸化炭素]]や[[一酸化炭素]]、[[炭酸]]、[[炭化物]]等を除き、炭素の化合物は[[有機化合物]](有機物)と呼ばれ、生命活動で生産されるほか、[[有機化学]]によって人工的にも多くの物質が生み出されている。 |
|||
無機化合物として一般的な[[二酸化炭素]] |
無機化合物として一般的な[[二酸化炭素]](CO{{sub|2}})は大気中にわずかに含まれ、光合成や呼吸など生命活動と密接な関わりを持つ。また、[[炭酸塩]]として[[方解石]](石灰岩)などの鉱物中にも分布している。 |
||
金属とのあいだでは炭素は |
金属とのあいだでは炭素は[[アセチリド]](C{{sub|2}}{{sup|2−}})や[[侵入型固溶体]]の形で化合物を作る。[[銑鉄]]と[[鋼]]の関係で見られるように、金属中の炭素量は硬度などの特性に大きな影響を与える。また、[[炭化ケイ素]](SiC)などいくつかの炭素化合物は格子状の結晶構造を持ち、ダイヤモンドと似た性質を持つ。 |
||
=== 炭素のオキソ酸 === |
=== 炭素のオキソ酸 === |
||
| 133行目: | 195行目: | ||
! [[オキソ酸]]の名称 !! 化学式 !! 構造式 !! オキソ酸塩の名称 !! 備考 |
! [[オキソ酸]]の名称 !! 化学式 !! 構造式 !! オキソ酸塩の名称 !! 備考 |
||
|- |
|- |
||
| '''[[炭酸]]'''<br /> |
| '''[[炭酸]]'''<br />(carbonic acid) || <chem>H2CO3</chem> || || '''[[炭酸塩]]'''<br />( - carbonate ) || 遊離酸は非常に不安定。[[塩 (化学)|塩]]は安定。 |
||
|- |
|- |
||
| '''[[過炭酸]]'''(ペルオキソ一炭酸)<br /> |
| '''[[過炭酸]]'''(ペルオキソ一炭酸)<br />(peroxomono carbonic acid) || <chem>H2CO4</chem> || || [[過炭酸塩]]<br />( - peroxomono cabonite ) || 遊離酸は単離できない。[[塩 (化学)|塩]]は安定。 |
||
|} |
|} |
||
※''オキソ酸塩名称の'-'には[[カチオン]]種の名称が入る。'' |
※''オキソ酸塩名称の'-'には[[カチオン]]種の名称が入る。'' |
||
== |
== 安全と注意 == |
||
純粋な炭素は人体に及ぼす毒性が非常に低く、グラファイトや木炭は安全に摂取することもできる。ただし不溶性で化学反応も起こしにくく、消化液の酸にも変化しない。そのため、一度組織内に入り込んだ炭素は長く残留する傾向にある。[[カーボンブラック]]はこの性質から[[入墨]]に使われた初期の素材のひとつと想像される。[[アイスマン]]の入墨は死後5200年間消えずに残っていた<ref>{{cite journal|first = Leopold|last = Dorfer|year = 1998|title = 5200-year old acupuncture in Central Europe?|journal = Science|volume = 282|pages = 242–243|doi = 10.1126/science.282.5387.239f|pmid = 9841386|last2 = Moser|first2 = M|last3 = Spindler|first3 = K|last4 = Bahr|first4 = F|last5 = Egarter-Vigl|first5 = E|last6 = Dohr|first6 = G|issue = 5387}}</ref>。 |
|||
大気中の[[二酸化炭素]]は[[炭素固定]]のプロセスによって各種有機物として固定されるが、[[呼吸]]や[[微生物]]による分解などの生命活動、あるいは[[火山]]活動などによって大気中へ放出される。このような[[炭素循環]]は地球の環境を考える上で重要であり、特に[[地球温暖化]]への対策として観測・研究が行われている。 |
|||
一方で、石炭粉やスス、カーボンブラック類を肺へ大量に吸入することは危険であり、肺組織への刺激から炭田労働者に肺鬱血病から[[塵肺]]を引き起こすこともある。同様に、研磨工程で生じるダイヤモンド粉を吸入または摂取してしまうことも危険である。[[ディーゼルエンジン]]の排出ガスに含まれる微細炭素粒子も、肺に蓄積し悪影響を与える可能性がある<ref>{{cite journal|last = Donaldson|first = K|year = 2001|title = Ultrafine particles|journal = Occupational and Environmental Medicine|volume = 58|pages = 211–216|url = http://oem.bmj.com/cgi/content/extract/58/3/211|doi = 10.1136/oem.58.3.211|pmid = 11171936|last2 = Stone|first2 = V|last3 = Clouter|first3 = A|last4 = Renwick|first4 = L|last5 = MacNee|first5 = W|issue = 3|pmc = 1740105}}</ref>。また、[[眼]]に入ると粘膜を刺激するため、取り扱いの際には保護メガネ着用が望まれる{{sfn|化学工業日報|1996|pp=102-103|loc=【炭素化合物】}}。 |
|||
炭素の低毒性は地球生物のほとんどに当てはまるが若干の例外もあり、たとえば[[ショウジョウバエ]]には炭素の微細粒子は致命的な毒性を発揮する<ref>{{cite web|url = http://www.sciencedaily.com/releases/2009/08/090807103921.htm |title = Carbon Nanoparticles Toxic To Adult Fruit Flies But Benign To Young |publisher = ScienceDaily |date = Aug. 17, 2009 | accessdate=2011-03-27|language=英語}}</ref>。 |
|||
== 脚注 == |
== 脚注 == |
||
{{脚注ヘルプ}} |
|||
<references /> |
|||
{{Reflist|2}} |
|||
== |
== 参考文献 == |
||
* {{Cite book| 和書|date=1998年(初版1997年)|title=元素111の新知識|edition=第六刷|publisher=[[講談社]]|author=桜井弘 |isbn=4-06-257192-7|pages=49-55|ref={{SfnRef|桜井|1997}}}} |
|||
* {{Cite book|和書|author=青木和光|year=2004|title=物質の宇宙史|publisher=[[新日本出版社]]|edition=初版|isbn=4-406-03068-9|ref={{SfnRef|青木|2004}}}} |
|||
* {{Cite book|和書|year=1996|title=12996の化学商品|publisher=[[化学工業日報]]|edition= |isbn=4-87326-204-6|ref={{SfnRef|化学工業日報|1996}}}} |
|||
* {{Cite book|和書|author=尾崎洋二|title=宇宙科学入門|publisher=[[東京大学]]出版会|year=2010|edition=第2版第1刷|isbn=978-4-13-062719-1|ref={{SfnRef|尾崎|2010}}}} |
|||
== 関連項目 == |
|||
{{Commons|Carbon}} |
{{Commons|Carbon}} |
||
* [[炭素税]] |
|||
* [http://www.meti.go.jp/statistics/tyo/seidou/result/ichiran/02_kagaku.html 日本国 経済産業省・化学工業統計月報] |
|||
* [[炭素星]] |
|||
* [http://www.webelements.com/carbon/ WebElements "Carbon"] |
|||
== 外部リンク == |
|||
{{元素周期表}} |
|||
* [https://www.meti.go.jp/statistics/tyo/seidou/result/ichiran/08_seidou.html#menu5 経済産業省生産動態統計年報 化学工業統計編] |
|||
{{Link FA|pt}} |
|||
* [https://www.webelements.com/carbon/ WebElements "Carbon"] {{en icon}} |
|||
{{Link FA|sk}} |
|||
* {{Wayback|url=https://rika-net.com/contents/cp0100a/contents/4860/4860.html |title=炭素 理科ねっとわーく(一般公開版) |date=20171003225241}} - 文部科学省 国立教育政策研究所 |
|||
{{Link FA|lmo}} |
|||
* {{ICSC|0702}} |
|||
* {{Kotobank}} |
|||
{{元素周期表}} |
|||
{{炭素の同素体}} |
|||
{{Normdaten}} |
|||
{{DEFAULTSORT:たんそ}} |
{{DEFAULTSORT:たんそ}} |
||
[[Category:炭素の化合物|*]] |
|||
[[Category:炭素|*]] |
[[Category:炭素|*]] |
||
[[Category:元素]] |
[[Category:元素]] |
||
[[Category:非金属元素]] |
|||
[[Category:第14族元素]] |
|||
{{Link GA|es}} |
|||
[[Category:第2周期元素]] |
|||
[[af:Koolstof]] |
|||
[[als:Kohlenstoff]] |
|||
[[am:ካርቦን]] |
|||
[[an:Carbonio]] |
|||
[[ar:كربون]] |
|||
[[ast:Carbonu]] |
|||
[[az:Karbon]] |
|||
[[bat-smg:Onglis]] |
|||
[[be:Вуглярод]] |
|||
[[be-x-old:Вуглярод]] |
|||
[[bg:Въглерод]] |
|||
[[bn:কার্বন]] |
|||
[[br:Karbon]] |
|||
[[bs:Karbon]] |
|||
[[ca:Carboni]] |
|||
[[co:Carboniu]] |
|||
[[cs:Uhlík]] |
|||
[[cv:Кăмрăк]] |
|||
[[cy:Carbon]] |
|||
[[da:Carbon]] |
|||
[[de:Kohlenstoff]] |
|||
[[el:Άνθρακας]] |
|||
[[en:Carbon]] |
|||
[[eo:Karbono]] |
|||
[[es:Carbono]] |
|||
[[et:Süsinik]] |
|||
[[eu:Karbono]] |
|||
[[fa:کربن]] |
|||
[[fi:Hiili]] |
|||
[[fr:Carbone]] |
|||
[[frr:Koolestuf]] |
|||
[[fur:Carboni]] |
|||
[[fy:Koalstof]] |
|||
[[ga:Carbón]] |
|||
[[gd:Gualan]] |
|||
[[gl:Carbono]] |
|||
[[gu:કાર્બન]] |
|||
[[gv:Carboan]] |
|||
[[hak:Than]] |
|||
[[haw:Kalepona]] |
|||
[[he:פחמן]] |
|||
[[hi:कार्बन]] |
|||
[[hif:Koila]] |
|||
[[hr:Ugljik]] |
|||
[[hsb:Wuhlik]] |
|||
[[ht:Kabòn]] |
|||
[[hu:Szén]] |
|||
[[hy:Ածխածին]] |
|||
[[ia:Carbon]] |
|||
[[id:Karbon]] |
|||
[[io:Karbo]] |
|||
[[is:Kolefni]] |
|||
[[it:Carbonio]] |
|||
[[jbo:tabno]] |
|||
[[jv:Karbon]] |
|||
[[ka:ნახშირბადი]] |
|||
[[kk:Көміртегі]] |
|||
[[kn:ಇಂಗಾಲ]] |
|||
[[ko:탄소]] |
|||
[[koi:Шомувтыр]] |
|||
[[ksh:Kohlenstoff]] |
|||
[[ku:Karbon]] |
|||
[[la:Carbonium]] |
|||
[[lb:Kuelestoff]] |
|||
[[li:Koolstof]] |
|||
[[lij:Carbonio]] |
|||
[[lmo:Carboni]] |
|||
[[ln:Kaboni]] |
|||
[[lt:Anglis]] |
|||
[[lv:Ogleklis]] |
|||
[[map-bms:Karbon]] |
|||
[[mdf:Седель]] |
|||
[[mg:Karbônina]] |
|||
[[mhr:Шӱйдӱҥ]] |
|||
[[mi:Waro]] |
|||
[[mk:Јаглерод]] |
|||
[[ml:കാർബൺ]] |
|||
[[mn:Нүүрстөрөгч]] |
|||
[[mr:कार्बन]] |
|||
[[ms:Karbon]] |
|||
[[mt:Karbonju]] |
|||
[[my:ကာဗွန်]] |
|||
[[myv:Седь]] |
|||
[[nah:Tecolli]] |
|||
[[nds:Kohlenstoff]] |
|||
[[ne:कार्बन]] |
|||
[[nl:Koolstof]] |
|||
[[nn:Karbon]] |
|||
[[no:Karbon]] |
|||
[[nov:Karbo]] |
|||
[[nv:Káábin]] |
|||
[[oc:Carbòni]] |
|||
[[pa:ਕਾਰਬਨ]] |
|||
[[pap:Karbon]] |
|||
[[pl:Węgiel (pierwiastek)]] |
|||
[[pnb:کاربن]] |
|||
[[pt:Carbono]] |
|||
[[qu:K'illimsayaq]] |
|||
[[ro:Carbon]] |
|||
[[ru:Углерод]] |
|||
[[sah:Карбон]] |
|||
[[scn:Carbòniu]] |
|||
[[sh:Ugljenik]] |
|||
[[simple:Carbon]] |
|||
[[sk:Uhlík]] |
|||
[[sl:Ogljik]] |
|||
[[sq:Karboni]] |
|||
[[sr:Угљеник]] |
|||
[[stq:Koolestof]] |
|||
[[su:Karbon]] |
|||
[[sv:Kol]] |
|||
[[sw:Kaboni]] |
|||
[[ta:கரிமம்]] |
|||
[[te:కార్బన్]] |
|||
[[tg:Карбон]] |
|||
[[th:คาร์บอน]] |
|||
[[tl:Karbon]] |
|||
[[tr:Karbon]] |
|||
[[tt:Күмер (химик элемент)]] |
|||
[[ug:كاربون]] |
|||
[[uk:Вуглець]] |
|||
[[ur:فحم]] |
|||
[[uz:Uglerod]] |
|||
[[vec:Carbonio]] |
|||
[[vi:Cacbon]] |
|||
[[vls:Carbong]] |
|||
[[wa:Carbone]] |
|||
[[war:Karbon]] |
|||
[[wuu:碳]] |
|||
[[xal:Нүртөр]] |
|||
[[yi:קוילנשטאף]] |
|||
[[yo:Carbon]] |
|||
[[zh:碳]] |
|||
[[zh-min-nan:Thoàⁿ-sò͘]] |
|||
[[zh-yue:碳]] |
|||
2024年9月9日 (月) 06:21時点における最新版
| |||||||||||||||||||||||||
| 外見 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
透明(ダイヤモンド)、黒色(グラファイト)
| |||||||||||||||||||||||||
| 一般特性 | |||||||||||||||||||||||||
| 名称, 記号, 番号 | 炭素, C, 6 | ||||||||||||||||||||||||
| 分類 | 非金属元素 | ||||||||||||||||||||||||
| 族, 周期, ブロック | 14, 2, p | ||||||||||||||||||||||||
| 原子量 | 12.0107 | ||||||||||||||||||||||||
| 電子配置 | [He] 2s2 2p2[1] | ||||||||||||||||||||||||
| 電子殻 | 2, 4(画像) | ||||||||||||||||||||||||
| 物理特性 | |||||||||||||||||||||||||
| 相 | 固体 | ||||||||||||||||||||||||
| 密度(室温付近) | 非結晶質[2] 1.8–2.1 g/cm3 | ||||||||||||||||||||||||
| 密度(室温付近) | グラファイト:2.260[1] g/cm3 | ||||||||||||||||||||||||
| 密度(室温付近) | ダイヤモンド:3.513[1] g/cm3 | ||||||||||||||||||||||||
| 昇華点 | 3915 K, 3642 °C, 6588 °F | ||||||||||||||||||||||||
| 三重点 | 4600 K (4327 °C), 10800[3][4] kPa | ||||||||||||||||||||||||
| 融解熱 | 117(グラファイト) kJ/mol | ||||||||||||||||||||||||
| 熱容量 | (25 °C) 8.517(グラファイト) 6.155(ダイヤモンド) J/(mol·K) | ||||||||||||||||||||||||
| 原子特性 | |||||||||||||||||||||||||
| 酸化数 | 3, 4[5], 2, 1 [6], 0, −1, −2, −3, −4[7] | ||||||||||||||||||||||||
| 電気陰性度 | 2.55(ポーリングの値) | ||||||||||||||||||||||||
| イオン化エネルギー | 第1: 1086.5 kJ/mol | ||||||||||||||||||||||||
| 第2: 2352.6 kJ/mol | |||||||||||||||||||||||||
| 第3: 4620.5 kJ/mol | |||||||||||||||||||||||||
| 共有結合半径 | 77 (sp3), 73 (sp2), 69 (sp) pm | ||||||||||||||||||||||||
| ファンデルワールス半径 | 170 pm | ||||||||||||||||||||||||
| その他 | |||||||||||||||||||||||||
| 磁性 | 反磁性[9] | ||||||||||||||||||||||||
| 熱伝導率 | (300 K) 119-165(グラファイト) 900-2300(ダイヤモンド) W/(m⋅K) | ||||||||||||||||||||||||
| 熱膨張率 | (25 °C) 0.8(ダイヤモンド)[10] μm/(m⋅K) | ||||||||||||||||||||||||
| 音の伝わる速さ (微細ロッド) |
(20 °C) 18350(ダイヤモンド) m/s | ||||||||||||||||||||||||
| ヤング率 | 1050(ダイヤモンド)[10] GPa | ||||||||||||||||||||||||
| 剛性率 | 478(ダイヤモンド)[10] GPa | ||||||||||||||||||||||||
| 体積弾性率 | 442(ダイヤモンド)[10] GPa | ||||||||||||||||||||||||
| ポアソン比 | 0.1(ダイヤモンド)[10] | ||||||||||||||||||||||||
| モース硬度 | 1-2(グラファイト) 10(ダイヤモンド) | ||||||||||||||||||||||||
| CAS登録番号 | 7440-44-0[8] | ||||||||||||||||||||||||
| 主な同位体 | |||||||||||||||||||||||||
| 詳細は炭素の同位体を参照 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
炭素(たんそ、英: carbon、カーボン、仏: carbone、独: Kohlenstoff)は、原子番号6の元素である[11]。元素記号はC[11]。原子量は12.01。非金属元素、第14族元素、第2周期元素の一つ。
名称
[編集]フランス語の「carbone」は、1787年にフランスの化学者ギトン・ド・モルボーが「木炭」を指すラテン語carboから[12]名づけた。英語のcarbonは、これが転じたものである[1]。
ドイツ語の「Kohlenstoff」も「炭の物質」を意味する[1]。
日本語の「炭素」という語は、宇田川榕菴が著作『舎密開宗』にて用いたのがはじめとされる。
特徴
[編集]単体・化合物両方においてきわめて多様な形状をとることができる。
非金属の炭素には、4つの外殻電子と4つの空席がある。そのため、価電子数4[13]と元素の中でももっとも多い4組の共有結合を持つことが可能であり、この特徴から多様な分子をつくる骨格となる[14][15]。炭素がほかの元素と結びついて作る化合物の種類は約5,400万種にのぼる[13]。
融点や昇華を起こす温度は全元素の中でもっとも高い。常圧下では融点を持たず、三重点は10.8±0.2MPa、4,600±300Kであり[3][4]、昇華は約3,900Kで起こる[16][17]。
炭素原子同士の共有結合は非常に堅牢であり[13]、それがつくる単体において、自然物としてはもっとも硬いことで知られるダイヤモンドからもっとも柔らかい部類に入るグラファイトまで、幅広い形態や同素体を持つ。
歴史
[編集]炭素の単体は有機物を不完全燃焼すれば簡単に取り出せるため、有史以前から知られていた[1][18]。ダイヤモンドの存在も紀元前2500年ごろの古代中国では知られており、古代ローマでは今日と同様に木から木炭を得ていた。古代エジプトでも、粘土で密封したピラミッドの中から空気を抜くために木を熱する方法が用いられた[19][20]。そのため、特定の元素発見者はいない[1]。

1722年、ルネ・レオミュールは鉄が鋼となるには何かしらの物質を吸収することを示したが、現在ではそれは炭素であることが明らかとなった[21]。1772年にはアントワーヌ・ラヴォアジエが燃焼によって水が生じず、重量あたり同じ比率の二酸化炭素を生じることを確かめ、ダイヤモンドが炭素の単体であることを証明した[22]。1779年にカール・ヴィルヘルム・シェーレは、グラファイトが従来考えられていたように鉛の一形態ではないと示し[22]、1786年にクロード・ルイ・ベルトレー、ガスパール・モンジュ、C.A.ヴァンデスモンドが炭素であることを明らかにした[23]。彼らがこれを知らしめた際、この元素にcarboneという名をつけ、ラヴォアジエが1789年にまとめた元素のテキストに採録された[22]。
同素体フラーレンが発見されたのは1985年であり[24]、同じくナノ構造体としてはバッキーボールやカーボンナノチューブも見つかった[25]。これらの発見は1996年ノーベル化学賞の授与対象となった[26][27]。これらに触発された更なる同素体探査の結果、「ガラス状炭素」や、厳密には無定形ではないが名づけられた「無定形炭素」等の発見へつながった[28]。
生成
[編集]炭素原子の生成にはヘリウムの原子核であるアルファ粒子の3重衝突が必要となる。これには約1億度の熱が必要となるが、ビッグバンでは宇宙がはじめに大きく膨張してすぐに急速に冷え、炭素は生成されなかったと考えられている[29]。しかし、その後形成された恒星内でトリプルアルファ反応によるヘリウム燃焼過程でエネルギーを放出しながら炭素が生成される[30]。こうして作られた炭素は、主系列星の内部で水素がヘリウムになるCNOサイクルを媒介し、星のエネルギー放射に一役買っている[31]。
分布
[編集]宇宙での存在比は水素、ヘリウム、酸素に次いで多い[32]。炭素は太陽や恒星、彗星のなかにも豊富に存在し、さまざまな惑星の大気にも含まれている。まれに隕石の中から微細なダイヤモンドが見つかることがあり、これは太陽系が原始惑星系円盤だったころ、またはそれ以前に超新星爆発時に生成されたものと考えられている[33]。

地球
[編集]元素分布
[編集]地球上でみると必ずしも割合的に非常にたくさん存在している元素というわけではない[11]。地球の地表及び海洋の元素分布では炭素は重量比0.08%にすぎない[11](これはチタンやマンガンを下回る[34])。ただ炭素は他の元素との結びつき方で、性質の異なる驚異的なほど多彩な化合物を作り出し、地球環境の中に存在している[35](後述)。
地殻中の元素の存在度では15番目に多い炭素[32]の約9割が鉱物として存在し、中でも還元された形、すなわち炭素粒・石油・石炭・天然ガス中が4分の3以上を占める。4分の1が炭酸塩の岩石(石灰岩、苦灰岩 (CaMg(CO3)2)、結晶質石灰岩など)である。海洋など水に溶け込んだ炭酸も多く、その量は炭素量で36兆トン存在する。ついで生物圏に1兆9,000億トン、大気圏の二酸化炭素として8,100億トンがある。
埋蔵石化燃料として石炭が9,000億トン、石油は1,500億トン、天然ガスが1,050億トンに加え、さらにシェールガスのような採掘しにくい形態で別に5,400億トンの存在が見込まれている[36]。これらとは別に、メタンハイドレートとして極地に封じられ、これの炭素量はシベリアの永久凍土層だけでも1兆4,000億トンと見積もられる[37]。
炭素循環
[編集]炭素は地球上で多様な状態を示している。炭素は地殻、海洋、生物圏、大気圏を循環しており、年間の移動量は約2,000億トンと見積もられている。
惑星上では、ある元素がほかの元素に転換することは非常に稀である。したがって、地球に含まれる全炭素量はほぼ一定である。そのため、炭素を用いる過程はどこかでそれを獲得し、また放出することが必要となる。このような経路は、二酸化炭素の形で循環する体系を形成する。たとえば、植物は生育地の環境内で、呼吸によって二酸化炭素を放出する一方、光のエネルギーを用いて吸収した二酸化炭素から炭素を固定するカルヴィン回路を働かせ、植物組織を形成する。動物は植物を食べて炭素を吸収し、呼吸によって一部を排出する。このような短期的な循環だけでなく、より複雑な炭素循環も機能する。たとえば海洋は二酸化炭素を溶かし込み、枯れた植物や動物の死体は、バクテリアなどが消化しないと地中で石油や石炭などの形で炭素をとどめることもある。それらが化石燃料として利用されれば、燃焼によって再び炭素は放出される[38]。

炭素化合物
[編集]炭素の特性は他の元素と結びついて化合物を作る段階にある[35]。炭素は他の元素を束にしてもまったく歯が立たないほど多様な化合物の世界を作り出している[35]。これまでに天然に発見されたものと化学者が人工的に作り出した化合物の数は7,000万を超えるといわれているが、その約8割は炭素化合物である[35]。
生物
[編集]炭素-炭素結合で有機物の基本骨格をつくり、すべての生物の構成材料となる。人体を構成する元素の約18%が炭素といわれている[35]。これは蛋白質、脂質、炭水化物に含まれる原子の過半数が炭素であることによる。光合成や呼吸など生命活動全般で重要な役割を担う。地表での炭素の重量比は0.08%にすぎないため、生命は自然界にあるわずかな炭素をかき集めてかろうじて成立している[35]
鉱物
[編集]石炭は商業的にも重要な炭素供給元であり、無煙炭では炭素含有率は92 - 98パーセントにまでなる[39]。これに石油や天然ガスなどを加えた炭素資源は、そのほとんどを燃料として利用している[40]。
天然の黒鉛(石墨[8]、グラファイト)は世界中に分布するが、産出が多い地域は中国、インド、ブラジル、北朝鮮である[41]。天然のダイヤモンドは歴史的に南インド産が有名だが[42]、18世紀にブラジルで発見され[43]、その後南アフリカでも採掘され[44]、現在の主要産出国にはロシア、ボツワナ、オーストラリア、コンゴ民主共和国が名を連ねる[45]。近年ではカナダ、ジンバブエ、アンゴラでも鉱山が開かれ[44]、アメリカ合衆国でも発見されている[46]。
同位体
[編集]原子核に6つの陽子を含む炭素原子には、3種類の同位体、12C(存在比98.93パーセント)、13C(1.07パーセント)、14C(微量)が自然界で存在し[47]、それぞれがさまざまな学問分野で重要な位置を占める。
12Cは1961年にIUPACによって原子量の基準とすることが決定され[48]、アボガドロ定数などの基礎的な定数はこれによって算出された。なお、2019年に改訂されたSIではアボガドロ定数を6.02214076×1023 毎モル(mol−1)と定義値とし、12Cは用いなくなった。
13Cは核スピンを持つため、核磁気共鳴分光法において重要な核種である。
14Cは、地球上の存在比が100京分の1[49]、大気中では1兆分の1程度でしかなく[50]、泥土や有機物の中に含まれている[49]。半減期約5,730年の放射性同位体であり[47]、ベータ崩壊を起こして窒素原子に変化する[51]。しかし、成層圏において大気中の窒素と宇宙線(中性子)が反応して常時新たに生成されている[51][52]。そのため古い石や化石などの閉じた系では時間とともに存在比が低くなることが知られ[52]、考古学や標本の分野で4万年スケール、最大6万年の[50]時代判定を行う放射性炭素年代測定法に使用したり[51][53][54]、過去の宇宙線強度が変化した様子を通じて太陽活動[55]や地球磁場の変遷[50]を分析するために使われる。
ほかにも、生物学や医学の分野でも14Cをマーカーにした多くの分析法が開発された。光合成の初期研究には炭素14(14C)が用いられ、その後は効果的な肥料の開発にも同位体が使われる[56]。ただし放射性物質である炭素14は取り扱いが難しいため、現在では放射能を持たない同位体元素である炭素13(13C)を用いた分析法も開発されている。
その他、炭素には半減期が非常に短い15種類の同位体が知られている。8C は半減期 1.98739 × 10-21秒で陽子放出やアルファ崩壊を起こす[57]。19Cは風変わりな中性子ハローの状態で存在する[58]。
単体の性質
[編集]同素体
[編集]
炭素は4本の共有結合ができ、結合の状態によって数種類の同素体を形成する[59]。炭素同士がsp2混成軌道を形成し、正六角形の平面構造を取った膜が重なったものがグラファイトになる[51]。2009年、グラファイトの基本構造である薄いグラフェンは非常に高い硬度を持つことが判明した[60]。しかし、グラファイトから薄いグラフェンを経済的に剥ぎ取る技術は確立されておらず、事業性の確立は今後の開発を待つ必要がある[61]。また、炭素がsp3混成軌道を形成して正四面体の立体結晶構造を取った巨大分子となったものがダイヤモンドとなる[51]。同じ炭素の同素体であるが、前者は電気伝導性が高く軟らかい、後者は絶縁体で硬いなど、まったく異なる性質を示す。ダイヤモンドが炭素の同素体であることを示したのはラヴォアジエである。実験内容は、密閉容器に納めたダイヤモンドを虫眼鏡により燃焼させると二酸化炭素だけが生成されるというものである。
木炭やススなどは結晶構造を持たないアモルファス状態であり「無定形炭素」と呼ばれる。この種類には、工業的に重要な炭素繊維や活性炭、コークスなども含まれる[62]。
以上3種は古くから知られていたが、20世紀後半以降、球状のグラフェンであるフラーレン[25][63]や多分野での開発が進んでいるカーボンナノチューブ[64]、カーボンナノバッド[65]、カーボンナノファイバー[66][67]などや、ロンズデーライト[68]やガラス状炭素[28]、カーボンナノフォーム[69]、カルビン[70]などの複雑な構造を持つ炭素の同素体が多数発見されている。
 |
|


生産と用途
[編集]炭素の単体は形状によってさまざまな分野で使用されている。アモルファス炭素としてはカーボンブラックや活性炭が大量に生産されており、黒色顔料(インク、コピートナー、墨汁など)やゴム製品への混錬剤、石油の脱硫などの吸着剤をはじめ、きわめて幅広い用途に用いられている。カーボンブラックの平成22年(2010年)度日本国内生産量は72万3,159トンである[71]。
天然のほか、コークスの成形焼結などでも製造される[72]黒鉛は、電池などの電極剤や鉛筆の芯、るつぼ、塗料などに使われる[8]ほか、黒鉛を成形した黒鉛ブロックは黒鉛減速沸騰軽水圧力管型原子炉「RBMK-1000」やコールダーホール型をはじめとした黒鉛炉という原子炉の炉心を構成しており、中性子の速度を下げる減速材として機能している[73][74]。
黒鉛から人工ダイヤモンドを作る技術は1880年ごろから取り組まれ、昭和28年(1953年)ごろには3000℃、13万気圧下で実現し、年間1億カラット以上が生産されている[51]。ダイヤモンドは宝飾用のほかカッターや研磨材また電極としても利用されている[75]。さらには次世代型半導体としても研究されている[76]。
アクリロニトリルを無酸素状態で熱分解し製造する炭素繊維は、軽くて強度や弾力に優れることから、船舶および航空機・宇宙船からスポーツ用具まで幅広い用途において金属を代替する素材として使用されている[62]。活性炭はヤシの殻を蒸し焼きにする方法に加え、廃タイヤから製造する方法も開発された。前者は冷蔵庫などの脱臭剤でよく使われ、後者は吸着力を利用した河川浄化など土木分野での利用が検討されている[62]。
石炭から作られるコークスは構成要素のほとんどが炭素であり、燃料や製鉄に使用されている。平成18年(2006年)度世界生産量は4億7,800万トンであり、その半分以上を中国が占めた[77]。油を燃やして得られるタイヤ着色などに使われる一般的なカーボンブラック[78]は水素を0.3 - 0.8パーセント程度含むが、アセチレンを熱分解または爆発させて製造するアセチレンブラックは水素含有率0.04パーセントと低く鎖状構造を作りやすい。そのため、導電性が要求される素材に用いられる[8]。
化合物
[編集]
炭素は多様な化合物を作ることができるため、これまで報告されているものは1,000万種をはるかに超える[14]。二酸化炭素や一酸化炭素、炭酸、炭化物等を除き、炭素の化合物は有機化合物(有機物)と呼ばれ、生命活動で生産されるほか、有機化学によって人工的にも多くの物質が生み出されている。
無機化合物として一般的な二酸化炭素(CO2)は大気中にわずかに含まれ、光合成や呼吸など生命活動と密接な関わりを持つ。また、炭酸塩として方解石(石灰岩)などの鉱物中にも分布している。
金属とのあいだでは炭素はアセチリド(C22−)や侵入型固溶体の形で化合物を作る。銑鉄と鋼の関係で見られるように、金属中の炭素量は硬度などの特性に大きな影響を与える。また、炭化ケイ素(SiC)などいくつかの炭素化合物は格子状の結晶構造を持ち、ダイヤモンドと似た性質を持つ。
炭素のオキソ酸
[編集]炭素のオキソ酸は慣用名をもつ。次にそれらを挙げる。
| オキソ酸の名称 | 化学式 | 構造式 | オキソ酸塩の名称 | 備考 |
|---|---|---|---|---|
| 炭酸 (carbonic acid) |
炭酸塩 ( - carbonate ) |
遊離酸は非常に不安定。塩は安定。 | ||
| 過炭酸(ペルオキソ一炭酸) (peroxomono carbonic acid) |
過炭酸塩 ( - peroxomono cabonite ) |
遊離酸は単離できない。塩は安定。 |
※オキソ酸塩名称の'-'にはカチオン種の名称が入る。
安全と注意
[編集]純粋な炭素は人体に及ぼす毒性が非常に低く、グラファイトや木炭は安全に摂取することもできる。ただし不溶性で化学反応も起こしにくく、消化液の酸にも変化しない。そのため、一度組織内に入り込んだ炭素は長く残留する傾向にある。カーボンブラックはこの性質から入墨に使われた初期の素材のひとつと想像される。アイスマンの入墨は死後5200年間消えずに残っていた[79]。
一方で、石炭粉やスス、カーボンブラック類を肺へ大量に吸入することは危険であり、肺組織への刺激から炭田労働者に肺鬱血病から塵肺を引き起こすこともある。同様に、研磨工程で生じるダイヤモンド粉を吸入または摂取してしまうことも危険である。ディーゼルエンジンの排出ガスに含まれる微細炭素粒子も、肺に蓄積し悪影響を与える可能性がある[80]。また、眼に入ると粘膜を刺激するため、取り扱いの際には保護メガネ着用が望まれる[8]。
炭素の低毒性は地球生物のほとんどに当てはまるが若干の例外もあり、たとえばショウジョウバエには炭素の微細粒子は致命的な毒性を発揮する[81]。
脚注
[編集]- ^ a b c d e f g h i j 桜井 1997, p. 49.
- ^ Chemical Rubber Company Handbook of Chemistry and Physics, 59th Edition, CRC Press, Inc, 1979
- ^ a b Haaland, D (1976). “Graphite-liquid-vapor triple point pressure and the density of liquid carbon☆☆☆”. Carbon 14: 357. doi:10.1016/0008-6223(76)90010-5.
- ^ a b Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. Carbon 43: 1115. doi:10.1016/j.carbon.2004.12.027.
- ^ “Fourier Transform Spectroscopy of the System of CP” (PDF) (英語). 2011年3月27日閲覧。
- ^ “Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical” (PDF) (英語). 2011年3月27日閲覧。
- ^ “Carbon: Binary compounds” (英語). WebElements. 2011年3月27日閲覧。
- ^ a b c d e 化学工業日報 1996, pp. 102–103, 【炭素化合物】.
- ^ “Magnetic susceptibility of the elements and inorganic compounds” (PDF) (英語). Handbook of Chemistry and Physics 81st edition, CRC press. 2011年3月27日閲覧。
- ^ a b c d e “C-Diamond” (英語). 2011年3月27日閲覧。
- ^ a b c d 佐藤健太郎『炭素文明論』新潮社、2013年、15頁。
- ^ Shorter Oxford English Dictionary, Oxford University Press
- ^ a b c d e f 編集長:水谷仁『ニュートン別冊周期表第2冊』ニュートンプレス、東京都、2010年、92-93頁。ISBN 978-4-315-51876-4。
- ^ a b Chemistry Operations (December 15, 2003). “Carbon” (英語). Los Alamos National Laboratory. 2011年3月27日閲覧。
- ^ 桜井 1997, p. 54.
- ^ Greenville Whittaker, A. (1978). “The controversial carbon solid−liquid−vapour triple point”. Nature 276: 695. doi:10.1038/276695a0.
- ^ J.M. Zazula (1997年). “On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam” (英語) (PDF). CERN 2011年3月27日閲覧。
- ^ “Timeline of Element Discovery” (英語). 2011年3月27日閲覧。
- ^ “Chinese made first use of diamond” (英語). BBC News. (17 May 2005) 2011年3月27日閲覧。
- ^ van der Krogt, Peter. “Carbonium/Carbon at Elementymology & Elements Multidict” (英語). 2011年3月27日閲覧。
- ^ Ferchault de Réaumur, R-A (1722). L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (English translation from 1956). Paris, Chicago
- ^ a b c Senese,Fred (200-09-09). “Who discovered carbon?” (英語). Frostburg State University. 2011年3月27日閲覧。
- ^ Federico Giolitti (1914). The Cementation of Iron and Steel. McGraw-Hill Book Company, inc.
- ^ H. W. Kroto, J. R. Heath, S. C. O'Brien, R. F. Curl and R. E. Smalley (1985). “C60: Buckminsterfullerene”. Nature 318: 162–163. doi:10.1038/318162a0.
- ^ a b c Peter Unwin. “Fullerenes(An Overview)” (英語). 2011年3月27日閲覧。
- ^ 桜井 1997, pp. 51–52.
- ^ “The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes"” (英語). 2011年3月27日閲覧。
- ^ a b Harris, PJF; Gallagher, J. G.; Hargreaves, J. S. J.; Harris, P. J. F. (2004). “Fullerene-related structure of commercial glassy carbons”. Philosophical Magazine, 84, 3159–3167 116: 122. doi:10.1007/s10562-007-9125-6.
- ^ 青木 2004, pp. 35–37, 第2章 ビッグバンと元素合成.
- ^ 青木 2004, pp. 53–79, 第3章 星の中での元素合成.
- ^ 尾崎 2010, pp. 20–33, 第2章 太陽と太陽系、4-5節.
- ^ a b “Biological Abundance of Elements” (英語). The Internet Encyclopedia of Science. 2011年3月27日閲覧。
- ^ Mark (1987). Meteorite Craters. University of Arizona Press. ISBN 0816509026
- ^ 佐藤健太郎『炭素文明論』新潮社、2013年、15-16頁。
- ^ a b c d e f 佐藤健太郎『炭素文明論』新潮社、2013年、16頁。
- ^ Helen Knight (12 June 2010). “Wonderfuel: Welcome to the age of unconventional gas, pp. 44–7” (英語). New Scientist. 2011年3月27日閲覧。
- ^ N. Shakhova, I. Semiletov, A. Salyuk, D. Kosmach (2008年). “Anomalies of methane in the atmosphere over the East Siberian shelf: Is there any sign of methane leakage from shallow shelf hydrates? 10” (PDF) (英語). European Geosciences Union, General Assembly 2008, Geophysical Research Abstracts EGU2008-A-01526. 2011年3月27日閲覧。
- ^ P. Falkowski, R. J. Scholes, E. Boyle, J. Canadell, D. Canfield, J. Elser, N. Gruber, K. Hibbard, P. Högberg, S. Linder, F. T. Mackenzie, B. Moore III, T. Pedersen, Y. Rosenthal, S. Seitzinger, V. Smetacek, W. Steffen. (2000). “The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System”. Science 290 (5490): 291–296. doi:10.1126/science.290.5490.291. PMID 11030643.
- ^ R. Stefanenko (1983). Coal Mining Technology: Theory and Practice. Society for Mining Metallurgy. ISBN 0895204045
- ^ Kasting, James (1998). “The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning”. Consequences: the Nature and Implication of Environmental Change 4 (1).
- ^ “Minerals Yearbook: Graphite, 2006” (PDF) (英語). USGS. 2011年3月27日閲覧。
- ^ Catelle, W.R. (1911). The Diamond. John Lane Company Page 159 discussion on Alluvial diamonds in India and elsewhere as well as earliest finds
- ^ J. W. Hershey (1940). The Book Of Diamonds: Their Curious Lore, Properties, Tests And Synthetic Manufacture. Kessinger Pub Co. p. 28. ISBN 1417977159
- ^ a b Janse, A. J. A. (2007). “Global Rough Diamond Production Since 1870”. Gems and Gemology (GIA) XLIII (Summer 2007): 98–119.
- ^ Marshall, Stephen; Shore, Josh (2004年10月22日). “The Diamond Life” (英語). Guerrilla News Network. 2008年10月10日時点のオリジナルよりアーカイブ。2011年3月27日閲覧。
- ^ Lorenz, V. (2007). “Argyle in Western Australia: The world's richest diamantiferous pipe; its past and future”. Gemmologie, Zeitschrift der Deutschen Gemmologischen Gesellschaft (DGemG) 56 (1/2): 35–40.
- ^ a b “Carbon – Naturally occurring isotopes” (英語). WebElements Periodic Table. 2011年3月27日閲覧。
- ^ “Official SI Unit definitions” (英語). 2011年3月27日閲覧。
- ^ a b Brown, Tom (March 1, 2006). “Carbon Goes Full Circle in the Amazon” (英語). Lawrence Livermore National Laboratory. 2011年3月27日閲覧。
- ^ a b c 早川由紀夫. “放射性炭素年代測定の原理と暦年代への換算”. 群馬大学教育学部. 2011年3月27日閲覧。
- ^ a b c d e f 桜井 1997, p. 50.
- ^ a b Bowman, S. (1990). Interpreting the past: Radiocarbon dating. British Museum Press. ISBN 0-7141-2047-2
- ^ Libby, WF (1952). Radiocarbon dating. Chicago University Press and references therein
- ^ Westgren, A. (1960年). “The Nobel Prize in Chemistry 1960” (英語). Nobel Foundation. 2011年3月27日閲覧。
- ^ 増田公明. “放射性炭素(C14)による過去の宇宙線強度と太陽活動の研究”. 名古屋大学太陽地球観測研究所. 2011年3月27日閲覧。[リンク切れ]
- ^ 植村福七「ラジオ・アイソトープの産業利用とその影響-主として工業利用-」『香川大学経済論叢』第31巻第3号、香川大学経済研究所、1958年9月、1-44頁、ISSN 0389-3030、NAID 120007011245。
- ^ “Use query for carbon-8”. 2007年12月21日閲覧。
- ^ “Beaming Into the Dark Corners of the Nuclear Kitchen” (英語). 2011年3月27日閲覧。
- ^ “World of Carbon – Interactive Nano-visulisation in Science &Engineering Edukation (IN-VSEE)” (英語). 2011年3月27日閲覧。
- ^ C. Lee; Wei, X; Kysar, JW; Hone, J (2008). “Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene”. Science 321 (5887): 385. doi:10.1126/science.1157996. PMID 18635798. 非専門家向けの内容要旨.
- ^ Sanderson, Bill (2008年8月25日). “Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator” (英語). nypost.com. 2011年3月27日閲覧。
- ^ a b c 桜井 1997, p. 52.
- ^ a b Ebbesen, TW, ed (1997). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. ISBN 0849396026
- ^ a b MS Dresselhaus, G Dresselhaus, Ph Avouris, ed (2001). “Carbon nanotubes: synthesis, structures, properties and applications”. Topics in Applied Physics (Berlin: Springer) 80. ISBN 3540410864.
- ^ Nasibulin, Albert G.; Pikhitsa, PV; Jiang, H; Brown, DP; Krasheninnikov, AV; Anisimov, AS; Queipo, P; Moisala, A et al. (2007). “A novel hybrid carbon material”. Nature Nanotechnology 2 (3): 156–161. doi:10.1038/nnano.2007.37. PMID 18654245.
- ^ Nasibulin, A; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. (2007). “Investigations of NanoBud formation”. Chemical Physics Letters 446: 109–114. doi:10.1016/j.cplett.2007.08.050.
- ^ Vieira, R (2004). “Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2 over nickel catalyst”. Applied Catalysis A 274: 1–8. doi:10.1016/j.apcata.2004.04.008.
- ^ a b Clifford, Frondel; Marvin, Ursula B. (1967). “Lonsdaleite, a new hexagonal polymorph of diamond”. Nature 214: 587–589. doi:10.1038/214587a0.
- ^ Rode, A.V.; Hyde, S.T.; Gamaly, E.G.; Elliman, R.G.; McKenzie, D.R.; Bulcock, S. (1999). “Structural analysis of a carbon foam formed by high pulse-rate laser ablation”. Applied Physics A-Materials Science & Processing 69: S755–S758. doi:10.1007/s003390051522.
- ^ Carbyne and Carbynoid Structures Series: Physics and Chemistry of Materials with Low-Dimensional Structures, Vol. 21 Heimann, R.B.; Evsyukov, S.E.; Kavan, L. (Eds.) 1999, 452 p., ISBN 0-7923-5323-4
- ^ (日本語) 2010年生産量3年ぶりプラスに カーボンブラック. 化学工業日報. (2011-02-15) 2011年3月27日閲覧。.
- ^ 化学工業日報 1996, p. 1592, 【黒鉛・人造黒鉛】.
- ^ “【黒鉛】 原子力用語集 カ行”. 経済産業省資源エネルギー庁. 2011年3月27日閲覧。
- ^ “各国原子炉開発の動向”. 内閣府原子力委員会. 2011年3月27日閲覧。
- ^ 桜井 1997, pp. 50–51.
- ^ 大串秀世. “「夢」ではなくなったダイヤモンド半導体”. 独立行政法人科学技術振興機構. 2011年3月27日閲覧。
- ^ “統計データ 第5章 鉱工業9 工業生産量‐化学・石油・セメント[統計表]”. 総務省. 2011年3月27日閲覧。[リンク切れ]
- ^ 化学工業日報 1996, pp. 1067–1069, 【カーボンブラック】.
- ^ Dorfer, Leopold; Moser, M; Spindler, K; Bahr, F; Egarter-Vigl, E; Dohr, G (1998). “5200-year old acupuncture in Central Europe?”. Science 282 (5387): 242–243. doi:10.1126/science.282.5387.239f. PMID 9841386.
- ^ Donaldson, K; Stone, V; Clouter, A; Renwick, L; MacNee, W (2001). “Ultrafine particles”. Occupational and Environmental Medicine 58 (3): 211–216. doi:10.1136/oem.58.3.211. PMC 1740105. PMID 11171936.
- ^ “Carbon Nanoparticles Toxic To Adult Fruit Flies But Benign To Young” (英語). ScienceDaily (Aug. 17, 2009). 2011年3月27日閲覧。
参考文献
[編集]- 桜井弘『元素111の新知識』(第六刷)講談社、1998年(初版1997年)、49-55頁。ISBN 4-06-257192-7。
- 青木和光『物質の宇宙史』(初版)新日本出版社、2004年。ISBN 4-406-03068-9。
- 『12996の化学商品』化学工業日報、1996年。ISBN 4-87326-204-6。
- 尾崎洋二『宇宙科学入門』(第2版第1刷)東京大学出版会、2010年。ISBN 978-4-13-062719-1。
関連項目
[編集]外部リンク
[編集]- 経済産業省生産動態統計年報 化学工業統計編
- WebElements "Carbon"
- 炭素 理科ねっとわーく(一般公開版) - ウェイバックマシン(2017年10月3日アーカイブ分) - 文部科学省 国立教育政策研究所
- 国際化学物質安全性カード 炭素 (ICSC:0702) 日本語版(国立医薬品食品衛生研究所による), 英語版
- 『炭素』 - コトバンク
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| |||||||||||||||||||||||||||||||||



