薬物代謝

薬物代謝(やくぶつたいしゃ)とは動植物における代謝の様式のひとつ。薬、毒物などの生体外物質(ゼノバイオティクス (Xenobiotics)、異物ともいう)を分解あるいは排出するための代謝反応の総称である。これらを行う酵素を総称して薬物代謝酵素という。全体的には対象物質の親水性を高め分解・排出しやすくする傾向がある。全般的に、生体に対する害を軽減する意味があると考えられるので解毒代謝ともいうが、結果的にはかえって毒性が増すこともある。また生体外物質のみでなく、生体内由来の不要となった物質(ステロイドホルモン、甲状腺ホルモン、胆汁酸、ビリルビンなど)も対象となる。
薬物代謝という名の通り、特に医薬品の代謝に重要であり、薬の効き目や副作用の個人差、複数の薬の間の相互作用などに大きく関わる。また薬物代謝に関与する酵素には薬物などの投与により発現誘導されるものが多く、生体の有害物質に対する防御の手段として重要である。薬物代謝に関与する代謝経路は、環境科学において重要と見られている。ある汚染物質が環境においてバイオレメディエーションにより分解されるか、残留性有機汚染物質となるかは、微生物の異物代謝により決定されるからである。異物を代謝する酵素群、特にグルタチオン-S-トランスフェラーゼ類は、殺虫剤や除草剤への耐性を与えるので、農業の分野で重要である。
薬物代謝は第1相から第3相に分類される。第1相では、シトクロムP450などの酵素が、生体外物質に反応性官能基や極性基を導入する。第2相では、変換された化合物が、グルタチオン-S-トランスフェラーゼのような転移酵素によって触媒され、極性化合物と結合する。第3相では、極性化合物との結合体が更に変換を受け、排出トランスポーターにより認識されて細胞から吐き出される。
透過障壁と解毒
[編集]生体が生体外物質から受けるストレスの主な特徴は、生体がさらされる化合物の種類が予測不能かつ長期的には多岐にわたるということである[1]。生体外物質解毒システムが直面している最大の問題は、正常な代謝に関わる化学物質の複雑な混合物から、ほとんど無制限とも言える種類の生体外化合物を除去しなければならないことである。この問題に対して、生物は物理的障壁と特異性が低い酵素システムの見事な組み合わせを進化させた。 全ての生命体は、内部環境への物質移動を制御するための疎水性浸透障壁として細胞膜を持っている。極性化合物は細胞膜を通り抜けて拡散することはできず、特異的に基質を選択する輸送タンパク質の仲介によって、有用な分子だけが混合物から細胞内に取り込まれる。つまりこの選択的取り込みのために、ほとんどの親水性分子は、輸送タンパク質に認識されず細胞内に入れない[2] 。一方、これらの障壁を通過する疎水性化合物の細胞内への拡散は制御できないので、生命体は、細胞膜による障壁では脂溶性生体外物質を排除できない。 しかし、浸透障壁があるので、生命体は膜透過性生体外物質に共通の疎水性を利用した異物代謝の機構を発達させることが可能である。生命体は、ほとんどあらゆる非極性化合物を代謝できるくらい、広範な基質特異性を獲得することで、選択性の問題を解決している[1]。有益な代謝産物は極性で、一般に1つ以上の荷電した官能基を持つので排除される。 正常な代謝から生じた反応性副生成物は、正常な細胞構造体の誘導体であり、通常その性質を引き継いで極性であるため、上述のシステムによって解毒されない。しかし、そのような化合物の種類は少ないので、特定の酵素により認識され排除される。反応性のメチルグリオキサールを除去するグリオキサラーゼシステム[3]と活性酸素化学種を除去する様々な抗酸化システム[4]がこの例として挙げられる。
解毒の段階
[編集]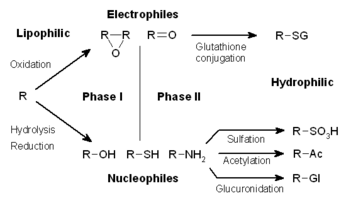
生体外物質の代謝は、変性、抱合、排出の3つの相に分けられる。これらの反応は細胞内で協奏的に行われ、生体外物質は解毒、排除される。
第1相(変性)
[編集]第1相において、様々な酵素が働き、基質に反応性があり極性を持つ官能基を導入する。最も一般的な変性の1つは、シトクロムP450が関与するオキシダーゼ反応系が触媒する水酸化である。これらの酵素複合体の働きで、非活性な炭素に酸素原子が付加し、水酸基が導入される、もしくはO-、N-、またはS-脱アルキル化が起こる[5]。P-450オキシダーゼの反応は下図に示されるように、シトクロームと結合した酸素の還元と高反応性オキソフェリル種の発生を経て進行する[6]
第1相の反応(非合成反応とも呼ばれる)には、複数のオキシダーゼが関与する酸化、還元、加水分解、環化、開環、酸素原子の付加、水酸基の脱離が含まれ、主に肝臓で行われる。これらの典型的な酸化的反応にはシトクロムP450モノオキシダーゼ(CYP)、NADPH、と酸素が関与している。フェノチアジン類、アセトアミノフェン、ステロイド類などの医薬品はこの方法で代謝される。第1相の反応による代謝物の極性が十分に高ければ、すぐに排出されるが、多くの代謝物は即座に除去されずに、続く内因性物質との結合反応により、高極性の複合体を形成した後排出される。第1相の酸化反応ではC-H結合のC-OH結合への変換が共通して起こる。この反応により、薬理的に不活性な化合物(プロドラッグ)が薬理活性を示す化合物に変化する場合がある。一方で、無毒な分子が有毒な分子に変換されることもある。胃での単純な加水分解は、通常無害であるが例外はある。例えば、第1相の代謝では、アセトニトリルはグリコニトリル (HOCH2CN)に変換されるが、即座に有毒な2種類の化合物、ホルムアルデヒドとシアン化水素に解離する。
医薬品候補化合物の第1相代謝は、酵素ではない触媒を用いて、実験室で確認することができる[7]。この生体反応の模倣反応では、しばしば第1相代謝物を含む生成物を与える。例として、胃腸薬トリメブチンの主な代謝物、デスメチルトリメブチン(ノルトリメブチン)、は市販薬を試験管内で酸化することで効率的に得られる。N-メチル基の水酸化は、ホルムアルデヒド分子の脱離をもたらし、一方O-メチル基の酸化はそれほど起こらない。
酸化
[編集]還元
[編集]シトクロムP450レダクターゼ(別名、NADPH:ferrihemoprotein oxidoreductase、NADPH-ヘムタンパク質レダクターゼ、NADPH:P450 oxidoreductase、P450 reductase、POR、CPR、CYPOR)は膜結合型酵素で、FAD及び FMN含有酵素NADPH-シトクロムP450レダクターゼからシトクロムP450 へ電子を伝達する。POR/P450システムにおける電子の流れは一般に以下の通り。
還元反応の間、化学物質は無益回路に入って電子を得てフリーラジカルとなり、即座に電子を酸素に受け渡す(電子を受け取った酸素はスーパーオキシドアニオンになる)。
加水分解
[編集]第2相(抱合)
[編集]その後の第2相の反応では、活性化された生体外物質の代謝物は、グルタチオン(GSH)、グリシンまたはグルクロン酸のような電荷を持つ化学種に抱合される。薬物の抱合反応が起こる部位には カルボキシ基 (-COOH)、ヒドロキシ基 (-OH)、アミノ基 (-NH2)、チオール (-SH)などがある。多くの場合活性な代謝物が生成される第1相の反応とは異なり、抱合反応の生成物は、分子量が増加し、基質より不活性になる傾向がある。GSHのような大きな陰イオンの付加により、反応性求電子剤は解毒され、より極性が高く細胞膜を通過して拡散することができない代謝物となり、積極的に排出へと輸送される。
これらの反応は、広い特異性を持つ一群の転移酵素によって触媒される。これらの転移酵素は組み合わせによって、求核性もしくは求電子性官能基を持つほとんどの疎水性化合物を代謝することができる[1] 。その中でもグルタチオン-S-トランスフェラーゼ類は、最も重要な酵素群である。
| 機構 | 酵素[8] | 補因子[8] | 場所[8] |
|---|---|---|---|
| メチル化 | メチルトランスフェラーゼ | S-アデノシルメチオニン | 肝臓、腎臓、肺、中枢神経系 |
| 硫酸抱合 | スルホトランスフェラーゼ | 3'-ホスホアデノシン-5'-ホスホ硫酸 | 肝臓、腎臓、腸 |
| アセチル化 |
|
アセチルCoA | 肝臓、肺、脾臓、胃粘膜、赤血球、リンパ球 |
| グルクロン酸抱合 | UDP-グルクロン酸転移酵素 | UDP-グルクロン酸 | 肝臓、腎臓、腸、肺、皮膚、前立腺、脳 |
| グルタチオン抱合 | グルタチオン-S-トランスフェラーゼ | グルタチオン | 肝臓、腎臓 |
| グリシン抱合 | N-アセチルトランスフェラーゼ | アセチルCoA | 肝臓、腎臓 |
第3相(追加変性及び排出)
[編集]第2相後、抱合された生体外物質はさらに代謝を受ける場合がある。例としてグルタチオン抱合体がシステイン抱合体からメルカプツール酸へと変換される反応が挙げられる[9] 。グルタチオン分子のグルタミン酸残基とグリシン残基はγ-グルタミルトランスフェラーゼとジペプチダーゼによって取り除かれ、最終段階でシステイン残基はアセチル化される。抱合体とその代謝物は代謝過程の第3相において、P糖タンパク質ファミリーの様々な膜輸送体に対して、陰イオン性置換基が親和性標識として働き、細胞から排出される[10] 。これらのタンパク質はABC輸送体ファミリーであり、非常に広範囲な疎水性陰イオンのATP依存性輸送を触媒し[11]、第2相の生成物を細胞外へ移動してさらなる代謝や排出システムに乗せる役割を果たす[12]。
内因性の毒素
[編集]上述のシステムでは、過酸化物や反応性のアルデヒド類のような、内因性の反応性代謝物は解毒できない場合がしばしばある。これはこれらの化学種が正常な細胞構成物の誘導体であり、通常その高い極性を引き継いでいるためである。しかし、そのような化合物の種類は少ないので、特定の酵素により認識され排除される。従って、有害な分子と有用な代謝物が類似しているため、それぞれの内因性毒素グループを代謝するために異なる解毒酵素が必要とされる。反応性のメチルグリオキサールを除去するグリオキサラーゼシステムと活性酸素化学種を除去する様々な抗酸化システムが、この特異的解毒システムの例として挙げられる。
代謝の場所
[編集]全ての生物の組織がある程度薬物を代謝する能力を備えているが、肝臓細胞の滑面小胞体が量的な意味で薬物代謝の主要器官である。肝臓は、大きな器官であること、また消化管から吸収された化学物質が最初に通過する器官であること、そして他の器官と比較して非常に高濃度の多くの薬物代謝酵素が存在していることから、薬物代謝への肝臓の寄与は大きい。ある薬物が消化管から吸収され、門脈を通じて肝循環へと入ると、薬物は代謝作用を受け、いわゆる初回通過効果を示す。その他の薬物代謝の場所として、消化管、肺、肝臓、皮膚の上皮細胞がある。通常これらの場所は局所的な毒性反応に対応する。
薬物代謝に影響する要因
[編集]ほとんどの脂溶性薬物の薬学的作用の持続時間と強度は、その薬物が不活性な生成物に代謝される速度によって決定される。その意味ではシトクロムP450システムが最も重要な経路であるといえる。一般に、何らかの要因で薬学的に活性な化合物の代謝速度が増加すると、薬物作用の持続時間と強度は減少する(例えば酵素誘導)。また逆の現象も起こる(例えば酵素阻害)。しかし、プロドラッグが薬物に変換される酵素反応においては、反応を司る酵素の誘導によってプロドラッグの変換が加速され、薬物の活性レベルが上昇する。一方で潜在的に毒性を示す可能性がある。様々な’’生理学的’’および’’病理学的’’要素が薬物代謝に影響する。生理学的要素には、年齢、個人差(たとえば、ゲノム薬理学)、腸肝循環、栄養、腸内細菌、性差などが含まれる。一般に薬物の代謝は、ヒトと動物において、胎児、新生児、高齢者は成人に比べて遅い。遺伝的多様性(多型)は、薬物の効果にある程度ばらつきが見られる原因として重要である。第2相のアセチル抱合に関与する、N-アセチル基転移酵素(またはN-アセチルトランスフェラーゼ)の例では、遺伝的要因によりヒトは、アセチル化が遅い体質と早い体質の集団に分かれる。集団の比率は人種によって異なる。
代謝が遅い体質の者は、用量依存性の毒性に対してより影響を受けやすいので、遺伝的多様性は、時として重篤な結果をもたらす。シトクロムP450酵素群に関しても個人差、人種間差があり、1から30パーセントの人に欠損が見られる。’’病理学的要因’’も肝臓、腎臓、心臓での薬物代謝に影響しうる。コンピュータ上でのモデル化やシミュレーションを用いて、ヒトへの臨床試験を行う前に、仮想の患者集団における薬物代謝反応が予見できる[13]。この方法により、薬害反応にさらされる危険性が高い個人を特定することが可能である。
歴史
[編集]ヒトが摂取した物質が体内でどのように変化して行くかについての研究は、化学者が、ベンズアルデヒドのような有機化合物が体内で酸化され、アミノ酸に抱合されることを発見した19世紀中頃始まった[14] 。19世紀後半には、メチル化、アセチル化、硫酸抱合などの基礎的解毒反応が発見された。20世紀初めになると、研究は、代謝物の生成に関わる酵素と反応経路の調査へ移行した。この分野は、1947年にリチャード・T・ウィリアムズが「解毒メカニズム」を出版したことを期に、独立した研究分野として定義されるようになった[15]。この近代的な生化学的研究により、1961年にグルタチオン-S-トランスフェラーゼが同定され[16]、1962年にはシトクロムP450群が発見された[17]。さらに1963年にはシトクロムP450が生体外物質の代謝において中心的役割を果たしていることが見出された[18][19]。
関連項目
[編集]参考文献
[編集]- ^ a b c Jakoby WB, Ziegler DM (December 1990). “The enzymes of detoxication”. J. Biol. Chem. 265 (34): 20715–8. PMID 2249981.
- ^ Mizuno N, Niwa T, Yotsumoto Y, Sugiyama Y (September 2003). “Impact of drug transporter studies on drug discovery and development”. Pharmacol. Rev. 55 (3): 425–61. doi:10.1124/pr.55.3.1. PMID 12869659.
- ^ Thornalley PJ (July 1990). “The glyoxalase system: new developments towards functional characterization of a metabolic pathway fundamental to biological life”. Biochem. J. 269 (1): 1–11. PMC 1131522. PMID 2198020.
- ^ Sies H (March 1997). “Oxidative stress: oxidants and antioxidants” (PDF). Exp. Physiol. 82 (2): 291–5. PMID 9129943.
- ^ Guengerich FP (June 2001). “Common and uncommon cytochrome P450 reactions related to metabolism and chemical toxicity”. Chem. Res. Toxicol. 14 (6): 611–50. doi:10.1021/tx0002583. PMID 11409933.
- ^ Schlichting I, Berendzen J, Chu K, Stock AM, Maves SA, Benson DE, Sweet RM, Ringe D, Petsko GA, Sligar SG (March 2000). “The catalytic pathway of cytochrome p450cam at atomic resolution”. Science 287 (5458): 1615–22. doi:10.1126/science.287.5458.1615. PMID 10698731.
- ^ Akagah B, Lormier AT, Fournet A, Figadère B (December 2008). “Oxidation of antiparasitic 2-substituted quinolines using metalloporphyrin catalysts: scale-up of a biomimetic reaction for metabolite production of drug candidates”. Org. Biomol. Chem. 6 (24): 4494–7. doi:10.1039/b815963g. PMID 19039354.
- ^ a b c Liston HL, Markowitz JS, DeVane CL (October 2001). “Drug glucuronidation in clinical psychopharmacology”. J Clin Psychopharmacol 21 (5): 500–15. doi:10.1097/00004714-200110000-00008. PMID 11593076.
- ^ Boyland E, Chasseaud LF (1969). “The role of glutathione and glutathione S-transferases in mercapturic acid biosynthesis”. Adv. Enzymol. Relat. Areas Mol. Biol.. Advances in Enzymology – and Related Areas of Molecular Biology 32: 173–219. doi:10.1002/9780470122778.ch5. ISBN 9780470122778. PMID 4892500.
- ^ Homolya L, Váradi A, Sarkadi B (2003). “Multidrug resistance-associated proteins: Export pumps for conjugates with glutathione, glucuronate or sulfate”. BioFactors 17 (1–4): 103–14. doi:10.1002/biof.5520170111. PMID 12897433.
- ^ König J, Nies AT, Cui Y, Leier I, Keppler D (December 1999). “Conjugate export pumps of the multidrug resistance protein (MRP) family: localization, substrate specificity, and MRP2-mediated drug resistance”. Biochim. Biophys. Acta 1461 (2): 377–94. doi:10.1016/S0005-2736(99)00169-8. PMID 10581368.
- ^ Commandeur JN, Stijntjes GJ, Vermeulen NP (June 1995). “Enzymes and transport systems involved in the formation and disposition of glutathione S-conjugates. Role in bioactivation and detoxication mechanisms of xenobiotics”. Pharmacol. Rev. 47 (2): 271–330. PMID 7568330.
- ^ Rostami-Hodjegan A, Tucker GT (February 2007). “Simulation and prediction of in vivo drug metabolism in human populations from in vitro data”. Nat Rev Drug Discov 6 (2): 140–8. doi:10.1038/nrd2173. PMID 17268485.
- ^ Murphy PJ (June 2001). “Xenobiotic metabolism: a look from the past to the future”. Drug Metab. Dispos. 29 (6): 79–80. PMID 11353742.
- ^ Neuberger A, Smith RL (1983). “Richard Tecwyn Williams: the man, his work, his impact”. Drug Metab. Rev. 14 (3): 559–607. doi:10.3109/03602538308991399. PMID 6347595.
- ^ Booth J, Boyland E, Sims P (June 1961). “An enzyme from rat liver catalysing conjugations with glutathione”. Biochem. J. 79 (3): 516–24. PMC 1205680. PMID 16748905.
- ^ Omura T, Sato R (April 1962). “A new cytochrome in liver microsomes”. J. Biol. Chem. 237: 1375–6. PMID 14482007.
- ^ Estabrook RW (December 2003). “A passion for P450s (remembrances of the early history of research on cytochrome P450)”. Drug Metab. Dispos. 31 (12): 1461–73. doi:10.1124/dmd.31.12.1461. PMID 14625342.
- ^ Estabrook RW, Cooper DY, Rosenthal O (1963). “The light reversible carbon monoxide inhibition of steroid C-21 hydroxylase system in adrenal cortex”. Biochem Z 338: 741–55. PMID 14087340.


