慢性骨髄性白血病
| 慢性骨髄性白血病 | |
|---|---|
 | |
| FISHにより検出されたフィラデルフィア染色体 | |
| 概要 | |
| 診療科 | 血液学 |
| 分類および外部参照情報 | |
| ICD-10 | C92.1 |
| ICD-9-CM | 205.1 |
| ICD-O | M9875/3 |
| DiseasesDB | 2659 |
| MedlinePlus | 000570 |
| MeSH | D015464 |
慢性骨髄性白血病(まんせいこつずいせいはっけつびょう Chronic myelogenous leukemia ,CML)とは、造血幹細胞の遺伝子が後天的に変異して、造血細胞が分化・成熟能を保ったまま自律的な増殖をし、血液において白血球や時に血小板が増加する血液腫瘍である。
発生率と疫学
[編集]慢性骨髄性白血病は年間に100万人あたり10-15人程度発生しすべての白血病(年間10万人あたり6人程度)の約2割を占める[1]。男性にやや多く(女性の1.3-2.2倍)発症年齢の中心値は45-55歳であるが、小児白血病の中ではわずか5%を占めるだけであり、青年層も発症はするが中年以降により多く見られる[2]。慢性骨髄性白血病は、慢性リンパ性白血病と違い、人種による発症率の差は無い[1]。
症状と血液・骨髄の検査所見
[編集]慢性骨髄性白血病の最初の病期であり患者の85%を占める慢性期では自覚症状に乏しいが、自覚することがある症状としては、慢性骨髄性白血病は脾腫を伴うことが多いので腹部膨満は比較的見られる自覚症状である。他には腹痛、倦怠感などがあることもあり、稀には発熱や出血、貧血なども見られることもある。しかし多くの患者では顕著な症状は無く、健康診断で白血球数の増多を指摘されて初めて受診し発見されることが多い。[3]。病期が進行し移行期から急性期になると骨髄は芽球が占拠し末梢血にも芽球があふれ、急性白血病と類似する諸症状(白血球減少による高い発熱を伴う感染症、血小板減少による易出血状態、赤血球減少による貧血の諸症状、各種臓器への白血病細胞の浸潤に伴う諸症状)が現れる。
慢性期の慢性骨髄性白血病の血液では白血球が著明に増加し(半数以上の患者では10万個/μl以上、基準上限値の10倍以上になる)、血小板も増加していることが多い。貧血は多くはないが、ヘモグロビン (Hb) 値が10g/dl以下のはっきりした貧血も20%の患者で見られる[2]。
増加している白血球は、好中球、好塩基球、好酸球であるが、特に好中球と好塩基球の増加は顕著である。好塩基球は一般には白血球の1%以下しかない稀な種類の白血球であるが、慢性骨髄性白血病では一番初期、他の血球に先んじて好塩基球が増加し始め、慢性期を通じて好塩基球は著明な増加を見せる[要出典]。好塩基球の増加が慢性骨髄性白血病の極めて特徴的な所見である。好塩基球に続いて好中球が増加し(元々白血球では一番多い種類だが)膨大な数になるが、好中球は顕微鏡観察では一見正常に見えるが、アルカリフォスファターゼ (NAP) 活性が著明に低下し、他の白血球増多症との重要な鑑別点となっている[3]。
骨髄では明白な過形成(細胞が増加し通常より高密度になっている状態)で骨髄系細胞(主として好中球・好塩基球・好酸球の幼若球)と赤血球の幼若球である赤芽球の数量の比(M:E比)は10:1-30:1と極端に骨髄系細胞に偏っている。それに加えて巨核球も通常は増加している。造血をしている正常な骨髄はおよそ半分は脂肪であるが、慢性骨髄性白血病では血液細胞が著増するので脂肪分はほとんど見られなくなる[3]。
病態生理
[編集]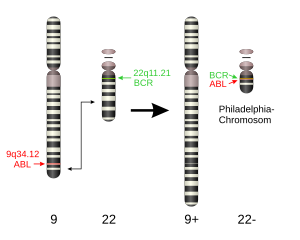
フィラデルフィア染色体として知られる染色体転座による遺伝子の後天的異常と明白に関連すると捉えられた最初の病気であった。フィラデルフィア染色体の名前は1960年代にペンシルベニア州フィラデルフィアの2人の研究者によって発見されたことに由来する。(9番染色体と22番染色体)各長腕の転座により、22番染色体上のBCR (breakpoint cluster region) と9番染色体のABL各遺伝子領域が複合し、融合(キメラ)遺伝子BCR-ABLを生じる。この産物である融合タンパクBCR-ABLは、恒常的に活性化されたチロシンキナーゼであり、JAK-STAT系等を介してアポトーシス抑制遺伝子BCL-XLの転写を促進するなど細胞の不死化を引き起こす。さらに、この融合タンパクはDNA修復を禁止するので、ゲノムが不安定となり、細胞は更なる遺伝子的異常を引き起こしやすくなる。フィラデルフィア染色体が検出される(陽性)細胞が骨髄芽球系かリンパ芽球性かでやや病態が異なり、後者はより難治性とされる。
病期
[編集]しばしば臨床的特徴と検査所見に基づいて3つの段階に分けられる。一般的には慢性期に始まり、数年間をかけて移行期へと移行し、最終的には急性転化期に陥る。急性期の身体状態は急性白血病と同様な振舞を示す。
- 慢性期(Chronic Phase, CP)
- 患者のおよそ85パーセントが診断時にこの段階である。この時期は、患者はほとんど無症状であるか、あっても軽度の疲労感や脾腫及び肝腫大による満腹感程度である。治療が行われない場合、数年で移行期や急性期に移行する。
- 慢性期においては、骨髄及び末梢血中の芽球の割合は10%未満である。
- 移行期(Accelerated Phase, AP)
- 移行期は急性期へ悪化する前段階であり、芽球の増加がみられ、末梢血中または骨髄中の芽球が10%以上20%未満の状態である。
- 急性期(Blast Phase, BP)
- 正常な造血機能が著しく障害されている段階であり、身体症状は急性骨髄性白血病に類似する。末梢血中または骨髄中の芽球は20%以上となり、髄外造血(転移)がみられることもある。芽球は骨髄球系・リンパ球系のどちらもとりうるが、骨髄球系が多い。
治療
[編集]第1世代のチロシンキナーゼ阻害薬 (TKI) イマチニブメシル酸塩(商品名グリベック)が2001年以来長く使われ長期の使用データも蓄積され、広く使用されている。イマチニブによっておよそ90%の患者が寛解を得て通常の社会生活を送ることができるが、一部に治療の初期または中途からイマチニブに治療抵抗性となる場合があり、イマチニブに抵抗性のある慢性骨髄性白血病患者には第2世代のチロシンキナーゼ阻害薬 (TKI) が開発され効果をしめしている(ただし、数十種類あるBCR-ABLたんぱく質の小変異の内、T315I BCR-ABLと呼ばれるATP結合部位のアミノ酸残基トレオニンがイソロイシンに変異したタイプのものは、イマチニブにも第二世代のTKIにも抵抗性であり、移植治療が推薦される[4])
第2世代のチロシンキナーゼ阻害薬は現在2種類が使用可能である。
- ニロチニブ(ニロチニブ塩酸塩水和物、商品名タシグナ)のBCR-ABLの阻害効果はイマチニブの約20倍強力である。
- ダサチニブ(ダサチニブ水和物、商品名スプリセル)2009年1月に承認された。
第3世代のチロシンキナーゼ阻害薬。
- ボスチニブ (商品名ボシュリフ)2014年9月承認。
チロシンキナーゼ阻害薬抵抗性を示すT315i変異に対する薬剤
- ポナチニブ 2016年1月承認
現在、実用化されているの分子標的薬以外にも、bafetinib(INNO-406, NS-187)などの新薬が開発段階にある。Bafetinibは日本で創薬されたチロシンキナーゼ阻害薬であり期待されている。
移行期や急性期に移行した場合、あるいはチロシンキナーゼ阻害薬に耐性をもった場合、チロシンキナーゼ阻害薬が最初から効きにくいサブタイプなどの慢性骨髄性白血病に対しは骨髄移植や臍帯血移植などの造血幹細胞移植が重要な治療法となる。
造血器腫瘍ガイドラインに基づく治療選択
[編集]造血器腫瘍診療ガイドライン2018年版補訂版[5]に基づく治療選択を以下に記す。
慢性期の治療
一次治療としてイマチニブ、ダサチニブ、ニロチニブの中から1剤を選択する。副作用が異なるため、患者背景に応じた治療選択を行う。
治療抵抗性となった場合には、上記にボスチニブを加えた薬剤のうち1剤を選択する。イマチニブを用いていた場合は、ダサチニブ、ニロチニブ、ボスチニブのうち1剤を選択する。ダサチニブ、ニロチニブを投与していた場合は、第2世代のうち投与していないほうの薬剤もしくはボスチニブのどちらかを選択する。
三次治療以降の場合やT315Iを認める場合にはポナチニブが選択肢となる。
進行期(移行期・急性期)の治療
移行期の場合はダサチニブ、ニロチニブが選択される。すでにチロシンキナーゼ阻害薬で治療中の場合には、ボスチニブ、ポナチニブも選択肢となる。
急性期の場合はチロシンキナーゼ阻害薬に化学療法の併用が検討され、さらに移植適応がある場合には同種造血幹細胞移植が行われる。
予後
[編集]初発慢性期
[編集]チロシンキナーゼ阻害薬が登場する以前の治療では初発慢性期であっても10年生存率は約25%に過ぎなかったが、イマチニブの登場により8年での全生存率は85%[6]と、血液悪性疾患の中では驚異的な成績を見せている。 イマチニブ不耐用・抵抗性の初発慢性期に対する第2世代チロシンキナーゼの成績は、ニロチニブで4年の全生存率78%[7]、ダサチニブで3年の全生存率87%[8]である。しかしT315I変異を有する例では、依然としてチロシンキナーゼ阻害薬登場以前と同程度の予後である。
移行期・急性期
[編集]慢性期にはきわめて有効であったイマチニブも、移行期においては4年生存率は45%[9]まで低下する。一方、第2世代チロシンキナーゼの成績は、ニロチニブで1年の全生存率は79%[10]、ダサチニブで3年の全生存率は82%[11]である。ただし同期間の無増悪生存率は低く(73%[10]と66%[11])、生存曲線も平坦化していない。
急性期においては、イマチニブ単独での1年全生存率は22%しかない。ニロチニブで20%前後の寛解を得たと報告されている(生存率は記載なし)[12]が、ニロチニブは日本では急性期に対する適応は無い。ダサチニブは適応があるが、単剤での全生存中央値は骨髄球系で11.8か月、リンパ球系で5.3か月[13]である。
出典
[編集]- ^ a b 押味『WHO分類第4版による白血病・リンパ系腫瘍の病態学』p.22
- ^ a b 浅野『三輪血液病学』p.1460
- ^ a b c 浅野『三輪血液病学』p.1463
- ^ 薄井「白血病幹細胞を標的とする薬剤開発」
- ^ “ホーム|造血器腫瘍診療ガイドライン 2018年版補訂版|一般社団法人 日本血液学会”. www.jshem.or.jp. 2021年10月21日閲覧。
- ^ アメリカ血液学会(ASH) 2009. #1126
- ^ Giles FJ (2013). “Nilotinib in imatinib-resistant or imatinib-intolerant patients with chronic myeloid leukemia in chronic phase: 48-month follow-up results of a phase II study.”. Leukemia 27 (1): 107-112. doi:10.1038/leu.2012.181. Epub 2012 Jul 5.. PMID 22763385.
- ^ R. M. Stone (2009). “Dasatinib dose-optimization study in chronic phase chronic myeloid leukemia (CML-CP): Three-year follow-up with dasatinib 100 mg once daily and landmark analysis of cytogenetic response and progression-free survival (PFS)”. J Clin Oncol. (ASCO Annual Meeting Proceedings (Post-Meeting Edition).
- ^ Silver RT (2009). “Sustained durability of responses and improved progression-free and overall survival with imatinib treatment for accelerated phase and blast crisis chronic myeloid leukemia: long-term follow-up of the STI571 0102 and 0109 trials.”. Haematologica 94 (5). doi:10.3324/haematol.2009.006999.. PMID 19407320.
- ^ a b le Coutre P (2008). “Nilotinib (formerly AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is active in patients with imatinib-resistant or -intolerant accelerated-phase chronic myelogenous leukemia.”. Blood 111 (4): 1834-1839. PMID 18048643.
- ^ a b Apperley JF (2009). “Dasatinib in the treatment of chronic myeloid leukemia in accelerated phase after imatinib failure: the START a trial.”. J Clin Oncol. 27 (21): 3472-3479. doi:10.1200/JCO.2007.14.3339.. PMID 19487385.
- ^ F. J. Giles (2008). “Nilotinib in patients with Philadelphia chromosome-positive chronic myelogenous leukemia in blast crisis (CML-BC) who are resistant or intolerant to imatinib”. J Clin Oncol. (ASCO Annual Meeting Proceedings (Post-Meeting Edition).
- ^ Cortes J (2008). “Efficacy and safety of dasatinib in imatinib-resistant or -intolerant patients with chronic myeloid leukemia in blast phase.”. Leukemia 22 (12). doi:10.1038/leu.2008.221.. PMID 18754032.
参考文献
[編集]書籍
- 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、ISBN 4-8306-1419-6
- 阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、ISBN 978-4-7849-4081-3
- 大野 竜三 編集『よくわかる白血病のすべて』永井書店、2005年、ISBN 4-8159-1736-1
- 小川聡 総編集 『内科学書』Vol.6 改訂第7版、中山書店、2009年、ISBN 978-4-521-73173-5
- 押味和夫 監修『WHO分類第4版による白血病・リンパ系腫瘍の病態学』中外医学社、2009年、ISBN 978-4-498-12525-4
- 杉本恒明、矢崎義雄 総編集 『内科学』第9版、朝倉書店、2007年、ISBN 978-4-254-32230-9
論文
- 薄井 紀子「白血病幹細胞を標的とする薬剤開発」『最新医学』Vol.66 No.3、最新医学社、2011.3
