利用者:Mzaki/シャーガス病
(17:17, 15 December 2009 UTC)(12:38, 2 September 2009 UTC)
ウィキペディアは医学的助言を提供しません。免責事項もお読みください。 |
| Mzaki/シャーガス病 | |
|---|---|
 | |
| An acute Chagas disease infection with swelling of the right eye (Romaña's sign). Source: CDC. | |
| 概要 | |
| 分類および外部参照情報 | |
| ICD-10 | B57 |
| ICD-9-CM | 086 |
| DiseasesDB | 13415 |
| MedlinePlus | 001372 |
| eMedicine | med/327 |
| MeSH | D014355 |
シャーガス病(シャーガスびょう、英: Chagas disease)は、原虫 Trypanosoma cruzi の感染を原因とする人獣共通感染症。主に吸血昆虫であるサシガメ類によって媒介されるが、輸血や臓器移植、原虫の混入した食料を摂取すること、母から子への垂直感染などによっても伝染する。アメリカトリパノソーマ病とも呼ばれる。
症状は経過に伴って変化する。初期の急性期には症状は穏やかで、感染部位が腫れる程度に留まる。進行すると、心臓や腸の肥大といった深刻な慢性症状に発展する。治療しなければ慢性症状によって致死的である。しかし現在の薬物療法は非常に不十分なものである。利用可能な薬剤は極めて毒性が強く、特に慢性期に対しては効果のない場合が多い。
シャーガス病はアメリカ州にのみ見出される疾病であり、特に中南米の貧しい田舎の地域で顕著である。患者は800万から1100万人と推定され、その大多数は感染していることを自覚していないと思われる。また田舎から都市部への人口流動にともなってシャーガス病の地理分布も拡大している。制圧戦略は主に媒介昆虫の排除とその他の感染経路の予防である。[1]
症状
[編集]
この疾病は感染後すぐの急性期と何年もかけて進行する慢性期とに分けられる。 急性期は数ヶ月程度続くが、無症状もしくはごく穏やかな症状に限られ、しかもシャーガス病に特徴的というわけでもないため、気付かれないことが多い。患者が自覚する症状としては、発熱、疲労、体の痛み、発疹、食欲減退、下痢、嘔吐などである。診察時の徴候としては肝臓や脾臓がやや肥大すること、リンパ節の腫れ、原虫が侵入した部位が腫れることなどがあるが、最も特徴的なのはロマーニャ徴候(Romaña's sign)と呼ばれる片眉の腫れである。たとえ急性期に症状が出た場合でも9割の患者では3から8週間で治まり[2]、治療しなければ感染が継続する。まれに劇的な心筋炎または脳炎によって死ぬ患者もいる[3]。また免疫系が弱っている患者にとっても致死的になる[1]。1割程度の患者では症状が治まらずに中間期に進行するばあいもある。
感染から数年から数十年経過した後に、およそ3割ほどの患者がシャーガス病の病状を示すようになる。この特徴的な慢性期では、神経系、消化器系、心臓が冒される。慢性症状を示す患者の3分の2では心臓が冒され、心拍異常や突然死を引き起こす。3分の1の患者は消化器系が冒され、腸や食道が肥大して機能を失い、体重が減る。嚥下障害(アカラシア)が最初の徴候となる場合もある。消化管に症状がある患者の2割から半数が心臓にも症状を示す[2]。まれではあるが、ボケのような神経症状を示す患者もいる。
シャーガス病の臨床所見はそれぞれの臓器における細胞が感染によって破壊され、炎症応答が起き、線維化することによる。例えば細胞内の無鞭毛型原虫が自律神経系の臓器内ニューロンを破壊することで、腸肥大や心臓動脈瘤が起きる。もし治療せずに放置すれば、シャーガス病は致死的である。[2]
病原体
[編集]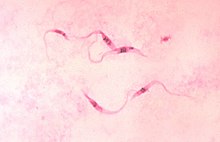
クルーズトリパノソーマ(Trypanosoma cruzi )はユーグレノゾアキネトプラスト類に属する鞭毛虫で、哺乳類に広く感染する。哺乳類吸血性であるオオサシガメ亜科のサシガメをベクターとする。
感染経路
[編集]

シャーガス病の流行地域では、サシガメ類による媒介が主な感染経路である[1]。サシガメは感染者あるいは感染動物から吸血することで感染する。日中は壁や天井の隙間に隠れているが、夜寝ている間に出てくる。サシガメは顔から吸血する傾向があるため、英語ではkissing bugと呼ばれる。吸血した後にその場で糞をするが、この糞に原虫が含まれている。刺された場所を掻いたりすると、糞が傷にすり込まれたり結膜のような粘膜に接触したりするため、糞の中の原虫が体内に侵入することになる。体内では原虫が細胞に侵入して二分裂により増殖し、再び血流中に原虫が放出されこれを繰り返す。[1]
輸血、臓器移植、母乳などを通じて伝染することもあり[4]、検査室での事故的感染も起きる。 また妊婦の体内で胎盤を経由して先天的に感染する場合もあり、ブラジルのある地域では死産の原因の13%を占めている。[5]
1991年、ブラジルパライバ州(Paraiba)の農園で働く労働者が汚染された食品を食べることで感染した。アサイージュースやガラパジュースなどでも感染が起きている。 [6][7][8] 報道や保健当局からのたびたびの警告にもかかわらず、この感染経路は未だに存在している。 [9]
診断
[編集]シャーガス病の診断は、凝血防止した血液やバフィーコート、あるいはギムザ染色した血液塗末標本を顕微鏡観察して原虫の存在を示すことによる。シャーガス病の病原体であるクルーズトリパノソーマは、顕微鏡下では病原性不明のランゲルトリパノソーマと紛らわしい。マウスに接種したり、特別な培地を用いて培養することで原虫を分離することもできる。また、未感染のサシガメに患者の血液を与えた後、サシガメ腸内を検査するという外因診断法もある。[10]
様々な免疫学的検査法があり、原虫の型を鑑別するのに利用可能である。 補体結合法、間接凝血法、間接蛍光法、放射免疫法、ELISA。 PCRを使った診断・型鑑別も可能である。[2]
予防
[編集]
シャーガス病に対するワクチンは現在存在しない。[11] 予防法としては殺虫剤(ピレスロイド)を噴霧あるいは塗布したり、田舎地帯における住居や衛生環境を改善したりして、媒介者であるサシガメ類を排除することによる[12]。都市居住者にとっては、休暇などの折りに侵淫地域で野外キャンプや宿泊をするのが危険になり得る。蚊帳の使用が推奨される。
ワクチン候補が多数検討されている。動物実験では、ランゲルトリパノソーマを接種することで効果があった[13]。 最近ではDNAワクチンも検討されている[14]。
ラテンアメリカ諸国では、輸血が第2の感染経路として頻繁に問題になる。 1993年に行われた血清学的調査によると、献血者のうちクルーズトリパノソーマに対する抗体を保有している人の割合は、アルゼンチン・ブラジル・チリで1.4%から18%ほど、ボリビアでは48%に達していた。すなわちこうした地域では肝炎(0.1%)やAIDS(0.1%)と比べても非常に高い輸血によるシャーガス病への感染リスクが存在する。[15] 感染者由来の輸血1単位あたりの感染見込みは2割ほどと推定されている。[16] ただしサシガメ対策により感染率は減少する。ブラジルの血液銀行におけるクルーズトリパノソーマの存在率は、1970年代の2%から1996年には0.96%まで低下している。[17] またシャーガス病が流行している国々では、献血に際して検査することがすでに必須となっている。[18] アメリカのFDAは献血者に対してクルーズトリパノソーマに対する抗体保有を検査することを認可したが、まだ義務化はされていない。[19] American Association of Blood Banksは患者由来だと判明した血液成分を過去に投与された人に通知し検査を受けさせるように推奨している。[20] かつては、献血された血液にgentian violet0.25 g/Lを加えて原虫を殺すことが行われていた。[21] 抗真菌剤のアムホテリシンBの利用が提案されているが、高価で毒性も高いことから利用が限られている。[22]
治療
[編集]
シャーガス病の治療には殺原虫療法と対症療法の2通りの方針がある。
殺原虫療法
[編集]抗原虫薬は感染初期で効果的だが、急性期だけに限られるわけではない。 ベンズニダゾール[23]やニフルチモックスが使われている。 しかしこれらの薬剤に対する耐性が報告されている。 [24] 副作用が大きい。 さらに10年間におよぶ長期投与をしても原虫を完全に排除することは出来ないことが報告されている。[25]
対症療法
[編集]慢性期になると、治療は対症療法になる。 たとえば、ペースメーカーやamiodaroneのような不整脈の薬を投与することで、慢性心臓疾患を示す患者を延命させることができる[26]が、 腸肥大に対しては外科的処置が必要である。 いずれにしても治癒には至らない。 シャーガス病による慢性心臓疾患に対する心臓移植は、現在ではよく行われている。 しかし最近までは、術後の免疫抑制の際に原虫が活動して心臓疾患が再発する可能性から禁忌となっていた。 [27] シャーガス病患者の生存率は低用量の免疫抑制剤シクロスポリンにより劇的に改善する。 最近になって心筋への造血幹細胞移植による幹細胞療法がシャーガス病患者の心不全リスクを劇的に下げることが示された。[28]
疫学
[編集]


シャーガス病の患者数は2008年時点で1600から1800万人であり、ラテンアメリカ人口の4分の1が感染のリスクにさらされており[29] 毎年2万人が死亡している。[2]
アメリカ合衆国南部からアルゼンチン南部に至るまで、両アメリカ大陸18ヶ国に分布している。 [1] シャーガス病の分布は生態学的に異なる2つの領域にまたがっている。 コーノ・スール地方では主な媒介者は住居の中あるいは周辺に生息している。 一方中央アメリカやメキシコでは媒介者は住居内や無居住地帯にも生息している。 いずれにせよ田舎に限定され、そこではヒトを含め24科150種以上の哺乳類がクルーズトリパノソーマの保虫宿主となっている。[18] サシガメは鳥類を吸血する場合もあるが、鳥類は感染抵抗性があり保虫宿主とは考えられていない。 サシガメの群体を住居や畜舎から駆逐した場合でも野生動物による「森林サイクル」から再出現する場合がある。とくに住居と疎林とが介在するサバンナのような地域で顕著である。[30]
熱帯雨林のような密林や都市部はヒトへの感染という観点からは良くない地域である。 しかし例えば新たに森林破壊が起きた地域やピアッサバ栽培地など、経済開発によって森林環境が削られると、サシガメが新たな食料を求めることによってヒトへの感染が起きるようになる。 [31]
アメリカ合衆国では、クルーズトリパノソーマの野生宿主はオポッサム、アライグマ、アルマジロ、リス、モリネズミ(woodrat)、ハツカネズミなどである。[32] 特にオポッサムは肛門腺でサシガメを経ずに原虫の生活環が回るという観点から重要である。 [32] アメリカ合衆国のオポッサムでの感染率は8.3%[32]から37.5%[33]となっている。また南東部のアライグマでは15.5%[32]から47%[34]となっている。 アルマジロでは1.1%[33]から28.8%.[35]である。 さらに、リス、ネズミといった小型の齧歯類はサシガメの吸血対象となりやすく森林サイクルの担い手として重要である。テキサスでは4種75試料のうち17.3%でクルーズトリパノソーマが見出された。[36]
サシガメ駆除などの予防衛生手段が効果を上げ、少なくとも2ヶ国で新規感染が無くなったにもかかわらず、慢性のシャーガス病はラテンアメリカ諸国では未だに大きな問題である。 人口移動が増えたことにより、輸血による感染がアメリカ合衆国でも目立つようになってきた。 [37] アメリカ合衆国にはラテンアメリカ諸国からの移民としておよそ50万人の感染者が生活している。[38]
シャーガス病対策が奏功して、コーン・スール地域では若年・小児層での感染例が72%現象したほか、少なくとも2ヶ国(1997年ウルグアイ・1999年チリ)ではサシガメ由来および輸血由来の感染が無くなった。[39][40] またアルゼンチンでは流行19地域のうち13地域で媒介が起こっていない[40]。 ブラジルでも主要なサシガメであるTriatoma infestansによる感染は起きていない[41]が、ブラジル北東部で顕著なT. brasiliensisやT. pseudomaculataといった種による感染は続いている[42]。
日本への中南米からの出稼ぎ者の中に、シャーガス病陽性患者が見つかっている。献血で感染することもあり、陽性の人は絶対に献血しないよう厚生労働省では呼びかけている。
サシガメ対策
歴史
[編集]
この病気の名はブラジル人医師のカルロス・シャーガスにちなんでいる。シャーガスは1909年初めてこの病気を記録したが[46][47]、 しかし公衆衛生上の問題だと認識されるようになったのは1960年代になってからである (ブラジルで1920年代に突発的流行があったがほとんど無視されている[48])。 彼はサシガメ科昆虫の腸管に新種のトリパノソーマ属原虫を見出し、それが実験的に吸血させたマーモセットへ伝染することを証明した。 その後の研究でリスザルも感染することがわかっている[49]。
シャーガスはこの病原体をTrypanosoma cruzi[46]と命名したが、その後すぐにSchizotrypanum cruzi[50]と改名した。種小名はブラジル人医師で疫学者のオズワルド・クルーズへの献名である。クルーズは20世紀初頭にリオデジャネイロなどで流行した黄熱・天然痘・腺ペストなどと戦ったことで有名である。シャーガスの仕事は、ある感染症を一人で完全に(つまり病原体・媒介者・宿主・症状・疫学をすべて)報告したという点で医学史上独特である。
しかしシャーガスは1925年まで主な感染経路はサシガメが刺すことだと誤信していた。実際には1915年に同僚のEmile Brumptが提案し1930年代に確認された通り、サシガメの糞が感染経路である。またシャーガスはそれとは知らずに寄生性真菌のニューモシスチスを見出している。これは後世エイズ患者の発症するニューモシスチス肺炎の病原体である。[47]シャーガスはこの2つの病原体を混同していたためSchizotrypanum属を設立したのだが、Pneumocystis属が記載されると名前をTrypanosoma cruziに戻した。
アルゼンチンではこの病気はMal de Chagas-Mazza[51]と呼ばれている。 これはアルゼンチン人医師で1926年からこの病気の研究を開始してアルゼンチンにおける第一人者となったサルバドール・マッサを顕彰してのことである。マッサは1927年に初めてアルゼンチンにクルーズトリパノソーマが存在することを示し、医学者たちやアルゼンチン政府の協力を取り付けることに成功した。[52]
チャールズ・ダーウィンがシャーガス病に苦しめられていたという説がある。 ダーウィンは『ビーグル号航海記』において、1835年3月25日メンドーサ近郊のパンパで大きな黒い虫に刺されたことを記録している。 ダーウィンはまだ若く概ね健康であったが、イギリス帰国後1年以上経った1837年9月20日に動悸を訴えて療養生活に入り、以後一生の間嘔吐などを伴う不可解な病気に苦しめられ続けた。 ウェストミンスター寺院に埋葬されているダーウィンの遺骸からPCRで検証しようとする試みがあったが、管理人の許可が得られなかった。 [53]
研究
[編集]動物実験で効果が認められる治療法がいくつかある。 オキシドスクアレンシクラーゼやスクアレンシンターゼの阻害剤[54][55]、システインプロテアーゼの阻害剤[54][56]、ネコメガエル属から得られるペプチドdermaseptin[57]、セスキテルペンラクトンであるdehydroleucodine (DhL)[58]、プリン取り込み阻害剤[54]、トリパノチオン代謝の阻害剤[59]などである。 クルーズトリパノソーマのゲノム情報から新しい創薬標的が見付かることも期待されている[60]。
取り組み
[編集]顧みられない病気のための新薬イニシアティブによって、シャーガス病の治療法の研究開発を推進するChagas: Time to Treat Campaignと題したキャンペーンが行われている。これは政策的興味と、一般に対する啓発と、公私を問わない投資とを引き出す目的で行われている。
現在ある薬は、12歳未満で急性期もしくは無徴候期にある子どもに限られる。 シャーガス病は一旦慢性症状を示すと完治することがない。[61][62][63] さらにこうした薬は高価でかつ副作用が強く、治療期間が長くなると継続するのが困難である。 シャーガス病患者のうちおよそ1%は何の治療も受けていないと推定されている。 [64]
そこでシャーガス病治療法の研究開発のために公私問わない資金投下が必要である。 しかし1億人が感染リスクにさらされているにも関わらず、 治療法を改良するための資金は極めて少なく、 2007年には顧みられない病気全体のわずか0.04%(100万ドル)にも満たない。 顧みられない病気の中でも顧みられていない病気であるといえる。 [65][66]
- 小児に適用可能な安全安価で効果的な薬
- 慢性期に適用可能な安全で効果的で、かつ現場に持ち込める薬
引用文献
[編集]- ^ a b c d e “DPDx – Trypanosomiasis, American. Fact Sheet”. Centers for Disease Control (CDC). 2008年9月11日閲覧。
- ^ a b c d e Carlier Y (27 February 2003). Chagas Disease (American Trypanosomiasis). eMedicine. Retrieved on 11 September 2008.
- ^ Guimarães FN, da Silva NN, Clausell DT, de Mello AL, Rapone T, Snell T, Rodrigues N (1968). “Um surto epidêmico de doença de Chagas de provável transmissão digestiva, ocorrido em Teutonia (Estrêla - Rio Grande Do Sul)”. Hospital (Rio J) 73 (6): 1767–804.
- ^ Santos Ferreira C, Amato Neto V, Gakiya E, Bezerra RC, Alarcón RS (2003). “Microwave treatment of human milk to prevent transmission of Chagas disease”. Rev Inst Med Trop São Paulo 45 (1): 41–2. PMID 12751321.
- ^ Hudson L, Turner MJ (November 1984). “Immunological consequences of infection and vaccination in South American trypanosomiasis [and discussion”]. Philos Trans R Soc Lond, B, Biol Sci 307 (1131): 51–61. doi:10.1098/rstb.1984.0108. PMID 6151688. Retrieved February 22, 2007 through JSTOR.
- ^ “Chagas’ disease (American trypanosomiasis) in southern Brazil” (PDF). CDR Weekly (United Kingdom Health Protection Agency) 15 (13). (April 2005) 2007年11月26日閲覧。.
- ^ Shikanai-Yasuda MA, Marcondes CB, Guedes LA (1991). “Possible oral transmission of acute Chagas' disease in Brazil”. Rev Inst Med Trop São Paulo 33 (5): 351–7. PMID 1844961.
- ^ da Silva Valente SA, de Costa Valente V, Neto HF (1999). “Considerations on the epidemiology and transmission of Chagas disease in the Brazilian Amazon”. Mem Inst Oswaldo Cruz 94 Suppl 1: 395–8. PMID 10677763.
- ^ Reis, T (August 18, 2007). “Açaí faz 1 vítima de Chagas a cada 4 dias na Amazônia” (Portuguese). Folha de São Paulo 2008年8月29日閲覧。
- ^ Brumpt E (1914). “Le xénodiagnostic. Application au diagnostic de quelques infections parasitaires et en particulier à la trypanosomose de Chagas” (PDF). Bull Soc Pathol Exot 7 (10): 706–10.
- ^ “A killer that preys on the poor: Chagas disease” (pdf). Médecins Sans Frontières: Activity Report 2003/2004. 2008年8月29日閲覧。
- ^ Eduardo N. Zerba (1999). “Susceptibility and resistance to insecticides of Chagas disease vectors” (PDF). Medicina (Buenos Aires) 59 (Suppl 2): 41–6.
- ^ Basso B, Moretti E, Fretes R (June 2008). “Vaccination with epimastigotes of different strains ofTrypanosoma rangeli protects mice against Trypanosoma cruzi infection”. Mem Inst Oswaldo Cruz 103 (4): 370–4. doi:10.1590/S0074-02762008000400010. PMID 18660992.
- ^ Dumonteil E, Escobedo-Ortegon J, Reyes-Rodriguez N, Arjona-Torres A, Ramirez-Sierra M (2004). “Immunotherapy of Trypanosoma cruziinfection with DNA vaccines in mice”. Infect Immun 72 (1): 46–53. doi:10.1128/IAI.72.1.46-53.2004. PMC 343959. PMID 14688079.
- ^ Sánchez-Guillén MC, Barnabé C, Guégan JF (October 2002). “High prevalence anti-Trypanosoma cruzi antibodies, among blood donors in the State of Puebla, a non-endemic area of Mexico”. Mem Inst Oswaldo Cruz 97 (7): 947–52. doi:10.1590/S0074-02762002000700004. PMID 12471419.
- ^ Schmunis GA (1999). “Prevention of transfusional Trypanosoma cruzi infection in Latin America”. Mem Inst Oswaldo Cruz 94 Suppl 1: 93–101. PMID 10677696 2008年9月1日閲覧。.
- ^ Vinhaes, MC (November 2001). "VIII. Os programas nacionais de controle na fase avancada de controle e os novos desafios estratégicos, políticos e epidemiológicos" (PDF). Grupo de Trabajo OPS para Consulta en Planificación, Operativa, Estrategia y Evaluación de Etapas Avanzadas del Control Antivectorial en Enfermedad de Chagas (Portuguese). Pan American Health Organization.
- ^ a b Morel CM, Lazdins J (October 2003). “Chagas disease”. Nat Rev Microbiol 1 (1): 14–5. doi:10.1038/nrmicro735. PMID 15040175.
- ^ Centers for Disease Control and Prevention (CDC) (February 2007). “Blood donor screening for Chagas disease—United States, 2006–2007”. MMWR Morb Mortal Wkly Rep 56 (7): 141–3. PMID 17318113.
- ^ Gregory KR (September 12, 2002). “Chagas' Disease”. American Association of Blood Banks. 2008年8月27日閲覧。
- ^ Docampo R, Moreno SN, Muniz RP, Cruz FS, Mason RP (June 1983). “Light-enhanced free radical formation and trypanocidal action of gentian violet (crystal violet)”. Science 220 (4603): 1292–5. doi:10.1126/science.6304876. PMID 6304876.
- ^ Cruz FS, Marr JJ, Berens RL (September 1980). “Prevention of transfusion-induced Chagas' disease by amphotericin B”. Am J Trop Med Hyg 29 (5): 761–5. PMID 6776830.
- ^ Garcia S, Ramos CO, Senra JF (April 2005). “Treatment with benznidazole during the chronic phase of experimental Chagas' disease decreases cardiac alterations”. Antimicrob Agents Chemother 49 (4): 1521–8. doi:10.1128/AAC.49.4.1521-1528.2005. PMC 1068607. PMID 15793134.
- ^ Buckner FS, Wilson AJ, White TC, Van Voorhis WC (December 1998). “Induction of resistance to azole drugs in Trypanosoma cruzi”. Antimicrob Agents Chemother 42 (12): 3245–50. PMC 106029. PMID 9835521.
- ^ Lauria-Pires L, Braga MS, Vexenat AC (2000). “Progressive chronic Chagas heart disease ten years after treatment with anti-Trypanosoma cruzi nitroderivatives”. Am J Trop Med Hyg 63 (3–4): 111–8. PMID 11388500.
- ^ Dubner S, Schapachnik E, Riera AR, Valero E (2008). “Chagas disease: state-of-the-art of diagnosis and management”. Cardiol J 15 (6): 493–504. PMID 19039752.
- ^ Bocchi EA, Bellotti G, Mocelin AO (June 1996). “Heart transplantation for chronic Chagas' heart disease”. Ann Thorac Surg 61 (6): 1727–33. doi:10.1016/0003-4975(96)00141-5. PMID 8651775.
- ^ Vilas-Boas F, Feitosa GS, Soares MB (August 2006). “[Early results of bone marrow cell transplantation to the myocardium of patients with heart failure due to Chagas disease”] (Portuguese). Arq Bras Cardiol 87 (2): 159–66. PMID 16951834.
- ^ “Chagas' Disease”. Seattle Biomedical Research Institute (2008年). 2008年9月1日閲覧。
- ^ Pinto-Dias JC (1992). "Epidemiology of Chagas disease". In Wendel S, Brener Z, Camargo ME, Rassi A (eds.) (ed.). Chagas Disease—American Trypanosomiasis: its impact on transfusion and clinical medicine. ISBT Brazil '92. XXII Congress of the International Society of Blood Transfusion. XX Brazilian Congress of Hematology. Extraordinary Congress of the Brazilian College of Hematology. São Paulo: Editorial ISBT Brazil. 2008年9月11日閲覧。
{{cite conference}}:|editor=に無意味な名前が入力されています。 (説明) - ^ Teixeira AR, Monteiro PS, Rebelo JM (2001). “Emerging Chagas disease: trophic network and cycle of transmission of Trypanosoma cruzi from palm trees in the Amazon”. Emerging Infect Dis 7 (1): 100–12. doi:10.3201/eid0701.010115. PMC 2631687. PMID 11266300.
- ^ a b c d Karsten V, Davis C, Kuhn R (June 1992). “Trypanosoma cruzi in wild raccoons and opossums in North Carolina”. J Parasitol 78 (3): 547–9. doi:10.2307/3283667. PMID 1597808.
- ^ a b Barr SC, Brown CC, Dennis VA, Klei TR (August 1991). “The lesions and prevalence of Trypanosoma cruzi in opossums and armadillos from southern Louisiana”. J Parasitol 77 (4): 624–7. doi:10.2307/3283170. PMID 1907654.
- ^ Yabsley MJ, Noblet GP (1 January 2002). “Seroprevalence of Trypanosoma cruzi in raccoons from South Carolina and Georgia”. J Wildl Dis 38 (1): 75–83. PMID 11838232.
- ^ Yaeger RG (March 1988). “The prevalence of Trypanosoma cruzi infection in armadillos collected at a site near New Orleans, Louisiana”. Am J Trop Med Hyg 38 (2): 323–6. PMID 3128127.
- ^ Burkholder JE, Allison TC, Kelly VP (April 1980). “Trypanosoma cruzi (Chagas) (Protozoa: Kinetoplastida) in invertebrate, reservoir, and human hosts of the lower Rio Grande valley of Texas”. J Parasitol 66 (2): 305–11. doi:10.2307/3280824. PMID 6771371.
- ^ Kirchhoff LV (August 1993). “American trypanosomiasis (Chagas' disease)—a tropical disease now in the United States”. N Engl J Med 329 (9): 639–44. doi:10.1056/NEJM199308263290909. PMID 8341339.
- ^ “Medical Encyclopedia: Chagas disease”. National Institutes of Health. 2008年9月11日閲覧。
- ^ Steele LS, MacPherson DW, Kim J, Keystone JS, Gushulak BD (January 2007). “The sero-prevalence of antibodies to Trypanosoma cruzi in Latin American refugees and immigrants to Canada”. J Immigr Minor Health 9 (1): 43–7. doi:10.1007/s10903-006-9014-x. PMID 17006766.
- ^ a b "The Southern Cone Initiative: an update". Special Programme for Research and Training in Tropical Diseases (TDR) (Press release). WHO. 2004. 2008年8月29日閲覧。
- ^ Massad E (September 2008). “The elimination of Chagas' disease from Brazil”. Epidemiol Infect 136 (9): 1153–64. doi:10.1017/S0950268807009879. PMID 18053273.
- ^ Ramos Jr AN, Carvalho DM (2001). “Os diferentes significados da certificação conferida ao Brasil como estando livre da doença de Chagas” (Portuguese). Cadernos de Saúde Pública 17 (6): 1403–12. doi:10.1590/S0102-311X2001000600024.
- ^ Pires HH, Lazzari CR, Diotaiuti L, Lorenzo MG (June 2000). “Performance of yeast-baited traps with Triatoma sordida, Triatoma brasiliensis, Triatoma pseudomaculata, and Panstrongylus megistus in laboratory assays”. Rev Panam Salud Publica 7 (6): 384–8. doi:10.1590/S1020-49892000000600005. PMID 10949899.
- ^ Luz C, Rocha LF, Nery GV, Magalhães BP, Tigano MS (March 2004). “Activity of oil-formulated Beauveria bassiana against Triatoma sordida in peridomestic areas in Central Brazil”. Mem Inst Oswaldo Cruz 99 (2): 211–8. doi:10.1590/S0074-02762004000200017. PMID 15250478.
- ^ Beard CB, Cordon-Rosales C, Durvasula RV (2002). “Bacterial symbionts of the Triatominae and their potential use in control of Chagas disease transmission”. Annu Rev Entomol 47: 123–41. doi:10.1146/annurev.ento.47.091201.145144. PMID 11729071.
- ^ a b Chagas C (1909). “Neue Trypanosomen”. Vorläufige Mitteilung Arch Schiff Tropenhyg 13: 120–2.
- ^ a b Redhead SA, Cushion MT, Frenkel JK, Stringer JR (2006). “Pneumocystis and Trypanosoma cruzi: nomenclature and typifications”. J Eukaryot Microbiol 53 (1): 2–11. doi:10.1111/j.1550-7408.2005.00072.x. PMID 16441572.
- ^ Coutinho M (June 1999). “Review of Historical Aspects of American Trypanosomiasis (Chagas' Disease) by Matthias Perleth” (fee required). Isis 90 (2): 397. doi:10.1086/384393.
- ^ Hulsebos LH, Choromanski L, Kuhn RE (1989). “The effect of interleukin-2 on parasitemia and myocarditis in experimental Chagas' disease”. J Protozool 36 (3): 293–8. PMID 2499678.
- ^ Chagas C (1909). “Nova tripanozomiase humana: Estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem [New human trypanosomiasis. Studies about the morphology and life-cycle of Schizotripanum cruzi, etiological agent of a new morbid entity of man]”. Mem Inst Oswaldo Cruz 1 (2): 159–218.
- ^ Mal de Chagas-Mazza
- ^ Historia de la enfermedad de Chagas
- ^ Adler D (1989). “Darwin's Illness”. Isr J Med Sci 25 (4): 218–21. PMID 2496051.
- ^ a b c Scientific Working Group on Chagas Disease [April 2005] (July 2007). Guhl F, Lazdins-Helds JK (eds.): Reporte del grupo de trabajo científico sobre la enfermedad de Chagas (in Spanish). Geneva: WHO. Retrieved on August 29, 2008. Executive summary in English
- ^ Urbina JA, Concepcion JL, Rangel S, Visbal G, Lira R (2002). “Squalene synthase as a chemotherapeutic target in Trypanosoma cruzi and Leishmania mexicana”. Mol Biochem Parasitol 125 (1–2): 35–45. doi:10.1016/S0166-6851(02)00206-2. PMID 12467972.
- ^ Engel JC, Doyle PS, Hsieh I, McKerrow JH (August 1998). “Cysteine protease inhibitors cure an experimental Trypanosoma cruzi infection”. J Exp Med 188 (4): 725–34. doi:10.1084/jem.188.4.725. PMC 2213346. PMID 9705954.
- ^ Brand GD, Leite JR, Silva LP (December 2002). “Dermaseptins from Phyllomedusa oreades and Phyllomedusa distincta. Anti-Trypanosoma cruzi activity without cytotoxicity to mammalian cells”. J Biol Chem 277 (51): 49332–40. doi:10.1074/jbc.M209289200. PMID 12379643.
- ^ Brengio SD, Belmonte SA, Guerreiro E, Giordano OS, Pietrobon EO, Sosa MA (April 2000). “The sesquiterpene lactone dehydroleucodine (DhL) affects the growth of cultured epimastigotes of Trypanosoma cruzi”. J Parasitol 86 (2): 407–12. PMID 10780563.
- ^ Fairlamb AH, Cerami A (1992). “Metabolism and functions of trypanothione in the Kinetoplastida”. Annu Rev Microbiol 46: 695–729. doi:10.1146/annurev.mi.46.100192.003403. PMID 1444271.
- ^ El-Sayed NM, Myler PJ, Bartholomeu DC (July 2005). “The genome sequence of Trypanosoma cruzi, etiologic agent of Chagas disease”. Science 309 (5733): 409–15. doi:10.1126/science.1112631. PMID 16020725.
- ^ Bern C, Montgomery SP, Herwaldt BL, Rassi A Jr, Marin-Neto JA, et al. (2007) Evaluation and treatment of chagas disease in the United States: a systematic review. JAMA 298: 2171–2181.
- ^ de Andrade AL, Zicker F, de Oliveira RM, Almeida Silva S, Luquetti A, et al. (1996) Randomised trial of efficacy of benznidazole in treatment of early Trypanosoma cruzi infection. Lancet 348: 1407–1413
- ^ Sosa Estani S, Segura EL, Ruiz AM, Velazquez E, Porcel BM, et al. (1998) Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas' disease. Am J Trop Med Hyg 59: 526–529.
- ^ Ribeiro I, Sevcsik A-M, Alves F, Diap G, Don R, et al. 2009 New, Improved Treatments for Chagas Disease: From the R&D Pipeline to the Patients. PLoS Negl Trop Dis 3(7): e484. doi:10.1371/journal.pntd.0000484
- ^ Moran M, Guzman J, Ropars AL, McDonald A, Jameson N, et al. (2009) Neglected disease research and development: how much are we really spending? PLoS Med 6: e30. doi:10.1371/journal.pmed.1000030
- ^ Ribeiro I, Sevcsik A-M, Alves F, Diap G, Don R, et al. 2009 New, Improved Treatments for Chagas Disease: From the R&D Pipeline to the Patients. PLoS Negl Trop Dis 3(7): e484. doi:10.1371/journal.pntd.0000484 [http://www.plosmedicine.org/article/info:doi/10.1371/journal.pmed.1000030
Further reading
[編集]- “International Symposium to commemorate the 90th anniversary of the discovery of Chagas disease (Rio de Janeiro, April 11–16, 1999)”. Memorias do Instituto Oswaldo Cruz 94 (Suppl. I). (1999). A Special issue of the Memórias do Instituto Oswaldo Cruz, covering all aspects of Chagas Disease
- Franco-Paredes C; Von, A; Hidron, A; Rodríguez-Morales, AJ; Tellez, I; Barragán, M; Jones, D; Náquira, CG et al. (2007). “Chagas disease: an impediment in achieving the Millennium Development Goals in Latin America”. BMC International Health and Human Rights 7: 7. doi:10.1186/1472-698X-7-7. PMC 2034380. PMID 17725836.
- Miles, Michael W.; Kevin M. Tyler (2003). American trypanosomiasis. Boston: Kluwer Academic Publishers. ISBN 1-4020-7323-2
