分子軌道法

量子化学において、分子軌道法(ぶんしきどうほう、英: Molecular Orbital method)、通称「MO法」とは、原子に対する原子軌道の考え方を、そのまま分子に対して適用したものである。
分子軌道法では、分子中の電子が原子間結合として存在しているのではなく、原子核や他の電子の影響を受けて分子全体を動きまわるとして、分子の構造を決定する[1]。
この分子中の一電子波動関数である「分子軌道」を求めるシュレーディンガー方程式は、非常に単純な分子、例えば水素分子イオン(H2+)では回転楕円体座標を使って厳密に解くことができる。しかしながら、通常は分子軌道を求めるのは困難であるため、分子軌道波動関数は、既知のn個の原子軌道の線形結合(重ね合わせ)で表せると仮定する[2]。
ここで展開係数について、基底状態については、時間依存しないシュレーディンガー方程式にこの式を代入し、変分原理を適用することで決定できる。この方法はLCAO(原子軌道の線型結合、Linear Combination of Atomic Orbital)近似と呼ばれる。もしが完全系を成すならば、任意の分子軌道をで表せる。
またユニタリ変換することで、量子化学計算における収束を速くすることができる。分子軌道法はしばしば原子価結合法と比較されることがある。
歴史
[編集]1927年に原子価結合法が成立した後、フリードリッヒ・フント、ロバート・マリケン、ジョン・クラーク・スレイター、ジョン・レナード-ジョーンズらによって開発された[3]。分子軌道理論はもともと「フント-マリケン理論」と呼ばれていた[4]。「オービタル」という名前は1932年にマリケンによって導入された[4]。1933年には分子軌道法は、有効な理論であると受け入れられるようになった[5]。ドイツの化学者エーリヒ・ヒュッケルによると、分子軌道法の最初の定量的な利用は1929年のレナード-ジョーンズによって成された[6]。分子軌道波動関数の正確な計算は、1938年にチャールズ・クールソンが水素分子について行った[7]。1950年には、分子軌道は「自己無撞着場ハミルトニアンの固有関数(波動関数)」として厳密に定義され、分子軌道法は厳密でつじつまが合うものになった[8]。この厳密なアプローチは分子におけるハートリー-フォック法として知られている。分子の計算において、分子軌道は原子軌道基底の観点で拡張され、ルーターン方程式が開発された[9]。これは多くの非経験的分子軌道法の発展につながった。またそれとは別に、半経験的分子軌道法として知られる方法で導かれた経験的なパラメーターを用いる多くの近似法でも分子軌道法は適用される[10]。
軌道の種類
[編集]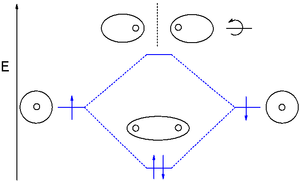
分子軌道 (MO) 理論は、原子間の結合によって生じる分子軌道を表わすために原子軌道の線形結合(LCAO)を用いる。これらはしばしば「結合性」軌道、反結合性軌道、非結合性軌道に分類される。結合性軌道は任意の原子対の「間」の領域に電子密度が集中しているため、その電子密度は2つの核のそれぞれを引き付ける傾向にあり、2つの原子を互いに結び付ける[11]。反結合性軌道はそれぞれの核の「背後」に電子密度を集中させるため、2つの核のそれぞれをもう一方から逆方向に引っ張る傾向にあり、実際に2つの核の間の結合を弱める。非結合性軌道中の電子は原子軌道を関連付けられる傾向にあり、互いに正の相互作用も負の相互作用もせず、これらの軌道中の電子は結合の強さに寄与することも損うこともない[11]。
分子の分子軌道は分子軌道ダイアグラムで図示することができる。
分類
[編集]分子軌道 (MO) は、シュレディンガー方程式を解くことによって得られる。この際用いる近似の程度によって、分子軌道法は大きく次の三つに分類できる。
利用例
[編集]脚注
[編集]- ^ Daintith, J. (2004). Oxford Dictionary of Chemistry. New York: Oxford University Press. ISBN 0-19-860918-3
- ^ Licker, Mark, J. (2004). McGraw-Hill Concise Encyclopedia of Chemistry. New York: McGraw-Hill. ISBN 0-07-143953-6
- ^ Coulson, Charles, A. (1952). Valence. Oxford at the Clarendon Press
- ^ a b Spectroscopy, Molecular Orbitals, and Chemical Bonding - Robert Mulliken's 1966 Nobel Lecture
- ^ Lennard-Jones Paper of 1929 - Foundations of Molecular Orbital Theory.
- ^ Hückel, E. (1934). Trans. Faraday Soc. 30, 59.
- ^ Coulson, C.A. (1938). Proc. Camb. Phil. Soc. 34, 204.
- ^ Hall, G.G. Lennard-Jones, Sir John. (1950). Proc. Roy. Soc. A202, 155.
- ^ Jensen (1999), pp. 65 - 69.
- ^ Jensen (1999), pp. 81 - 92.
- ^ a b Miessler and Tarr (2013), Inorganic Chemistry, 5th ed, 117-165, 475-534.
参考文献
[編集]- 藤永茂『分子軌道法』岩波書店、1980年。
- Jensen, F. (1999). Introduction to Computational Chemistry. John Wiley & Sons. ISBN 0471980854
- A. ザボ, N.S. オストランド、大野公男、坂井建男、望月祐志訳、『新しい量子化学上・下』東京大学出版会.。
- H. Eyring, J. Walter and G. Kimball (1944). Quantum Chemistry. New York: Wiley




