分子論の歴史

化学における分子論の歴史(ぶんしろんのれきし、英: history of molecular theory)は、2つ以上の原子の間に強い化学結合が存在するという概念や考え方の起源をたどるものである。
前史
[編集]現代の分子の概念は、レウキッポスやデモクリトスなど、すべての宇宙は原子と空隙で構成されていると主張した科学以前のギリシャの哲学者までさかのぼることができる。紀元前450年頃、エンペドクレスは、基本元素(火(![]() )、土(
)、土(![]() )、空気(
)、空気(![]() )、水(
)、水(![]() ))と、それらの元素が相互作用する引力と斥力という「力(forces)」を想像した。それ以前にヘラクレイトスは、火と変化は相反する性質の組み合わせによって生じる結果であり、人間の存在の根源であると主張していた[1]。プラトンは『ティマイオス』において、ピタゴラスに倣(なら)って、数、点、線、三角形などの数学的基礎をこの儚い(はかない)世界の基本構成単位あるいは要素とし、火、空気、水、土の四元素を真の数学的原理あるいは要素の中間にある物質の状態として考えた[2]。5番目の元素である「不壊(ふえ)の真髄」であるエーテルは、天体の基本的な構成要素と考えられていた。レウキッポスやエンペドクレスの視点は、エーテルとともにアリストテレスに受け入れられ、中世およびルネサンス期のヨーロッパに受け継がれた。19世紀には、純粋な化学元素や水素や酸素などの異なる化学元素の個々の原子が結合して、水分子のような化学的に安定した分子を形成することが実験的に証明され、分子の近代的な概念が発展し始めた。
))と、それらの元素が相互作用する引力と斥力という「力(forces)」を想像した。それ以前にヘラクレイトスは、火と変化は相反する性質の組み合わせによって生じる結果であり、人間の存在の根源であると主張していた[1]。プラトンは『ティマイオス』において、ピタゴラスに倣(なら)って、数、点、線、三角形などの数学的基礎をこの儚い(はかない)世界の基本構成単位あるいは要素とし、火、空気、水、土の四元素を真の数学的原理あるいは要素の中間にある物質の状態として考えた[2]。5番目の元素である「不壊(ふえ)の真髄」であるエーテルは、天体の基本的な構成要素と考えられていた。レウキッポスやエンペドクレスの視点は、エーテルとともにアリストテレスに受け入れられ、中世およびルネサンス期のヨーロッパに受け継がれた。19世紀には、純粋な化学元素や水素や酸素などの異なる化学元素の個々の原子が結合して、水分子のような化学的に安定した分子を形成することが実験的に証明され、分子の近代的な概念が発展し始めた。
17世紀
[編集]原子の形や結合性に関する最古の考え方は、レウキッポス、デモクリトス、エピクロスによって提唱されたもので、彼らは物質の固さは関係する原子の形に対応すると推論している。たとえば、鉄の原子はフック(鉤、かぎ)を持ち、しっかりと噛み合っている固体で、水の原子は滑らかで滑りやすく、塩の原子は味が鋭く尖っていて、空気の原子は軽くて渦を巻き、他のすべての物質に浸透しているという[3]。この考えの主唱者はデモクリトスであった。彼は、感覚に基づく類推によって、原子をその形、大きさ、および部品の配置によって区別し、原子の姿を図示した。さらに、結合は原子に備わった連結器による物質的結合で説明された。これには、フックアンドアイ(鉤と目)もあれば、ボールアンドソケット(球と球受け)もあった(図を参照)[4]。

スコラ学の台頭とローマ帝国の衰退により、さまざまな四元素説やその後の錬金術説が支持されるようになり、原子論は長い間放棄された。しかし、17世紀になると、ガッサンディやアイザック・ニュートンの業績を中心に原子論が復活した。ガッサンディは、当時の科学者の中でも特に古代史を深く研究して、エピクロスの自然哲学に関する大著を書き、説得力のある支持者として活躍した。彼は、空洞内を移動する原子の大きさや形を説明することで、物質の性質を説明できると推論した。熱さは小さくて丸い原子によるもので、寒さは先端が尖った角錐型の原子によるもので、これが厳しい冷たさによる刺痛を説明し、固体はフックが互いに噛み合うことで結合している[5]。ニュートンは、当時流行していた「フック型原子」、「接着型原子」(静止状態の物体)、「共同運動による結合」などのさまざまな原子結合論を認め、有名な著書『光学(Opticks)』(1704年)の「問31」で、粒子は何らかの力で互いに引き合い『直接接触すると非常に強く、短い距離では化学操作を起こし、粒子から遠くないところまで届いて何らかの影響を及ぼす』とむしろ信じていた[6]。
しかし、より具体的には、「分子(molecule)」、すなわち原子が結合した集合体や単位という概念は、ロバート・ボイルが1661年に出版した有名な著書『懐疑的化学者(The Sceptical Chymist)』の中で、『物質は微粒子の集団から構成されており、化学変化はその集団の再編成によって生じる』とした彼の仮説に端を発している。ボイルは、物質の基本要素は「微粒子(corpuscles)」と呼ばれる種類や大きさの異なる粒子で構成されており、これらの粒子は自身を集団に編成することができると主張した。
1680年、フランスの化学者ニコラ・ルメリは、粒子説に基づいて、あらゆる酸性物質は尖った粒子から構成され、アルカリ性物質はさまざまな細孔を持つことを規定した[7]。この考え方によれば、分子は点と細孔の幾何学的な錠によって結合された微粒子から構成されている。
18世紀
[編集]
「原子の組み合わせ」としての結合という考え方の前身は、「化学的親和力による結合」の理論であった。たとえば、1718年、フランスの化学者エティエンヌ・フランソワ・ジョフロアは、ボイルによる集団の組み合わせの概念を基に、ある種の錬金術的な「力(force)」が特定の構成要素を引き寄せるという考えを基に、粒子の組み合わせを説明する化学的親和力の理論を構築した。ジョフロアの名前は、彼が1718年と1720年にフランス・アカデミーに提出した「親和性の表(tables des rapports)」に関連して最もよく知られている。
この表は、物質と物質の相互作用に関する観察結果をまとめたもので、試薬によって物質の親和力が異なることを示している。この表は、クロード・ルイ・ベルトレーが導入したより洗練された概念に取って代わられるまで、この世紀の終わりまで流行し続けた。
1738年、スイスの物理学者で数学者のダニエル・ベルヌーイは、気体分子運動論の基礎となる『流体力学(Hydrodynamica)』を発表した。ベルヌーイはこの著作で、気体はあらゆる方向に移動する多数の分子で構成され、それらが表面に衝突することで我々が感じる気体圧力が発生し、我々が熱として感じるものはその運動エネルギーに他ならないという、現在も使われている主張を展開した。この理論はすぐに受け入れられなかった。それは、エネルギー保存がまだ確立されておらず、また、分子間の衝突が完全に弾性的であることが物理学者に明らかでなかったことが一因である。1789年に、ウィリアム・ヒギンズが、原子価結合の概念の予示となる「究極粒子(ultimate particles)」の組み合わせと呼ぶものについての考えを発表した。ヒギンズによれば、たとえば酸素の究極粒子と窒素の究極粒子の間の力は6であり、力の強さはそれに応じて分割され、他の究極粒子の組み合わせについても同様である。

19世紀
[編集]
こうした考え方と同様に、1803年、ジョン・ドルトンは、最も軽い元素である水素の原子量を1として、たとえば無水亜硝酸の比率は2対3であり、N2O3という式を得ると判定した。ドルトンは、原子が「噛み合って(hooked)」分子を形成していると誤って想像していた。その後、1808年にドルトンは、有名な「結合した原子(atoms)の図」を発表した。
「分子(molecule)」という言葉はアメデオ・アヴォガドロが作り出した[8]。1811年の論文『物体の素分子の相対質量の決定に関するエッセイ(Essay on Determining the Relative Masses of the Elementary Molecules of Bodies)』で、彼は本質的に次のように述べている。すなわち、パーティントンの『化学の歴史(A Short History of Chemistry)』によると[9]、
気体の最小粒子は必ずしも単純な原子ではなく、これらの原子が特定の数だけ引力で結合して一個の分子(molecule)を形成している。
なお、この引用文は直訳ではないことに留意すること。アボガドロは、原子と分子の両方に「分子」という名称を使用している。具体的には、原子を指して「基本分子(elementary molecule)」と呼び、さらに面倒なことに「化合物分子(compound molecules)」や「複合分子(composite molecules)」とも呼んでいる。
アボガドロはヴェルチェッリに滞在中、簡潔なメモ(memoria)を書き、その中で、現在アボガドロの法則と呼ばれている「同温・同圧のもと、同体積の気体は同数の分子を含む」という仮説を宣言した。この法則は、同じ温度と圧力のもとで、同じ体積の異なる気体の質量の間に生じる関係が、それぞれの分子量の間の関係に対応することを意味している。そのため、気体試料の質量から相対分子量を計算することができるようになった。
アボガドロは、1808年にジョセフ・ルイス・ゲイ=リュサックが発表した気体の反応体積比に関する法則と、1803年ドルトンが発表した原子論とを調和させるために、この仮説を打ち立てた。アボガドロが解決しなければならなかった最大の難問は、原子と分子に関する当時の大混乱であった。アボガドロの業績のうち最も重要な功績の一つは、単純な粒子も分子で構成され得ること、そしてそれが原子で構成されていることを認め、両者を明確に区別したことである。これに対してドルトンは、そのような可能性を考えなかった。不思議なことに、アボガドロは偶数個の原子を含む分子だけを考慮し、なぜ奇数個を除外したのかは述べていない。
1826年、フランスの化学者ジャン=バティスト・デュマは、アボガドロの研究を基に、次のように述べている。
同じような状況下にある気体は、同じ距離に置かれた分子(molecules)や原子(atoms)から構成されており、これは、同じ体積に同じ数の分子や原子が含まれていると言っているのと同じである。
こうした考え方と同調して、1833年にフランスの化学者マルク・アントワーヌ・オーギュスト・ゴーダンは、アボガドロの原子量に関する仮説を[10]、直線状の水分子のような半正確な分子形状と、H2Oのような正確な分子式の両方を明確に示す「体積図(volume diagrams)」を使って明確に説明した。
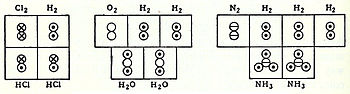
フリードリヒ・アウグスト・ケクレは、『元素の原子性に関する理論』(1857-58)をまとめた2つの論文で、有機分子のすべての原子が他のすべての原子にどのように結合しているかについての理論を初めて提示した。彼は、炭素原子は4価であり、互いに結合して有機分子の炭素骨格を形成することができると提唱した。
1856年、スコットランドの化学者アーチボルド・クーパーは、パリのシャルル・ヴュルツの研究室でベンゼンの臭素化について研究を始めた[11]。ケクレの2番目の論文が発表されてから1ヵ月後、クーパーの独立した、ほとんど同一の分子構造の理論が発表された。彼は分子構造について「現代のティンカートイのように、原子は互いに結合して特定の立体構造をとる」と非常に具体的な考えを提示した。また、クーパーは、結合を表すために括弧を使った古い方法と組み合わせて、原子と原子の結合を実線を使って表す方法を初めて採用し、いくつかの分子では原子の直鎖を仮定し、また酒石酸やシアヌル酸のような分子では環状構造を仮定した[12]。後の出版物では、クーパーの結合は、下図のエタノールやシュウ酸のように、まっすぐな「点線」を用いて表現されている(これが植字工の好みであるかどうかは不明)。

1861年、ウィーンの無名の高校教師ヨハン・ヨーゼフ・ロシュミットが自費出版した「化学研究 I(Chemische Studien I)」という冊子には、環状構造と二重結合構造の両方を示す先駆的な分子像が掲載された[13]。

また、ロシュミットはベンゼンの式の可能性も示唆したが、この問題は未解決のままであった。1865年に、ベンゼンの現代的な構造を最初に提唱したのはケクレである。ベンゼンが環状である特徴は、結晶学者のキャスリーン・ロンスデールによって、最終的に確認された。ベンゼンは、すべての結合を説明するために、炭素の二重結合が交互に存在しなければならないという点で、特別な問題を提示する。

1865年、ドイツの化学者アウグスト・ヴィルヘルム・フォン・ホフマンは、英国王立研究所での講義で使用する球と棒の分子模型(下図のメタンなど)を初めて作成した。

この模型は、1855年に同僚のウィリアム・オドリングが提唱した「炭素は4価である」という説に基づいている。ホフマンの配色は、炭素=黒、窒素=青、酸素=赤、塩素=緑、硫黄=黄、水素=白であり、現在でも使用されている[14]。ホフマンのモデルの欠点は、炭素の結合が四面体ではなく平面で示されていることや、原子の大きさが比例していないなど(水素よりも炭素が小さい)、基本的に幾何学的なものであった。
1864年、スコットランドの有機化学者アレキサンダー・クラム・ブラウンは、原子の記号を円で囲み、それぞれの原子の価数を満たすように破線でつないだ分子の絵を描き始めた。
1873年は、多くの人々によると「分子」の概念が発展してゆく歴史上で重要な年であったと言われている。この年、スコットランドの著名な物理学者であるジェームス・クラーク・マクスウェルが、Nature 9月号に13ページにわたる有名な論文『分子(Molecules)』を発表した[15]。この論文の冒頭で、マクスウェルは次のように明確に述べている。
原子とは2つに切断できない物体であり、分子 (molecule) とは、ある特定の物質の可能な限りの最小部分である。
マクスウェルはデモクリトスの原子論について述べた後、「分子(molecule)」という言葉が現代の言葉であると語っている。彼は、『それはジョンソンの辞書には載っていない。この言葉が体現するのは、近代化学に属する考え方である。』と述べている。「原子」は物質的な点であり、「潜在的な力(potential forces)」に覆い囲まれ、「飛んでいる分子(flying molecules)」が固体に絶え間なく衝突すると、空気や他の気体の圧力と呼ばれるものが発生すると言われている。しかし、この時点でマクスウェルは、誰も分子を見たことも、扱ったこともないと指摘する。
1874年、ヤコブス・ヘンリクス・ファント・ホッフとジョセフ・アキール・ル・ベルは、炭素原子と隣接する原子との化学結合が正四面体の角に向いていると仮定することで、光学活性の現象が説明できることを、独自に提唱した。これによって、分子の立体的な性質がよりよく理解できるようになった。
エミール・フィッシャーは、2次元の紙面上に3次元の分子を表示するフィッシャー投影式を開発した。

1898年、ルートヴィッヒ・ボルツマンは『気体論講義(Lectures on Gas Theory)』の中で、原子価理論を用いて気相分子の解離現象を説明し、その際に原子軌道の重なりの初歩的かつ詳細な図を初めて描いた。ボルツマンは、最初にヨウ素分子の蒸気が高温になると原子に解離するという既知の事実に着目し、2つの原子から構成される分子、ボルツマンの言う「二重原子(double atom)」の存在を、2つの原子の間に働く引力で説明しなければならないと述べている。ボルツマンは、この化学的引力は、化学的価数に関する特定の事実によって、原子の表面にある「感度領域(sensitive region)」という比較的小さな領域と関連しているに違いないと述べている。
ボルツマンは、この感度領域は原子の表面にあるか、あるいは部分的に原子の内部にあり、原子としっかりと結合している可能性があると述べている。具体的には、『2つの原子の感度領域が接触しているか、一部が重なっている場合のみ、2つの原子の間に化学的な引力が生じる。そのとき、両者は化学的に結合していると言う。』と述べた。この図の詳細は次のとおりで、原子Aのα感度領域と原子Bのβ感度領域が重なっていることを示している[16]。

20世紀以降
[編集]20世紀初頭、アメリカの化学者ギルバート・ニュートン・ルイスは、ハーバード大学で学部生を教える際に、原子の周りの電子を表すために、講義の中で点を使うようになった。この絵が学生たちに好評だったことが、ルイスをこの方向に向かわせた。ルイスは、特定の数の電子を持つ元素が特別に安定しているように見えることに着目した。この現象は、1904年にドイツの化学者リヒャルト・アベッグが指摘したもので、ルイスはこれを「アベッグの原子価の法則」と呼んだ(現在は一般にアベッグの規則として知られている)。ルイスには、原子核の周りに8個の電子の核(core)が形成されると、その層が満たされ、新しい層が始まるように思えた。また、ルイスは、8個の電子を持つさまざまなイオンも、特別な安定性を持っているように見えることにも注目した。こうした考えを基に、彼は「8個の電子で満たされた層を持つイオンや原子は、特別に安定である(Ions or atoms with a filled layer of eight electrons have a special stability)」という「八隅説」あるいは「オクテット則」を提唱した[17]。
さらにルイスは、立方体に8つの角があることに着目して、原子は立方体の角のように電子が利用できる8つの側面を持っていることに気づいた。その後、1902年には、立方体原子がその側面で結合して立方体構造の分子を形成するという概念を考案した。
つまり、下図の構造 C のように、2つの原子が辺を共有することで、電子対結合が形成される。この場合、2つの電子が共有される。同様に、帯電したイオン結合は、構造 A のように辺を共有することなく、ある立方体から別の立方体へ電子が移動することによって形成される。ルイスはまた、1つの角だけを共有する中間状態 B も仮定した。

それゆえに、2つの立方体原子の間で面を共有することによって二重結合が形成される。その結果、4個の電子が共有される。
1913年、カリフォルニア大学バークレー校の化学科長を務めていたルイスは、バークレー校に1年間滞在していたイギリスの大学院生、アルフレッド・ラック・パーソンによる論文の予備的な下書きを読んだ。この論文でパーソンは、電子は単なる電荷ではなく、小さな磁石であること(彼は「マグネトン」と呼んだ)、さらに化学結合は2つの原子の間で2つの電子が共有されることによって生じることを示唆した[18]。これは、ルイスによれば、2つの電子が2つの完全な立方体の間で共有辺を形成することによって結合が起こることを意味していた。
こうした考えを基に、ルイスは1916年の有名な論文『原子と分子(The Atom and the Molecule)』の中で、原子や分子を表すための「ルイス構造式」を導入し、点は電子を、線は共有結合を表した。この論文で彼は、2つの原子が1個から6個の電子を共有することで、単電子結合、単結合、二重結合、三重結合を形成する電子対結合の概念を打ち立てた。

ルイス自身の言葉を借りれば、
1つの電子は2つの異なる原子の殻の一部を形成することができ、どちらか一方にのみ属するとは言えない。
さらにルイスは、原子は立方体を完成させるのに必要な数の電子を得たり失うことでイオンを形成する傾向があることを提唱した。このように、ルイス構造式では、分子の構造を構成する各原子を化学記号で表す。結合している原子と原子の間には線が引かれ、場合によっては線の代わりに点の組が使われることもある。また、孤立電子対を形成する過剰電子も点の組で表され、それらが存在する原子の横に配置される。

新しい結合モデルに関する彼の考えを要約して、ルイスは次のように述べている[19]。
2つの原子は、1つの原子から別の原子への電子を移動させるだけでなく、1つまたは複数の電子対を共有することによっても、八隅説またはオクテット則に従うことができる...。こうして結合した2つの電子が、2つの原子中心間にあり、2つの原子の殻の中で共同して保持されるとき、これを化学結合と考えた。こうして、有機化学者の信条の一つであるフックアンドアイの物理的実体が具体的に見えてくるのである。
翌1917年、ライナス・ポーリングという無名のアメリカ人化学技術者が、オレゴン農業大学(現・オレゴン州立大学)で、原子間の結合の記述法として当時主流だったドルトンのフックアンドアイ結合を学んでいた。このモデルでは、各原子には、他の原子と結合するためのフックとアイがそれぞれ一定数備わっている。フックとアイが噛み合うと化学結合が形成される。しかし、ポーリングはこの古風な方法に納得せず、新たな分野である量子物理学に新しい方法を求めた。
1927年、物理学者フリッツ・ロンドンとヴァルター・ハイトラーは、新しい量子力学を、水素分子における可飽和性で非動的な引力と斥力[訳語疑問点]、すなわち交換力の取り扱いに適用した。この問題を原子価結合の観点から扱った彼らの共同論文は[20]、化学を量子力学の下に置くという点で画期的なものであった。彼らの研究は、博士号を取得したばかりのポーリングに影響を与え、グッゲンハイム・フェローシップでチューリッヒのハイトラーやロンドンのもとを訪ねた。
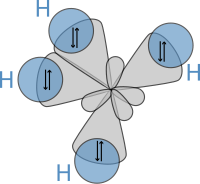
その後、1931年にポーリングは、ハイトラーとロンドンの研究、およびルイスの有名な論文に見られる理論を基に、量子力学を用いて分子の性質や結合角・結合に伴う回転といった構造式を計算する画期的な論文『化学結合の本性(The Nature of the Chemical Bond)』[21](参照: 原稿)を発表した。これらの概念に基づいて、ポーリングは、4つの sp³ 混成軌道が水素の 1s 軌道に重なって4つの σ結合を形成する CH4 のような分子の結合を説明する混成理論を展開した。この4つの結合は同じ長さと強さであるため、下図に示すような分子構造になる。
これらの優れた理論が評価され、ポーリングは1954年にノーベル化学賞を受賞した。ポーリングは1963年にノーベル平和賞を受賞したことでノーベル賞を2度受賞している。
1926年、フランスの物理学者ジャン・ペランは、分子の存在を決定的に証明したことにより、ノーベル物理学賞を受賞した。彼は、いずれも液相系に関する3種類の方法で計算することによりアボガドロ定数を決定した。1番目はガンボージ石鹸のようなエマルションを使用し、2番目はブラウン運動を実験的に研究し、3番目はアインシュタインの液相における粒子回転の理論を検証した[22]。
1937年、化学者K.L.Wolfは、酢酸二量体における水素結合を説明するために超分子(Übermoleküle, (en:英語版) )という概念を導入した。これはやがて、非共有結合を研究する超分子化学 (en:英語版) の分野へとつながってゆく。
1951年、物理学者アーウィン・ウィルヘルム・ミュラーは、電界イオン顕微鏡を発明し、原子を見ることに初めて成功した[23]。下図は、金属点の先端に結合した原子配列である。

1999年、ウィーン大学の研究者は、C60分子における波動と粒子の二重性についての実験結果を報告した[24]。Zeilingerらが発表したデータは、C60分子のド・ブロイ波干渉と矛盾しないものであった。この実験は、波動と粒子の二重性の適用範囲を巨視的方向に約1桁拡張するものとして注目された[25]。
2009年、IBMの研究者は、初めて実際の分子の写真を撮ることに成功し、原子間力顕微鏡を使用して、ペンタセン分子のすべての原子と結合を画像化した[26]。
-
1,5,9-トリオキソ-13-アザトリアンギュレンのAFM画像とその化学構造[29]
参考項目
[編集]脚注
[編集]- ^ Russell, Bertrand (2007). A History of Western Philosophy. Simon & Schuster. p. 41. ISBN 978-1-4165-5477-6
- ^ Russell, Bertrand (2007). A History of Western Philosophy. Simon & Schuster. p. 145. ISBN 978-1-4165-5477-6
- ^ Pfeffer, Jeremy, I.; Nir, Shlomo (2001). Modern Physics: An Introduction Text. World Scientific Publishing Company. p. 183. ISBN 1-86094-250-4
- ^ See testimonia DK 68 A 80, DK 68 A 37 and DK 68 A 43. See also Cassirer, Ernst (1953). An Essay on Man: an Introduction to the Philosophy of Human Culture. Doubleday & Co.. p. 214. ISBN 0-300-00034-0. ASIN B0007EK5MM
- ^ Leicester, Henry, M. (1956). The Historical Background of Chemistry. John Wiley & Sons. p. 112. ISBN 0-486-61053-5
- ^ (a) Isaac Newton, (1704). Opticks. (pg. 389). New York: Dover.
(b) Bernard, Pullman; Reisinger, Axel, R. (2001). The Atom in the History of Human Thought. Oxford University Press. p. 139. ISBN 0-19-515040-6 - ^ Lemery, Nicolas. (1680). An Appendix to a Course of Chymistry. London, pgs 14-15.
- ^ Ley, Willy (June 1966). “The Re-Designed Solar System”. Galaxy Science Fiction: 94–106.
- ^ Avogadro, Amedeo (1811). “Masses of the Elementary Molecules of Bodies”. Journal de Physique 73: 58–76.
- ^ Seymour H. Mauskopf (1969). “The Atomic Structural Theories of Ampère and Gaudin: Molecular Speculation and Avogadro's Hypothesis”. Isis 60 (1): 61–74. doi:10.1086/350449. JSTOR 229022.
- ^ “Chemical Bonding Concept/Skills Development”. intro.chem.okstate.edu. 2023年1月1日閲覧。
- ^ Bowden, Mary Ellen (1997). Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. pp. 90–93. ISBN 9780941901123
- ^ Bader, A. & Parker, L. (2001). "Joseph Loschmidt", Physics Today, Mar.
- ^ Ollis, W. D. (1972). “Models and molecules”. Proceedings of the Royal Institution of Great Britain 45: 1–31.
- ^ Maxwell, James Clerk, "Molecules Archived 2007-02-09 at the Wayback Machine.". Nature, September, 1873.
- ^ Boltzmann, Ludwig (1898). Lectures on Gas Theory (Reprint ed.). Dover. ISBN 0-486-68455-5
- ^ Cobb, Cathy (1995). Creations of Fire - Chemistry's Lively History From Alchemy to the Atomic Age. Perseus Publishing. ISBN 0-7382-0594-X
- ^ Parson, A.L. (1915). "A Magneton Theory of the Structure of the Atom". Smithsonian Publication 2371, Washington.
- ^ "Valence and The Structure of Atoms and Molecules", G. N. Lewis, American Chemical Society Monograph Series, page 79 and 81.
- ^ Heitler, Walter; London, Fritz (1927). “Wechselwirkung neutraler Atome und homöopolare Bindung nach der Quantenmechanik”. Zeitschrift für Physik 44 (6–7): 455–472. Bibcode: 1927ZPhy...44..455H. doi:10.1007/BF01397394.
- ^ Pauling, Linus (1931). “The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules”. J. Am. Chem. Soc. 53 (4): 1367–1400. doi:10.1021/ja01355a027.
- ^ Perrin, Jean, B. (1926). Discontinuous Structure of Matter, Nobel Lecture, December 11.
- ^ Mitch Jacoby, "Atomic Imaging Turns 50", Chemical & engineering News, 83:48, pp. 13–16, 28 November 2005
- ^ Arndt, M.; O. Nairz; J. Voss-Andreae; C. Keller; G. van der Zouw; A. Zeilinger (14 October 1999). “Wave-particle duality of C60 molecules”. Nature 401 (6754): 680–682. Bibcode: 1999Natur.401..680A. doi:10.1038/44348. PMID 18494170.
- ^ Rae, A. I. M. (14 October 1999). “Quantum physics: Waves, particles and fullerenes”. Nature 401 (6754): 651–653. Bibcode: 1999Natur.401..651R. doi:10.1038/44294.
- ^ Single molecule's stunning image.
- ^ Iwata, Kota; Yamazaki, Shiro; Mutombo, Pingo; Hapala, Prokop; Ondráček, Martin; Jelínek, Pavel; Sugimoto, Yoshiaki (2015). “Chemical structure imaging of a single molecule by atomic force microscopy at room temperature”. Nature Communications 6: 7766. Bibcode: 2015NatCo...6.7766I. doi:10.1038/ncomms8766. PMC 4518281. PMID 26178193.
- ^ Dinca, L.E.; De Marchi, F.; MacLeod, J.M.; Lipton-Duffin, J.; Gatti, R.; Ma, D.; Perepichka, D.F.; Rosei, F. (2015). “Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene”. Nanoscale 7 (7): 3263–9. Bibcode: 2015Nanos...7.3263D. doi:10.1039/C4NR07057G. PMID 25619890.
- ^ Hapala, Prokop; Švec, Martin; Stetsovych, Oleksandr; Van Der Heijden, Nadine J.; Ondráček, Martin; Van Der Lit, Joost; Mutombo, Pingo; Swart, Ingmar et al. (2016). “Mapping the electrostatic force field of single molecules from high-resolution scanning probe images”. Nature Communications 7: 11560. Bibcode: 2016NatCo...711560H. doi:10.1038/ncomms11560. PMC 4894979. PMID 27230940.
推薦文献
[編集]- 化学史への招待. 化学史学会. オーム社. (2019-01-26). ISBN 978-4-274-22251-1. OCLC 1088393430
- 原子論・分子論の原典 第1巻. 化学史学会. 学会出版センター. (1989). ISBN 4-7622-2583-5. OCLC 672883757
- Partington, J.R. (1989). A Short History of Chemistry. Dover Publications, Inc. ISBN 0-486-65977-1
- Atkins, Peter (2003). Atkins' Molecules, 2nd Ed. Cambridge University Press. ISBN 0-521-53536-0
- Sargent, Ted (2006). The Dance of Molecules - How Nanotechnology is Changing our Lives. Thunder's Mouth Press. ISBN 1-56025-809-8
- Scerri, Eric R. (2007). The Periodic Table, Its Story and Its Significance. Oxford University Press. ISBN 978-0-19-530573-9
外部リンク
[編集]- IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook.M04002. - IUPACによる分子の定義



