二酸素錯体
二酸素錯体 (にさんそさくたい、Dioxygen complexes) は、配位子にO2を含む配位化合物である[1][2]。これらの化合物の研究は、ミオグロビン、ヘモグロビン、ヘムエリスリン、ヘモシアニンなどの酸素運搬タンパク質に触発されている[3]。いくつかの遷移金属はO2と錯体を形成し、これらの錯体の多くは可逆的に形成される[4]。O2の結合は、細胞呼吸、腐食、工業化学などの多くの重要な現象の最初のステップである。最初の合成酸素錯体は、1938年にコバルト (II) 錯体が可逆的に結合したO2で実証された[5]。
単核二酸素錯体
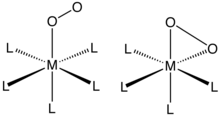
[編集]O2は「エンドオン」(η 1-) または「サイドオン」(η 2-) のいずれかで単一の金属中心に結合する。これらの化合物の結合と構造は通常、単結晶X線結晶構造解析によって評価され、全体的な形状とO-O距離の両方に焦点が当てられ、O2配位子の結合次数が明らかになる。
η1-O2配位子を持つ錯体
[編集]
ポルフィリン (および関連するアニオン性大環状配位子) のコバルト (II) および鉄 (II)錯体に由来するO2付加物はこの結合様式を示す。ミオグロビンとヘモグロビンは有名な例であり、同様に動作する多くの合成類似体が説明されている。O2の結合は通常、金属 (II) 中心から電子移動によって進行して金属 (III) のスーパーオキシド(O −
2)錯体を生成すると説明される。シトクロムP450およびα-ケトグルタル酸依存性ヒドロキシラーゼのメカニズムによって示されるように、Fe-η1-O2結合が Fe(IV)オキソセンターの形成を助長する。O2は、単核錯体について上で説明したのと同じモードによって、二金属ユニットの1つの金属に結合できる。よく知られている例は、タンパク質ヘムエリスリンの活性部位である。これは、1つのFe中心でO2に結合する二鉄カルボキシレートを特徴としている。O2の最初の攻撃はおそらく単一の金属で起こるが、二核錯体も結合に協力することができる。
η2-O2配位子を持つ錯体
[編集]η2-結合は、二酸素の配位化学で見られる最も一般的なモチーフである。このような錯体は、低原子価の金属錯体を酸素で処理することによって生成することができる。例えばバスカ錯体は、O2と可逆的に結合する。(Ph = C6H5)
- IrCl(CO)(PPh3)2 + O2
 IrCl(CO)(PPh3)2O2
IrCl(CO)(PPh3)2O2
変換は、2 e- 酸化還元反応プロセスとして説明される。Ir (II) が二酸素変換による金属過酸化物への変換でIr (III) へ変換する。O2は三重項基底状態を持ち、バスカ錯体は一重項であるため、一重項酸素を使用した場合よりも反応が遅くなる[7]。いくつかの η2-O2錯体の磁気特性は、配位子が実際には過酸化物ではなくスーパーオキシド (超酸化物) であることを示している[8]。
η2-O2のほとんどの錯体は、O2からではなく、過酸化水素を使用して生成される。クロム酸イオン ([CrO4)]2−) は、例えばテトラペルオキソクロメートに変換することができる。過酸化水素とチタン (IV) 水溶液との反応により、鮮やかな色のペルオキシ錯体が得られる。これは、過酸化水素だけでなくチタンの有用なテストでもある[9]。
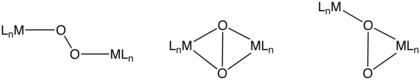
二核二酸素錯体
[編集]
このタイプの錯体には次のような結合様式が含まれる。(μ2-η2,η2-), (μ2-η1,η1-) および (μ2-η1,η2-)。二金属ユニットからの電子移動の程度に応じて、これらのO2配位子は再びペルオキソまたはスーパーオキソとして説明することができる。ヘモシアニンは、架橋O2結合モチーフを利用するO2-運搬体である。それは銅センターのペアを備えている[10]。

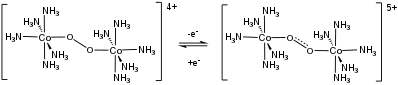
サレンのコバルト (II) 錯体であるサルコミンは、最初の合成O2運搬体である[12]。固体錯体の溶媒和誘導体は、0.5当量のO2に結合する。
- 2 Co(salen) + O2 → [Co(salen)]2O2
可逆的な電子移動反応は、いくつかの二核O2錯体で見られる[13]。
他の酸素配位子との関係と用途
[編集]二酸素錯体は、酸素配位子の他のファミリーの前駆体である。金属オキソ化合物は、錯化後のO–O結合の開裂から生じる。ヒドロペルオキソ錯体は、金属による二酸素の還元の過程で生成される。金属触媒によるO2の還元は、燃料電池の重要な半反応である。
O2による金属触媒酸化は、二酸素錯体を介して進行するが、実際の酸化剤は多くの場合オキソ誘導体である。O2の金属錯体への可逆的結合は、空気から酸素を精製する手段として使用されてきたが、液体空気の極低温蒸留が依然として主要な技術である。
脚注
[編集]- ^ Yee, Gereon M.; Tolman, William B. (2015). “Chapter 5: Transition Metal Complexes and the Activation of Dioxygen”. In Kroneck, Peter M. H.; Sosa Torres, Martha E.. Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. 15. Springer. pp. 131–204. doi:10.1007/978-3-319-12415-5_5
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego, CA: Academic Press. ISBN 0-12-352651-5
- ^ Lippard, S. J.; Berg, J. M. (1994). Principles of Bioinorganic Chemistry. Mill Valley, CA: University Science Books. ISBN 0-935702-73-3
- ^ Berry, R. E. (2004). "Reactivity and Structure of Complexes of Small Molecules: Dioxygen". Comprehensive Coordination Chemistry II. Comprehensive Coordination Chemistry II. Vol. 1. pp. 625–629. doi:10.1016/B0-08-043748-6/01161-0. ISBN 9780080437484。
- ^ Tsumaki, Tokuichi (1938). “Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine [Secondary valence ring compounds. IV. On some inner-complex cobalt salts of oxyaldimine]”. Bull. Chem. Soc. Jpn. 13 (2): 252–260. doi:10.1246/bcsj.13.252.
- ^ S. J. Lippard, J. M. Berg “Principles of Bioinorganic Chemistry” University Science Books: Mill Valley, CA; 1994. ISBN 0-935702-73-3.
- ^ Selke, M.; Foote, C. S. (1993). “Reactions of Organometallic Complexes with Singlet Oxygen. Photooxidation of Vaska's Complex”. J. Am. Chem. Soc. 115 (3): 1166–1167. doi:10.1021/ja00056a061.
- ^ Egan, James W.; Haggerty, Brian S.; Rheingold, Arnold L.; Sendlinger, Shawn C.; Theopold, Klaus H. (1990). “Crystal structure of a side-on superoxo complex of cobalt and hydrogen abstraction by a reactive terminal oxo ligand”. Journal of the American Chemical Society 112 (6): 2445–2446. doi:10.1021/ja00162a069.
- ^ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4
- ^ Elwell, Courtney E.; Gagnon, Nicole L.; Neisen, Benjamin D.; Dhar, Debanjan; Spaeth, Andrew D.; Yee, Gereon M.; Tolman, William B. (2017). “Copper–Oxygen Complexes Revisited: Structures, Spectroscopy, and Reactivity”. Chemical Reviews 117 (3): 2059–2107. doi:10.1021/acs.chemrev.6b00636. PMC 5963733. PMID 28103018.
- ^ M. Calligaris, G. Nardin, L. Randaccio, A. Ripamonti (1970). “Structural Aspects of the Synthetic Oxygen-Carrier NN′-Ethylenebis(Salicylideneiminato)cobalt(II): Structure of the Addition Compound with Oxygen Containing Dimethylformamide”. J. Chem. Soc. A: 1069. doi:10.1039/j19700001069.
- ^ Tokuichi Tsumaki (1938). “Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine”. Bulletin of the Chemical Society of Japan 13 (2): 252–260. doi:10.1246/bcsj.13.252.
- ^ Schaefer, William Palzer (1968). “Structure of Decaammine-μ-Peroxo-Dicobalt Disulfate Tetrahydrate”. Inorganic Chemistry 7: 725–731. doi:10.1021/ic50062a022.