レジオネラ・ニューモフィラ
| レジオネラ属 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Legionella pneumophila
| |||||||||||||||||||||
| 分類 | |||||||||||||||||||||
| |||||||||||||||||||||
| 学名 | |||||||||||||||||||||
| Legionella pneumophila77 Brenner DJ, Steigerwalt AG, McDade JE 1979 |
レジオネラ・ニューモフィラ(Legionella pneumophila、L. ニューモフィラ )は、レジオネラ属のグラム陰性で好気性の桿菌の1種で、多形性、鞭毛、非胞子形成の細菌[1][2]。L.ニューモフィラは、このグループの主要なヒト病原性細菌であり、レジオネラ症として知られるレジオネラ感染症の原因物質。
自然の中で、L.ニューモフィラは、淡水と土壌アメーバ属のアカントアメーバとネグレリアに感染する[3]。感染の機構は、アメーバとヒトの細胞で類似している。
特徴
[編集]L.ニューモフィラは、単極性鞭毛を有するグラム陰性、非胞子形成、好気性桿菌で、しばしば球桿菌(coccobacillus)に分類される 。 好気性であり、ゼラチンを加水分解したり、ウレアーゼを生成することはできない。また、非発酵性である。 L.ニューモフィラは色素沈着も自己蛍光も発しない。オキシダーゼおよびカタラーゼ陽性で、 ベータラクタマーゼを産生する。 L. ニューモフィラのコロニーの形態は、灰色がかった白色で、きめのあるカットガラスの外観をしている。また、システインと鉄が必要である。酵母エキスの培地で「オパールのような(opal-like)」コロニーで成長する。
細胞膜構造
[編集]L.ニューモフィラはグラム陰性菌に分類されるが、外側の細胞膜の、さらに外側リーフレットに含まれるユニークなリポ多糖の含有量のため、染色が不十分である[4]。この生物の体細胞抗原特異性の基礎は、その細胞壁の側鎖に位置している。さまざまな糖の成分と配置の両方に関するこれらの側鎖の化学組成は、多くのグラム陰性細菌を血清学的に分類する重要な手段である、体細胞またはO抗原決定基の性質を決定する。L.ニューモフィラには少なくとも35の異なる血清型が記載されており、他のいくつかの種もいくつかの血清型に細分されている。
検出
[編集]血清は、スライド凝集反応と蛍光抗体法(蛍光標識抗体を使用した組織内の細菌の直接検出)の両方に使用されている。 患者の特定の抗体は、間接蛍光抗体検査によって決定できる。 ELISAおよび微小凝集検査も適用されている。
レジオネラは 、グラム染色では不十分に染色され、銀では陽性に染色され、鉄とシステインを含む緩衝化木炭酵母エキスで培養される。
生態環境と宿主
[編集]
レジオネラ・ニューモフィラは、環境中のアメーバ 、特にアカントアメーバとネグレリアの種に侵入して複製できる通性細胞内寄生虫(facultative intracellular parasite)であり、L.ニューモフィラの自然宿主として機能する。これらの宿主は、 塩素処理などの環境ストレスからの保護にも寄与する[5]。
発生頻度
[編集]米国では、1年に100,000人の居住者あたり約2件のレジオネラ感染症が発症する[6] [出典無効]。感染は夏にピークに達する。 風土病地域では、肺炎の約4%〜5%がレジオネラ・ニューモフィラによって引き起こされる[7] 。
病因
[編集]ヒトでは、L.ニューモフィラは マクロファージ内に侵入して複製する。細菌の内在化は、抗体と補体の存在によって強化されるが、絶対に必要というわけではない。バクテリアの内在化は、食作用を通して起こるようだ。しかし、L.ニューモフィラは未知のメカニズムを介して非食細胞にも感染することができる。 コイル状の食作用として知られるまれな形態の食作用がL.ニューモフィラで報告されているが、これはDot/Icm分泌システムに依存せず、他の病原体でも観察されている[8]。内在化すると、バクテリアは膜結合液胞に包囲され、それがなければバクテリアを分解するリソソームと融合しない。この保護されたコンパートメントでは、細菌が増殖する。
Dot/IcmタイプIV分泌システムとエフェクタータンパク質
[編集]細菌はDot/Icmとして知られるIVB分泌システムを使用して、 エフェクタータンパク質を宿主に注入する。これらのエフェクターは、宿主細胞内で生存する細菌の能力を高めることに関与している。L.ニューモフィラは、330を超える「エフェクター」タンパク質をコードし[9]、Dot/Icm転座システムによって分泌され、宿主細胞のプロセスを妨害して細菌の生存を助ける。レジオネラ属は、宿主細胞に分泌される可能性が高い10,000以上、場合によっては最大18,000までのエフェクターをコードすると予測されている[10][11]。
L.ニューモフィラがそのエフェクタータンパク質を使用する1つの重要な方法は、 レジオネラ含有液胞と宿主のエンドソームとの融合を妨害し、それにより溶解から保護することである。 [12] Dot / Icm転座エフェクターのノックアウト研究は、それらが細菌の細胞内生存に不可欠であることを示しているが、多くの個々のエフェクタータンパク質は冗長に機能すると考えられている。この多数の転座エフェクタータンパク質とそれらの冗長性は、細菌が多くの異なる原生動物宿主で進化した結果である可能性が高い[13]。
レジオネラ含有液胞
[編集]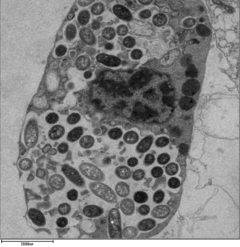
レジオネラがマクロファージと原生動物の中で生き残るためには、レジオネラを含む液胞(LCV)として知られる特殊な区画を作成する必要がある。 Dot/Icm分泌システムの作用により、細菌は通常のエンドソーム輸送経路による分解を防ぎ、代わりに複製することができる。内在化の直後に、細菌は小胞体由来の小胞とミトコンドリアをLCVに特異的に補充し、Rab5やRab7などのエンドソームマーカーの補充を防ぐ。液胞の形成と維持は、病因にとって重要である。Dot /Icm分泌システムを欠く細菌は病原性はなく、細胞内で複製できないが、Dot/IcmエフェクターSdhAを削除すると、液胞膜が不安定になり、細菌の複製は起こらない [14] [15]。
栄養素の獲得
[編集]レジオネラは、システイン、ロイシン、メチオニン、バリン、スレオニン、イソロイシン、およびアルギニンの7つのアミノ酸に対して栄養要求性である[16]。宿主細胞内に入ると、レジオネラは成長して繁殖するために栄養素を必要とする。 空胞内では、栄養素の利用可能性は低い。アミノ酸の高い需要は、宿主細胞質に見られる遊離アミノ酸の輸送によってカバーされていない。 アミノ酸の可用性を向上させるために、寄生虫はプロテアソーム分解の宿主メカニズムを促進する。これにより、寄生虫の液胞内増殖に使用できるL.ニューモフィラ感染細胞の細胞質に過剰な遊離アミノ酸が生成される。
L.ニューモフィラは、アミノ酸を取得するために、LCVの膜に局在する3つの宿主酵素、ファルネシルトランスフェラーゼ、Ras変換酵素-1プロテアーゼ、およびイソプレニルシステインカルボキシルメチルトランスフェラーゼの活性によってファルネシル化されるAnkB真正F-Boxエフェクターを使用する。 ファルネシル化により、AnkBは液胞の細胞質側に固定される。
AnkBがLCV膜に固定されると、SCF1ユビキチンリガーゼ複合体と相互作用し、K48結合ポリユビキチン化タンパク質をLCVにドッキングするためのプラットフォームとして機能する。
K48結合ポリユビキチン化は、2〜24アミノ酸長のペプチドを放出するプロテアソーム分解のマーカーであり、細胞質に存在するさまざまなオリゴペプチダーゼおよびアミノペプチダーゼによってアミノ酸に急速に分解される。アミノ酸は、SLC1A5 (中性アミノ酸輸送体)などのさまざまなアミノ酸輸送体を介してLCVにイ取り込まれる。 アミノ酸は、L.ニューモフィラの主要な炭素およびエネルギー源であり、ほぼ12のクラスのABCトランスポーター、アミノ酸膜輸送系、および多くのプロテアーゼを使用して利用する。輸入されたアミノ酸は、TCAサイクル(クレブスサイクル )を通じて、および炭素と窒素の供給源として、エネルギーを生成するためにL.ニューモフィラによって使用される。
しかし、アミノ酸の獲得のためのプロテアソーム分解の促進は、宿主から炭素およびエネルギー源を得るための唯一の毒性戦略ではないかもしれない。 タイプII分泌分解酵素は、炭素およびエネルギー源を生成するための追加戦略を提供する。
ゲノミクス
[編集]| NCBIゲノムID | 416 |
|---|---|
| 倍数性 | haploid |
| ゲノムサイズ | 3.44 Mb |
| 染色体数 | 1 |
| 完了年 | 2004 |
2004年、3つの臨床的肺炎レンサ球菌分離株の完全なゲノム配列の決定と公表は、特に肺炎レンサ球菌とレジオネラ属全般の分子生物学の理解への道を開いた。180のレジオネラ株の遺伝子含有量を研究するためにDNAアレイを使用した詳細な比較ゲノム解析により、高いゲノム可塑性と頻繁な遺伝子の水平伝播が明らかになった。L.ニューモフィラのライフサイクルに関するさらなる洞察は、その自然宿主であるアカントアメーバ・カステラーニ(Acanthamoeba castellanii)でのL.ニューモフィラの遺伝子発現プロファイルを調べることで得られました。L.ニューモフィラは二相性のライフサイクルを示し、遺伝子発現プロファイルに従って透過性および複製特性を定義する[2]。
遺伝的形質転換
[編集]形質転換は、周囲の液体培地を介したある細菌から別の細菌へのDNAの移動を伴う細菌適応である。形質転換は細菌版の交尾である [17]。細菌が外因性DNAを結合し、取り込み、その染色体に再結合するためには、「コンピテンス(competence )」と呼ばれる特別な生理学的状態に入らなければならない。
L.ニューモフィラのコンピテンスを誘導する可能性のある分子を特定するために、64の毒性分子をテストした[18]。これらの分子のうち、6つのDNA損傷剤のみが、強いコンピテンス能誘導を引き起こした。 これらは、マイトマイシンC (DNA鎖間架橋を導入)、ノルフロキサシン 、オフロキサシン 、およびナリジキシン酸(二本鎖切断を引き起こすDNAジャイレースの阻害剤)、ビシクロマイシン (二本鎖切断を引き起こす)およびヒドロキシ尿素 (DNA塩基の酸化を引き起こす)だった。 これらの結果は、レジオネラ肺炎における形質転換の能力がDNA損傷への応答として進化したことを示唆している。おそらく、能力の誘導は、他の病原性細菌で起こるように、自然宿主での生存の利点を提供する[17]。
薬物ターゲット
[編集]細菌のいくつかの酵素は、暫定的な薬物標的として提案されている。たとえば、鉄摂取経路の酵素は重要な薬物標的として提案されている[19]。さらに、IMP/GMP特異的5 'ヌクレオチダーゼのcN-IIクラスは、速度論的に広範囲に特徴付けられている。 四量体酵素は、正のホモトロピック協同性、基質活性化の側面を示し、酵素に対して、したがって生物に対して有効な薬物を設計するために標的とすることができるユニークなアロステリック部位を提示する。さらに、この酵素はその人間の対応物とは異なり、薬物開発の魅力的な標的となっている[20]。
治療
[編集]マクロライド(アジスロマイシンまたはクラリスロマイシン)またはフルオロキノロン(レボフロキサシンまたはモキシフロキサシン)は、レジオフロキサシンがアジスロマイシンに対する耐性を高める第一選択薬であると考えられているヒトのレジオネラ肺炎の標準治療薬である。2つの研究は、マクロライドよりもレボフロキサシンの優位性を支持しているが、FDAは承認していない[21]。
脚注
[編集]- ^ Brock Biology of Microorganisms (11th ed.). Prentice Hall. (2005). ISBN 0-13-144329-1
- ^ a b Legionella: Molecular Microbiology. Caister Academic Press. (2008). ISBN 978-1-904455-26-4
- ^ “Preliminary report on the pathogenicity of Legionella pneumophila for freshwater and soil amoebae”. Journal of Clinical Pathology 33 (12): 1179–83. (December 1980). doi:10.1136/jcp.33.12.1179. PMC 1146371. PMID 7451664.
- ^ Ryan KJ; Ray CG (editors) (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. ISBN 0-8385-8529-9
- ^ “Morphology of Legionella pneumophila according to their location within Hartmanella vermiformis”. Research in Microbiology 154 (9): 619–21. (November 2003). doi:10.1016/j.resmic.2003.08.003. PMID 14596898.
- ^ “Legionnaires Disease, Pontiac Fever Fast Facts - Legionella - CDC”. www.cdc.gov (30 April 2018). 2020年3月2日閲覧。
- ^ RKI RKI-Ratgeber für Ärzte - ウェイバックマシン(2011年7月19日アーカイブ分)
- ^ “Coiling phagocytosis is the preferential phagocytic mechanism for Borrelia burgdorferi”. Infection and Immunity 60 (10): 4205–12. (October 1992). PMC 257454. PMID 1398932.
- ^ “Legionella pneumophila, armed to the hilt: justifying the largest arsenal of effectors in the bacterial world”. Current Opinion in Microbiology 29: 74–80. (February 2016). doi:10.1016/j.mib.2015.11.002. PMID 26709975.
- ^ “Genomic analysis of 38 Legionella species identifies large and diverse effector repertoires”. Nature Genetics 48 (2): 167–75. (February 2016). doi:10.1038/ng.3481. PMC 5050043. PMID 26752266.
- ^ “Legionella genus genome provide multiple, independent combinations for replication in human cells”. Proceedings of the National Academy of Sciences of the United States of America 116 (6): 2265–2273. (February 2019). doi:10.1073/pnas.1808016116. PMC 6369783. PMID 30659146.
- ^ “Ankyrin repeat proteins comprise a diverse family of bacterial type IV effectors”. Science 320 (5883): 1651–4. (June 2008). doi:10.1126/science.1158160. PMC 2514061. PMID 18566289.
- ^ “Legionella pneumophila adaptation to intracellular life and the host response: clues from genomics and transcriptomics”. FEBS Letters 581 (15): 2829–38. (June 2007). doi:10.1016/j.febslet.2007.05.026. PMID 17531986.
- ^ “The Dot/Icm effector SdhA is necessary for virulence of Legionella pneumophila in Galleria mellonella and A/J mice”. Infection and Immunity 81 (7): 2598–605. (July 2013). doi:10.1128/IAI.00296-13. PMC 3697626. PMID 23649096.
- ^ “The protein SdhA maintains the integrity of the Legionella-containing vacuole”. Proceedings of the National Academy of Sciences of the United States of America 109 (9): 3481–6. (February 2012). doi:10.1073/pnas.1121286109. PMC 3295292. PMID 22308473.
- ^ Best, Ashley; Kwaik, Yousef Abu (October 9, 2018). “Evolution of the Arsenal of Legionella pneumophila Effectors to Modulate Protist Hosts”. mBio 9 (5): 1313. doi:10.1128/mBio.01313-18. PMC 6178616. PMID 30301851.
- ^ a b “Adaptive value of sex in microbial pathogens”. Infection, Genetics and Evolution 8 (3): 267–85. (May 2008). doi:10.1016/j.meegid.2008.01.002. PMID 18295550.
- ^ “Antibiotics and UV radiation induce competence for natural transformation in Legionella pneumophila”. Journal of Bacteriology 193 (5): 1114–21. (March 2011). doi:10.1128/JB.01146-10. PMC 3067580. PMID 21169481.
- ^ Cianciotto, Nicholas P (May 2015). “An update on iron acquisition by Legionella pneumophila : new pathways for siderophore uptake and ferric iron reduction”. Future Microbiology 10 (5): 841–851. doi:10.2217/fmb.15.21. ISSN 1746-0913. PMC 4461365. PMID 26000653.
- ^ Srinivasan, Bharath; Forouhar, Farhad; Shukla, Arpit; Sampangi, Chethana; Kulkarni, Sonia; Abashidze, Mariam; Seetharaman, Jayaraman; Lew, Scott et al. (March 2014). “Allosteric regulation and substrate activation in cytosolic nucleotidase II from Legionella pneumophila”. FEBS Journal 281 (6): 1613–1628. doi:10.1111/febs.12727. PMC 3982195. PMID 24456211.
- ^ The Sanford Guide to Antimicrobial Therapy 2013
外部リンク
[編集]- 「Legionella pneumophila」 - PubMedの全文記事
- レジオネラ肺炎、レジオネラ病の原因物質およびMetaPathogenでのポンティアック熱 - ウェイバックマシン(2013年7月1日アーカイブ分)
- レジオネラ・ニューモフィラタイプ株 - -細菌多様性メタデータベースBac Dive
