ラジカル時計
化学の分野において、ラジカル時計(ラジカルとけい、英: Radical clock、ラジカルクロック)は、フリーラジカル反応の反応速度を決定するための間接的な方法論を支援する化合物である。ラジカル時計化合物それ自体は既知の速度で反応し、別の反応の速度を決定するための較正を提供する。
多くの有機化学機構は直接的には同定できないが、捕捉反応から推論される中間体を含む[1]。こういった中間体がラジカルである時、それらの寿命はラジカル時計から推定することができる[2][3]。より直接的な方法としては、フラッシュ光分解(フラッシュフォトリシス)やパルス放射線分解(パルスラジオリシス)で中間体を生成して単離する方法があるが、これらの方法は時間がかかり、高価な装置を必要とする。ラジカル時計という間接的な方法でも、研究対象となる反応に通常必要とされる以上の機器や装置を必要とせずに、相対的または絶対的な速度定数を得ることができる[4]。
理論と技術
[編集]ラジカル時計反応は、既知の速度定数を持つ単分子ラジカル反応と、未知の速度定数を持つ2分子ラジカル反応が競合して、未転位の生成物と転位の生成物を生成する反応である。未転位のラジカルであるU• の転位は、既知の速度定数(kr)でR• の生成(クロック反応)に進む。これらのラジカルは捕捉剤ABと反応して、未転位生成物UAと再転位生成物RAをそれぞれ生成する[5]。
2つの生成物の収率は、ガスクロマトグラフィー(GC)や核磁気共鳴(NMR)で求めることができる。捕捉剤の濃度、ラジカル時計の既知の速度定数、生成物の比率から。未知の速度定数を間接的に求めることができる。
U•とR•の間に化学平衡が存在すれば、再配列された生成物が支配的になる[3]。単分子再配列反応は一次、2分子捕捉反応は二次(いずれも不可逆)であるから、未知の速度定数(kR)は次のようにして求められる[6]。
時計の速度
[編集]ラジカル時計反応の駆動力は、転位する能力である[1]。一般的なラジカル時計には、ラジカル環化反応、開環反応、1,2-転移などがある[3]。一般的な転位反応には、5-ヘキセニルの環化反応とシクロプロピルメチルの開環反応がある[1]。

|

|
5-ヘキセニルラジカルは、エントロピー的にもエンタルピー的にも6員環の可能性よりも有利なため、環化反応を起こして5員環を生成する[1][3]。 この反応の速度定数は、298 Kで2.3×105 s−1である[5]。
シクロプロピルメチルラジカルは、環ひずみを取り除きエンタルピー的にも有利な非常に速い開環反応を起こす[1][3]。 この反応の速度定数は、298 Kで8.6×107 s−1である[7]。
ラジカル反応の絶対的な速度定数を求めるためには、1級アルキルなどのラジカル群ごとに単分子時計反応を時間的に校正する必要がある[3]。EPR分光法を用いることで、単分子反応の絶対的な速度定数をさまざまな温度で測定することができる[3][4]。 そして、アレニウスの式を適用することで、ラジカル時計反応を行う特定の温度における速度定数を算出することができる。
ラジカル時計を使って反応を研究する場合、その転位反応速度を決定するときと同じであるという暗黙の前提がある。様々な溶媒中でのシクロブチルメチルと5-ヘキセニルの転位反応を理論的に研究したところ、その反応速度は溶媒の性質によってごくわずかな影響を受けるだけであった[5]。
ラジカル時計の速度は、どのような種類の置換基を付けるかによって、増減を調整することができる。下の図では、ラジカル時計にさまざまな置換基を付けた場合の速度を示している[1][出典無効]。
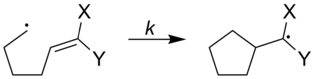
| ||
| X | Y | k (s−1) |
|---|---|---|
| Ph | Ph | 5x107 |
| OCH3 | H | 1.4x105 |
| OCH3 | CN | 2.5x108 |
| CN | H | 1.6x108 |
ラジカル時計の一般的なクラスと特定の置換基を選択することで、幅広い速度の反応を研究するのに適した速度定数を持つものを選ぶことができる。これまでに10−1から1012 M−1 s−1までの反応がラジカル時計を用いて研究されている[2]。
利用例
[編集]ラジカル時計は、ナトリウムナフタレニドによるハロゲン化アルキルの還元、エノンの反応、ヴィッティヒ転位[8]、ジアルキル水銀化合物の還元的脱離反応、ジオキシランのジヒドロキシル化、求電子的フッ素化などに用いられている[3]。
出典
[編集]- ^ a b c d e f Johnson, C.C.; Lippard, S.J.; Liu, K.E.; Newcomb, M. (1993). “Radical Clock Substrate Probes and Kinetic Isotope Effect Studies of the Hydroxylation of Hydrocarbons by Methane Monooxygenase”. J. Am. Chem. Soc. 115: 939–947. doi:10.1021/ja00056a018.
- ^ a b Roschek, B. Jr.; Tallman, K.A.; Rector, C.L.; Gillmore, J.G.; Pratt, D.A.; Punta, C.; Porter, N.A. (2006). “Peroxyl Radical Clocks”. J. Org. Chem. 71: 3527–3532. doi:10.1021/jo0601462.
- ^ a b c d e f g h Griller, D.; Ingold, K.U. (1980). “Free-radical clocks”. Acc. Chem. Res. 13: 317–323. doi:10.1021/ar50153a004.
- ^ a b Moss, R.A.; Platz, M.; Jones, M. Reactive Intermediate Chemistry. Wiley, John & Sons, Incorporated, 2004. 127–128.
- ^ a b c Fu, Y.; Li, R.-Q.; Liu, L.; Guo, Q.-X. (2004). “Solvent effect is not significant for the speed of a radical clock”. Res. Chem. Intermed. 30 (3): 279–286. doi:10.1163/156856704323034012.
- ^ Newcomb, M. (1993). “Competition Methods and Scales for Alkyl Radical Reaction Kinetics”. Tetrahedron 49 (6): 1151–1176. doi:10.1016/S0040-4020(01)85808-7.
- ^ Bowry, V.W.; Lusztyk, J.; Ingold, K.U. (1991). “Calibration of a new horologery of fast radical "clocks". Ring-opening rates for ring- and α-alkyl-substituted cyclopropylcarbinyl radicals and for the bicyclo[2.1.0]pent-2-yl radical”. J. Am. Chem. Soc. 113: 5687–5698. doi:10.1021/ja00015a024.
- ^ Garst, John F.; Smith, Calvin D. (March 1976). “Wittig rearrangements of aralkyl alkyl ethers” (英語). Journal of the American Chemical Society 98 (6): 1526–1537. doi:10.1021/ja00422a041. ISSN 0002-7863.

![{\displaystyle {\begin{array}{l}{\ce {U. + AB ->[k_R] {UA}+ B.}}\\{\bigg \downarrow }{k_{r}}\\{\ce {R. + AB -> {RA}+ B.}}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4abb8b060be8190d61bdb4b7df1812862dca45d4)
![{\displaystyle k_{R}={\frac {k_{r}[{\ce {UA}}]}{{\ce {[AB][RA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82eef2a563a3b63951d50036a74666ea862bb854)