ユビキチン活性化酵素
| Ubiquitin—protein ligase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 酵母のユビキチン活性化酵素(E1)-ユビキチン複合体の結晶構造[1] | |||||||||
| 識別子 | |||||||||
| EC番号 | 6.2.1.45 | ||||||||
| CAS登録番号 | 74812-49-0 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 遺伝子オントロジー | AmiGO / QuickGO | ||||||||
| |||||||||
ユビキチン活性化酵素(ユビキチンかっせいかこうそ、英: ubiquitin-activating enzyme)またはE1酵素(E1 enzyme)はユビキチン化反応の最初の段階を触媒し、タンパク質をプロテアソームによる分解の標的とする。標的タンパク質へのユビキチンまたはユビキチン様タンパク質の共有結合による付加は、真核生物でタンパク質の機能を調節する主要な機構である[2]。細胞分裂、免疫応答、胚発生など多くの過程がユビキチンとユビキチン様タンパク質による翻訳後修飾によって調節されている[2]。
ユビキチン化の概要
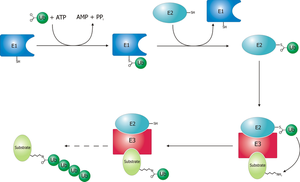
[編集]ユビキチン活性化酵素(E1)は、ユビキチン化のプロセスを開始する。E1酵素はATPとともにユビキチンタンパク質を結合する。その後、E1酵素はユビキチンを2番目のタンパク質、ユビキチン結合酵素(E2)へ受け渡す。E2タンパク質はユビキチンリガーゼ(E3)と複合体を形成する。ユビキチンリガーゼはタグ付けを必要とするタンパク質を認識し、標的タンパク質へのユビキチンの転移を触媒する。この経路は標的タンパク質に十分なユビキチン鎖が形成されるまで繰り返される[3]。
構造と機構
[編集]ユビキチン化カスケードの開始時にE1酵素はATP-Mg2+とユビキチンを結合し、ユビキチンのC末端のアシルアデニル化反応(acyl adenylation)を触媒する[4]。次の段階として、E1酵素の触媒残基のシステインがユビキチン-AMP複合体を攻撃し、アシル基を置換するとともにチオエステル結合を形成しAMPが脱離する[2]。最終的に、E2酵素の触媒システインがE1~ユビキチン複合体を攻撃し、チオエステル交換反応(transthioesterification)によってE1~ユビキチン複合体からE2酵素へユビキチンが転移される[5]。しかし、チオエステル交換反応の過程はきわめて複雑であり、E1酵素とE2酵素が中間体となる複合体を形成し、双方の酵素が互いに結合するために一連のコンフォメーション変化が引き起こされる[5]。
この機構を通じて、E1酵素は2分子のユビキチンを結合している。2つ目のユビキチンも同様にアデニル化が行われるが、同様のチオエステル複合体の形成はこれまで記載されていない。2つ目のユビキチンの機能は大部分が不明であるが、チオエステル交換反応の際にE1酵素のコンフォメーション変化を促進する可能性が考えられている[2]。
アイソザイム
[編集]次に挙げる遺伝子はユビキチン活性化酵素をコードしている
疾患との関連
[編集]ユビキチン-プロテアソームシステムは、細胞内での適切なタンパク質分解に重要である。このシステムの機能不全は細胞の恒常性を破壊し、多くの異常をもたらす。正常に機能している細胞では、ユビキチンまたはユビキチン様タンパク質が共有結合することで標的タンパク質の表面が変化する。これらのユビキチン化されたタンパク質はタンパク質分解経路または非タンパク質分解経路による分解へと向けられる[7]。このシステムの異常によって、がん、糖尿病、脳卒中、アルツハイマー病、筋萎縮性側索硬化症、多発性硬化症、喘息、炎症性腸疾患、自己免疫性甲状腺炎、炎症性関節炎、全身性エリテマトーデスなど多数の先天性・後天性疾患が引き起こされる可能性がある[7]。
UBE1遺伝子のミスセンス変異とXL-SMA
[編集]ユビキチン-プロテアソーム経路が関係するさまざまな疾患の中に、X-linked infantile spinal muscular atrophy(XL-SMA、X連鎖型の乳幼児期の脊髄性筋萎縮症)がある[8]。この致命的な小児疾患は、前角細胞の喪失と乳幼児期の死亡と関係している。臨床的な特徴には、低血圧、反射消失、先天性多発性拘縮がある。大規模な変異解析によってXL-SMAの6家族のスクリーニングが行われ、2家族で新規ミスセンス変異、3家族で新規のC→T同義置換がみられた。これらはすべて、ユビキチン活性化酵素をコードするUBE1遺伝子のエクソン15に位置しており、家族内で疾患と共にsegregationしていることが観察された。簡潔に言うと、UBE1のミスセンス変異は、軸索構造と神経細胞の維持に関与するタンパク質ギガキソニンとの複合体形成の阻害をもたらす可能性がある。それによって微小管結合タンパク質MAP1Bの分解が阻害されて蓄積し、神経細胞死の増加がもたらされる[8]。そのため、UBE1遺伝子の変異はXL-SMAの遺伝的原因であることが疑われる。
出典
[編集]- ^ PDB: 3CMM; “Structural insights into E1-catalyzed ubiquitin activation and transfer to conjugating enzymes”. Cell 134 (2): 268–78. (July 2008). doi:10.1016/j.cell.2008.05.046. PMID 18662542.
- ^ a b c d e f “Ubiquitin-like protein activation by E1 enzymes: the apex for downstream signalling pathways”. Nature Reviews Molecular Cell Biology 10 (5): 319–31. (May 2009). doi:10.1038/nrm2673. PMC 2712597. PMID 19352404.
- ^ “Protein degradation by the ubiquitin-proteasome pathway in normal and disease states”. Journal of the American Society of Nephrology 17 (7): 1807–19. (July 2006). doi:10.1681/ASN.2006010083. PMID 16738015.
- ^ “Pleiotropic effects of ATP.Mg2+ binding in the catalytic cycle of ubiquitin-activating enzyme”. The Journal of Biological Chemistry 281 (21): 14729–37. (May 2006). doi:10.1074/jbc.M513562200. PMID 16595681.
- ^ a b “Structural insights into E1-catalyzed ubiquitin activation and transfer to conjugating enzymes”. Cell 134 (2): 268–78. (July 2008). doi:10.1016/j.cell.2008.05.046. PMID 18662542.
- ^ This figure is adapted from Scheme 1 of "The Mechanism of Ubiquitin Activating Enzyme: A Kinetic and Equilibrium Analysis" by Arthur Haas. “The mechanism of ubiquitin activating enzyme. A kinetic and equilibrium analysis”. The Journal of Biological Chemistry 257 (17): 10329–37. (September 1982). PMID 6286650.
- ^ a b “The ubiquitin-proteasome system and its role in inflammatory and autoimmune diseases”. Cellular & Molecular Immunology 3 (4): 255–61. (August 2006). PMID 16978533.
- ^ a b “Rare Missense and Synonymous Variants in UBE1 Are Associated with X-Linked Infantile Spinal Muscular Atrophy”. American Journal of Human Genetics 82 (1): 188–93. (January 2008). doi:10.1016/j.ajhg.2007.09.009. PMC 2253959. PMID 18179898.

![ユビキチン活性化酵素がATPとユビキチンを結合する一連の流れ。2分子のユビキチンがどのように同時に結合するかについても示されている[6]。](http://upload.wikimedia.org/wikipedia/commons/thumb/0/01/Ubiquitin-activating_enzyme_bound_to_ATP_and_ubiquitin_substrate.png/300px-Ubiquitin-activating_enzyme_bound_to_ATP_and_ubiquitin_substrate.png)
![E1タンパク質は2つの同一な活性部位のそれぞれでユビキチン分子を結合する。重要残基のシステインとアルギニンが赤でラベルされている[2]。](http://upload.wikimedia.org/wikipedia/commons/thumb/9/91/Ubiquitin_activating_enzyme_cysteine_highlighted.png/300px-Ubiquitin_activating_enzyme_cysteine_highlighted.png)
![非結合状態の活性部位の拡大図。アルギニン603番は、ユビキチンがE2酵素へ転移された際に触媒残基であるシステイン600番をrechargeすると考えられている[2]。](http://upload.wikimedia.org/wikipedia/commons/thumb/3/36/Cys_and_Arg_active_site_of_ubiquitin_activating_enzyme.png/300px-Cys_and_Arg_active_site_of_ubiquitin_activating_enzyme.png)