アリールジアルキルホスファターゼ
アリールジアルキルホスファターゼ(Aryldialkylphosphatase、EC 3.1.8.1)は、 有機リン系殺虫剤のリン酸トリエステルの加水分解を触媒する酵素であり、金属タンパク質である[1]。 ホスホトリエステラーゼ(phosphotriesterase、PTE)、有機リン加水分解酵素(organophosphorus hydrolase)、パラチオン加水分解酵素(parathion hydrolase)、パラオキソナーゼ(paraoxonase)、パラチオンアリールエステラーゼ(parathion aryl esterase)などの名称でも知られる。
- アリールジアルキルリン酸 + 水 ジアルキルリン酸 + アリールアルコール
従って、この酵素の基質はアリールジアルキルリン酸と水の2つ、生成物はジアルキルリン酸とアリールアルコール(フェノール)の2つである。
この酵素をコードする遺伝子(opd、organophosphate-degrading)はシュードモナスPseudomonas diminutaに内在する巨大プラスミド(pSC1、51 kb)に存在しているが[2]。遺伝子はフラボバクテリウム属Flavobacterium sp. ATCC27551など他の多くの生物種にも存在しているが、そこでも染色体外エレメント(pSM55、43 kb)にコードされている[2]。
リン酸エステルはリン酸のエステルの一般名称であり、有機リン化合物の一つである。殺虫剤、除草剤、神経ガス等の成分として用いられる。毒性の低いリン酸エステルは、溶媒、可塑剤、極圧添加剤等に用いられる。 有機リン系殺虫剤は世界中の殺虫剤使用量の約38%を占める[3]。
| ホスホトリエステラーゼファミリー (Phosphotriesterase family) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 識別子 | |||||||||||
| 略号 | PTE | ||||||||||
| Pfam | PF02126 | ||||||||||
| InterPro | IPR001559 | ||||||||||
| PROSITE | PDOC01026 | ||||||||||
| SCOP | 1dpm | ||||||||||
| SUPERFAMILY | 1dpm | ||||||||||
| |||||||||||
遺伝子
[編集]有機リン(OP)系殺虫剤を分解することができる細菌は、世界中のさまざまな土壌試料中に同定されている[3][4]。有機リン系殺虫剤を分解する細菌種は、1973年にフィリピンの土壌試料から初めて単離された(Flavobacterium sp. ATCC27551)[5]。その後、他の種もOP分解能力を持つことが示された。例としては、Pseudomonas diminuta(アメリカ合衆国の土壌試料から単離)、Agrobacterium radiobacter(オーストラリアの土壌試料から単離)、Alteromonas haloplanktis(アメリカ合衆国の土壌試料から単離)、Pseudomonas sp. WBC-3(中国の土壌試料から単離)がある[3]。
全ゲノムの配列相同性検索によって、opdと同じ遺伝子ファミリーの配列は、大腸菌Escherichia coli(yhfV)や結核菌Mycobacterium tuberculosis、ウシ型結核菌Mycobacterium bovisなどの病原性細菌、放射線耐性生物として知られるDeinococcus radiodurans、嫌気性細菌Desulfatibacillum alkenivorans、好熱性細菌Geobacillus sp.とThermoanaerobacter sp. X514、など他の細菌にも同定されている[3]。有機リンを加水分解する能力は細菌に限定されない。いくつかの菌類とシアノバクテリアもOPを加水分解することが発見されている[3]。また、相同配列はSulfolobus acidocaldariusなど一部の古細菌にも存在している[6]。
Flavobacterium sp. ATCC27551とPseudomonas diminutaに存在する遺伝子(opd)は高度に保存されているが[4]、遺伝子が存在しているプラスミドは、遺伝子が存在する 5.1 kbの保存領域を除いて、大きく配列が大きく異なる[2]。
Flavobacteriumのopd遺伝子構成の注意深い観察からは、トランスポゾンのように機能する可能性のある構造であることが示唆されている。このことは、他の細菌種間での遺伝子の広範な分布がDNAの水平伝播によって生じた可能性を示している。opd遺伝子は、Tn3ファミリーのトランスポゾンに特徴的な転移挿入配列と隣接している。さらに、opd遺伝子の上流には、トランスポザーゼ様の配列(TnpAと相同)やレゾルバーゼ様の配列(TnpRと相同)も同定されており[4]、これらはTn3などのクラスIIトランスポゾンに特徴的な配列である。
opd遺伝子の下流には他のORFが同定されており、OPの分解産物の1つであるp-ニトロフェノールを分解するタンパク質がコードされている。このタンパク質は、ホスホトリエステラーゼ(PTE)の存在下で劇的な活性の上昇が観察されるため、PTEとの複合体として機能すると考えられている[4]。
タンパク質
[編集]構造
[編集]ホスホトリエステラーゼ(PTE)は、反応の触媒を行う2つの亜鉛イオンを持つ金属酵素ファミリーに属する。金属原子は共通のリガンドを介して連結され、周囲に密集したヒスチジン残基のイミダゾイル基が配位している[7]。このタンパク質は二量体を形成する[8]。全体構造はα/βバレルモチーフから構成され、このモチーフは他の20種類の触媒タンパク質にも存在している。これらのタンパク質の活性部位はβバレルのC末端部分に位置し、PTEでも同様である[7]。

触媒
[編集]有機リンに対する触媒は、基質のリン中心に関して配置の反転を伴う求核置換反応(SN2機構)を介して行われる[7]。活性部位では、金属カチオンが基質のP-O結合をさらに分極化し、求核攻撃に対する感受性を高めることで触媒を補助している。さらに、塩基性残基が水分子からプロトンを引き抜き、その結果形成された水酸化物イオン(OH-)が2つの2価カチオンを橋渡しし、求核剤として機能する。その後、OH-は基質のリン中心を攻撃し、続いてプロトン移動が起こる。P-O結合は切断され、反応産物が活性部位から放出される[9]。ホスホトリエステラーゼの反応回転数(kcat)は、パラオキソンの加水分解の場合ほぼ 104 /sであり、その反応産物はジエチルリン酸とp-ニトロフェノールである。
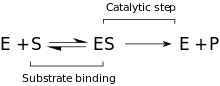
速度論
[編集]提唱されている反応速度論に関するモデルでは、酵素(E)と基質(S)の間で起こる可逆的な結合段階が含まれ、ミカエリス複合体(ES)が形成される。続いて不可逆的段階が起こり、P-O結合が切断されて一過的な酵素-反応産物複合体(EP)が形成される。最後に、反応産物(P)が放出されて酵素(E)が再生される[9]。

細胞内局在
[編集]ホスホトリエステラーゼは膜結合タンパク質であり、29アミノ酸の標的化ペプチド(Tatモチーフ)が付加された状態で翻訳される[10][11][12]。細胞膜へ挿入された後、モチーフは成熟タンパク質から切除される[1]。タンパク質は内膜に固定され、ペリプラズム側を向いている[13]。
機能
[編集]ホスホトリエステラーゼは、基質中のトリエステル結合を切断することで、有機リン化合物を加水分解する。

この酵素は非常に広い基質特異性を持ち[11]、反応の触媒は非常に効率的である。PTEはパラオキソンを拡散律速に近い速度で加水分解し[14]、このことは酵素がこの基質の利用を最適化するよう進化したことを示唆している[12]。PTEは合成有機リントリエステルとモノフルオロリン酸化合物に特異的に作用する[3]。天然の基質は存在しないようであり、パラオキソンや他の一般的な農業用殺虫剤の利用に最適化した進化を行った可能性がある[14]。
パラオキソンに対する反応の産物はジエチルリン酸とp-ニトロフェノールである[4]。p-ニトロフェノールは、 opd遺伝子の750塩基対下流にコードされる酵素によってさらに分解される。この酵素は 29 kDaの加水分解酵素であると推定されており、芳香族化合物を分解し、PTEと協働的に機能する[4]。この酵素はPseudomonas putida、Pseudomonas azelaica、Rhodococcus sp.、P. fluorescensに存在する加水分解酵素と相同である[4]。
有機リン化合物は細菌に対する毒性はないが、動物に対してはアセチルコリンエステラーゼ阻害剤として機能する[15]。一部の細菌種は有機リンを栄養源や炭素源として利用することができる[13]。
環境に対する重要性
[編集]ホスホトリエステラーゼは、バイオレメディエーションのための強力な生体触媒の候補であると見なされている[7]。その広い基質特異性と触媒効率のため、opd遺伝子を含む微生物は農薬の過剰使用のために有毒となった土壌の無毒化に利用できる可能性のある魅力的な標的となっている[3]。有機リンはアセチルコリンエステラーゼ阻害剤として機能する。アセチルコリンは神経伝達物質であり、昆虫や哺乳類の中枢神経系の必須の構成要素である。アセチルコリンの適切な代謝回転の阻害によって中枢神経系は過剰興奮し、最終的には死に至る[3][16]。有機リン分解微生物は、こうした毒性化合物を環境中から除去するための、効率的で、安価で、環境に優しい手法として利用できる可能性がある[3]。
出典
[編集]- ^ a b “Expression and subcellular localization of organophosphate hydrolase in acephate-degrading Pseudomonas sp. strain Ind01 and its use as a potential biocatalyst for elimination of organophosphate insecticides”. Letters in Applied Microbiology 57 (1): 63–8. (July 2013). doi:10.1111/lam.12080. PMID 23574004.
- ^ a b c “Dissimilar plasmids isolated from Pseudomonas diminuta MG and a Flavobacterium sp. (ATCC 27551) contain identical opd genes”. Applied and Environmental Microbiology 54 (10): 2586–9. (October 1988). PMC 204325. PMID 3202637.
- ^ a b c d e f g h i “Organophosphorus-degrading bacteria: ecology and industrial applications”. Nature Reviews. Microbiology 7 (2): 156–64. (February 2009). doi:10.1038/nrmicro2050. PMID 19098922.
- ^ a b c d e f g “Transposon-like organization of the plasmid-borne organophosphate degradation (opd) gene cluster found in Flavobacterium sp”. Applied and Environmental Microbiology 69 (5): 2533–9. (May 2003). doi:10.1128/AEM.69.5.2533-2539.2003. PMC 154515. PMID 12732518.
- ^ “A Flavobacterium sp. that degrades diazinon and parathion”. Canadian Journal of Microbiology 19 (7): 873–5. (July 1973). doi:10.1139/m73-138. PMID 4727806.
- ^ “The genome of Sulfolobus acidocaldarius, a model organism of the Crenarchaeota”. Journal of Bacteriology 187 (14): 4992–9. (July 2005). doi:10.1128/JB.187.14.4992-4999.2005. PMC 1169522. PMID 15995215.
- ^ a b c d “Three-dimensional structure of phosphotriesterase: an enzyme capable of detoxifying organophosphate nerve agents”. Biochemistry 33 (50): 15001–7. (December 1994). doi:10.1021/bi00254a008. PMID 7999757.
- ^ “Crystal structure of methyl parathion hydrolase from Pseudomonas sp. WBC-3”. Journal of Molecular Biology 353 (3): 655–63. (October 2005). doi:10.1016/j.jmb.2005.08.057. PMID 16181636.
- ^ a b “Mechanism for the hydrolysis of organophosphates by the bacterial phosphotriesterase”. Biochemistry 43 (19): 5707–15. (May 2004). doi:10.1021/bi0497805. PMID 15134445.
- ^ “Purification and characterization of three parathion hydrolases from gram-negative bacterial strains”. Applied and Environmental Microbiology 55 (2): 289–93. (February 1989). PMC 184103. PMID 2541658.
- ^ a b Classen, John J.; Engler, Cady R.; Kenerley, Charles M.; Whittaker, A. Dale (April 2000). “A logistic model of subsurface fungal growth with application to bioremediation”. Journal of Environmental Science and Health, Part A 35 (4): 465–488. doi:10.1080/10934520009376982.
- ^ a b Caldwell, S. R.; Newcomb, J. R.; Schlecht, K. A.; Raushel, F. M. (1991-07-30). “Limits of diffusion in the hydrolysis of substrates by the phosphotriesterase from Pseudomonas diminuta”. Biochemistry 30 (30): 7438–7444. doi:10.1021/bi00244a010. ISSN 0006-2960. PMID 1649628.
- ^ a b “Microbial degradation of organophosphorus compounds”. FEMS Microbiology Reviews 30 (3): 428–71. (May 2006). doi:10.1111/j.1574-6976.2006.00018.x. PMID 16594965.
- ^ a b “Purification and properties of the phosphotriesterase from Pseudomonas diminuta”. The Journal of Biological Chemistry 264 (33): 19659–65. (November 1989). PMID 2555328.
- ^ Lotti, Marcello (2002-12-27). “Promotion of organophosphate induced delayed polyneuropathy by certain esterase inhibitors”. Toxicology 181-182: 245–248. doi:10.1016/s0300-483x(02)00291-3. ISSN 0300-483X. PMID 12505319.
- ^ Ragnarsdottir, K. V. (2000). “Environmental fate and toxicology of organophosphate pesticides”. Journal of the Geological Society 157 (4): 859–876. doi:10.1144/jgs.157.4.859.
関連文献
[編集]- “Serum esterases. I. Two types of esterase (A and B) hydrolysing p-nitrophenyl acetate, propionate and butyrate, and a method for their determination”. The Biochemical Journal 53 (1): 110–7. (January 1953). doi:10.1042/bj0530110. PMC 1198110. PMID 13032041.
- “Membrane marker enzymes. Characterization of an arylesterase of guinea pig cerebral cortex utilizing p-nitrophenyl acetate as substrate”. Biochimica et Biophysica Acta 276 (1): 180–91. (July 1972). doi:10.1016/0005-2744(72)90019-8. PMID 5047702.
- “Distinction between 'A'-esterases and arylesterases. Implications for esterase classification”. The Biochemical Journal 245 (1): 293–6. (July 1987). doi:10.1042/bj2450293. PMC 1148115. PMID 2822017.
- Main AR (1960). “The differentiation of the A-type esterases in sheep serum”. Biochem. J. 75: 188–195. doi:10.1042/bj0750188. PMC 1204348. PMID 14420012.

