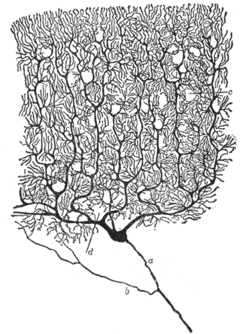
プルキンエ細胞
| 神経細胞: プルキンエ細胞 | |
|---|---|
 | |
| 場所 | 小脳 |
| 機能 | 抑制性ニューロン |
| 神経伝達物質 | GABA |
| 形態 | flat dendritc arbor |
| シナプス前 | 平行線維および登上線維 |
| シナプス後 | 深部小脳核 |
| NeuroLex ID | sao471801888 |
プルキンエ細胞(プルキンエさいぼう、英: Purkinje cells (発音: [pərˈkɪndʒi] purr-KIN-jee))は小脳皮質にあるγ-アミノ酪酸 (GABA) 作動性の抑制性ニューロンである。 この神経細胞の名前はチェコの解剖学者であるヤン・エヴァンゲリスタ・プルキニェに由来する。
形態と出入力
[編集]

プルキンエ細胞はヒトの脳の中でベッツ細胞に次いで大きい神経細胞であり[1]、おびただしい数の分枝をもつ大きな樹状突起が特徴的である。
これらの細胞は小脳のうちで顆粒層と分子層の間にあるプルキンエ層(プルキンエ細胞層)と呼ばれるところに分布している。ただ、樹状突起を伸ばす方向は各々平行で、ドミノのように並んでいる。 この樹状突起が作る大きなシート状の構造に顆粒細胞からきた平行線維が垂直方向に走ってきてグルタミン酸性のシナプスを形成する。この平行線維からの入力は比較的弱いが、延髄の下オリーブ核から下小脳脚を通って入ってくる登上線維は樹状突起や細胞体にまきつきながら接合し、強力な入力を行っている。 1つのプルキンエ細胞に対し200,000本の平行線維がシナプスを形成するが、入ってくる登上線維は1本のみである(逆に1つの顆粒細胞には100程度のプルキンエ細胞が接合し、1つの登上線維は枝分かれして数個のプルキンエ細胞と接合する)。 分子層にある籠細胞(バスケット細胞)と星状細胞はプルキンエ細胞に対しそれぞれ軸索起始部と樹状突起でシナプスを形成しており、抑制性の入力を行っている(神経伝達物質としてGABAを使用)。 プルキンエ細胞は運動協調性に関する小脳皮質からの唯一の出力で、深部小脳核(歯状核など)に対して抑制性の投射を行っている。
電気生理学的活動
[編集]
MF: 苔状線維.
DCN: 深部小脳核.
IO: 下オリーブ核.
CF: 登上線維.
GC: 顆粒細胞.
PF: 平行線維.
PC: プルキンエ細胞.
GgC: ゴルジ細胞.
SC: 星状細胞.
BC: 籠細胞.
プルキンエ細胞は2つの異なる種類の電気生理学的活動を示す:
- 単純スパイクは17~150Hzの頻度[2]で、自発的ないし顆粒細胞から平行線維を介した刺激により発火している。
- 複雑スパイクは急速な発火であるが一つのまとまった波として見ると多くとも1~2Hzの頻度でしか生じない。この発火は登上線維の興奮によりカルシウムを介して行われる。
プルキンエ細胞は自発的な電気生理学的活動を示すが、これはナトリウム依存的あるいはカルシウム依存的な発火によるものである[3][4]。特にプルキンエ細胞の電位依存性ナトリウムチャネル(Nav1.6)では通常の神経細胞のそれとは異なり、発火後の不活性状態が完全には起こらず、しかも閾値が低く不活性化してもすぐに静止状態に戻る性質があるので活動電位が終了したとしても脱分極ができるので連続発火が可能となっている[5]。 プルキンエ細胞に存在するカルシウムチャネルは「プルキンエ:Purkinje」の頭文字をとってP型カルシウムチャネルと呼ばれるが[6]、これもプルキンエ細胞の機能に大きく関わっているとされる(なおP型カルシウムチャネルは、Q型カルシウムチャネルと同じ遺伝子CACNA1Aに由来するのでしばしばP/Q型カルシウムチャネル〔Cav2.1またはα1Aチャネル〕と総称される)。伊藤正男らによると、平行線維と登上線維をほぼ同時に組み合わせて刺激すると、一定期間平行線維とプルキンエ細胞間のシナプス伝達効率が低下するという長期抑圧(LTD: long term depression)が観察される[7]。これは小脳での運動学習機構の基礎とされ、登上線維からの刺激を誤差信号とする「教師あり学習」の仮説(Marr-Albus-Ito仮説)の根拠にもなっている。
プルキンエ細胞の樹状突起は内因性カンナビノイドを放出して一時的に興奮性・抑制性のシナプスを下方制御(ダウンレギュレート)することが示唆されている[8]。
プルキンエ細胞と関連した臨床症状
[編集]ATM遺伝子に異常があり先天性免疫不全を示す毛細血管拡張性運動失調症ではプルキンエ細胞の変性・脱落が生じ、小脳失調(歩行障害)を生じる。ただ、詳しい機序は不明である。P型カルシウムチャネル(Cav2.1)に異常がある脊髄小脳失調症6型(脊髄小脳変性症の1つ)ではプルキンエ細胞が優先的に脱落し小脳失調を呈する。
画像
[編集]出典
[編集]- ^ Purves, Dale, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White (2008). Neuroscience. 4th ed.. Sinauer Associates. pp. 432–4. ISBN 978-0-87893-697-7
- ^ Raman IM, Bean BP (1999). “Ionic currents underlying spontaneous action potentials in isolated cerebellar Purkinje neurons”. J. Neurosci. 19 (5): 1663-1674. PMID 10024353.
- ^ Llinás R, Hess R (July 1976). “Tetrodotoxin-resistant dendritic spikes in avian Purkinje cells”. Proc. Natl. Acad. Sci. U.S.A. 73 (7): 2520–3. doi:10.1073/pnas.73.7.2520. PMC 430632. PMID 1065905.
- ^ Llinás R, Sugimori M (August 1980). “Electrophysiological properties of in vitro Purkinje cell somata in mammalian cerebellar slices”. J. Physiol. (Lond.) 305: 171–95. PMC 1282966. PMID 7441552.
- ^ Schaller KL, Caldwell JH (2003). “Expression and distribution of voltage-gated sodium channels in the cerebellum”. Cerebellum 2 (1): 2-9. doi:10.1080/14734220309424. PMID 12882229.
- ^ Llinás RR, Sugimori M, Cherksey B (1989). “Voltage-dependent calcium conductances in mammalian neurons. The P channel”. Ann. N. Y. Acad. Sci. 560: 103–11. doi:10.1111/j.1749-6632.1989.tb24084.x. PMID 2545128.
- ^ Ito M, Kano M (1982). “Long-lasting depression of parallel fiber-Purkinje cell transmission induced by conjunctive stimulation of parallel fibers and climbing fibers in the cerebellar cortex”. Neurosci. lett. 33 (3): 253-258. doi:10.1016/0304-3940(82)90380-9. PMID 6298664.
- ^ Kreitzer AC, Regehr WG (March 2001). “Retrograde inhibition of presynaptic calcium influx by endogenous cannabinoids at excitatory synapses onto Purkinje cells”. Neuron 29 (3): 717–27. doi:10.1016/S0896-6273(01)00246-X. PMID 11301030.
参考文献
[編集]- 小澤瀞司、福田康一郎ら『標準生理学』(第7版)医学書院、2009年。ISBN 978-4260003018。
- 川人光男 (2000年). “小脳に学習で獲得される内部モデル” (PDF). 神経情報科学サマースクール NISS2000 テキスト. 2011年4月2日閲覧。
- 京都大学大学院医学科 高次脳形態学教室. “Inverse Dynamic Model in the Cerebellum 小脳の内部モデルについて” (PDF). 2011年4月2日閲覧。



