フリース転位
フリース転位(フリースてんい、Fries rearrangement)はフェニルエステルから芳香族ヒドロキシケトンへの転位反応である[1][2][3][4][5]。ルイス酸によって触媒される。
反応機構
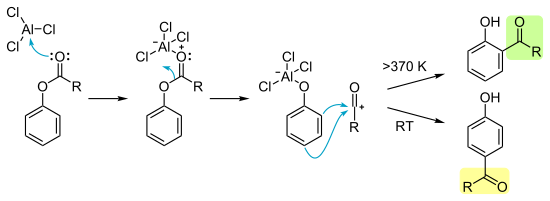
[編集]さまざまな検討が行われてきたが、フリース転位の正確な反応機構は明らかになっていない。異なる置換基を持つ混合物の交差実験によって、分子間および分子内反応であることを示す証拠が得られている。反応速度は溶媒や基質に依存しない。広く受け入れられているのは以下のようなカルボカチオン中間体を含む機構である。
反応の最初の段階は、塩化アルミニウム AlCl3 などルイス酸のアシル基上のカルボニル基の酸素原子への配位である。反応基質中、フェノール上の酸素原子よりもカルボニル酸素原子の方が電子密度が高いため、ルイス塩基性が強い。配位によってアシル基とフェノール酸素の結合が分極し、塩化アルミニウムはフェノール酸素上に転位する。同時にアシリウムイオンが生成し、これが芳香族求電子置換反応によって芳香環上に付加する。このとき発生するプロトンは、塩化アルミニウム上の塩素と結合して塩化水素となる。この置換反応の配向性は温度によって変化し、低温ではパラ置換、高温ではオルト置換が起こる。
適用範囲
[編集]フェノール類はエステル化することは比較的容易だが、フリーデル・クラフツ反応を起こしにくい。そのため、フリース転位は芳香族ヒドロキシケトンの工業的合成に有用である。例えばアセトアミノフェンやサルブタモールなどの医薬品を合成する際の中間体の調製に用いられる。触媒としては、塩化アルミニウム、三フッ化ホウ素、ビスマストリフラートなどのルイス酸のほか、フッ化水素やメタンスルホン酸などのプロトン酸も使うことができる。それらの化合物は腐食性が高く有毒なため、環境への負荷がより小さい触媒も研究されている。
制限
[編集]どのような場合でも反応に使うことができるのは、反応条件下で安定なアシル基を持つエステルのみである。多数の置換基を持つ基質の場合、立体障害により収率が低下する。芳香環上のメタ位に不活性基を持つと、フリーデル・クラフツ反応と同じく反応に不利な影響を及ぼす。
光フリース転位
[編集]熱反応のほか、光フリース転位 (photo Fries rearrangement) と呼ばれる光反応も知られる[6][3]。ラジカルの発生を含み、不活性化基が存在しても進行する。収率は低いため、この反応は実験室規模での合成に限られる。

アニオン性フリース転位
[編集]上記以外にも、アニオン性の中間体を経るフリース転位も知られている。この場合、強塩基の存在下でアリールエステルの芳香環上のオルト位がメタル化され、求核攻撃によって転位が起こる。
参考文献
[編集]- ^ Fries, K.; Finck, G. Ber. 1908, 41, 2447.
- ^ Fries, K.; Pfaffendorf, W. Ber. 1910, 43, 212.
- ^ a b Smith, M. B.; March, J. Advanced Organic Chemistry, 5th Ed.; John Wiley & Sons: Chichester, 2001; pp 725–727.
- ^ Miller, E.; Hartung, W. H. "o-Propiophenol and p-propiophenol". Org. Synth., Coll. Vol. 2, p.543 (1943); Vol. 13, p.90 (1933). オンライン版
- ^ Amin, G. C.; Shah, N. M. "2,5-Dihydroxyacetophenone". Org. Synth., Coll. Vol. 2, p.543 (1943); Vol. 13, p.90 (1933). オンライン版
- ^ Bellus, D. Advances in Photochemistry; John Wiley & Sons: Chichester, 1971; Vol. 8, pp 109–159.
