(2E,6E)-ファルネシル二リン酸シンターゼ
| (2E,6E)-ファルネシル二リン酸シンターゼ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 識別子 | |||||||||
| EC番号 | 2.5.1.10 | ||||||||
| CAS登録番号 | 37277-79-5 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||
(2E,6E)-ファルネシル二リン酸シンターゼ((2E,6E)-farnesyl diphosphate synthase)はテルペノイドやステロイドの合成に関わるプレニル基転移酵素の1つで、次の化学反応を触媒する酵素である。
- ゲラニル二リン酸 + イソペンテニル二リン酸 二リン酸 + (2E,6E)-ファルネシル二リン酸
組織名はgeranyl-diphosphate:isopentenyl-diphosphate geranyltranstransferaseである。単にファルネシル二リン酸シンターゼという場合が多く、また別名としてゲラニルtransトランスフェラーゼ(geranyltranstransferase)がある。
分布
[編集]ほぼすべての生物に保存されている。
構造
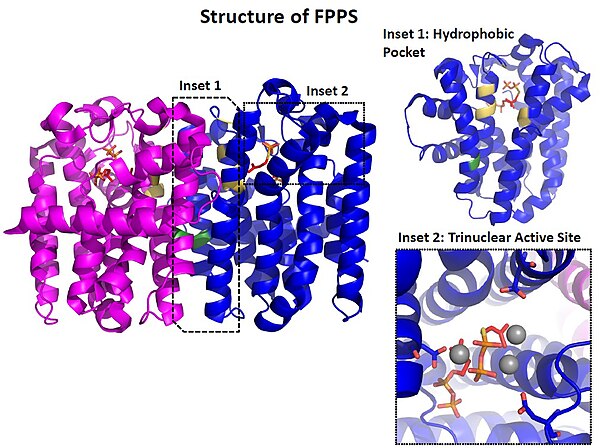
[編集]ファルネシル二リン酸シンターゼはホモ2量体で機能している。単量体は分子量およそ30kDaのポリペプチドで、11本のαヘリックスからなる。2ヶ所によく保存されたDDxxDモチーフが存在し、ここにマグネシウムイオンを介して基質が結合する[1]。
反応機構
[編集]反応はイオン化-縮合-脱離の3過程で進行するSN1反応である。まず基質であるゲラニル二リン酸(またはジメチルアリル二リン酸)のアニオン性脱離基である二リン酸を3つのマグネシウムイオンがキレートする。これにより生じたカルボカチオンを、イソペンテニル二リン酸の二重結合が求核攻撃することで2つの分子が結合する。最後にプロトンが脱離することでファルネシル二リン酸(またはゲラニル二リン酸)が生じる。[1]
医学上の重要性
[編集]| ファルネシル二リン酸シンターゼ | |
|---|---|
| 識別子 | |
| 略号 | FDPS |
| Entrez | 2224 |
| HUGO | 3631 |
| OMIM | 134629 |
| RefSeq | NM_002004 |
| UniProt | P14324 |
| 他のデータ | |
| EC番号 (KEGG) | 2.5.1.10 |
| 遺伝子座 | Chr. 1 q22 |
骨ページェット病や骨粗鬆症の治療に用いられるビスホスホネート(リセドロネートなど)は、ファルネシル二リン酸シンターゼの阻害によりタンパク質のプレニル化を抑制し、破骨細胞の活動を抑えて骨の吸収を防ぐ。[1][2]
参考文献
[編集]- ^ a b c d Hosfield et al. (2004). “Structural basis for bisphosphonate-mediated inhibition of isoprenoid biosynthesis”. J. Biol. Chem. 279 (10): 8526–8529. doi:10.1074/jbc.C300511200. PMID 14672944.
- ^ Guo et al. (2007). “Bisphosphonates target multiple sites in both cis- and trans-prenyltransferases”. PNAS 104 (24): 10022–10007. doi:10.1073/pnas.0702254104. PMC 1877987. PMID 17535895.

