ビニルシクロプロパン転位
ビニルシクロプロパン転位( - てんい、Vinylcyclopropane rearrangement)、あるいはビニルシクロプロパン-シクロペンテン転位(vinylcyclopropane-cyclopentene rearrangement)は、ビニル基を持つシクロプロパン環がシクロペンテン環に変換される、環拡大反応のことである[1][2][3]。

数々の実験により、反応機構が解明されてきており、現在はジラジカルを介した二段階反応、または軌道の対称性により起こるペリ環状反応のいずれかにより進行すると考えられている[4]。
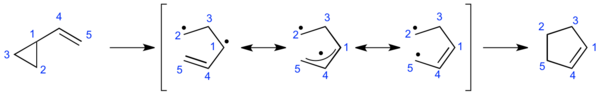
シクロペンテン環を構築できるため、天然物の全合成において当反応は利用されている。
起源と歴史
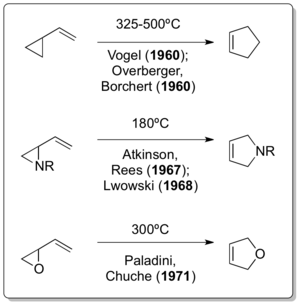
[編集]1959年、Humble Oil and Refining社(現在のエクソンモービルの前身となった企業の一つ)の化学者であるノーマン・ニューライター(英語版) は、石油精製の際に副生成物として生じるブタジエンの有効な利用法について研究していた。そこで、カルベン化学に精通していたウィリアム・デーリングに相談を持ちかけ、彼はカルベンとブタジエンを反応させることを提案した[5]。デーリングは、ブロモホルムやクロロホルムから生じたカルベンと1,3-ブタジエンを反応させる方法を報告したばかりであった[6]。この反応により、1,1-ジクロロ-2,2-ジメチルシクロプロパンが生成する。そこで、ニューライターは、この1,1-ジクロロ-2,2-ジメチルシクロプロパンを熱分解が生じる温度(400℃以上)で反応させると、転位生成物である4,4-ジクロロシクロペンテンが生成することを確認した(下図参照)。当反応が歴史上初めて確認されたビニルシクロプロパン転位である[7]。

ニューライターの報告の一年後、Emanuel Vogel[8]らは、炭素、水素以外の元素を含まない化合物のビニルシクロプロパン転位を報告した[9][10]。それ以降、1967年にはAtkinsonらに[11]、1968年にはLwowskiに[12]、1971年にはPaladiniらによって[13]、ビニルシクロプロパン転位の応用反応が報告されている。(下図参照)
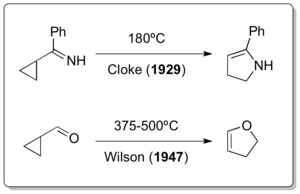
古典的なビニルシクロプロパン転位が発見された後、ヘテロ原子を有する化合物のビニルシクロプロパン転位が報告されるのに30年要したことは、特筆に値する。ところが、1922年にニコライ・デミャーノフが行ったホフマン脱離を用いたビニルシクロプロパン合成の実験の際、ビニルシクロプロパン転位は起こっていたであろうと考えられている[14]。また、1929年にはClokeに[15]、1947年にはWilsonによって[16]、ビニルシクロプロパン転位に似た同様の反応が報告されていた。(下図参照)
脚注
[編集]- ^ E M Mil'vitskaya, A V Tarakanova and Alfred F Plate. Thermal Rearrangements of Vinylcyclopropanes. Russ. Chem. Rev. 1976;45:469-478. doi:10.1070/RC1976v045n05ABEH002675.
- ^ Z. Goldschmidt and B. Crammer. Vinylcyclopropane rearrangements. Chem. Soc. Rev. 1988;17:229-267. doi:10.1039/CS9881700229.
- ^ Hudlicky, Tomas; Reed, Josephine W. (2010). “From Discovery to Application: 50 Years of the Vinylcyclopropane-Cyclopentene Rearrangement and Its Impact on the Synthesis of Natural Products”. Angewandte Chemie International Edition 49 (29): 4864–76. doi:10.1002/anie.200906001. PMID 20586104.
- ^ Baldwin, John E. (2003). “Thermal Rearrangements of Vinylcyclopropanes to Cyclopentenes”. Chemical Reviews 103 (4): 1197–212. doi:10.1021/cr010020z. PMID 12683781.
- ^ Woodworth, Robert C.; Skell, Philip S. (1957). “Reactions of bivalent carbon species. Addition of dihalocarbenes to 1,3-butadiene”. J. Am. Chem. Soc. 79 (10): 2542. doi:10.1021/ja01567a048.
- ^ Doering, W. von E.; Hoffman, A. Kentaro (1954). “The Addition of Dichlorocarbene to Olefins”. J. Am. Chem. Soc. 76 (23): 6162. doi:10.1021/ja01652a087.
- ^ Neureiter, Norman (1959). “Pyrolysis of 1,l-Dichloro-2-vinylcyclopropane. Synthesis of 2-Chlorocyclopentadiene”. J. Org. Chem. 24 (12): 2044. doi:10.1021/jo01094a621.
- ^ Vogel, Emanuel (1960). “Kleine Kohlenstoff-Ringe”. Angewandte Chemie 72: 4. doi:10.1002/ange.19600720103.
- ^ Overberger, C. G.; Borchert, A. E. (1960). “Novel thermal rearrangements accompanying acetate pyrolysis in small ring systems”. J. Am. Chem. Soc. 82 (4): 1007. doi:10.1021/ja01489a069.
- ^ Overberger, C. G.; Borchert, A. E. (1960). “Ionic Polymerization. XVI. Reactions of 1-Cyclopropylethanol-Vinylcyclopropane”. J. Am. Chem. Soc. 82 (18): 4896. doi:10.1021/ja01503a036.
- ^ Atkinson, R. S.; Rees, C. W. (1967). “A vinylaziridine to pyrroline rearrangement”. Chemical Communications (London) (23): 1232a. doi:10.1039/C1967001232a.
- ^ Lwowski, Walter; Rice, Susan N.; Lwowski, Walter (1968). “Singlet and Triplet Nitrenes. 111. The Addition of Carbethoxynitrene to 1,3-Dienes”. J. Org. Chem. 33 (22): 481. doi:10.1021/jo01266a001.
- ^ Paladini, J; Chuche, X. X. (1971). “Rearrangement thermique d'epoxydes vinyliques”. Tetrahedron Letters 12 (46): 4383. doi:10.1016/S0040-4039(01)97447-7.
- ^ Demjanow, N. J.; Dojarenko, Marie (1922). “Über Vinylcyclopropan, einige Derivate des Methyl-cyclopropyl-carbinols und die Isomerisation des Cyclopropan-Ringes”. Ber. Dtsch. Chem. Ges. B 55 (8): 2718. doi:10.1002/cber.19220550846.
- ^ Cloke, J. B.; Borchert, A. E. (1929). “The formation of pyrrolines from gamma-chloropropyl and cyclopropyl ketimines”. J. Am. Chem. Soc. 51 (18): 1174. doi:10.1021/ja01379a028.
- ^ Wilson, C. L.; Borchert, A. E. (1947). “Reactions of Furan Compounds. VII. Thermal Interconversionof 2,3-Dihydrofuran and Cyclopropane Aldehyde”. J. Am. Chem. Soc. 69 (18): 3002. doi:10.1021/ja01204a020.
