パロノセトロン
表示
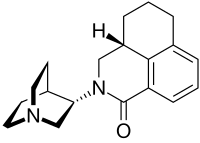 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| Drugs.com | monograph |
| MedlinePlus | a610002 |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 | |
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 97% (oral) |
| 血漿タンパク結合 | 62% |
| 代謝 | Hepatic, 50% (mostly CYP2D6-mediated, CYP3A4 and CYP1A2 also involved) |
| 半減期 | Approximately 40 hours |
| 排泄 | Renal, 80% (of which 49% unchanged); fecal (5 to 8%) |
| データベースID | |
| CAS番号 |
135729-61-2 |
| ATCコード | A04AA05 (WHO) |
| PubChem | CID: 148211 |
| DrugBank |
DB00377 |
| ChemSpider |
4892289 |
| UNII |
5D06587D6R |
| ChEMBL |
CHEMBL1189679 |
| 化学的データ | |
| 化学式 | C19H24N2O |
| 分子量 | 296.407 g/mol |
| |
パロノセトロン(palonosetron)は、5-HT3受容体拮抗薬の一つで、癌化学療法による急性または遅発性の悪心・嘔吐(化学療法誘発性悪心嘔吐(CINV))の予防・治療に用いられる。商品名アロキシ。第III相臨床試験により、遅発性悪心嘔吐の抑制効果については、グラニセトロンよりも優れているとの結果が出た[1]。
化学療法剤投与の30分前に静注または点滴静注する[2]。
米国ではカプセル剤も存在し、化学療法剤投与の1時間前に服用するよう推奨されている[3]。経口投与剤が米国で承認されたのは2008年8月であり、大規模臨床試験で遅延性の悪心・嘔吐に効果が見られなかった[3]ことから、用途は急性期の悪心・嘔吐に限定されている。
効能・効果
[編集]抗悪性腫瘍剤(シスプラチンなど)投与に伴う消化器症状(悪心、嘔吐)(遅発期を含む)
副作用
[編集]治験時の副作用発現率は34.3%であり、その主なものは便秘(16.5%)、頭痛(3.9%)、ALT(GPT)上昇73例(5.4%)、QT延長58例(4.3%)、AST(GOT)上昇49例(3.6%)、血管痛(3.1%)などであった[4]。
重大な副作用として添付文書に記載されているものは、ショック、アナフィラキシーである。
薬物動態
[編集]注射後の血中半減期は、30〜40時間である[5]:21-22。主に肝臓[5]:27で代謝され、尿中[5]:29に排泄される。腎障害または肝障害があると、半減期が延長され、軽度・中等度腎障害で47.3時間、重度腎障害で61.5時間、中等度肝障害で56.3時間、重度肝機能障害で59.9時間である[5]:23-24。
出典
[編集]- ^ “アロキシ.jp > 世界が注目したパロノセトロン国内第III相試験”. 2014年10月27日閲覧。
- ^ De Leon A (2006). “Palonosetron (Aloxi): a second-generation 5-HT(3) receptor antagonist for chemotherapy-induced nausea and vomiting”. Proceedings (Baylor University. Medical Center) 19 (4): 413–6. PMC 1618755. PMID 17106506.
- ^ a b Waknine, Yael (September 4, 2008). “FDA Approvals: Nplate, Aloxi, Vidaza”. Medscape. 2008年9月4日閲覧。 Freely available with registration.
- ^ “アロキシ静注0.75mg/アロキシ点滴静注バッグ0.75mg 添付文書” (2014年7月). 2016年6月20日閲覧。
- ^ a b c d “アロキシ静注0.75mg/アロキシ点滴静注バッグ0.75mg インタビューフォーム” (PDF) (2014年4月). 2016年6月20日閲覧。
