ピラン (化学)
表示
(パイレインから転送)
| ピラン (化学) | |
|---|---|
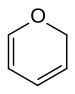 2H-ピラン
|
 4H-ピラン
|

|

|
2H-Pyran, 4H-Pyran | |
別称 2H-Oxine, 4H-Oxine | |
| 識別情報 | |
| CAS登録番号 | 289-66-7 (2H) |
| PubChem | 186148 (2H)136135 (4H) |
| ChemSpider | 161812 (2H) 119912 (4H) |
| UNII | CH5P2A5WTT |
| |
| |
| 特性 | |
| 化学式 | C5H6O |
| モル質量 | 82.1 g mol−1 |
| 関連する物質 | |
| 関連物質 | ジヒドロピラン テトラヒドロピラン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ピラン (pyran) は、化学式 C5H6O で表される、1個の酸素原子を含む6員環のエーテル化合物である。二重結合の位置が異なる異性体として2H-ピランと4H-ピランの2種が存在する。2H-ピランでは飽和炭素が2位に、4H-ピランでは4位にある。
化学では母体のピランはそれほど重要ではないが、さまざまな誘導体が生体物質として知られている。
「ピラン」の語はより飽和度の高い類縁体であるテトラヒドロピラン構造を表すのに使われることがある。たとえば6員環の単糖はピラノースと呼ばれる。すなわち、D-グルコースの6員環構造の別名はD-グルコピラノースである。
合成とさらなる不飽和化
[編集]グルタルアルデヒドを塩化水素の共存下に加熱すると 4H-ピランが発生する[1][2]。
4H-ピランを臭素化して得られる 3-ブロモ-4H-ピランにカリウム tert-ブトキシドと 18-クラウン-6 を作用させると、さらに不飽和度の進んだ 3δ2-ピラン(4H-ピランから 3,4位の水素がとれた環状アレン)が短寿命の化学種として発生する[2]。
関連項目
[編集]脚注
[編集]- ^ Strating, J.; Keijer, J. H.; Molenaar, E.; Brandsma, L. Angew. Chem. 1962, 74, 465.
- ^ a b Engels, B.; Schoneboom, J. C.; Munster, A. F.; Groetsch, S.; Christl, M. J. Am. Chem. Soc. 2002, 124, 287-297. DOI: 10.1021/ja011227c
