ニトラミド
表示
| ニトラミド | |
|---|---|

| |
 |
|
Nitramide | |
| 識別情報 | |
| CAS登録番号 | 7782-94-7 |
| PubChem | 24534 |
| ChemSpider | 22941 |
| UNII | B8N6F7BJTL |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | H2N2O2 |
| モル質量 | 62.03 g mol−1 |
| 外観 | 無色固体[2] |
| 密度 | 1.378 g/cm3 |
| 融点 |
72 - 75 °C, 270 K, -31 °F [2] |
| 酸解離定数 pKa | 6.5[3] |
| 関連する物質 | |
| 関連物質 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
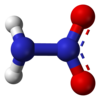
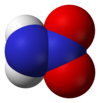
ニトラミド(Nitramide)は、分子式H2N−NO2の化合物である。置換誘導体R12H2N−NO2は、ニトラミド類とも呼ばれる。トリメチレントリニトロアミン(RDX)やシクロテトラメチレンテトラニトラミン(HMX)等、ニトラミドのオルガニル誘導体R−NH−NO2及びR2N−NO2は、爆薬として広く用いられる。ニトラミドは次亜硝酸の異性体であり、水酸基がアミノ基に置換した硝酸の窒素アナログと見ることもできる。
構造
[編集]ニトラミド分子は、アミン基がアミド基に結合したものである。気相では非平面型[4]であるが結晶相では平面型[2]であると報告されている。
合成
[編集]ThieleとLachmanによる最初の合成では、ニトロカルバミン酸カリウムの加水分解が行われた[2]。
- (K+
)
2(O
2N–N−
–CO−
2) + 2 H
2SO
4 → H
2N–NO
2 + CO
2 + 2 KHSO
4
その他の合成法には、ニトロカルバミン酸の加水分解やスルファミン酸ナトリウムと硝酸の反応や、五酸化二窒素と2等量のアンモニアの反応等がある。
- Na(SO
3NH
2) + HNO
3 → H
2N–NO
2 + NaHSO
4 - N
2O
5 + 2 NH
3 → H
2N–NO
2 + [NH
4]+
NO−
3
有機ニトラミド
[編集]→詳細は「ニトラミン」を参照

ニトラミンとも呼ばれる有機ニトラミドは、爆薬として重要である。ヘキサメチレンテトラミンをニトロリシスすることで合成できる。
出典
[編集]- ^ a b https://pubchem.ncbi.nlm.nih.gov/compound/Nitramide
- ^ a b c d Häußler, A.; Klapötke, T. M.; Piotrowski, H. (2002). “Experimental and Theoretical Study on the Structure of Nitramide H2NNO2”. Zeitschrift für Naturforschung 57 b (2): 151–156.
- ^ Perrin, D. D., ed (1982). Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution. IUPAC Chemical Data (2nd ed.). Oxford: Pergamon (1984発行). Entry 154. ISBN 0-08-029214-3. LCCN 82--16524
- ^ Tyler, J. K. (1963). “Microwave Spectrum of Nitramide”. Journal of Molecular Spectroscopy 11 (1–6): 39–46. doi:10.1016/0022-2852(63)90004-3.
