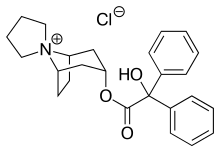
トロスピウム
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Regurin、Sanctura、他、多くのジェネリック[1] |
| Drugs.com | monograph |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 薬物動態データ | |
| 血漿タンパク結合 | 50–85% |
| 半減期 | 20時間 |
| データベースID | |
| CAS番号 | 10405-02-4 |
| ATCコード | G04BD09 (WHO) |
| PubChem | CID: 107979 |
| DrugBank | DB00209 |
| ChemSpider |
10482307 |
| UNII |
1E6682427E |
| ChEBI | CHEBI:32270 |
| ChEMBL | CHEMBL1201344 |
| 化学的データ | |
| 化学式 | C25H30ClNO3 |
| 分子量 | 427.97 g·mol−1 |
| |
トロスピウム( 英: Trospium) は、過活動膀胱の治療などに用いられるムスカリン受容体拮抗薬のこと[1]。
概要
[編集]1966年に特許が取得され、1974年に医療用途として承認された[2] 。2004年にアメリカで承認された。2007年に1日1回の投与で良い徐放剤が発売された。2009年ヨーロッパではジェネリックになり、2012年にアメリカで徐放剤のジェネリックが承認された。化学的には第四級アンモニウムカチオンであり、血液脳関門を通過せず、平滑筋を弛緩させ、過活動膀胱を緩和させる[1]。トロスピウム特有の副作用として、口渇、胃のむかつき、便秘などがある。一方で血液脳関門を通過しないため、他のムスカリン受容体拮抗薬のような中枢神経系の副作用は引き起さない[3]。
医療用途
[編集]トロスピウムは、切迫性尿失禁の症状を伴う過活動膀胱の治療に使用される。トロスピウムは、妊婦を対象とした十分な研究が存在しないため、妊娠カテゴリー C に格付けされている[4]。動物実験では胎児に影響を与える兆候がみられた。母乳移行性も確認されている[4]。
副作用
[編集]副作用は、抗コリン薬の典型的な胃腸への影響であり、口渇、消化不良、便秘などがある。中枢系の副作用は頭痛であるが、頻度は低い。
薬物動態
[編集]経口投与後、吸収されるのは用量の10%未満である。 20mg用量のバイオアベイラビリティは9.6%(範囲:4.0~16.1%)である。最高血中濃度 (Cmax) は、投与後5~6時間。半減期は20時間。
歴史
[編集]トロスピウムの合成は、アメリカのRobert Pfleger Chemische Fabrik GmbH、Heinz Bertholdt 、Robert Pfleger 、Wolfram Schulz 氏の科学者により開発され、アメリカ特許第 3,480,626 号 (DE119442 に相当) に登録されており、1967 年に初めて文献に報告された[5][6]。
医薬品として初めての承認されたのは1999年8月にドイツのマダウス社のRegurin20mg錠である。1999年マダウスは社はトロスピウムのアメリカでの権利をInterneuron社にライセンス供与し、Interneuron社はアメリカで臨床試験を実施してFDAから承認を受けた[7][8] 。Interneuron社は2002年にを社名をIndevus社に変更した[9]。Indevus社はPliva社の子会社であるOdyssey Pharmaceuticalsと提携し、2004 年5月にトロスピウムをアメリカで「SANCTURA」という商品名で発売した[10][11]。2005 年にPliva社との関係は解消され、ライセンスは Esprit Pharmaに売却された[12]。2007年9月にアラガンがEsprit Pharmaを買収し、ライセンスの交渉を行い、Indevus社との新しい契約では、アラガンがトロスピウムのアメリカでの製造、マーケティングを完全に引き継ぐことになった[13]。2007年8月13日、FDAは、トロスピウムの徐放剤である「SANCTURA XR」を承認した[14] 。
開発
[編集]2007年にIndevus社はCOPDの治療法として吸入型のトロスピウムを開発し、臨床試験を行った[15]。
2023年現在、キサノメリンとトロスピウムの合剤であるKarXTが統合失調症の治療薬としてアメリカで第3相臨床試験中である[16]。
出典
[編集]- ^ a b c “Regurin XL 60mg”. UK eMC (3 July 2015). 2023年12月17日閲覧。
- ^ (英語) Analogue-based Drug Discovery. John Wiley & Sons. (2006). p. 446. ISBN 9783527607495
- ^ “Trospium chloride treatment of overactive bladder”. Ann Pharmacother 43 (2): 283–95. (February 2009). doi:10.1345/aph.1L160. PMID 19193592.
- ^ a b FDA “Trospium chloride label”. U.S. Food and Drug Administration (January 2011). 2023年12月17日閲覧。
- ^ US 6974820 which cites US 3480626 and “[On azoniaspire-compounds. 2. Preparation of esterified azoniaspire-compounds of nortropan-3-alpha- or 3-beta-ol (1)]”. Arzneimittelforschung 17 (6): 719–26. (1967). PMID 5632538.
- ^ DE patent 1194422, Bertholdt H, Pfleger R, Schulz W, "[Verfahren zur Herstellung von Azoniaspironortropanderivaten] (A process for preparing azonia-spirono-tropane derivatives)", issued 1965-06-10, assigned to Dr. Robert Pfleger Chemische Fabrik GmbH
- ^ “Indevus to apply for new drug status for incontinence drug”. Boston Business Journal (23 September 2002). 2023年12月17日閲覧。
- ^ “A Biotech Phoenix Could Be Rising”. Forbes (25 September 2002). 2023年12月17日閲覧。
- ^ “Indevus Pharmaceuticals, Inc., Formerly Interneuron, to Begin Trading on Nasdaq”. Indevus Press Release (2 April 2002). 2023年12月17日閲覧。
- ^ “Sanctura (trospium chloride)”. CenterWatch. 13 May 2016閲覧。
- ^ “Indevus Announces FDA Approval Of Sanctura”. Indevus Press Release (28 May 2004). 2023年12月17日閲覧。
- ^ “Novartis, P&G enter agreement for OAB drug”. Urology Times (21 July 2005). 2023年12月17日閲覧。
- ^ “Indevus Announces Allergan as New Partner for Sanctura Brand”. Indevus Press Release (19 September 2007). 2023年12月17日閲覧。
- ^ “Indevus' Sanctura XR approved by US FDA”. The Pharma Letter (13 August 2007). 2023年12月17日閲覧。
- ^ “Alkermes, Indevus testing COPD drug”. UPI (25 April 2007). 2023年12月17日閲覧。
- ^ “FDA kicks off review of Karuna’s schizophrenia drug KarXT”. pharmaphorum. pharmaphorum (2023年11月29日). 2023年12月13日閲覧。
