トルバプタン
 不特定の立体化学 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | サムスカ、Samsca |
| Drugs.com | monograph |
| MedlinePlus | a609033 |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 | |
| 薬物動態データ | |
| 生物学的利用能 | 56% |
| 血漿タンパク結合 | 99% |
| 代謝 | Hepatic (CYP3A4-mediated)[1] |
| 半減期 | 12 時間 |
| データベースID | |
| CAS番号 |
150683-30-0 |
| ATCコード | C03XA01 (WHO) |
| PubChem | CID: 216237 |
| IUPHAR/BPS | 2226 |
| ChemSpider |
187438 |
| UNII |
21G72T1950 |
| ChEMBL | CHEMBL344159en:Template:ebicite |
| 別名 | N-{4-[(6R)-9-chloro-6-hydroxy-2-azabicyclo[5.4.0]undeca-8,10,12-triene-2-carbonyl]-3-methyl-phenyl}-2-methyl-benzamide |
| 化学的データ | |
| 化学式 | C26H25ClN2O3 |
| 分子量 | 448.941 g/mol |
| |
トルバプタン(Tolvaptan)は、選択的競合的バソプレシン受容体拮抗薬であり、鬱血性心不全、肝硬変、抗利尿ホルモン不適合分泌症候群(SIADH)による低ナトリウム血症の治療に用いられるほか、常染色体優性多発性嚢胞腎の腎容積増加抑制や腎機能低下抑制に用いられる。商品名サムスカ、大塚製薬製造販売。開発コードOPC-41061。2022年6月からは大塚製薬以外の各社による後発医薬品(ジェネリック)も薬価収載されている[2]。
効能・効果
[編集]2010年10月に厚生労働省に「ループ利尿薬等の他の利尿薬で効果不充分な心不全における体液貯留」について承認[3]された後、2013年9月に「肝硬変における体液貯留」について[4]、2014年3月に「腎容積が既に増大しており、かつ、腎容積の増大速度が速い常染色体優性多発性嚢胞腎(ADPKD)の進行抑制」について[5]それぞれ追加承認を取得した。
米国では、2009年5月に低ナトリウム血症について承認された[6]後、多発性嚢胞腎について優先審査品目に指定されている[7]。
カナダでは2015年2月、ADPKDの治療薬としての使用が承認された[8]。同月、欧州で欧州医薬品委員会がADPKDの治療薬としての承認を勧告し[9]、5月に欧州委員会が承認した[10]。
臨床試験
[編集]2004年の臨床試験で、低血圧や低カリウム血症のない心不全患者に対して従来の利尿薬と併用された場合に、トルバプタンは水分の排出を増加させ、血中ナトリウム濃度を改善し、腎機能障害を起こさないことが示された[11]。2012年に公表された臨床試験(TEMPO 3:4 ClinicalTrials.gov登録番号:NCT00428948)の結果、主要評価項目ならびに副次的評価項目が達成された。トルバプタンを平均1日投与量95mgで3年以上投与すると、腎容積の増大が偽薬と比べて50%抑制(ト群:2.80%/年、偽群:5.51%/年、p<0.001)され、腎機能低下が約30%抑えられた(クレアチニン低下量 ト群:2.61mg/mL/年、偽群:3.81mg/mL/年、p<0.001)[12]。
禁忌
[編集]トルバプタンは以下の患者には禁忌である[13]。
- トルバプタンまたは類似化合物に過敏症の既往のある患者
- 無尿の患者(心不全または肝硬変患者に用いる場合)
- 口渇を感じない患者
- 水分摂取が困難な患者
- 高ナトリウム血症の患者
- 重篤な腎機能障害(eGFR 15mL/min/1.73m2未満)のある患者(嚢胞腎患者に用いる場合)
- 慢性肝炎、薬剤性肝機能障害等の肝機能障害(嚢胞腎患者に用いる場合)
- 適切な水分補給が困難な肝性脳症の患者(心不全または肝硬変患者に用いる場合)
- 妊婦または妊娠している可能性のある婦人
副作用
[編集]添付文書に記載されている重大な副作用は、腎不全、血栓塞栓症、高ナトリウム血症、肝機能障害、ショック、アナフィラキシー、過度の血圧低下、心室細動、心室頻拍、肝性脳症、汎血球減少、血小板減少である。
米国FDAはトルバプタンに肝毒性があり肝機能障害を引き起こす可能性があるとして、トルバプタンを30日間を超えて投与すべきでないこと、および肝障害のある患者に投与すべきでないことを決定した[14]。
合成経路
[編集]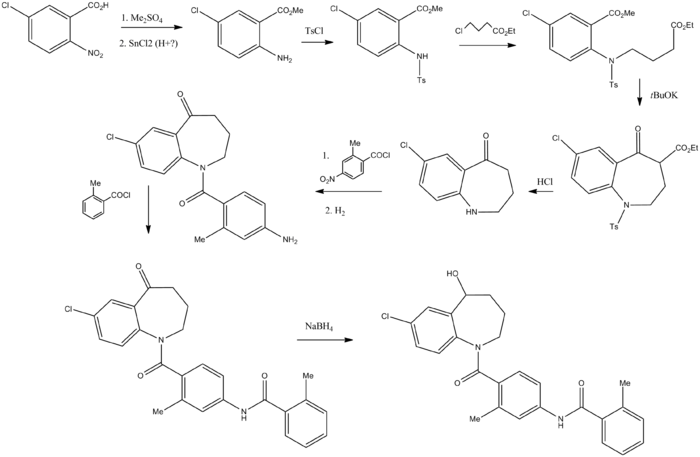
立体化学
[編集]トルバプタンは、ラセミ体、すなわち、以下の2つのエナンチオマーの1:1混合物である:[16]
| エナンチオマーの トルバプタン | |
|---|---|
 CAS-Number: 331947-66-1 |
 CAS-Number: 331947-44-5 |
出典
[編集]- ^ Shoaf S, Elizari M, Wang Z, et al. (2005). “Tolvaptan administration does not affect steady state amiodarone concentrations in patients with cardiac arrhythmias”. J Cardiovasc Pharmacol Ther 10 (3): 165–71. doi:10.1177/107424840501000304. PMID 16211205.
- ^ 「フェブリク」「サムスカ」など12成分に初の後発品―17日に薬価収載 - AnswersNews 2022年6月16日
- ^ “電解質排泄の増加を伴わず水分のみ排泄する作用を持つバソプレシンV2-受容体拮抗剤「サムスカ錠15mg」製造販売承認取得”. 大塚製薬 (2010年10月27日). 2015年3月4日閲覧。
- ^ “水利尿薬「サムスカ錠7.5mg」が世界で初めて「肝硬変における体液貯留」の追加効能を承認取得”. 大塚製薬 (2013年9月17日). 2015年3月4日閲覧。
- ^ “大塚製薬創製の「サムスカ」腎臓の希少疾病ADPKDの世界初の治療薬として日本で承認”. 大塚製薬 (2014年3月24日). 2015年3月4日閲覧。
- ^ “FDA Approves Samsca to Treat Hyponatremia”. FDA (2009年5月22日). 2015年3月4日閲覧。
- ^ Otsuka Maryland Research Institute, Inc.
- ^ “欧州初、ADPKD(常染色体優性多発性のう胞腎)治療薬として欧州医薬品委員会が「トルバプタン」の承認勧告”. 大塚製薬 (2015年2月27日). 2015年3月4日閲覧。
- ^ “ADPKDに対する初の治療薬「JINARC™」(ジンアーク)、カナダで承認”. 大塚製薬 (2015年2月27日). 2015年3月4日閲覧。
- ^ “大塚製薬創製「JINARC」(ジンアーク)欧州初となるADPKD治療薬の販売承認を取得”. 大塚製薬 (2015年5月28日). 2015年5月31日閲覧。
- ^ Gheorghiade M, Gattis W, O'Connor C, et al. (2004). “Effects of tolvaptan, a vasopressin antagonist, in patients hospitalized with worsening heart failure: a randomized controlled trial”. JAMA 291 (16): 1963–71. doi:10.1001/jama.291.16.1963. PMID 15113814.
- ^ (2012) Tolvaptan in Patients with Autosomal Dominant Polycystic Kidney Disease
- ^ “サムスカ錠7.5mg/サムスカ錠15mg/サムスカ錠30mg 添付文書” (2015年1月). 2015年3月4日閲覧。
- ^ "U.S. Food and Drug Administration." Samsca (Tolvaptan): Drug Safety Communication. N.p., 30 Apr. 2013. Web. 1 June 2014. <http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm350185.htm>
- ^ Kondo, K.; Ogawa, H.; Yamashita, H.; Miyamoto, H.; Tanaka, M.; Nakaya, K.; Kitano, K.; Yamamura, Y. et al. (1999). “7-Chloro-5-hydroxy-1-[2-methyl-4-(2-methylbenzoylamino)benzoyl]-2,3,4,5-tetrahydro-1H-1-benzazepine (OPC-41061): A potent, orally active nonpeptide arginine vasopressin V2 receptor antagonist”. Bioorganic & Medicinal Chemistry 7 (8): 1743. doi:10.1016/S0968-0896(99)00101-7.
- ^ Rote Liste Service GmbH (Hrsg.): Rote Liste 2017 - Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte). Rote Liste Service GmbH, Frankfurt/Main, 2017, Aufl. 57, ISBN 978-3-946057-10-9, S. 222.
- Gheorghiade M, Niazi I, Ouyang J et al. (2003). “Vasopressin V2-receptor blockade with tolvaptan in patients with chronic heart failure: results from a double-blind, randomized trial”. Circulation 107 (21): 2690–6. doi:10.1161/01.CIR.0000070422.41439.04. PMID 12742979.
