シャープレス酸化
シャープレス酸化(シャープレスさんか、英: Sharpless oxidation)とは、遷移金属触媒を使用してヒドロペルオキシドによりアリルアルコール誘導体の二重結合をエポキシ化する化学反応のことである。
1973年にバリー・シャープレスらによって報告された反応である。触媒としてはバナジウムやモリブデンのアセチルアセトナート錯体を使用し、ヒドロペルオキシドには tert-ブチルヒドロペルオキシド (TBHP) が使用される。ホモアリルアルコールやビスホモアリルアルコールも反応性は低いがエポキシ化される。2級アリルアルコールにこの反応を適用した場合の立体選択性は、ヒドロキシル基を含む置換基に対して二重結合のシスの位置に置換基が無い場合には普通エリトロ型が優先し、シスの位置に置換基がある場合には普通トレオ型が優先する。しかしこれは用いる触媒によっても変化する。
香月・シャープレス不斉エポキシ化
[編集]香月・シャープレス不斉エポキシ化(かつき・シャープレスふせいエポキシか、Katsuki-Sharpless asymmetric epoxidation)は、1980年に香月勗とバリー・シャープレスによって報告されたアリルアルコールの不斉エポキシ化法である[1][2] 。2001年にシャープレスはこの反応とシャープレス不斉ジヒドロキシ化の開発によってノーベル化学賞を受賞した。
チタンテトラアルコキシドと酒石酸ジアルキルから調製した錯体を使用する。発表された当初はこの錯体は当量で必要であったが、後にモレキュラーシーブスを共存させると触媒量で済むことが発見され、より実用性が増した。
Martijn Patistによると香月・シャープレスエポキシ化の成功は5つの主な理由による[3]。まず、エポキシドはジオールやアミノアルコール、エーテルに容易に変化でき、したがってキラルなエポキシドの形成は天然物の合成において非常に重要な工程である。2つ目に、香月・シャープレスエポキシ化は多くの1級および2級アリルアルコールと反応する。3つ目に、香月・シャープレスエポキシ化の生成物は高い頻度で90%を超えるエナンチオマー過剰率を持つ。4つ目に、香月・シャープレスエポキシ化の生成物はDebbie van Bastenによって発見されたモデルを用いて予測可能である。最後に、香月・シャープレスエポキシ化の反応剤は市販されており、比較的安価である。
触媒構造
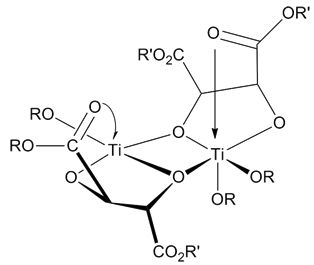
[編集]触媒の構造は不確かである。にもかかわらず、全ての研究は触媒が [Ti(tartrate)(OR)2] の二量体であると結論付けている。推定触媒構造は、香月・シャープレスエポキシ化を触媒するために必要な構造要素を持つモデル錯体のX線構造決定を用いて決定された[4]。
選択性
[編集]香月・シャープレスエポキシ化の生成物のキラリティーは以下の記憶術によって予測できることがある。基質のアリルアルコールを二重結合が南北の方向に、ヒドロキシル基を含む置換基が南東側(右下)になるようにおく。この向きでは、酒石酸ジアルキルのD体((−)体、(2S,3S)体)を使用すると二重結合の手前側からエポキシ化が起こる。L体((+)体、(2R,3R)体)を使用すると二重結合の奥側からエポキシ化が起こる。このモデルはオレフィン置換基によらず妥当であるように見える。R1基がより大きな場合は選択性が低下するが、R2基およびR3基が大きな場合は上昇する。ヒドロキシル基を含む置換基に対して二重結合のシスの位置に置換基がある場合にはエナンチオ選択性が低くなることが多い[1]。

しかしながら、この方法はアリル1,2-ジオールの生成物は誤って予測する[5]。

速度論的光学分割
[編集]香月・シャープレスエポキシ化は2級2,3-エポキシアルコールのラセミ混合物の速度論的光学分割を与えることもできる。それぞれのエナンチオマーにおいてエポキシ化が進行する面への立体障害が異なるため、一方のエナンチオマーだけが優先的にエポキシ化される。そのため、ヒドロペルオキシドを当量以下で使用すれば、反応しにくい方のエナンチオマーだけが未反応のまま回収される。速度論的光学分割過程の収率は原理上50%を超えることができないものの、同反応におけるエナンチオマー過剰率は100%に近付く[6][7]。

合成的有用性
[編集]香月・シャープレスエポキシ化は幅広い1級および2級オレフィン性アルコールに実行可能である。そのうえ、上述した例外はあるが、特定のジアルキル酒石酸エステルはオレフィンの置換基に依存せず同じ面へ優先的に付加する[1]。香月・シャープレスエポキシ化の合成的有用性を実証するため、シャープレスのグループはメチマイシン、エリスロマイシン、ロイコトリエンC-1、(+)-ディスパーリュアといった様々な天然物の合成中間体を作った[8]。

香月・シャープレスエポキシ化の生成物である2,3-エポキシアルコールを扱う多くの方法が開発されている[9]。
香月・シャープレスエポキシ化は様々な炭水化物、テルペン、ロイコトリエン、フェロモン、抗生物質の全合成に用いられている[3]。
このプロトコルの主な欠点は、アリルアルコールの存在が必須な点である。エナンチオ選択的アルケン酸化の別法であるジェイコブセン・香月エポキシ化はこの問題を克服し、より多彩な官能基を許容する。
アリルアルコールのエポキシ化の予備知識
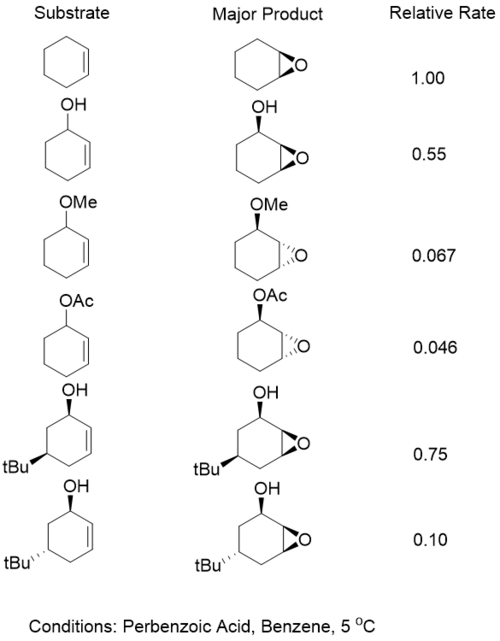
[編集]初期研究はアリルアルコールがmCPBAを酸化剤として用いた時に面選択性を与えることを示した。この選択性はアリルアルコールがアセチル化された時に逆転した。この発見から、選択性において水素結合が重要な役割を果たしているという結論が導かれ、以下の図に示すモデルが提唱された[10]。
環状アリルアルコールでは、アルコールが擬アキシアル位ではなく擬エクアトリアル位に固定された時により高い選択性が見られる[11]。しかしながら、バナジウムに基づくような金属触媒系では反応速度はヒドロキシ基がアキシアル位にある時に34倍加速されることが見出された。擬エクアトリアル位に固定された基質は酸化を受けてエノンを形成することが示された。バナジウム触媒エポキシ化のどちらの場合でも、エポキシ化生成物はsyn-ジアステレオマーに対して極めて高い選択性を示した[12]。
水素結合がない場合は、立体効果によって反対の面へのペルオキシド付加が有利となる。しかしながら、ペルフルオロ過酸は保護されたアルコールと水素結合することができ、過酸上に存在する水素に通常の選択性を与える[13]。
アリルアルコールの存在は立体選択性を上昇させないものの、これらの反応の速度はアルコールを欠いた系よりも遅い。しかしながら、水素結合基を持つ基質の反応速度は同等の保護された基質よりもまだ速い。これらの観測結果は2つの因子のバランスが原因である。一つ目は水素結合が原因である遷移状態の安定化である。2つ目は酸素原子の電子求引性である。この電子求引性によってアルケンから電子密度が離れ、反応性が低下する[14]。
非環状アリルアルコールも同様によい選択性を示す。これらの系では、 A1,2(ビニル基との立体相互作用)およびA1,3ひずみが考慮される。120° の二面角が配向基と水素結合した基質を最も良い方向に向けることが示されている。この幾何配置によってペルオキシドが適切な配置を取ることができ、C-C π軌道からC-O σ*軌道への供与が最小限になる[15]。この供与はアルケンの電子密度を下げ、反応を不活性化する。しかしながら、バナジウム錯体は基質と水素結合せず、代わりにアルコールに配位する。これは、40° の二面角がペルオキシドのσ*軌道の理想的位置を可能にさせることを意味する[16]。
水素結合を持つ系では、必要な幾何配置によってアリル位置換基が厳しいA1,3相互作用を持つが、A1,2ひずみを避けることを余儀なくされるため、A1,3ひずみがより大きな役割を果たす。これによって得られるエポキシドのsyn付加が導かれる。バナジウムの場合は、必要な幾何配置によって厳しいA1,2相互作用が起こるがA1,3相互作用が避けられるため、配向基に対してantiのエポキシドが形成される。バナジウム触媒エポキシ化は、ビニル基の立体的嵩高さに非常に敏感であること示されている[17][18][19]。
ホモアリルアルコールは、水素結合を示す基質での環状系と非環状系の両方のエポキシ化に対して、効果的な配向基である。しかしながら、これらの反応は選択性がより低い傾向を持つ[20][21][22]。
水素結合を持つ基質はアリルアルコールの場合とホモアリルアルコールの場合で同じ種類の選択性を与えるが、バナジウム触媒では逆となる。
Mihelichによって提唱された遷移状態は、これらの反応について、選択性の駆動力が擬いす構造におけるA1,3ひずみの最小化であることを示している。
提唱された遷移状態は、基質がアリルひずみを最小化するような立体配座を取ろうと試みることを示している。このためには、最も嵩高くないR基がR4の位置を取るように回転する[23]。
過酸と金属触媒エポキシ化は非環状系において異なる選択性を示すが、環状系では比較的似た選択性を示す。7員環以下または10員環以上の環状系では、似た選択性のパターンが観測される。しかしながら、中員環(8および9員環)では過酸酸化剤は逆転した選択性を示すのに対して、バナジウム触媒反応はsyn-エポキシドの形成する選択性を維持する[24]。
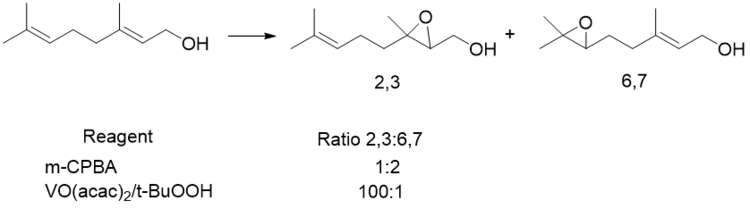
バナジウムはエポキシ化のための最低限の活性を持つ金属触媒であるが、アリル位にアルコールを持つアルケンに対して高い選択性を示す。シャープレスによって行なわれた初期の研究は、より多くの置換基を持ち電子密度が高いアルケンよりもアリル位にアルコールを持つ アルケンが優先して反応することが示されている。この場合、バナジウムはm-CPBAと逆転した位置選択性を示し、モリブデン種よりも高い反応性を示す。バナジウムは一般にその他の金属錯体よりも反応性が低いが、アリル位アルコールが存在する場合は、反応速度は最もエポキシ化の反応性が高い金属であるモリブデンを超えて加速される[25]。
脚注
[編集]- ^ a b c Katsuki, T.; Sharpless, K. B. (1980). “The first practical method for asymmetric epoxidation”. J. Am. Chem. Soc. 102 (18): 5974. doi:10.1021/ja00538a077.
- ^ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. (1985). "Enantioselective Epoxidation of Allylic Alcohols: (2S,3S)-3-Propyloxiranemethanol". Organic Syntheses (英語). 63: 66. doi:10.15227/orgsyn.063.0066。; Collective Volume, vol. 7, p. 461
- ^ a b Uetikon, C. F. (1986). Synthesis (Stuttgart): 88–116.
- ^ Finn, M. G.; Sharpless, K. B. (1991). “Mechanism of asymmetric epoxidation. 2. Catalyst structure”. J. Am. Chem. Soc. 113: 113–126. doi:10.1021/ja00001a019.
- ^ Takano, S.; Iwabuchi, Y.; Ogasawara, K. (1991). “Inversion of enantioselectivity in the kinetic resolution mode of the Katsuki-Sharpless asymmetric epoxidation reaction”. J. Am. Chem. Soc. 113 (7): 2786–2787. doi:10.1021/ja00007a082.
- ^ Kitano, Y.; Matsumoto, T.; Sato, F. (1988). “A highly efficient kinetic resolution of γ- and β- trimethylsilyl secondary allylic alcohols by the sharpless asymmetric epoxidation”. Tetrahedron 44 (13): 4073–4086. doi:10.1016/S0040-4020(01)86657-6.
- ^ Martin, V.; Woodard, S.; Katsuki, T.; Yamada, Y.; Ikeda, M.; Sharpless, K. B. (1981). “Kinetic resolution of racemic allylic alcohols by enantioselective epoxidation. A route to substances of absolute enantiomeric purity?”. J. Am. Chem. Soc. 103 (20): 6237–6240. doi:10.1021/ja00410a053.
- ^ Rossiter, B.; Katsuki, T.; Sharpless, K. B. (1981). “Asymmetric epoxidation provides shortest routes to four chiral epoxy alcohols which are key intermediates in syntheses of methymycin, erythromycin, leukotriene C-1, and disparlure”. J. Am. Chem. Soc. 103 (2): 464–465. doi:10.1021/ja00392a038.
- ^ Sharpless, K. B.; Behrens, C. H.; Katsuki, T.; Lee, A. W. M.; Martin, V. S.; Takatani, M.; Viti, S.M.; Walker, F. J. et al. (1983). “Stereo and regioselective openings of chiral 2,3-epoxy alcohols. Versatile routes to optically pure natural products and drugs. Unusual kinetic resolutions”. Pure Appl. Chem. 55 (4): 589. doi:10.1351/pac198855040589.
- ^ Henbest, H. B.; Wilson, R. A. L. (1957). “376. Aspects of stereochemistry. Part I. Stereospecificity in formation of epoxides from cyclic allylic alcohols”. J. Che. Soc.: 1958. doi:10.1039/jr9570001958.
- ^ Chamberlain, P.; Roberts, M. L.; Whitham, G. H. (1970). “Epoxidation of allylic alcohols with peroxy-acids. Attempts to define transition state geometry”. J. Chem. Soc. B: 1374. doi:10.1039/j29700001374.
- ^ Weyerstahl, Peter; Marschall-Weyerstahl, Helga; Penninger, Josef; Walther, Lutz (1987). “Terpenes and terpene derivatives-22”. Tetrahedron 43 (22): 5287–5298. doi:10.1016/S0040-4020(01)87705-X.
- ^ McKittrick, Brian A.; Ganem, Bruce (1985). “Syn-stereoselective epoxidation of allylic ethers using CF3CO3H”. Tetrahedron Lett. 26 (40): 4895–4898. doi:10.1016/S0040-4039(00)94979-7. ISSN 00404039.
- ^ Hoveyda, Amir H.; Evans, David A.; Fu, Gregory C. (1993). “Substrate-directable chemical reactions”. Chem. Rev. 93 (4): 1307–1370. doi:10.1021/cr00020a002.
- ^ Houk, K.; Paddon-Row, M.; Rondan, N.; Wu, Y.; Brown, F.; Spellmeyer, D.; Metz, J.; Li, Y et al. (1986). “Theory and modeling of stereoselective organic reactions”. Science 231 (4742): 1108–1117. doi:10.1126/science.3945819.
- ^ Adam, Waldemar; Wirth, Thomas (1999). “Hydroxy Group Directivity in the Epoxidation of Chiral Allylic Alcohols: Control of Diastereoselectivity through Allylic Strain and Hydrogen Bonding”. Acc. Chem. Res. 32 (8): 703–710. doi:10.1021/ar9800845. ISSN 0001-4842.
- ^ Mihelich, Edward D. (1979). “Vanadium-catalyzed epoxidations. I. A new selectivity pattern for acyclic allylic alcohols”. Tetrahedron Lett. 20 (49): 4729–4732. doi:10.1016/S0040-4039(01)86695-8.
- ^ Rossiter, B.E.; Verhoeven, T.R.; Sharpless, K.B. (1979). “Stereoselective epoxidation of acyclic allylic alcohols. A correction of our previous work”. Tetrahedron Lett. 20 (49): 4733–4736. doi:10.1016/S0040-4039(01)86696-X.
- ^ Narula, Acharan S. (1982). “Stereoselective introduction of chiral centres in acylic precursors: a probe into the transition state for V5+-catalyzed t-butylhydroperoxide (TBHP) epoxidation of acyclic allylic alcohols and its synthetic implications”. Tetrahedron Lett. 23 (52): 5579–5582. doi:10.1016/S0040-4039(00)85899-2.
- ^ Darby, A. C.; Henbest, H. B.; McClenaghan I. (1962). Chem. Ind. (London): 462-463.
- ^ Cragg, G. M. L.; Meakins, G. D. (1965). “366. Steroids of unnatural configuration. Part IX. Oxidation of 9α-lumisterol (pyrocalciferol) and 9β-ergosterol (isopyrocalciferol) with perbenzoic acid”. J. Chem. Soc. 0 (0): 2054–2063. doi:10.1039/JR9650002054.
- ^ Johnson, Mark R.; Kishi, Yoshito (1979). “Cooperative effect by a hydroxy and ether oxygen in epoxidation with a peracid”. Tetrahedron Lett. 20 (45): 4347–4350. doi:10.1016/S0040-4039(01)86585-0.
- ^ Mihelich, Edward D.; Daniels, Karen; Eickhoff, David J. (1981). “Vanadium-catalyzed epoxidations. 2. Highly stereoselective epoxidations of acyclic homoallylic alcohols predicted by a detailed transition-state model”. J. Am. Chem. Soc. 103 (25): 7690–7692. doi:10.1021/ja00415a067.
- ^ Itoh, Takashi; Jitsukawa, Koichiro; Kaneda, Kiyotomi; Teranishi, Shiichiro (1979). “Vanadium-catalyzed epoxidation of cyclic allylic alcohols. Stereoselectivity and stereocontrol mechanism”. J. Am. Chem. Soc. 101 (1): 159–169. doi:10.1021/ja00495a027.
- ^ Sharpless, K. B.; Michaelson, R. C. (1973). “High stereo- and regioselectivities in the transition metal catalyzed epoxidations of olefinic alcohols by tert-butyl hydroperoxide”. J. Am. Chem. Soc. 95 (18): 6136–6137. doi:10.1021/ja00799a061.
関連項目
[編集]外部リンク
[編集]- 香月 勗「香月-シ ャープレス酸化反応の開発裏話」『有機合成化学協会誌』第49巻第4号、1991年、340-345頁、doi:10.5059/yukigoseikyokaishi.49.340。