グリシン
| グリシン[1] | |
|---|---|

|

|

|

|
Glycine | |
別称 Aminoethanoic acid Aminoacetic acid | |
| 識別情報 | |
| 略称 | Gly, G |
| CAS登録番号 | 56-40-6 |
| PubChem | 750 |
| ChemSpider | 730 |
| UNII | TE7660XO1C |
| EC番号 | 200-272-2 |
| E番号 | E640 (調味料) |
| KEGG | C00037 |
| ChEMBL | CHEMBL773 |
| 727 | |
| |
| |
| 特性 | |
| 化学式 | C2H5NO2 |
| モル質量 | 75.07 g mol−1 |
| 示性式 | H2NCH2COOH |
| 外観 | 白色の固体 |
| 密度 | 1.1607 g/cm3 |
| 融点 |
233 °C (分解) |
| 水への溶解度 | 25 g/100 mL |
| 溶解度 | エタノール、ピリジンに可溶。エーテルには不溶。 |
| 酸解離定数 pKa | 2.34 (カルボキシル基), 9.6 (アミノ基)[2] |
| 危険性 | |
| 半数致死量 LD50 | 2600 mg/kg (マウス;経口) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |

グリシン(英: glycine)とは、2-アミノ酢酸の事であり、地球生物のDNAに規定されている20種類のアミノ酸の中の1つでもある。アミノ酸の構造の側鎖が –H で不斉炭素を持たないため、生体を構成する α-アミノ酸の中では唯一、 D-, L- の立体異性体が無い。非極性側鎖アミノ酸に分類される。
多くの種類のタンパク質ではグリシンはわずかしか含まれていないが、ゼラチンやエラスチンといった、動物性タンパク質のうちコラーゲンと呼ばれるものに多く(全体の3分の1くらい)含まれる。
1820年にフランス人化学者アンリ・ブラコノーによりゼラチンから単離された。 甘かったことからギリシャ語で甘いを意味する glykys に因んで glycocoll と名付けられ、後に glycine に改名された。
生合成・代謝
[編集]グリシンは糖原性アミノ酸の1つである。
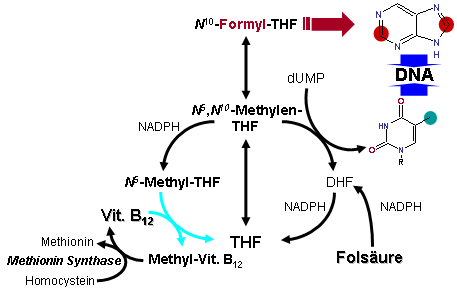
グリシン開裂系はテトラヒドロ葉酸により以下の反応でグリシンを開裂する[3]。
- テトラヒドロ葉酸 + グリシン + NAD+ = 5,10-メチレンテトラヒドロ葉酸+ NH3 + CO2 + NADH + H+
グリシン開裂系とは別に、グリシンヒドロキシメチルトランスフェラーゼ(セリンヒドロキシメチルトランスフェラーゼ)(EC 2.1.2.1)の働きにより、可逆的にグリシンをL-セリンに相互に変換し、5,10-メチレンテトラヒドロ葉酸をテトラヒドロ葉酸に変換する反応が触媒される[4][5]。
- 5,10-メチレンテトラヒドロ葉酸+ グリシン + H2O = テトラヒドロ葉酸 + L-セリン [6]
グリシン開裂系とセリンヒドロキシメチルトランスフェラーゼによる2つの反応を複合すると以下の反応式が示される。また、その全容は図の通りである。
- 2 グリシン セリン
グリシンが仮に脱アミノ化を受けるとグリコール酸が生成し、酸化を受けるとグリオキシル酸が生成するが、グリオキシル酸はヒトではエチレングリコールからシュウ酸に代謝される際の中間体で、酸化を受けると有害なシュウ酸が生成される[7][8]。その反応を回避する観点から、グリシンの代謝は重要な意義がある。
生体内での利用
[編集]グリシンは様々な生体物質の原料として利用されている。一部を以下に示す。
- コラーゲン
- コラーゲンタンパク質のペプチド鎖を構成するアミノ酸は、
―(グリシン)―(アミノ酸X)―(アミノ酸Y)―と、グリシンが3残基ごとに繰り返す一次構造を有する。この配列は、コラーゲン様配列と呼ばれ、コラーゲンタンパク質の特徴である。 - ポルフィリン
- 動物においてはグリシンおよびスクシニルCoAからアミノレブリン酸合成酵素(EC 2.3.1.37)の作用でアミノレブリン酸が合成され、これを原料にポルフィリンが合成され、ヘムとして利用される。
- グルタチオン
- グルタチオンはグルタミン酸、システイン、グリシンが、この順番でペプチド結合したトリペプチドである。生体内で抗酸化物質として機能する。
- クレアチン
- アルギニンとグリシンから、グリシンアミジノトランスフェラーゼ (EC 2.1.4.1)、グアニジノ酢酸-N-メチルトランスフェラーゼ (EC 2.1.1.2)、クレアチンキナーゼ (EC 2.7.3.2) の作用により、クレアチンリン酸として合成される。この反応は腎臓と肝臓にて行われる。クレアチンは、筋肉中に存在しエネルギー源として貯蔵される。
- プリン体の原料
- グリシン開裂系により生成された5,10-メチレンテトラヒドロ葉酸から10-ホルミルテトラヒドロ葉酸が生成され、DNAであるアデニンやグアニンのプリン体の生合成で2個所のホルミル化の反応に関わっている。→詳細は「10-ホルミルテトラヒドロ葉酸」を参照
- ヘムの原料
- ヘムは、ヘモグロビンの構成要素の1つである。ポルフィリンとヘムの生合成の律速酵素は、グリシンとスクシニルCoAがδ-アミノレブリン酸へ縮合することを媒介するアミノレブリン酸シンターゼ(アミノレブリン酸合成酵素、Aminolevulinic acid synthase、EC 2.3.1.37)である。アミノレブリン酸シンターゼは、ミトコンドリア内に所在する。アミノレブリン酸の生成がヘム合成の第1段階の反応である[9]。
物性
[編集]- 分子量 75.07
- 等電点 5.97
- 溶解性 水・蟻酸に易溶、エタノールに不溶
- 溶解度(水、g/100g)22.5 (20℃)、33.2 (40℃)、45.3 (60℃)
- ファンデルワールス半径 48
- 味甘(閾値 1.1 mg/ml)
神経伝達物質と高グリシン血症
[編集]中枢神経系においてグリシンはGABAに次いで重要な抑制性神経伝達物質である。今のところグリシンの受容体として知られているものは全てイオンチャネル型であり、グリシンが結合すると内蔵しているCl−チャネルの透過性が増えてCl−が細胞内に流れ込み抑制性シナプス後電位(IPSP)を発生させる。痙攣誘発剤であるストリキニーネはグリシン受容体に対する特異的な阻害薬である。一方で、興奮性神経伝達物質としての役割も知られている。グリシンはNMDA受容体に存在するグリシン結合部位に作用し、チャネルの開口を補助する。グリシン受容体に対しては約100uM, NMDA受容体に対しては約100nM~1uMのED50を示すとされている。
葉酸の触媒過程の全容において、平衡がテトラヒドロ葉酸側に偏っており、テトラヒドロ葉酸から5,10-メチレンテトラヒドロ葉酸を供給するグリシン開裂系は葉酸系の代謝過程で重要な役割を果たしている。
高グリシン血症
[編集]高グリシン血症は、脳や肝臓に存在するグリシン開裂系の酵素の遺伝的な欠損により、体液中や脳にグリシンが大量に蓄積することにより発症する先天性アミノ酸代謝異常症の一つである。グリシンは中枢神経系で神経伝達物質として働くため、グリシン蓄積が重篤な神経障害をもたらす[10]。
工業的な製造と利用
[編集]工業的な製造方法では、ホルムアルデヒドとシアン化水素とアンモニアからアミノアセトニトリル(グリシノニトリル)を合成し、これを水酸化ナトリウム等で加水分解してグリシンの金属塩を製造した後、硫酸等の酸で中和するストレッカー法、ホルムアルデヒドとシアン化水素からグリコロニトリルを合成し、これとアンモニアと二酸化炭素とを水の存在下にて反応させることによりヒダントインを製造した後、加水分解により製造するヒダントイン法が知られている[11]。静菌作用があり、日持ち向上剤に使われるほか[12]、ブロイラーの生産性向上を目的とした飼料添加物[13]、グリシンを主成分として睡眠の改善効果を謳った機能性表示食品も市販されている[14]。
メチオニン削減・長寿効果
[編集]グリシンは、肝臓に含まれる転移酵素のグリシン-N-メチルトランスフェラーゼ (GNMT) によってS-アデノシル-L-メチオニン (SAM) を分解する。そのため、メチオニン過剰障害の緩和に使うことができ[15][16][17]、家畜への応用が研究されている[15][16]。
また、動物実験の結果、短命の原因はメチオニンにあると見られており[18][19][17]、その分解を補助するグリシンに長寿効果のある可能性がある[17]。また、グリシンは、前立腺癌、乳癌、結腸直腸の発生率と正の相関関係にあるIGF-1[20]の値を下げるという動物実験の結果がある[17]。
出典
[編集]- ^ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (11th ed.), Merck, (1989), ISBN 091191028X, 4386.
- ^ Dawson, R.M.C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ^ 菊地 吾郎「 グリシン開裂反応の機構と生理的意義, 特に高グリシン血症との関連 」 『日本医科大学雑誌』1993年 60 巻 6 号 369-374 doi:10.1272/jnms1923.60.369
- ^ Appaji Rao N, Ambili M, Jala VR, Subramanya HS, Savithri HS (April 2003). “Structure-function relationship in serine hydroxymethyltransferase”. Biochim. Biophys. Acta 1647 (1-2): 24-9. PMID 12686103.
- ^ Stover P, Schirch V (August 1990). “Serine hydroxymethyltransferase catalyzes the hydrolysis of 5,10-methenyltetrahydrofolate to 5-formyltetrahydrofolate”. J. Biol. Chem. 265 (24): 14227-33. PMID 2201683.
- ^ http://www.genome.jp/dbget-bin/www_bget?enzyme+2.1.2.1
- ^ 山口千美, 小川由英, 諸角誠人, 田中徹, 北川龍一「実験的蓚酸カルシウム結石症におけるリンゴ酸塩コハク酸塩および重炭酸塩の結石形成抑制に関する研究」『日本泌尿器科學會雑誌』第78巻第2号、日本泌尿器科学会、1987年、311-318頁、doi:10.5980/jpnjurol1928.78.2_311。
- ^ Carney, Edward W (1994). “An integrated perspective on the developmental toxicity of ethylene glycol”. Reproductive toxicology (Elsevier) 8 (2): 99-113. doi:10.1016/0890-6238(94)90017-5.
- ^ 田村, 藍、安, 然、大西, 裕子、石川, 智久「ポルフィリン生合成とヘム代謝におけるヒトABCトランスポーターの役割」『日本薬理学雑誌』第130巻第4号、2007年、270–274頁、doi:10.1254/fpj.130.270、ISSN 0015-5691。
- ^ 高グリシン血症 (難病情報センター)
- ^ アミノ酸の製造方法(特開2008-74729)
- ^ グリシンの静菌作用(有機合成薬品工業)
- ^ 『グリシンを利用した無薬飼料給与時のブロイラーの生産性の改善』(レポート)。CRID 1690013498978580096。「山梨県畜産試験場 / 畜産酪農技術センター本所及びH29年度以降の長坂支所の研究成果情報を掲載」
- ^ グリナ(味の素)
- ^ a b 上田博史, 横田浩臣, 田先威和夫「ヒナのメチオニン過剰障害に及ぼすグリシンの緩和効果」『日本家禽学会誌』第16巻第3号、1979年、113-120頁、doi:10.2141/jpsa.16.113。
- ^ a b 太田能之, 石橋晃「ブロイラーのメチオニン不足および過剰による成長阻害におよぼす飼料中グリシンの影響」『日本家禽学会誌』第32巻第2号、1995年、81-89頁、doi:10.2141/jpsa.32.81。
- ^ a b c d Dietary glycine supplementation mimics lifespan extension by dietary methionine restriction in Fisher 344 rats The FASEB Journal 2011年
- ^ Amino-acid imbalance explains extension of lifespan by dietary restriction in Drosophila Nature 2009年
- ^ アミノ酸代謝促進で長寿に ~Sアデノシルメチオニン代謝が寿命延長の鍵~ 平成27年9月24日 東京大学、科学技術振興機構 2015年
- ^ Growth factors in milk and dairy products: ANSES publishes its opinion on their impact on the risk of developing cancer フランス食品環境労働衛生安全庁 (ANSES) 2012年5月4日
関連項目
[編集]外部リンク
[編集]- グリシン - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- グリシン - 脳科学辞典 主に神経伝達物質としてのグリシンの機能の解説
- グリシン受容体 - 脳科学辞典



