イオン液体による二酸化炭素回収
イオン液体による二酸化炭素回収(イオンえきたいによるにさんかたんそかいしゅう、英: Ionic liquids in carbon capture)とは、イオン液体を吸収剤として二酸化炭素回収や炭素隔離に応用することである。イオン液体は、室温付近で液体として存在する塩であり、極性で揮発性のない物質であるため、多くの用途が検討されている。また、気候変動の緊急性から、二酸化炭素回収・貯留時のエネルギー関連における利用に関する研究が進められている。
吸収を利用した二酸化炭素回収
[編集]溶媒としてのイオン液体
[編集]アミン類は、二酸化炭素の燃焼後回収技術において、最も一般的な吸収剤である。特に、モノエタノールアミン(MEA)は、二酸化炭素燃焼後回収や天然ガスの「スイートニング」など、他の二酸化炭素分離プロセスにおいて、産業規模で使用されている[1]。しかし、アミンは腐食性があり、時間の経過とともに分解するため、大規模な産業設備が必要である。一方、イオン液体は低い蒸気圧を持っている。この特性は、強いクーロン引力によるものである。蒸気圧は、物質の熱分解点(通常、300 ℃以上)まで低いままである[2]。原則として、この低い蒸気圧はそれらの使用を単純化するため、「グリーン」な代替手段となる。また、これにより、二酸化炭素ガス流の汚染や環境への漏洩リスクも低減する[3]。
二酸化炭素の、イオン液体への溶解度は、主にアニオンによって支配され、カチオンの影響はそれほど大きくない[4]。また、ヘキサフルオロリン酸塩(PF−
6)およびテトラフルオロホウ酸塩(BF−
4)は、特に二酸化炭素の回収に適していることが示されている[4]。
イオン液体は、さまざまな液液抽出プロセスの溶媒として検討されてきたが、商品化されることはなかった[5]。一方、イオン液体は、気体の吸収や抽出蒸留などの産業において、従来の揮発性溶媒の代替品として使用されている。さらに、イオン液体は、水性二相系の生成や生体分子の精製のための共溶媒としても使用されている。
プロセス
[編集]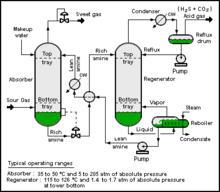
代表的な二酸化炭素回収プロセスは、供給ガス、吸収塔、放散塔、大気と隔離するための、高濃度二酸化炭素ガス流の出力部、および大気に放出するための、低濃度二酸化炭素ガス流の出力部から構成される。イオン液体を用いたプロセスは、二酸化炭素が高温で放散塔で再生されるアミンガス処理と同様のプロセス使用する可能性がある。ただし、イオン液体は、圧力変動や不活性ガスを使用して二酸化炭素を剥離できるため、プロセスの必要エネルギー量を削減できる[3]。
イオン液体による二酸化炭素回収に関する現在の課題は、アミンよりも作業能率が低いことである。そこで、化学吸着や物理吸着を利用した特異的なイオン液体が開発され、作業能率を向上させる試みが行われている。これらの例としては、1-ブチル-3-プロピルアミンイミダゾリウムテトラフルオロホウ酸が挙げられる[2]。
不利な点
[編集]選択性
[編集]二酸化炭素回収において、効果的な吸収剤は、二酸化炭素が他の気体成分よりも優先的に吸収剤に溶解し、高い選択性を示すものである。燃焼後二酸化炭素回収では、最も顕著な分離は二酸化炭素と窒素であるが、予燃焼分離では、一酸化炭素は主に水素から分離される。また、煙道ガスには、炭化水素、二酸化硫黄、硫化水素など、他の成分や不純物がなどが含まれる場合がある。したがって、二酸化炭素回収に、適切な溶媒を選択する前に、特定のプロセス条件と煙道ガス組成において、溶媒中で二酸化炭素が他の成分よりもはるかに高い溶解度を維持し、高い選択性を持つことを確認することが重要である。
イオン液体の二酸化炭素の選択性は、研究者によって広く研究されている。一般的に、極性分子や電気四重極モーメントを持つ分子は、液体のイオン性物質中で高い溶解性を示す[6]。高温のプロセス条件では、二酸化炭素の溶解度が低下する一方で、メタンや水素などの他の成分の溶解度は温度の上昇とともに増加するため、溶媒の効果が低下することが判明している。しかし、イオン液体中の窒素の溶解度は比較的低く、温度上昇とともに増加しないため、燃焼後回収におけるイオン液体の使用は、二酸化炭素/窒素選択性が一貫して高いことが適切である[7]。煙道ガスの一般的な不純物である硫化水素の存在は、イオン液体への二酸化炭素の溶解を著しく抑制するため、技術者は、特定の煙道ガスに適した溶媒を選択する際には、慎重に考慮する必要がある[8]。
粘度
[編集]イオン液体を二酸化炭素の吸収に使用する際の主な懸念は、市販の溶媒と比較して粘度が高いことである。化学吸着を利用するイオン液体は、二酸化炭素分離のために、溶質-溶媒間の化学反応に依存している。この反応の反応速度は、二酸化炭素の溶媒内での拡散率に依存するため、粘度と反比例の関係にある。イオン液体中の二酸化炭素の自己拡散率は、一般的に10・10m2/s程であり[9]、二酸化炭素回収に使用される市販の溶媒よりも約1桁小さい。イオン液体の粘度は、アニオンとカチオンの種類、アルキル鎖の長さ、および溶媒中の水やその他の不純物の量に応じて大きく変化する[10][11]。これらの溶媒は「設計」することができ、これらの特性を選択できるため、低粘度のイオン液体を開発することが、現在の研究テーマとなっている。また、担持イオン液体相(SILPs)は、この問題の解決策の一つとして提案されている[5]。
調整可能性
[編集]
全ての分離技術で必要とされるように、イオン液体は混合物の1つまたは複数の相に対して選択性を示す。 ヘキサフルオロリン酸1-ブチル-3-メチルイミダゾリウム(BMIM-PF6)は、液液分離における揮発性有機溶媒の代替として早期に特定された室温のイオン液体である[12]。他の[PF6]および[BF4]を含むイオン液体や、1-エチル-3-メチルイミダゾリウム(EMIM)や、トリヘキシル(テトラデシル)ホスホニウム([P66614])などの、非従来型カチオンを含むイオン液体の二酸化炭素吸収特性についても研究されている[3]。イオン液体での異なるアニオンとカチオンの組み合わせの選択は、それらの選択性や物理的特性に影響を与える。また、イオン液体中の有機カチオンは、鎖長を変えたり、置換基を変えることで「調整」することができる[5]。最後に、イオン液体は、他のイオン液体、水、またはアミンと混合することで、吸収容量や吸収熱などの面で異なる特性を得ることができる。よって、イオン液体は、このような調整可能性から、「デザイナー溶媒」と呼ばれる[13]。
テトラフルオロホウ酸1-ブチル-3-プロピルアミンイミダゾリウムは、二酸化炭素の吸収に特化して開発されたもので、化学吸着を利用して二酸化炭素を吸収し、吸収/再生サイクルを繰り返しても効率を維持するように設計されている[2]。他のイオン液体についても、二酸化炭素吸収剤としての利用のためにシミュレーションされたり実験的に試験されている。
産業への応用
[編集]現在、二酸化炭素回収には、主にエネルギーと溶剤を大量に消費するアミンをベースとした吸収技術が使用されている。化学プロセスにおける揮発性有機化合物のみでも、数十億ドルの産業規模を占めている[12]。したがって、イオン液体は、その他の欠点が解決されれば、魅力的な代替手段になり得る。
二酸化炭素回収プロセスにおいて、アニオンとカチオンは重要な役割を果たす。分光学的な結果から、二酸化炭素分子がアニオンに好適に結合するという好ましい相互作用が示唆されている。さらに、水素結合やファンデルワールス結合、静電引力などの分子間力が、イオン液体への二酸化炭素の溶解度に寄与している。このため、イオン液体は二酸化炭素の溶解度を、規則溶解度理論(RST)によって正確にモデル化できるため、より高度なモデルを開発するためのコストを削減できる。
日本の状況
[編集]日本では、産業技術総合研究所東北センターで各種の化学プロセスに適応したイオン液体および、それを用いた高効率の化学プロセスの研究開発が行われている[14]。また、ダイセルと共同で、膜にイオン液体を浸透させることで、選択的に二酸化炭素を透過させることができる「イオン液体分離膜」の開発に成功した[15][16]。さらに、中央大学、日本大学、金沢大学、地球環境産業技術研究機構の研究グループにより、電子状態インフォマティクスによるイオン液体の設計、合成および、二酸化炭素溶解度の精密測定が行われ、過去最高の二酸化炭素物理吸収量を持つイオン液体の開発に成功した[17][18]。
脚注
[編集]- ^ Arthur Kohl and Richard Nielson (1997). Gas Purification (5th ed.). Gulf Publishing. ISBN 978-0-88415-220-0
- ^ a b c Bates, Eleanor D.; Mayton, Rebecca D.; Ntai, Ioanna; Davis, James H. (2002). “CO2 Capture by a Task-Specific Ionic Liquid”. Journal of the American Chemical Society 124 (6): 926・927. doi:10.1021/ja017593d. ISSN 0002-7863. PMID 11829599.
- ^ a b c Zhang, Xiangping; Zhang, Xiaochun; Dong, Haifeng; Zhao, Zhijun; Zhang, Suojiang; Huang, Ying (2012). “Carbon capture with ionic liquids: overview and progress”. Energy & Environmental Science 5 (5): 6668. doi:10.1039/c2ee21152a. ISSN 1754-5692.
- ^ a b Ramdin, Mahinder; de Loos, Theo W.; Vlugt, Thijs J.H. (2012). “State-of-the-Art of CO2 Capture with Ionic Liquids”. Industrial & Engineering Chemistry Research 51 (24): 8149・8177. doi:10.1021/ie3003705. ISSN 0888-5885.
- ^ a b c Rodr・guez, H・ctor (2016). Ionic Liquids for Better Separation Processes. Green Chemistry and Sustainable Technology. doi:10.1007/978-3-662-48520-0. ISBN 978-3-662-48518-7. ISSN 2196-6982
- ^ Weingartner, H (2008). “Understanding ionic liquids at the molecular level: facts, problems, and controversies”. Angew. Chem. Int. Ed. 47 (4): 654・670. doi:10.1002/anie.200604951. PMID 17994652.
- ^ Anthony, J. L.; Maginn, E. J.; Brennecke, J. F. (2002). “Solubilities and thermodynamic properties of gases in the ionic liquid 1-n-butyl-3- methylimidazolium hexafluorophosphate.”. J. Phys. Chem. B 106 (29): 7315・7320. doi:10.1021/jp020631a.
- ^ Ramdin, M.; de Loos, T. W.; Vlugt, T. J. H (2012). “State-of-the-Art of CO2 Capture with Ionic Liquids”. Ind. Eng. Chem. Res. 51 (24): 8149・8177. doi:10.1021/ie3003705.
- ^ Maginn, E. J. (2009). “Molecular simulation of ionic liquids: current status and future opportunities”. J. Phys.: Condens. Matter 21 (37): 373101. doi:10.1088/0953-8984/21/37/373101. PMID 21832331.
- ^ Jacquemin, J; Husson, P.; Padua, A. A. H.; Majer, V. (2006). “Density and viscosity of several pure and water-saturated ionic liquids”. Green Chemistry 8 (2): 172・180. doi:10.1039/b513231b.
- ^ Gardas, R. L.; Coutinho, J. A. P. (2009). “Group contribution methods for the prediction of thermophysical and transport properties of ionic liquids”. AIChE J. 55 (5): 1274・1290. doi:10.1002/aic.11737.
- ^ a b Huddleston, Jonathan G.; Willauer, Heather D.; Swatloski, Richard P.; Visser, Ann E.; Rogers, Robin D. (1998). “Room temperature ionic liquids as novel media for 'clean' liquid・liquid extraction”. Chem. Commun. (16): 1765・1766. doi:10.1039/A803999B. ISSN 1359-7345.
- ^ Freemantle, Michael (1998). “Designer Solvents”. Chemical & Engineering News 76 (13): 32・37. doi:10.1021/cen-v076n013.p032. ISSN 0009-2347.
- ^ “イオン液体でCO2をはじめ各種のガスを吸収・分離”. 産総研マガジン (2019年9月30日). 2024年3月29日閲覧。
- ^ “産総研とダイセルが開発、大気中のCO2を回収する「イオン液体分離膜」の仕組み”. ニュースイッチ (2022年11月18日). 2024年3月29日閲覧。
- ^ “産総研とダイセルが挑むカーボンニュートラル実現!”. 産総研マガジン (2024年1月31日). 2024年3月29日閲覧。
- ^ “中央大・日大・金沢大など、「過去最高の物理吸収量を持つCO2吸収液(イオン液体)の理論設計とその迅速具現化」に成功”. 日本経済新聞 (2023年2月27日). 2024年3月29日閲覧。
- ^ Kuroki, Nahoko; Suzuki, Yuki; Kodama, Daisuke; Firoz Alam, Chowdhury; Yamada, Hidetaka; Mori, Hirotoshi (9 March 2023). “Machine Learning-Boosted Design of Ionic Liquids for CO2 Absorption and Experimental Verification”. The Journal of Physical Chemistry B 127 (9): 2022・2027. doi:10.1021/acs.jpcb.2c07305.
参考文献
[編集]- Blanchard, Lynnette A.; Hancu, Dan; Beckman, Eric J.; Brennecke, Joan F. (1999). “Green processing using ionic liquids and CO2”. Nature 399 (6731): 28・29. Bibcode: 1999Natur.399...28B. doi:10.1038/19887. ISSN 0028-0836.
- Camper, Dean; Bara, Jason E.; Gin, Douglas L.; Noble, Richard D. (2008). “Room-Temperature Ionic Liquid・Amine Solutions: Tunable Solvents for Efficient and Reversible Capture of CO2”. Industrial & Engineering Chemistry Research 47 (21): 8496・8498. doi:10.1021/ie801002m. ISSN 0888-5885.
