β-ラクトグロブリン
β-ラクトグロブリン (Beta-lactoglobulin) は、牛乳や羊乳に含まれる主要な (~3 g/l) 乳清タンパク質の1つで、他の多くの哺乳類の乳にも含まれる。ただし、ヒトの母乳には含まれない。構造、性質、生物学的役割等について、多くの研究がなされている[1][2][3]。
構造と役割
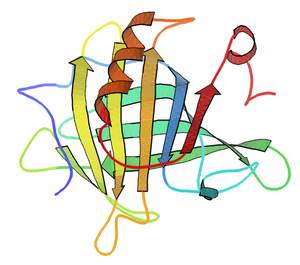
[編集]乳清タンパク質を構成するもう1つの主要なタンパク質であるα-ラクトアルブミンと異なり、β-ラクトグロブリンには明らかな機能は同定されていないが、いくつかの疎水性分子に結合し、輸送の役割を担っていることが示唆されている。いくつかの遺伝的変異体が同定されており、ウシにおける主要なものには、A及びBの符号が付けられている。豊富に存在し、単離も容易なため、生物物理学的な研究に頻繁に用いられる。構造は、X線結晶構造解析や核磁気共鳴(NMR)で何度も決定され、そのうちの1つの構造は右図に示されている。β-ラクトグロブリンの性質は、乳製品の製造に関わるので、食品工業の観点から興味を持たれてきた[4]。
ウシのβ-ラクトグロブリンは、162残基の比較的小さなタンパク質で、分子量は18.4kDaである。生理的状態ではほぼ二量体を形成しているが、pHが約3以下になるとモノマーに解離する。しかし、構造自体はかなり低いpH値になっても元のまま保存されていることがNMRを使って示されている[5]。
β-ラクトグロブリンの溶液は、様々な条件でゲルを形成し、この時は構造が壊れて凝集することができる[6]。低pH、低イオン強度で長時間加熱すると透明なゲルが形成され、この中ではタンパク質分子は、繊維状に凝集している。
このタンパク質のフォールディング中間体が分光や変性剤を用いて研究され、元の構造はβシートであるのに対し、αヘリックスだけでできている興味深い中間体となっていることが示された。恐らくフォールディング過程の凝集を避けるために、進化がヘリックスの中間体を選択したのだと考えられる[7]。
牛乳は、Annex IIIa of Directive 2000/13/ECに記載のあるアレルゲンとして知られ、製造者はβ-ラクトグロブリンの有無を記載しなければならない。食品検査の研究機関は、食品中のβ-ラクトグロブリンの有無や存在量を測定するのに、ELISA法を用いることができる。
出典
[編集]- ^ Hambling, S. G., A. S. McAlpine, and L. Sawyer. 1992. Advanced Dairy Chemistry: 1. Proteins, chapter: Beta-lactoglobulin. Elsevier Applied Science, 141-190.
- ^ Sawyer, L., and G. Kontopidis. 2000. The core lipocalin, bovine beta-lactoglobulin. Biochim Biophys Acta 1482:136-48.
- ^ Kontopidis, G., C. Holt, and L. Sawyer. 2004. Invited review: beta-lactoglobulin: binding properties, structure, and function. J Dairy Sci 87:785-96.
- ^ Jost, R. 1993. Functional characteristics of dairy proteins. Trends in Food Science & Technology 4:283-288.
- ^ Uhrinova, S., M. H. Smith, G. B. Jameson, D. Uhrin, L. Sawyer, and P. N. Barlow. 2000. Structural changes accompanying ph-induced dissociation of the beta-lactoglobulin dimer. Biochemistry 39:3565-74.
- ^ Bromley, E. H. C., M. R. H. Krebs, and A. M. Donald. 2005. Aggregation across the length scales in beta-lactoglobulin. Faraday Discussions. 128:13-27.
- ^ Kuwajima K., Yamaya H. & Sugai S. 1996. The Burst-phase Intermediate in the Refolding of beta-Lactoglobulin Studied by Stopped-flow Circular Dichroism and Absorption Spectroscopy. Journal of Molecular Biology, 264:806-822.
