βシート
βシート(英: β-sheet)は、βプリーツシート(英: β-pleated sheet)とも呼ばれ、正常なタンパク質の二次構造における共通モチーフである。βシートは、βストランド(β-strand、β鎖)が、少なくとも2~3本の骨格水素結合によって横方向に結合して構成され、全体的にねじれたプリーツ(折り目)状シートを形成している。βストランドとは、一般的に3~10アミノ酸長のポリペプチド鎖の区間であり、骨格は伸長したコンフォメーション(立体配座)になっている。このβシートの超分子会合は、アルツハイマー病などのアミロイドーシスで見られるフィブリルやタンパク質凝集体の形成に関与していると考えられている。
歴史
[編集]
a) 正面図。隣接するストランドのペプチドN-H基とC=O基の間の逆平行水素結合(点線)を示している。矢印はストランドの方向を示し、電子密度の等高線は水素以外の原子の輪郭を示している。酸素原子は赤玉、窒素原子は青玉、水素原子は簡略化のために省略している。側鎖は最初の側鎖炭素原子(緑)のみ表示している。
b) aの中央の2本のβストランドを端から見た図。右巻きのねじれと、シートから逆方向に交互に突き出たCαと側鎖のプリーツ(折り目)を示している。
最初のβシート構造は、1930年代にウィリアム・アストベリーによって提案された。彼は、平行または逆平行に伸長したβストランドのペプチド結合間の水素結合というアイデアを提案した。しかし、アストベリーは、正確なモデルを構築するために必要なアミノ酸の結合形状に関するデータを持っておらず、特に、ペプチド結合が平面であることを知らなかった。1951年にライナス・ポーリングとロバート・コリーによって改良版が提案された。このモデルには、ペプチド結合の平面性が組み込まれていた(ケト-エノール互変異性化によるものと彼らが以前に説明したもの)。
構造と配向
[編集]ジオメトリ
[編集]
大半のストランドは、別のストランドに隣接して配列して、一方のストランド骨格のN-H基が隣接するもう一方のストランド骨格のC=O基と水素結合を形成することで、広範な水素結合ネットワークを形成している。完全に伸長したβストランドにおいては、連続した側鎖が真上、次に真下、次に真上などを指す。βシートの中で隣り合うβストランドは、Cα原子が隣り合い、側鎖が同じ方向を向くように配置される。βストランドが「プリーツ」状に見えるのは、Cα原子の四面体化学結合によるものである。たとえば、側鎖が真上を向いている場合、C′の結合角は約109.5°であるため、その結合はわずかに下を向いている必要がある。このプリーツにより、Cα
i と Cα
i + 2 の間の距離は、完全に伸長した2つのトランスペプチドから予想される7.6Å(0.76 nm)ではなく、約6Å(0.60 nm)となる。水素結合したβストランド内の隣接するCα原子間の「横方向」の距離は約5Å(0.50 nm)である。

しかし、βストランドが完全に伸長することはほとんどなく、むしろねじれを示す。エネルギー的に有利とされる (φ, ψ) = (–135°, 135°) 付近の二面角(左図:ラマチャンドランプロットの左上の広い領域)は、完全に伸長したコンフォメーション (φ, ψ) = (–180°, 180°) から大きく乖離(かいり)している[1]。このねじれは、大きなシートに含まれる個々のβストランドがばらばらになるのを防ぐために、二面角の交互の変動に関連することが多い。強くねじれたβヘアピンの好例はタンパク質BPTI(アプロチニン)で見られる。
側鎖はプリーツの折り目から外側に向かってシートの平面に対してほぼ垂直に伸びている。連続したアミノ酸残基はシートの交互の面で外側に向かっている。
水素結合パターン
[編集]ペプチド鎖にはN末端とC末端による方向性があるため、βストランドでも方向性があると言える。それらは通常、タンパク質トポロジー図でC末端を指す矢印で表される。隣接するβストランドは、逆平行、平行、または混合配列で水素結合を形成することができる。
逆平行配列では、連続したβストランドが交互に方向を変え、一方のストランドのN末端が次のストランドのC末端に隣接する。これは、カルボニルとアミンの間のストランド間水素結合が有利な配向である平面になるため、最も強いストランド間安定性を生み出す配置である。ペプチド骨格の二面角(φ, ψ)は、逆平行シートでは約(–140°, 135°)である。この場合、2つの原子 Cα
i と Cα
j が水素結合した2つのβストランドで隣接していれば、互いのペプチド基に2つの共有骨格の水素結合を形成することになる。これは近接ペア水素結合として知られている。
平行配列では、連続するストランドのN末端がすべて同じ方向に向いている。この配列は、ストランド間の水素結合パターンに非平面性が生じるため、わずかに不安定になる可能性がある。平行シートの二面角(φ, ψ)は約(–120°, 115°)である。1つのモチーフの中で、相互作用する平行なストランドが5本以下であることは稀であり、ストランドの数が少ないと不安定になることが示唆されるが、N末端とC末端が整列しているストランドは必然的に非常に離れていなければならないため、平行βシートの形成は基本的に困難である[要出典]。また、小さなアミロイド形成配列は、一般的に、主に平行βシートストランドからなるβシートフィブリルに凝集するように見えることから、平行βシートがより安定している可能性があるという証拠もある。
平行βシート構造では、水素結合している2つのβストランドにおいて、2つの原子 Cα
i と Cα
j が隣接している場合、お互いに水素結合するのではなく、一方の残基が他方の残基を挟むように水素結合を形成する(その逆はない)。たとえば、残基 i は、残基 j − 1 および j + 1 と水素結合を形成することがあり、これはワイドペア水素結合として知られている。一方、残基 j は、異なる残基と水素結合するかもしれないし、まったく結合しないこともある。
平行βシートの水素結合配列は、11個の原子を持つアミドリングモチーフの配列に似ている。
最後に、個々のストランドは混合結合パターンを示すことがあり、これは一方が平行ストランドで他方が逆平行ストランドからなる。このような配列は、ランダムな配向分布が示唆するほど一般的ではなく、このパターンが逆平行配列よりも不安定であることを示唆している。しかし、タンパク質全体には他の構造的特徴が常に多数存在するため、バイオインフォマティクス解析で構造熱力学を引き出すことはどうしても困難である。また、タンパク質は、フォールディング熱力学だけでなく、フォールディング動力学によって本質的に制約を受けるため、バイオインフォマティクス解析から安定性を結論づけるには常に注意が必要である。
βストランドの水素結合は完全である必要はなく、βバルジとして知られる局所的な破壊が見られることがある。
水素結合はシートの平面にほぼ沿っており、ペプチドカルボニル基は連続する残基と交互方向を向いている。これと比較して、αヘリックスでは連続するカルボニル基は同じ方向を向いている。
アミノ酸の傾向
[編集]大きな芳香族残基(チロシン、フェニルアラニン、トリプトファン)やβ分岐アミノ酸(スレオニン、バリン、イソロイシン)は、βシートの中間にあるβストランド内に存在することが有利とされている。βシート内の端部ストランドにはさまざまな種類の残基(プロリンなど)が見られる可能性があるが、これはおそらく、凝集やアミロイド形成につながる可能性のあるタンパク質間の「端と端」の結合を避けるためであると考えられる[2]。
一般的な構造モチーフ
[編集]
βヘアピン
[編集]βシートが関与する非常に単純な構造モチーフは、βヘアピン(β-hairpin)である。2本の逆平行ストランドが2~5残基の短いループで連結されており、そのうち1残基はグリシンまたはプロリンであることが多く、どちらも残基もタイトターン(ストランドの向きの急転換)またはβバルジループに必要な二面角コンフォメーションをとることができる。また、個々のストランドは、αヘリックスを含むより長いループで、より複雑な方法で結合することもできる。
グリークキー・モチーフ
[編集]
グリークキー・モチーフ(Greek key motif)は、隣接する4本の逆平行ストランドとその連結ループから構成されている。これは、3本の逆平行ストランドがヘアピンで結ばれており、4本目は1本目に隣接し、より長いループで3本目と結ばれている。このタイプの構造は、タンパク質フォールディングの過程で容易に形成される[3][4]。ギリシャの装飾用アートワークによく見られるパターンにちなんで名付けられた(ギリシア雷文を参照)。
β-α-βモチーフ
[編集]構成要素であるアミノ酸のキラリティーのため、多くの高次βシート構造で見られる様に、すべてのストランドが右巻きのねじれを示す。特に、平行な2本のストランド間の連結ループは、ほとんどの場合、右巻きのクロスオーバーキラリティーを持っており、これはシート固有のねじれにとって有利である[5]。この連結ループはしばしばらせん状の領域を含んでおり、その場合はβ-α-βモチーフと呼ばれる。β-α-β-αモチーフと呼ばれる近縁のモチーフは、最も一般的に観察されるタンパク質の三次構造であるTIMバレルの基本構成要素を形成する。

βメアンダー・モチーフ
[編集]βメアンダー・モチーフ(β-meander motif)は、ヘアピンループで連結した2本以上の連続した逆平行βストランドから構成される単純な超二次構造タンパク質のトポロジー[6][7]。このモチーフは、βシートで一般的であり、βバレルやβプロペラなど、いくつかの構造的特徴で見られる。

Ψループ・モチーフ
[編集]プサイループ・モチーフ(Ψ-loop)は、2本の逆平行ストランドと、その間に水素結合で結合した1本のストランドで構成されている[8]。単一のΨループには、4つの可能なストランドトポロジーがある[9]。このモチーフは、タンパク質のフォールディング中に形成される可能性が低いと思われるために珍しい。Ψループは、アスパラギン酸プロテアーゼファミリーで初めて発見された[9]。
βシートを持つタンパク質の構造的特徴
[編集]βシートは、all-β、α+β、α/βドメインに存在し、また多くのペプチドや小タンパク質にも存在するが、全体的な構造は完全に明らかにされていない[10][11]。all-βドメインは、βバレル、βサンドウィッチ、βプリズム、βプロペラ、βヘリックスを形成することがある。
構造トポロジー
[編集]βシートのトポロジーは、骨格に沿って水素結合しているβストランドの順序を表す。たとえば、フラボドキシンフォールドは、5本ストランドからなるトポロジー21345の平行βシートを持っている。したがって端部ストランドは、骨格に沿ってβストランド2とβストランド5になる。明示的に綴ると、βストランド2はβストランド1とH結合し、βストランド3とH結合し、βストランド4とH結合し、βストランド5とH結合し、その他の端部ストランドと結合する。同系統で、上述のグリークキー・モチーフは、4123のトポロジーを持っている。βシートの二次構造は、ストランドの数、それらのトポロジー、およびそれらの水素結合が平行か逆平行かで大まかに説明できる。
βシートには、開いている(2本の端部ストランドを持つ)ものと(例:フラボドキシンフォールドや免疫グロブリンフォールド)、閉じているβバレルがある(例:TIMバレルなど)。βバレルは、しばしばそれらのずれや傾斜を用いて表現される。 開いたβシートの中には、非常に湾曲していて折り重なるものや(例:SH3ドメイン)、馬蹄型をしているものもある(例:リボヌクレアーゼ阻害剤)。開いたβシートは、面と面を合わせても(例:βプロペラドメインや免疫グロブリンフォールド)、端と端を合わせても、一つの大きなβシートを形成することができる。
動的な特徴
[編集]βプリーツシート構造は、伸長したβストランドのポリペプチド鎖から構成され、隣接するストランドどうしは水素結合で結合している。このように伸長した骨格構造をもつため、βシートは伸びに抵抗する。タンパク質のβシートは、低周波のアコーディオン運動をしている可能性があり、これはラマン分光法で観測され[12]、準連続体モデルで解析された[13]。
平行βヘリックス
[編集]
βヘリックスは、2本または3本の短いβストランドが短いループで連結した構造単位の繰り返しから形成される。これらの単位は、同じストランドの連続した部分が互いに平行に水素結合するように、らせん状に積み重ねられている。詳細についてはβヘリックスの記事を参照のこと。
左巻きのβヘリックスでは、ストランド自体は真っ直ぐでねじれておらず、結果としてらせん表面はほぼ平坦で、右図の古細菌の炭酸脱水酵素(PDB: 1QRE)のように正三角柱の形状をなしている。他にも、リピドA合成酵素LpxAや、片面にThr側鎖が規則的に並びて、氷の構造を模倣した昆虫の不凍タンパク質などがあげられる[14]。
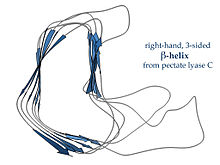
左図のペクチン酸リアーゼ酵素やP22ファージテイルスパイクタンパク質に代表されるように、右巻きβヘリックスは、断面があまり規則的ではなく、より長く、片側がくぼんでいる。3つの連結ループのうち、1つは一貫してわずか2残基の長さであり、他は可変であり、結合部位や活性部位を形成するためにしばしば精巧に作られている[15]。
細菌メタロプロテアーゼの中には、二面βヘリックス(右巻き)が存在する。その2つのループはそれぞれ6残基長で、GGXGXD配列モチーフの骨格とAsp側鎖酸素を利用して、安定化カルシウムイオンに結合し、構造の完全性を維持する[16]。このフォールドは、SCOP分類でβロールと呼ばれている。
病理
[編集]アミロイドβ(アミロイド斑を参照)のように、モノマーでは無秩序または、らせん状になっているタンパク質の中には、病理ではβシートに富んだオリゴマー構造を形成するものがある。アルツハイマー病の原因として、アミロイドβタンパク質のオリゴマー型が関係している。その構造はまだ完全には解明されていないが、最近のデータでは、珍しい2本ストランドのβヘリックスに似ている可能性が示唆されている[17]。
また、βシート構造に含まれるアミノ酸残基の側鎖について、シートの片面に表れる側鎖の多くを疎水性にし、シートの反対面では表れる側鎖の多くを極性または帯電性(親水性)になるよう配置することもできる[18]。これはシートが極性(水性環境)と非極性(油性環境)の境界を形成する場合に有用である。
参照項目
[編集]脚注
[編集]- ^ Voet, Donald; Voet, Judith G. (2004). Biochemistry (3rd ed.). Hoboken, NJ: Wiley. pp. 227–231. ISBN 0-471-19350-X
- ^ Richardson JS, Richardson DC (March 2002). “Natural beta-sheet proteins use negative design to avoid edge-to-edge aggregation”. Proceedings of the National Academy of Sciences of the United States of America 99 (5): 2754–9. doi:10.1073/pnas.052706099. PMC 122420. PMID 11880627.
- ^ Tertiary Protein Structure and Folds: section 4.3.2.1. From Principles of Protein Structure, Comparative Protein Modelling, and Visualisation
- ^ Hutchinson EG, Thornton JM (April 1993). “The Greek key motif: extraction, classification and analysis”. Protein Engineering 6 (3): 233–45. doi:10.1093/protein/6.3.233. PMID 8506258.
- ^ See sections II B and III C, D in Richardson JS (1981). Anatomy and Taxonomy of Protein Structures. 34. 167–339. doi:10.1016/s0065-3233(08)60520-3. ISBN 0-12-034234-0
- ^ “SCOP: Fold: WW domain-like”. 2012年2月4日時点のオリジナルよりアーカイブ。2007年6月1日閲覧。
- ^ PPS '96 - Super Secondary Structure
- ^ Hutchinson EG, Thornton JM (February 1996). “PROMOTIF--a program to identify and analyze structural motifs in proteins”. Protein Science 5 (2): 212–20. doi:10.1002/pro.5560050204. PMC 2143354. PMID 8745398.
- ^ a b Hutchinson EG, Thornton JM (1990). “HERA--a program to draw schematic diagrams of protein secondary structures”. Proteins 8 (3): 203–12. doi:10.1002/prot.340080303. PMID 2281084.
- ^ Hubbard TJ, Murzin AG, Brenner SE, Chothia C (January 1997). “SCOP: a structural classification of proteins database”. Nucleic Acids Research 25 (1): 236–9. doi:10.1093/nar/25.1.236. PMC 146380. PMID 9016544.
- ^ Fox NK, Brenner SE, Chandonia JM (January 2014). “SCOPe: Structural Classification of Proteins--extended, integrating SCOP and ASTRAL data and classification of new structures”. Nucleic Acids Research 42 (Database issue): D304-9. doi:10.1093/nar/gkt1240. PMC 3965108. PMID 24304899.
- ^ Painter PC, Mosher LE, Rhoads C (July 1982). “Low-frequency modes in the Raman spectra of proteins”. Biopolymers 21 (7): 1469–72. doi:10.1002/bip.360210715. PMID 7115900.
- ^ Chou KC (August 1985). “Low-frequency motions in protein molecules. Beta-sheet and beta-barrel”. Biophysical Journal 48 (2): 289–97. doi:10.1016/S0006-3495(85)83782-6. PMC 1329320. PMID 4052563.
- ^ Liou YC, Tocilj A, Davies PL, Jia Z (July 2000). “Mimicry of ice structure by surface hydroxyls and water of a beta-helix antifreeze protein”. Nature 406 (6793): 322–4. doi:10.1038/35018604. PMID 10917536.
- ^ Branden, Carl; Tooze, John (1999). Introduction to Protein Structure. New York: Garland. pp. 20–32. ISBN 0-8153-2305-0
- ^ Baumann U, Wu S, Flaherty KM, McKay DB (September 1993). “Three-dimensional structure of the alkaline protease of Pseudomonas aeruginosa: a two-domain protein with a calcium binding parallel beta roll motif”. The EMBO Journal 12 (9): 3357–64. PMC 413609. PMID 8253063.
- ^ Nelson R, Sawaya MR, Balbirnie M, Madsen AØ, Riekel C, Grothe R, Eisenberg D (June 2005). “Structure of the cross-beta pine of amyloid-like fibrils”. Nature 435 (7043): 773–8. doi:10.1038/nature03680. PMC 1479801. PMID 15944695.
- ^ Zhang S, Holmes T, Lockshin C, Rich A (April 1993). “Spontaneous assembly of a self-complementary oligopeptide to form a stable macroscopic membrane”. Proceedings of the National Academy of Sciences of the United States of America 90 (8): 3334–8. doi:10.1073/pnas.90.8.3334. PMC 46294. PMID 7682699.
推薦文献
[編集]- Cooper J (31 May 1996). “Super Secondary Structure - Part II”. Principles of Protein Structure Using the Internet. 25 May 2007閲覧。
- “Open-sided Beta-meander”. Structural Classification of Proteins (SCOP) (20 October 2006). 4 February 2012時点のオリジナルよりアーカイブ。31 May 2007閲覧。


