グアニジン
表示
| グアニジン | |
|---|---|

|
|

|
|
| 識別情報 | |
| CAS登録番号 | 113-00-8 |
| PubChem | 3520 |
| ChemSpider | 3400 |
| UNII | JU58VJ6Y3B |
| EC番号 | 204-021-8 |
| DrugBank | DB00536 |
| MeSH | Guanidine |
| ChEBI | |
| ChEMBL | CHEMBL821 |
| 4783 | |
| バイルシュタイン | 506044 |
| Gmelin参照 | 100679 |
| 特性 | |
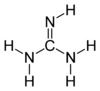
| 化学式 | CH5N3 |
| モル質量 | 59.07 g mol−1 |
| 融点 |
50 °C, 323 K, 122 °F |
| log POW | −1.251 |
| 熱化学 | |
| 標準生成熱 ΔfH |
−57 – −55 kJ mol−1 |
| 標準燃焼熱 ΔcH |
−1.0511 – −1.0531 MJ mol−1 |
| 薬理学 | |
| 消失半減期 | 7–8 hours |
| 危険性 | |
| 半数致死量 LD50 | 475 mg/kg (経口、ラット)[2] |
| 関連する物質 | |
| 関連物質 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
グアニジン (guanidine) は、有機化合物。強い塩基性を持つ結晶性の固体で、グアニンの分解によって得られる。またタンパク質の代謝によって生成し、尿中にも検出される。
性質
グアニジンは、共鳴により共役酸の正電荷が3つの窒素上に非局在化できるため安定であり、また強い塩基性を示す({{pKa}}=12.5)。結果として、生理的条件においては、プロトン化された+1価の陽イオン(グアニジニウムイオン)として存在する。
用途
プラスチックや爆薬の原料として用いられる。また水素結合を作りやすい性質から、生化学分野においてはタンパク質の変性剤として塩酸塩(塩化グアニジニウム、GdmCl)やチオシアン酸塩(グアニジンチオシアン酸塩、GuSCN)がよく用いられる。化石燃料に代わる燃料としての研究も進められている。誘導体は、有機合成において強塩基として用いられる。
誘導体
グアニジンを含む化合物としてアミノ酸の一種であるアルギニンがあり、タンパク質内でDNAとの結合など重要な役割を負う。またアルギニンから生合成されたグアニジノ基を含むアルカロイドが知られており、サキシトキシンやテトロドトキシンなど強い生理作用を持つものが多い。他に、ニトログアニジンは爆薬として用いられる。
近年、アルギニンを多数含むペプチドが細胞膜を容易に透過することが発見され、この作用の源がグアニジノ基にあることが証明されている。グアニジノ基を多数結合させておけば大分子量のタンパク質や人工分子も容易に細胞内に取り込ませられるため、医薬・生化学分野において応用の期待が高まっている。
脚注
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. pp. 883. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4
- ^ “Guanidine hydrochloride”. ChemIDplus. National Library of Medicine. 2014年8月12日時点のオリジナルよりアーカイブ。2014年8月10日閲覧。
