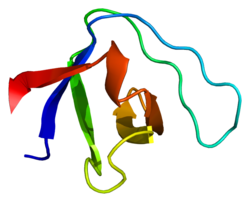
αII-スペクトリン
αII-スペクトリン(αII-spectrin)、スペクトリンα2(spectrin α2)またはSPTAN1(spectrin alpha, non-erythrocytic 1)は、ヒトではSPTAN1遺伝子にコードされるタンパク質である[5][6][7]。αII-スペクトリンはさまざまな組織で発現しており、心筋のZ線構造、コスタメア、筋鞘で高度に発現している。αII-スペクトリンの変異は早期乳児てんかん性脳症(EIEE、発達性てんかん性脳症(DEE)、大田原症候群)5と関係しており、αII-スペクトリンはギラン・バレー症候群と乳児の先天性心疾患のバイオマーカーとして有用である可能性がある。
構造
[編集]αII-スペクトリンは選択的スプライシングが行われることが記載されており、複数の転写産物バリアントが生じる。具体的には、心筋細胞では4種類のスプライスバリアントが同定されている[8][9]。主に赤血球に存在するαI-スペクトリンとは異なり[10]、αII-スペクトリンはほとんどの組織で発現している。αII-スペクトリンは心筋では筋細胞のZ線構造、コスタメア、筋鞘に存在し[11][12][13]、心臓線維芽細胞では細胞骨格ネットワークの表面に沿って存在している[14]。αII-スペクトリンはβII-スペクトリンとのヘテロ二量体として存在するのが最も一般的であり、二量体は自己重合してヘテロ四量体を形成する[5][15][16]。
機能
[編集]スペクトリンは広範囲に分布する細胞骨格タンパク質で、アクチンの架橋、細胞接着、細胞間コミュニケーション、細胞周期の調節に関与する[17][18][19]。心筋におけるαII-スペクトリンの役割はあまり理解されていないが、筋鞘下のドメインの組織化と、連続的な心筋収縮と関係したストレスに対する筋鞘の安定化に関与していると考えられている[16]。αII-スペクトリンの機能的多様性は4種類のスプライスバリアントから明らかである。1つ目はαII-cardi+と呼ばれる心臓特異的バリアントで、21番目のスペクトリンリピートに21アミノ酸が挿入されている。挿入はβ-スペクトリンに対する結合親和性を調節し、筋細胞の成長と分化を調節している[8]。2つ目のバリアントはSH3i+と呼ばれるもので、10番目のスペクトリンリピートに20アミノ酸が挿入されている。プロテインキナーゼAとプロテインキナーゼCによるリン酸化部位を含み、スペクトリンのCa2+依存的切断とタンパク質間相互作用を調節する[20]。3つ目は15番目のスペクトリンリピートに5アミノ酸が挿入されており、挿入部位は抗原性の高いエピトープやp53のアンキリン様p53結合タンパク質に対する結合部位と類似している[8][21]。4つ目は21番目のスペクトリンリピートに6アミノ酸が挿入されており、その機能は明らかにされていない[11][22]。
アンジオテンシンIIによって誘導される心臓のリモデリングに応答して、心臓線維芽細胞でαII-スペクトリンの遺伝子発現がアップレギュレーションされることが示されている[23]。
疾患と損傷の動物モデルからは、αII-スペクトリンが多様な機能に関与していることが示唆されている。超低体温循環停止のイヌモデルでは、αII-スペクトリンの分解産物が心臓手術後の神経損傷と関連したマーカーであることが示されている[24]。
臨床的意義
[編集]SPTAN1遺伝子の変異は、早期乳児てんかん性脳症(EIEE、発達性てんかん性脳症(DEE)、大田原症候群)5の原因となる[25]。
αII-スペクトリンは、先天性心疾患を抱える乳児で脳の壊死とアポトーシスのバイオマーカーとしての有用性が示されている。αII-スペクトリンの分解産物は、開心術周術期と術後の新生児の血清中に検出される[26]。ギラン・バレー症候群の患者の脳脊髄液では、αII-スペクトリンのタンパク質レベルの上昇が検出される[27]。
相互作用
[編集]αII-スペクトリン(SPTAN1)は次に挙げる因子と相互作用することが示されている。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000197694 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000057738 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ a b “Comparison of nonerythroid alpha-spectrin genes reveals strict homology among diverse species”. Mol Cell Biol 8 (1): 1–9. (February 1988). doi:10.1128/MCB.8.1.1. PMC 363070. PMID 3336352.
- ^ Leto, T. L.; Fortugno-Erikson, D.; Barton, D.; Yang-Feng, T. L.; Francke, U.; Harris, A. S.; Morrow, J. S.; Marchesi, V. T. et al. (1988). “Entrez Gene: SPTAN1 spectrin, alpha, non-erythrocytic 1 (alpha-fodrin)”. Molecular and Cellular Biology 8 (1): 1–9. doi:10.1128/MCB.8.1.1. PMC 363070. PMID 3336352.
- ^ “cDNA cloning, sequencing and chromosome mapping of a non-erythroid spectrin, human alpha-fodrin”. Differentiation 34 (1): 68–78. (1987). doi:10.1111/j.1432-0436.1987.tb00052.x. PMID 3038643.
- ^ a b c “Characterization and expression of a heart-selective alternatively spliced variant of alpha II-spectrin, cardi+, during development in the rat”. Journal of Molecular and Cellular Cardiology 48 (6): 1050–9. (Jun 2010). doi:10.1016/j.yjmcc.2010.01.001. PMC 3537504. PMID 20114050.
- ^ “Brain and muscle express a unique alternative transcript of alphaII spectrin”. Biochemistry 38 (48): 15721–30. (Nov 1999). doi:10.1021/bi991458k. PMID 10625438.
- ^ “Mapping the human erythrocyte beta-spectrin dimer initiation site using recombinant peptides and correlation of its phasing with the alpha-actinin dimer site”. The Journal of Biological Chemistry 271 (12): 6636–44. (Mar 1996). doi:10.1074/jbc.271.12.6636. PMID 8636080.
- ^ a b “Cardiac myofibrillogenesis inside intact embryonic hearts”. Developmental Biology 318 (2): 236–46. (Jun 2008). doi:10.1016/j.ydbio.2008.03.011. PMC 2496890. PMID 18455713.
- ^ “The transitional junction: a new functional subcellular domain at the intercalated disc”. Molecular Biology of the Cell 17 (4): 2091–100. (Apr 2006). doi:10.1091/mbc.E05-12-1109. PMC 1415289. PMID 16481394.
- ^ “Not just a plasma membrane protein: in cardiac muscle cells alpha-II spectrin also shows a close association with myofibrils”. Journal of Muscle Research and Cell Motility 25 (2): 119–26. (2004). doi:10.1023/b:jure.0000035892.77399.51. PMID 15360127.
- ^ “Alpha-spectrin in detergent-extracted whole-mount cytoskeletons of chicken embryo heart fibroblasts”. The Histochemical Journal 25 (9): 678–86. (Sep 1993). doi:10.1007/bf00157882. PMID 8226104.
- ^ “Spectrin alpha II and beta II isoforms interact with high affinity at the tetramerization site”. The Biochemical Journal 374 (Pt 3): 613–24. (Sep 2003). doi:10.1042/BJ20030507. PMC 1223645. PMID 12820899.
- ^ a b “The spectrin-associated cytoskeleton in mammalian heart”. Frontiers in Bioscience 10 (1–3): 3020–33. (1 September 2005). doi:10.2741/1759. PMID 15970557.
- ^ “Role of an alternatively spliced form of alphaII-spectrin in localization of connexin 43 in cardiomyocytes and regulation by stress-activated protein kinase”. Journal of Molecular and Cellular Cardiology 42 (3): 572–81. (Mar 2007). doi:10.1016/j.yjmcc.2006.11.018. PMC 1983066. PMID 17276456.
- ^ “AlphaII-spectrin is critical for cell adhesion and cell cycle”. The Journal of Biological Chemistry 284 (4): 2409–18. (Jan 2009). doi:10.1074/jbc.M801324200. PMID 18978357.
- ^ “alphaII-Spectrin interacts with five groups of functionally important proteins in the nucleus”. Cell Biology International 30 (11): 866–78. (Nov 2006). doi:10.1016/j.cellbi.2006.06.005. PMID 16889989.
- ^ “c-Src binds alpha II spectrin's Src homology 3 (SH3) domain and blocks calpain susceptibility by phosphorylating Tyr1176”. The Journal of Biological Chemistry 278 (9): 7735–41. (Feb 2003). doi:10.1074/jbc.M210988200. PMID 12446661.
- ^ “Ankyrin binds to the 15th repetitive unit of erythroid and nonerythroid beta-spectrin”. The Journal of Cell Biology 115 (1): 267–77. (Oct 1991). doi:10.1083/jcb.115.1.267. PMC 2289929. PMID 1833409.
- ^ “Caenorhabditis elegans beta-G spectrin is dispensable for establishment of epithelial polarity, but essential for muscular and neuronal function”. The Journal of Cell Biology 149 (4): 915–30. (May 2000). doi:10.1083/jcb.149.4.915. PMC 2174577. PMID 10811831.
- ^ “Identification of differentially expressed genes induced by angiotensin II in rat cardiac fibroblasts”. Clinical and Experimental Pharmacology & Physiology 33 (1–2): 41–6. (2006). doi:10.1111/j.1440-1681.2006.04321.x. PMID 16445697.
- ^ “Alpha II-spectrin breakdown products serve as novel markers of brain injury severity in a canine model of hypothermic circulatory arrest”. The Annals of Thoracic Surgery 88 (2): 543–50. (Aug 2009). doi:10.1016/j.athoracsur.2009.04.016. PMC 3412404. PMID 19632410.
- ^ “Early onset West syndrome with severe hypomyelination and coloboma-like optic discs in a girl with SPTAN1 mutation”. Epilepsia 53 (6): e106–10. (Jun 2012). doi:10.1111/j.1528-1167.2012.03437.x. PMID 22429196.
- ^ “Detection of alpha II-spectrin breakdown products in the serum of neonates with congenital heart disease*”. Pediatric Critical Care Medicine 15 (3): 229–35. (Mar 2014). doi:10.1097/PCC.0000000000000059. PMC 4059536. PMID 24395002.
- ^ “Proteome analysis of cerebrospinal fluid in Guillain–Barré syndrome (GBS)”. Journal of Neuroimmunology 185 (1–2): 190–4. (Apr 2007). doi:10.1016/j.jneuroim.2007.01.022. PMID 17367871.
- ^ “Identification of a candidate human spectrin Src homology 3 domain-binding protein suggests a general mechanism of association of tyrosine kinases with the spectrin-based membrane skeleton”. J. Biol. Chem. 273 (22): 13681–92. (May 1998). doi:10.1074/jbc.273.22.13681. PMID 9593709.
- ^ a b “Human alpha spectrin II and the FANCA, FANCC, and FANCG proteins bind to DNA containing psoralen interstrand cross-links”. Biochemistry 40 (24): 7025–34. (June 2001). doi:10.1021/bi002917g. PMID 11401546.
- ^ a b “Human alpha spectrin II and the Fanconi anemia proteins FANCA and FANCC interact to form a nuclear complex”. J. Biol. Chem. 274 (46): 32904–8. (November 1999). doi:10.1074/jbc.274.46.32904. PMID 10551855.
- ^ “Nonerythroid alphaII spectrin is required for recruitment of FANCA and XPF to nuclear foci induced by DNA interstrand cross-links”. J. Cell Sci. 116 (Pt 5): 823–35. (March 2003). doi:10.1242/jcs.00294. PMID 12571280.
- ^ “Interaction of the C-terminal domain of delta glutamate receptor with spectrin in the dendritic spines of cultured Purkinje cells”. Neurosci. Res. 34 (4): 281–7. (September 1999). doi:10.1016/s0168-0102(99)00061-9. PMID 10576550.
- ^ a b “Cutting edge: integration of human T lymphocyte cytoskeleton by the cytolinker plectin”. J. Immunol. 167 (2): 641–5. (July 2001). doi:10.4049/jimmunol.167.2.641. PMID 11441066.
- ^ “Plectin and IFAP-300K are homologous proteins binding to microtubule-associated proteins 1 and 2 and to the 240-kilodalton subunit of spectrin”. J. Biol. Chem. 262 (3): 1320–5. (January 1987). PMID 3027087.
- ^ “Synaptic scaffolding proteins in rat brain. Ankyrin repeats of the multidomain Shank protein family interact with the cytoskeletal protein alpha-fodrin”. J. Biol. Chem. 276 (43): 40104–12. (October 2001). doi:10.1074/jbc.M102454200. PMID 11509555.
関連文献
[編集]- “Regulation and intracellular localization of the epithelial isoforms of the Na+/H+ exchangers NHE2 and NHE3.”. Clinical and Investigative Medicine 22 (5): 195–206. (1999). PMID 10579058.
- “The role of caspase cascade on the development of primary Sjögren's syndrome.”. J. Med. Invest. 50 (1–2): 32–8. (2003). PMID 12630566.
- “Immunoreactive forms of human erythrocyte ankyrin are present in diverse cells and tissues.”. Nature 281 (5732): 597–9. (1979). doi:10.1038/281597a0. PMID 492324.
- “Interaction domains of neurofilament light chain and brain spectrin.”. Biochem. J.. 275 ( Pt 2) (2): 521–7. (1991). doi:10.1042/bj2750521. PMC 1150082. PMID 1902666.
- “Site specificity in the interactions of synapsin 1 with tubulin.”. Biochem. J.. 276 ( Pt 3) (3): 793–9. (1991). doi:10.1042/bj2760793. PMC 1151074. PMID 1905928.
- “Mapping the binding sites of human erythrocyte ankyrin for the anion exchanger and spectrin.”. J. Biol. Chem. 265 (18): 10589–96. (1990). PMID 2141335.
- “Generation of diversity in nonerythroid spectrins. Multiple polypeptides are predicted by sequence analysis of cDNAs encompassing the coding region of human nonerythroid alpha-spectrin.”. J. Biol. Chem. 265 (8): 4427–33. (1990). PMID 2307671.
- “Association of spectrin with desmin intermediate filaments.”. J. Cell. Biochem. 30 (2): 101–9. (1986). doi:10.1002/jcb.240300202. PMID 2939097.
- “Phosphorylation of ankyrin down-regulates its cooperative interaction with spectrin and protein 3.”. J. Cell. Biochem. 37 (3): 301–15. (1988). doi:10.1002/jcb.240370305. PMID 2970468.
- “Ankyrin-independent membrane protein-binding sites for brain and erythrocyte spectrin.”. J. Biol. Chem. 263 (28): 14417–25. (1988). PMID 2971657.
- “Plectin and IFAP-300K are homologous proteins binding to microtubule-associated proteins 1 and 2 and to the 240-kilodalton subunit of spectrin.”. J. Biol. Chem. 262 (3): 1320–5. (1987). PMID 3027087.
- “cDNA cloning, sequencing and chromosome mapping of a non-erythroid spectrin, human alpha-fodrin.”. Differentiation 34 (1): 68–78. (1987). doi:10.1111/j.1432-0436.1987.tb00052.x. PMID 3038643.
- “Binding of brain spectrin to the 70-kDa neurofilament subunit protein.”. Eur. J. Biochem. 169 (3): 651–7. (1988). doi:10.1111/j.1432-1033.1987.tb13657.x. PMID 3121319.
- “Structure and evolution of a non-erythroid spectrin, human alpha-fodrin.”. Biochem. Soc. Trans. 15 (5): 804–7. (1988). doi:10.1042/bst0150804. PMID 3691949.
- “Cloning, expression and characterization of two putative calcium-binding sites in human non-erythroid alpha-spectrin.”. Eur. J. Biochem. 230 (2): 658–65. (1995). doi:10.1111/j.1432-1033.1995.0658h.x. PMID 7607240.
- “Adducin: a physical model with implications for function in assembly of spectrin-actin complexes.”. J. Biol. Chem. 270 (32): 18990–6. (1995). doi:10.1074/jbc.270.32.18990. PMID 7642559.
- “Dynamic properties of ankyrin in T lymphocytes: colocalization with spectrin and protein kinase C beta.”. J. Cell Biol. 125 (2): 345–58. (1994). doi:10.1083/jcb.125.2.345. PMC 2120020. PMID 8163551.
- “Identification of the spectrin subunit and domains required for formation of spectrin/adducin/actin complexes.”. J. Biol. Chem. 271 (26): 15695–702. (1996). doi:10.1074/jbc.271.26.15695. PMID 8663089.
- “Site-directed mutagenesis of alpha II spectrin at codon 1175 modulates its mu-calpain susceptibility.”. Biochemistry 36 (1): 57–65. (1997). doi:10.1021/bi962034i. PMID 8993318.