グリコシルホスファチジルイノシトール
グリコシルホスファチジルイノシトール (glycosylphosphatidylinositol、略称: GPI) またはGPIアンカーは、翻訳後修飾によってタンパク質のC末端に取り付けられる糖脂質である。GPIアンカーを含むタンパク質は、多種多様な生物学的過程において重要な役割を果たしている[1]。GPIアンカーに繋ぎ止められるものには、酵素、受容体、免疫系タンパク質、認識抗原などがある。
GPI化されたタンパク質はシグナル配列を含んでいるため、小胞体(ER)へと向かう。タンパク質はER膜に共翻訳的に挿入され、その疎水性C末端によってER膜へと結合する。タンパク質の大半は小胞体内腔へと延びている。疎水性C末端配列は次に切断され、GPIアンカーによって置き換えられる。タンパク質が分泌経路を通って処理されると、ベシクルを介してゴルジ体へ、最終的には原形質膜へと移送される。原形質膜では細胞膜の外葉へとくっつき続ける。GPI化はこういったタンパク質が膜へと付着する唯一の手段であるため、ホスホリパーゼによるGPI基の切断は膜からのタンパク質の制御された放出をもたらすこととなる。後者の機構はin vitroで用いられる。すなわち、酵素アッセイにおいて膜から放出された膜タンパク質はGPI化タンパク質である。
ホスホリパーゼC(PLC)はGPIアンカー化されたタンパク質に含まれるホスホグリセロール結合を切断することが知られている酵素である。PLCによる処理は、細胞外膜からのGPI結合タンパク質の遊離を引き起こす。T細胞マーカーThy-1およびアセチルコリンエステラーゼは、腸および胎盤のアルカリホスファターゼと同様に、GPI結合タンパク質であることが知られており、PLCを用いた処理によって遊離する。GPI結合型タンパク質は脂質ラフトに優先的に局在していると考えられており、これは原形質膜ミクロドメイン内での高度な秩序を示唆している。

構造
[編集]
GPIアンカーは、ホスファチジルイノシトールにN-アセチルグルコサミン残基とマンノース残基3分子が線状にグリコシド結合し、非還元末端のマンノースにはホスホエタノールアミンがリン酸エステル結合し、そのアミノ基にはタンパク質のC末端がアミド結合した構造をしている。右図の中央のコア四糖にはタンパク質の種類によって様々な糖が結合する。また、右端の脂肪酸残基(R1、R2)にも種類がいろいろある。
タンパク質をつけたGPIアンカーは糖タンパク質と同じように細胞膜の外面にある。これは、GPIアンカーがゴルジ体から放出された分泌小胞の膜の内面にあり、それが細胞膜まで運搬されると小胞の内膜が細胞膜の外面になるように融合するためである(詳しくはゴルジ体を参照)。GPIアンカーと結合する前のタンパク質はC末端側に20~30の疎水性アミノ酸残基(シグナルペプチド)を持っている。これはGPIアンカーと結合するときに除去される。GPIアンカーと結合したタンパク質は後にホスファチジルイノシトールに特異的なホスホリパーゼによって処理されると細胞膜から切断される。
GPIアンカーの生合成
[編集]GPI基の合成
[編集]| 反応式 | 酵素など |
|---|---|
 |
1: 6N-アセチルグルコサミニルトランスフェラーゼ複合体 Rは脂肪酸 |
 |
2: N-デアセチラーゼ GlcNH2はグルコサミン Pはリン酸 |
 |
3: イノシトールアシルトランスフェラーゼ |
 |
4: 4-マンノシルトランスフェラーゼ (MT-I) Dol-Pはドリコールリン酸 Manはマンノース残基 |
 |
5: エタノールアミンホスホトランスフェラーゼ |
 |
6: 4-マンノシルトランスフェラーゼ (MT-II) 7: 4-マンノシルトランスフェラーゼ (MT-III) |
 |
8: PI上の脂肪酸の置換 9: エタノールアミンホスホトランスフェラーゼ |
タンパク質との結合
[編集]この反応は粗面小胞体で起こり、タンパク質は膜融合で細胞膜の外側を向く。
| 反応式 | 説明 |
|---|---|
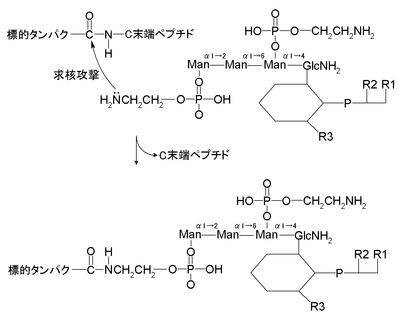 |
GPI基のN原子の不対電子が標的タンパク質とC末端ペプチド(C端シグナルペプチド)の間のカルボキシル基に求核攻撃をする。そして、C末端ペプチドは除去され、GPIアンカーが完成する。 |
医学
[編集]GPIアンカーの異常が原因でおきる病気
- 発作性夜間血色素尿症
- 先天性GPI欠損症(IGD)
参考文献
[編集]- 『ヴォート生化学』、(上下)、第3版、田宮信雄訳、東京化学同人、2005年、313,673-674頁
- 木下 タロウ (2014). “グリコシルホスファチジルイノシトール(GPI)アンカー型タンパク質の生化学”. 生化学 86 (5).
脚注
[編集]- ^ Paulick, Margot G.; Bertozzi, Carolyn R. (2008-07-08). “The Glycosylphosphatidylinositol Anchor: A Complex Membrane-Anchoring Structure for Proteins”. Biochemistry 47 (27): 6991–7000. doi:10.1021/bi8006324. ISSN 0006-2960. PMC 2663890. PMID 18557633.
