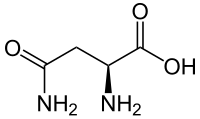
アスパラギン
| L-アスパラギン | |
|---|---|
| |

| |
Asparagine | |
別称 2-Amino-3-carbamoylpropanoic acid | |
| 識別情報 | |
| CAS登録番号 | 70-47-3 |
| PubChem | 236 |
| ChemSpider | 6031 |
| UNII | 7NG0A2TUHQ |
| EC番号 | 200-735-9 |
| KEGG | C00152 |
| ChEMBL | CHEMBL58832 |
| |
| |
| 特性 | |
| 化学式 | C4H8N2O3 |
| モル質量 | 132.12 g mol−1 |
| 示性式 | NH2COCH2CH(COOH)NH2 |
| 酸解離定数 pKa | 2.02 (カルボキシル基), 8.8 (アミノ基)[1] |
| 危険性 | |
| NFPA 704 | |
| 引火点 | 219 ℃ |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
アスパラギン(英: asparagine)は、アミノ酸のひとつで、2-アミノ-3-カルバモイルプロピオン酸のこと。略号は N あるいは Asn。アスパラガスからはじめて単離されたことによりこの名がついた。
中性極性側鎖アミノ酸に分類される。蛋白質構成アミノ酸のひとつで、非必須アミノ酸。グリコーゲン生産性を持つ。コドンはAAUまたはAACである。
歴史
[編集]アスパラギンは1806年、フランスのルイ=ニコラ・ヴォークランとピエール=ジャン・ロビケ(当時は助手)によりアスパラガスの汁から結晶として単離され、単離された最初のアミノ酸となった[2][3]。
1809年、ピエール=ジャン・ロビケは甘草の根からもアスパラギン様物質を単離したが、1828年、それはアスパラギンであったことが確認された[4]。
タンパク質内での機能
[編集]アスパラギンの側鎖はペプチド骨格と水素結合を形成することができる。つまり、他のペプチド骨格の代わりに水素結合サイトを埋めることができる。そのため、この残基はαヘリックスの始点、終点、βシートのターンで見られる。構造の類似したグルタミンは立体配座エントロピーが大きいため、このような機能は持たない。
また、アスパラギンはタンパクのN-グリコシル化の標的となる。
生合成
[編集]生体内では、アスパラギン酸からアスパラギンシンテターゼにより生合成される。また、アスパラギナーゼによりアスパラギン酸とアンモニアに分解される。

物性
[編集]- 分子量 132.12
- 等電点 5.41
- 溶解性 水にやや難溶。
- 溶解度(水、g/100g)2.36 (20℃)、5.94 (40℃)、13.7 (60℃)(一水和物の場合)
- ファンデルワールス半径 96
がんへの影響
[編集]英科学誌「ネイチャー」に掲載された研究論文で、動物実験段階ではあるがアスパラギンが不足すると乳がん細胞の成長が妨げられることが分かった。実験の内容はがんにかかったマウスに低アスパラギンの食事やアスパラギンを阻害する薬を与えるというものである。通常、がんにかかったマウスだとがんが転移して2~3週間程度で亡くなるが、低アスパラギンの食事やアスパラギンを阻害する薬を与えたマウスでは転移が抑えられた[5]。
出典
[編集]- ^ Dawson, R.M.C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ^ Vauquelin LN, Robiquet PJ (1806). “La découverte d'un nouveau principe végétal dans le suc des asperges”. Annales de Chimie 57: 88–93.
- ^ R.H.A. Plimmer (1912) [1908]. R.H.A. Plimmer & F.G. Hopkins. ed. The chemical composition of the proteins. Monographs on biochemistry. Part I. Analysis (2nd ed.). London: Longmans, Green and Co.. p. 112 January 18, 2010閲覧。
- ^ http://www.henriettesherbal.com/eclectic/kings/glycyrrhiza.html
- ^ “がん進行・転移に食品が影響か=英研究”. BBC. 2018年2月9日閲覧。
関連項目
[編集]外部リンク
[編集]- アスパラギン - 素材情報データベース<有効性情報>(国立健康・栄養研究所)


