真性多血症
真性多血症(しんせいたけつしょう:英名 Polycythemia vera)とは骨髄増殖性腫瘍(MPN)のひとつで、造血幹細胞の後天的な遺伝子異常がもたらす増殖によって血液中の赤血球数および循環血液量の絶対的増加をきたす疾患であり、また白血球や血小板も増加し全血球が増加していることが多い。PVと略称され、「赤血病」とも通称される。
概要
[編集]絶対赤血球量の著明な増加が起こり、また白血球や血小板も増加していることが多い疾患である[註 1]。年間発症率は10万人あたり0.2-2人程度の稀な疾患であり、患者の多くは中高年男性であるが、少ないながらも若年者や女性も発症する。赤血球が増える原因は従来は不明であったが、2005年にJAK2キナーゼに関わる遺伝子の変異が発見され、2011年現在ではJAK2キナーゼに関わる遺伝子の変異によるエリスロポエチン受容体の異常が原因とされている。受容体の異常が原因であるために、他の多血症とは違い、赤血球を増やす因子であるエリスロポエチンの血中濃度は逆に低値であることが多い。血球が増え血液の粘度が高まることで様々な症状が現れ、無治療で放っておくと診断後の平均寿命は18ヶ月程度であるが、瀉血を中心にして抗がん剤や抗血小板剤を適宜使用する治療によって、多くの患者では通常の生活を送り永らえることができる疾患である。コントロールは比較的容易な疾患であるが、根本的な治療法は2010年時点ではない。
疫学
[編集]発症率は民族や年齢・性別で大きく異なり、また資料によっても大きくことなるが、欧米では人口100万人あたり5-26人、日本では100万人あたり2-20人程度[註 2]の発症率と考えられている[1][2]。一般にはアジア人に少なく欧米人に多いといわれるが、日本語のある内科学の教科書では日本人は100万人に2人、オーストラリアでは100万人に13人、欧米では100万人に8-10人としている[3]。男性に多い疾患[註 3]であり、また中高年に多く[註 4]診断時中央値は約60歳[4]であるが、男女年齢を問わず発症は起こりえる[4][5]。
症状と血液学的所見
[編集]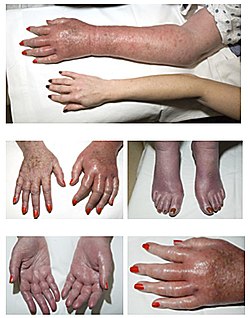

真性多血症では無症状のこともあるが、各血球が増え血液が濃くなり血液粘度が上昇して流れにくくなるため、中枢神経系の血液循環が障害されることで、頭痛、めまい、ほてり、のぼせ、耳鳴りの症状が起きることが多い。入浴後の全身のかゆみがよく見られ、血液の絶対量が増えるために赤ら顔や高血圧も一つの特徴である。血栓症や、逆に出血などの血管イベントが起こりやすく、脳梗塞や心筋梗塞が起きると重大なことになりかねない[6]。また、自覚はしないことが多いが肝脾腫、特に脾腫は多い[7]。極端な例では2次性の尖端紅痛症を伴うこともある[8]。
真性多血症は正確には循環赤血球量(RCM:Red cell mass)の絶対量が増加する疾患であり、National Polycythemia Vera Study Groupの診断基準も循環赤血球量で決められていたが、循環赤血球量を正確に測定するのは容易ではなく[註 5]、そのためRCMの代替として血液単位量あたりのHb量を用いても十分に相関することが分かっているのでWHO基準では男性でHb18.5g/dL、女性で16.5g/dL以上、あるいは各人の基礎値から2g/dL以上増加して、Hb17g/dL、女性で15g/dL以上になればRCMの増加とみなしてよいとされている[9]。
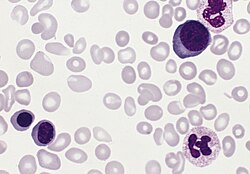
血液では赤血球数の絶対的な増加に加え、幼若な白血球や赤芽球の出現が見られ、大小、楕円、涙滴状などの形態異常の赤血球も見られるようになる[10]。赤血球は正球性正色素性であるが、出血があったり、貯蔵鉄を使い果たすと小球性低色素性になる[註 6][11]。
骨髄では三系統すべてでの過形成であり、診断時に線維化していることは稀である[10]。骨髄では赤血球系の著明な増加に加え、巨核球の巨大化、多分葉化、増加と集中などの異常が見られる[12]。線維化すると特発性骨髄線維症と同様の所見が見られる[12]。
治療
[編集]真性多血症の治療の目的は第一にはヘマトクリット(Ht、赤血球容積率)を下げて血栓リスクを減らすことであり、赤血球量の増加や血液粘度上昇に伴う諸症状を緩和することである。血液粘度はHtが約50%あたりから急激に増すため[13]、Htを45%以下にコントロールすることが目標とされる[14]。
そのために治療の第一選択は瀉血であり、状況に応じて化学療法(主に抗がん剤)や抗血小板剤も使われる[14]。治療中には白血病化や骨髄線維化に注意し監視することも重要である[14]。
瀉血
[編集]瀉血(しゃけつ)とは血液を抜いて捨て去る治療であり、血液細胞が多すぎる病気である真性多血症では基本的な治療である。
Ht>55%が治療開始の目安であり、1回の瀉血は400-600ml程度である[註 7]。瀉血した後一ヶ月程度でHtは元に戻るのでHtを見ながら繰り返し瀉血し、理想的にはHtを男性で45%以下女性で42%以下血小板数を40万/μl以下にコントロールすること、あるいは少なくともHt45%以下を目標とする[14][15][16]。瀉血を繰り返すうちに貯蔵鉄がなくなるとヘモグロビンの材料が乏しくなるため、赤血球は小型の物になり、Htの増加は抑え易くなる[17]。そのため赤血球が小さくなっても鉄剤の投与は厳禁である[17]。 ただし、研究者によっては鉄欠乏は皮膚掻痒の増大や倦怠感を招きQOLを下げるとして鉄剤の投与に肯定的な意見もある[18]。
化学療法
[編集]コントロールを行うのに十分な瀉血が行えないときや、血小板が多く血栓リスクがコントロールしにくいときには化学療法が併用されることが多い[14]。
化学療法では多くはヒドロキシカルバミド(ヒドロキシウレア, 商品名: ハイドレア)が使われる。ヒドロキシカルバミドは代謝拮抗剤に分類される抗がん剤で細胞の増殖を抑える働きがある[7][14]。
ハイドレアは弱いながらも抗がん剤の一種であり、妊娠の際の催奇性や長期の使用では二次性の発ガンリスクがあるので、特に若い患者にはインターフェロンαの使用が検討されることがあるが、インターフェロンαの副作用は強く、また高価であるので一般的ではない[14][7]。瀉血療法よりもハイドロキシウレアの方が血栓症発症率、全死亡率が低いという報告がある[19][20]。
ハイドレア以外にはラニムスチン(商品名: サイメリン)を2-3ヶ月に1回静注[21]や、ブスルファン(商品名: マブリン散)も使われることがある[22]。
2015年09月24日にJAK2阻害作用をもつ分子標的治療薬であるルキソリチニブ(商品名: ジャカビ)が、既存治療が無効である場合の効能追加を認められた[23]。
抗血小板剤
[編集]赤血球数やHt値のコントロールには無関係であるが、血栓症リスクを減らすために低容量アスピリンなどの抗血小板剤も使われることが多い[14]。低容量アスピリンは副作用も少なく血栓症の予防に効果が高い[24]ために低リスク患者から高リスク患者まで広範に推奨される。ただし血小板数が150万/μlを超えた場合はヴォン・ヴィレブランド因子が消費されて減少し易出血傾向が現れることがあり、アスピリンの投与は出血傾向を助長することがあるので血小板数が150万/μlを超えた場合にはアスピリンは控えることが多い[25]。
JAK2V617F変異遺伝子と血球増加のメカニズム
[編集]2005年にJAK2V617F変異遺伝子が発見されPV患者の97%で認められている。JAK2V617F変異遺伝子に類似したJAK2エクソン12遺伝子変異もその後発見され、真性多血症患者のほぼ100%にJAK2遺伝子に関する異常が存在することがわかり、2008年に発表されたWHO分類第4版では診断基準項目の大基準とされた[26]。近年JAK2V617F変異遺伝子が血球増加に直接関わっていることが判明しており[27]、またJAK2V617F変異遺伝子を標的にした分子標的薬も続々に開発のテーブルに乗る[28]など、JAK2V617F変異遺伝子の発見によってPVに関する知見は大きく動いている。
正常な造血細胞は、外部からの適切なコントロールによるG-CSFなどの造血に関わるサイトカイン・ホルモンが受容体に結びつくことによるシグナル伝達で細胞分裂・増殖を始めるが、それらの因子の中でも重要な因子であるエリスロポエチン(EPO)を感受する造血細胞上の受容体にエリスロポエチン受容体がある。エリスロポエチン受容体にはエリスロポエチンが結合した時に起きるシグナルを伝達する働きを持っている酵素にJAK2キナーゼ(チロシンキナーゼ)があるが、このJAK2キナーゼは4つの領域に分かれ、そのうちの一つJH2領域の617番目のアミノ酸は正常な状態ではバリンである。しかしJAK2遺伝子変異によりこのバリンがフェニルアラニンに置き換わってしまうのがJAK2V617F変異であり、JAK2V617F変異するとエリスロポエチンによるシグナルがない状態でもエリスロポエチンが受容体に結合したかのようにシグナル伝達をしてしまい、そのため造血途中の幼若な血液細胞は盛んに分裂・増殖するようになる。赤血球が必要以上に増えるとエリスロポエチンを産出している腎臓はエリスロポエチンの産出を減らして造血のコントロールを試みるが(そのため、PV患者では血中のエリスロポエチン濃度は低値である)もはやエリスロポエチンの存在と無関係にシグナル伝達を行ってしまうJAK2V617F変異キナーゼの基では造血のコントロールを受け付けない状態になってしまい、血液細胞の産出が亢進した状態が続くようになる[7][27][11](電化製品で例えるとスイッチを入れていないのに、スイッチの部品が壊れて勝手に電源が入ってしまい、スイッチを切ろうとしても切れない状態になったようなものである)。JAK2V617F変異は同時に赤芽球のアポトーシスを止めるシグナルも発信するので、両面で赤血球数の増加をもたらす[29]。
試験管の中で造血細胞を培養すると、健康人の正常な造血前駆細胞はエリスロポエチンを加えないと増殖することができないが、PV患者の前駆細胞特にCFU-Eはエリスロポエチンを加えなくとも盛んに分裂・増殖してコロニーを形成する。このことから、2008年WHO診断基準では「内因性の赤芽球コロニー形成がある。」という小基準が加えられた[29]。
予後
[編集]未治療の真性多血症患者の予後は平均18ヶ月で、主な死因は血栓症30%、白血病あるいは骨髄異形成症候群への移行20%、骨髄線維症化、出血などである[14]。
真性多血症の経過が長期に及ぶと約15%の患者が消耗期と呼ばれる後天性骨髄線維症状態化する。 消耗期では巨核球が集塊を作り組織の線維化が進み、骨髄での造血が阻害されるため、多血期とは逆に極端な貧血となる。消耗期の病態は原発性骨髄線維症と類似するが、PVから移行した骨髄線維症は特発性骨髄線維症よりも不良であり、3年生存率は30%に過ぎない[14][15]。
瀉血等、治療を受けている真性多血症患者の10年生存率は72.8%であり[註 8]、死因は血栓症、出血、骨髄線維症化、白血病化、がん、である。ヒドロキシカルバミドを使用すると白血病化は増えるが、血栓症は有意に減る[4]。(PV患者は比較的高齢者が多いので、これらの死因にはPVとは無関係に起きたものも多いと考えられる)
患者の妊娠について
[編集]真性多血症は男性に多く、また比較的高齢者に多い病気であり、若い女性患者は多くはない。そのためにPV患者の妊娠例は少ないものの、日本では1964年から2004年の間に36例が報告されている。PV患者の妊娠例36例の内、流産が8例、死産が7例、新生児死亡が3例、早産を含めて出産成功例が18例となっている[30]。健康女性の妊娠と比べてリスクが高いことは否定はできないが、半数は生児を得ている。また、母体側も子癇前症4例、産褥期肺塞栓症が2例、産褥期血腫が1例とやはりリスクが高いことがうかがえる[30]。妊娠を希望する場合および授乳を希望する場合にはヒドロキシカルバミド (商品名ハイドレア)は禁忌[31]であり、瀉血と抗血小板剤を用い、慎重な観察下での十分な管理によるリスクコントロールが不可欠である[30]。妊婦では血栓症リスクを減らすためにHtは36%未満にコントロールすることを薦める意見もあるが、使える薬剤の限られる妊婦では容易な目標ではない。低容量アスピリンは出産直前の期間以外では推奨されるが、妊婦にも使用可能なインターフェロンは副作用も多く意見は分かれている[32]。それ以外の薬剤、特に抗がん剤は難しい。
歴史
[編集]真性多血症は太古から存在していたと思われるが、医学界に初めて報告されたのは1892年Vasquezによるもので、1903年のOslerによる詳細な報告と合わせ、真性多血症は別名Vasquez-Osler病と呼ばれたこともあった(2010年現在では使われることはない)[5]。循環赤血球量が絶対的に増加する病態はそれ以降知られていたが、1951年Dameshekは慢性骨髄性白血病・本態性血小板血症・骨髄線維症と真性多血症がそれぞれ造血幹細胞レベルの異常で発症し細胞は分化能を失わず相互に病型移行することから、以上の4疾患を骨髄増殖性疾患(こつずいぞうしょくせいしっかん英名Myeloproliferative disease、略称MPD)として疾患群とする概念提唱し[1][33]、2001年WHO基準では真性多血症を含むMPDはチロシンキナーゼの恒常的活性化による骨髄系造血細胞の1系統以上の自律的増加を本体とする病態と位置付けられ、2005年に見つかったJAK2V617F変異やJAK2exon変異の発見がそれを裏付け、2008年WHOでは診断基準にJAK2遺伝子変異を診断基準に盛り込んだ[1][33]。
診断基準
[編集]2008年WHO分類2008による診断基準[34]
真性多血症は、以下の大基準の1と2の両方を同時に満たす、もしくは大基準の1と小基準の2つ以上を同時に満たすことで診断される。
- 大基準
- ヘモグロビン値(Hg) 男性18.5g/dl 女性16.5g/dl以上、もしくは以下の所見のいずれかが確認できる
- JAK2V617F変異遺伝子、もしくは類似したJAK2遺伝子変異が存在する。
- 小基準
- 骨髄において赤血球・白血球・血小板各系統の増生が認められる。
- 血清エリスロポイエチン値が低値を示す。
- 内因性の赤芽球コロニー形成がある。
旧診断基準
[編集]2008年WHOによる診断基準が発表されるまで、いくつかの組織が診断基準を設けていたが、下記はPolycythemia vera study groupによって設けられ、一般的によく用いられた診断基準である[7]。
真性赤血球増加症の診断基準(National Polycythemia Vera Study Groupの診断基準)
- 循環赤血球量の増加(男性≧36mL/kg、女性≧32mL/kg)
- SaO2 ≧92%
- 脾腫が存在する事。
- 血小板増加(>40万/mm3)
- 白血球増加(>12,000/mm3)
- 末梢血好中球アルカリホスファターゼ(NAP)スコア上昇
- ビタミンB12 血清中または結合能のいずれかが上昇
- 血清ビタミンB12>900pg/mL
- ビタミンB12結合能>2,200pg/mL
上記[1+2+3]または[1+2+(4〜7のうち2項目)]であれば、本症と診断する。
註釈
[編集]- ^ 赤血球数は600万を超え(押味『 WHO分類第4版による白血病・リンパ系腫瘍の病態学』p30)、ヘモグロビンは男性で18.5g/dl以上、女性で16.5/dl以上(WHO2008診断基準より)になり、白血球・血小板も増えるが、白血球は増えても2万以下、血小板は増えても100万以下であることが多い-出典『三輪血液病学』p945-946
- ^ 日本人の発症率は文献によって大きく違い阿部『造血器腫瘍アトラス』p235では100万人に2人、浅野『三輪血液病学』p945では100万人に5人、押味『 WHO分類第4版による白血病・リンパ系腫瘍の病態学』p30では10万人に2人となっているであるが、アジア人には比較的少なく、欧米人では多く、特にユダヤ人でもっとも多いとされている。いずれにしても稀であり多血症のほとんどは真性多血症ではなく、喫煙や腎疾患などによる二次性の多血症である(喫煙する中高年男性に赤ら顔が多いのは喫煙による一酸化炭素がヘモグロビンに結びついておきる慢性的な低酸素状態に反応して多血症状態になったものである)
- ^ 前述と同じく文献によって若干異なるが概ね男性:女性の比率は1.3-2:1程度である
- ^ ハリソン内科学p.707では全体では10万人に2人の発症率が高齢者では10万人に18人になるとしている。
- ^ 循環赤血球量の測定には放射性物質クロム51(放射性クロム酸ナトリウム注射液)を用いる。血液を採取し採取した赤血球に放射性クロム酸ナトリウムを含ませる(マーキング)、マーキングした赤血球の数を調べた上で体内に戻し、マーキングした赤血球が十分に撹拌されたところで再度採血し赤血球のなかにマーキングされた赤血球がどの程度の割合で存在するか調べて循環赤血球量を測る。この方法ではマーキングして体内に戻す赤血球数が正確にわかっていれば循環赤血球量も正確に測定できるが、マーキングした赤血球が溶血することもあり、またこの検査を行える施設は少ない、あるいは同じく放射性物質でマーキングされたアルブミン(ヨウ化人血清アルブミン(ヨウ素131))あるいはその他のトレーサーを一定量血液に入れ、血漿中のトレーサー濃度とHtを測定することで循環赤血球量を測定する方法もあるが、放射性物質ヨウ素131でマーキングされたアルブミンを使う方法も実施できる施設は少なく、非放射性物資を使う方法は誤差が多い。
- ^ 赤血球細胞質の主要構成物質であるヘモグロビンの材料である鉄が十分にあると赤血球は大きさも色も基準値内であるが、材料である鉄が欠乏すると赤血球は小さく色の薄いものになる
- ^ ただし治療者によっては1回の瀉血量を少なめにして、そのかわり瀉血回数を増やすこともある。大阪市立大学 血液内科2011.2.19閲覧
- ^ PVでは初診時の平均年齢が60歳近いことをお忘れなく
- ^ この場合はヘモグロビン(Hg)もしくはヘマトクリット(Ht)値が同じ条件の集団全体の中で少ないほうから並べて99%以内に入らないということである
出典
[編集]- ^ a b c 押味『 WHO分類第4版による白血病・リンパ系腫瘍の病態学血液学』p18-19
- ^ マーシャル『ウィリアムズ血液学マニュアル』p.174
- ^ 小川『内科学書』p.163
- ^ a b c 阿部『造血器腫瘍アトラス』p235
- ^ a b 押味『 WHO分類第4版による白血病・リンパ系腫瘍の病態学血液学』p30
- ^ 浅野『三輪血液病学』p945
- ^ a b c d e 大阪市立大学・血液内科・真性多血症2011.02.19閲覧
- ^ メルクマニュアル・先端紅痛症2011.11.22閲覧
- ^ 押味『 WHO分類第4版による白血病・リンパ系腫瘍の病態学血液学』p32-34
- ^ a b 浅野『三輪血液病学』p945-946
- ^ a b 押味『 WHO分類第4版による白血病・リンパ系腫瘍の病態学血液学』p31
- ^ a b 直江『WHO血液腫瘍分類』p52
- ^ 浅野『三輪血液病学』p47
- ^ a b c d e f g h i j 浅野『三輪血液病学』p946
- ^ a b マリー E.『血液/腫瘍学シークレット』p.77
- ^ N Engl J Med 2013; 368:22-33
- ^ a b 『血液内科クリニカルスタンダード』p295
- ^ マリー E.『血液/腫瘍学シークレット』p.78
- ^ Fruchtman SM, et al. From efficacy to safety: a Polycythemia Vera Study group report on hydroxyurea in patients with polycythemia vera. Semin Hematol. 1997 Jan;34(1):17-23.
- ^ Tatarsky I, and others. Management of polycythemia vera with hydroxyurea. Semin Hematol. 1997 Jan;34(1):24-8.
- ^ 黒川『内科学』pp.1374
- ^ 吉田『血液疾患診療ハンドブック』pp.341-344
- ^ https://www.kegg.jp/medicus-bin/japic_med?japic_code=00066785
- ^ Landolfi R, et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med. 2004 Jan 8;350(2):114-24.
- ^ 下田「骨髄増殖性疾患分子病態と治療」p.648-655
- ^ 直江『WHO血液腫瘍分類』p49
- ^ a b 東京医科大学 大屋敷「慢性骨髄増殖性疾患の最新検査」2011.02.19閲覧
- ^ 磯部「骨髄増殖性腫瘍に対する新規分子標的薬」
- ^ a b マリー E.『血液/腫瘍学シークレット』p.76
- ^ a b c 三森「真性赤血球増加症と妊娠」
- ^ ブリストル・マイヤーズ株式会社 ハイドレア 製品情報
- ^ マリー E.『血液/腫瘍学シークレット』p.77-78
- ^ a b 阿部『造血器腫瘍アトラス』p178
- ^ 押味『 WHO分類第4版による白血病・リンパ系腫瘍の病態学血液学』p33
参考文献
[編集]- 書籍
-
- 押味和夫 監修『WHO分類第4版による白血病・リンパ系腫瘍の病態学』中外医学社、2009年、ISBN 978-4-498-12525-4
- 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、ISBN 4-8306-1419-6
- 阿部 達生 編集『造血器腫瘍アトラス』日本医事新報社、2009年、ISBN 978-4-7849-4081-3
- 小川聡 総編集 『内科学書』Vol.6 改訂第7版、中山書店、2009年、ISBN 978-4-521-73173-5
- 黒川 清、他 編集主幹『内科学』Ⅱ第2版、文光堂、2003年、ISBN 4-8306-1289-4
- 直江 知樹、他 編集『WHO血液腫瘍分類』医薬ジャーナル社、2010年、ISBN 978-4-7532-2426-5
- 東原 正明、須永 真司 編集『血液内科クリニカルスタンダード』文光堂、2008年、ISBN 978-4-8306-1421-7
- 吉田 彌太郎 編集『血液疾患診療ハンドブック』改訂版、医薬ジャーナル社、2009年、ISBN 978-4-7532-2412-8
- アンソニー S.ファウチ、他、編『ハリソン内科学』第3版、 福井次矢、他 日本語版監修、メディカル・サイエンス・インターナショナル、2009年、ISBN 978-4-89592-627-0
- マーシャル・A.リクトマン、他 編『ウィリアムズ血液学マニュアル』奈良信雄訳、メディカル・サイエンス・インターナショナル、2003年、ISBN 4-89592-344-4
- マリー E.ウッド,ジョージ K.フィリップス編『血液/腫瘍学シークレット』奈良信雄監訳、メディカル・サイエンス・インターナショナル、2004年、ISBN 4-89592-375-4
- 論文
-
- 磯部 泰司、小松 則夫「骨髄増殖性腫瘍に対する新規分子標的薬」『Annual Review 血液 2010』中外医学社、2010、p91-98
- 下田 晴子、下田 和哉「骨髄増殖性疾患分子病態と治療」『血液内科』第62巻第5号、科学評論社、2011年5月、pp.648-655
- 三森 徹、小松 則夫「真性赤血球増加症と妊娠」月刊誌『血液・腫瘍科』第55巻第4号、科学評論社、2007年10月、pp.393-398
