「ソホスブビル」の版間の差分
| (2人の利用者による、間の3版が非表示) | |||
| 66行目: | 66行目: | ||
| StdInChIKey = TTZHDVOVKQGIBA-IQWMDFIBSA-N |
| StdInChIKey = TTZHDVOVKQGIBA-IQWMDFIBSA-N |
||
}} |
}} |
||
'''ソホスブビル''' |
'''ソホスブビル'''(Sofosbuvir)は[[C型肝炎]][[ウイルス]](HCV)感染症の治療薬として使用される[[ヌクレオチド]][[アナログ]]の一つである。ウイルスの[[NS5B]][[RNA依存性RNAポリメラーゼ|ポリメラーゼ]]を阻害する。商品名'''ソバルディ'''。従来の治療に比べ、ソホスブビルを含むレジメンでの治療効果(ウイルス学的著効(SVR)達成率)は2〜4倍とされ、副作用も少ない<ref>{{Cite journal |author=Berden FA, Kievit W, Baak LC, ''et al.'' |title=Dutch guidance for the treatment of chronic hepatitis C virus infection in a new therapeutic era |journal=Neth J Med |volume=72 |issue=8 |pages=388–400 |date=October 2014 |pmid=25387551 |doi= |url=}}</ref><ref>{{Cite journal |author=Cholongitas E, Papatheodoridis GV |title=Sofosbuvir: a novel oral agent for chronic hepatitis C |journal=Ann Gastroenterol |volume=27 |issue=4 |pages=331–337 |year=2014 |pmid=25332066 |pmc=4188929 |doi= |url=}}</ref><ref>{{Cite journal |author=Tran TT |title=A review of standard and newer treatment strategies in hepatitis C |journal=Am J Manag Care |volume=18 |issue=14 Suppl |pages=S340–9 |date=December 2012 |pmid=23327540 |doi= |url=}}</ref>。従来は重篤な副作用を伴う事の多いインターフェロンの注射<ref>{{Cite journal |author=Calvaruso V, Mazza M, Almasio PL |title=Pegylated-interferon-α(2a) in clinical practice: how to manage patients suffering from side effects |journal=Expert Opin Drug Saf |volume=10 |issue=3 |pages=429–35 |date=May 2011 |pmid=21323500 |doi=10.1517/14740338.2011.559161 |url=}}</ref>が必須であったが、ソホスブビルを用いると多くの患者が{{仮リンク|ペグインターフェロン|en|pegylated interferon}}(pegIFN)を用いる事なく治療に成功する<ref>{{Cite journal |author=Yau AH, Yoshida EM |title=Hepatitis C drugs: the end of the pegylated interferon era and the emergence of all-oral interferon-free antiviral regimens: a concise review |journal=Can J Gastroenterol Hepatol |volume=28 |issue=8 |pages=445–51 |date=September 2014 |pmid=25229466 |doi= |url=}}</ref>。開発コードPSI-7977、GS-7977。 |
||
ソホスブビルはHCVウイルスが自身のRNAを複製する |
ソホスブビルはHCVウイルスが自身のRNAを複製するために用いる[[RNAポリメラーゼ]]を阻害する。米国{{仮リンク|ファーマセット|en|Pharmasset}}社が発見し、米国[[ギリアド・サイエンシズ]]社が同社を買収<ref>{{cite web |url=http://www.bloomberg.co.jp/news/123-LV0FE41A1I4H01.html |title=米ギリアド、ファーマセットを110億ドルで買収へ-肝炎治療薬取得 |publisher=Bloomberg |date=2011-11-22 |accessdate=2015-05-14}}</ref>して[[医薬品開発|開発]]した<ref>{{Cite web | url = http://www.gilead.com/pipeline | title = PSI-7977 | publisher = Gilead Sciences |accessdate=2015-05-14}}</ref><!--日付不明-->。 |
||
2013年、米国[[アメリカ食品医薬品局|FDA]]は[[C型肝炎ウイルス#Genotypes|HCVジェノタイプ]]2 |
2013年、米国[[アメリカ食品医薬品局|FDA]]は[[C型肝炎ウイルス#Genotypes|HCVジェノタイプ]]2および3に対する経口薬治療法としてソホスブビル(SFV)と[[リバビリン]](RBV)の併用を、未治療のHCVジェノタイプ1および4に対する3剤併用療法としてpegIFN+RBV+SFVを承認した<ref name="medscape">{{Cite web | url = http://www.medscape.com/viewarticle/817371 | title = FDA Approves 'Game Changer' Hepatitis C Drug Sofosbuvir| author = Tucker M | date = December 6, 2013| publisher = Medscape |accessdate=2015-05-14}}</ref>。2014年にはウイルス由来NS5A阻害薬[[レジパスビル]](LDP)とSFVの併用療法が承認された<ref>{{Cite web |url=http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm418365.htm |title=FDA approves first combination pill to treat hepatitis C |work= |accessdate=2015-05-14}}</ref>。また、日本においてもLDP/SFV配合剤(商品名'''ハーボニー'''配合錠)が承認され、HCVジェノタイプIに対するIFNフリーの経口薬として販売されている<ref>{{Cite web |url=http://www.gilead.co.jp/~/media/japan/pdfs/press%20releases/8-31-2015/20150831_final_harvoni_launch_release_jpn.pdf?la=ja-jp|title=ギリアド・サイエンシズ ジェノタイプ1型C型慢性肝炎治療薬「ハーボニー配合錠」を新発売 |work= |accessdate=2015-09-06}}</ref>。 |
||
LDP+SFVの併用療法は、ジェノタイプ1(日米 |
LDP+SFVの併用療法は、ジェノタイプ1(日米ならびに欧州の多くの地域で最も頻度の高い型)について、前治療の有無または[[肝硬変]]の有無にかかわらず、インターフェロン未使用で高い治療率を誇る<ref name=harvoni>{{Cite web |url=http://www.gilead.com/~/media/Files/pdfs/medicines/liver-disease/harvoni/harvoni_pi.pdf |title=harvoni package insert |format=pdf |date=2015-03 |accessdate=2015-05-14}}</ref>。 |
||
[[WHO必須医薬品モデル・リスト]]に収載されている<ref>{{Cite web |url=http://www.who.int/medicines/publications/essentialmedicines/EML2015_8-May-15.pdf |title=www.who.int |format= |work= |accessdate=2015-05-14}}</ref>。 |
[[WHO必須医薬品モデル・リスト]]に収載されている<ref>{{Cite web |url=http://www.who.int/medicines/publications/essentialmedicines/EML2015_8-May-15.pdf |title=www.who.int |format= |work= |accessdate=2015-05-14}}</ref>。 |
||
| 78行目: | 78行目: | ||
==効能・効果== |
==効能・効果== |
||
日本で承認されている効能・効果は以下のとおり。 |
日本で承認されている効能・効果は以下のとおり。 |
||
* 単剤(ソバルディ) |
* 単剤(ソバルディ):セログループ2(ジェノタイプ2)のC型慢性肝炎またはC型代償性肝硬変におけるウイルス血症の改善<ref name="tenpu">{{cite web|url=http://www.info.pmda.go.jp/go/pack/6250042F1020_1_06/|title=ソバルディ錠400mg 添付文書|accessdate=2016-07-31|date=2016-07|publisher=}}</ref> |
||
* LDP配合剤(ハーボニー) |
* LDP配合剤(ハーボニー) :セログループ1(ジェノタイプ1)のC型慢性肝炎またはC型代償性肝硬変におけるウイルス血症の改善<ref name="tenpu2">{{cite web|url=http://www.info.pmda.go.jp/go/pack/6250107F1026_1_06/|title=ハーボニー配合錠 添付文書|accessdate=2016-07-31|date=2016-07|publisher=}}</ref> |
||
米国では、ジェノタイプ1、2、3、4のC型肝炎に対してリバビリンとの併用 |
米国では、ジェノタイプ1、2、3、4のC型肝炎に対してリバビリンとの併用またはリバビリンと{{仮リンク|ペグインターフェロン|en|pegylated interferon}}との併用で用いられる。あるいはジェノタイプ1に対してはNS5A阻害剤であるレジパスビルとの併用も認められている<ref name=harvoni/>。[[ヒト免疫不全ウイルス|HIV]]との[[重感染]]にも使用できる<ref name=Sofosbuvir>{{Cite web|title=Sofosbuvir Full Prescribing Information|url=https://www.gilead.com/~/media/Files/pdfs/medicines/liver-disease/sovaldi/sovaldi_pi.pdf|website=Www.Gilead.Com|publisher=Gilead|accessdate=28 October 2014}}</ref>。 |
||
2014年前半、{{仮リンク|米国肝臓学会議|en|American Association for the Study of Liver Diseases}}と{{仮リンク|米国感染症学会|en|Infectious Diseases Society of America}}がC型肝炎の管理について共同声明を発表した。声明では、ソホスブビルとリバビリンの併用は、インターフェロンの有無に |
2014年前半、{{仮リンク|米国肝臓学会議|en|American Association for the Study of Liver Diseases}}と{{仮リンク|米国感染症学会|en|Infectious Diseases Society of America}}がC型肝炎の管理について共同声明を発表した。声明では、ソホスブビルとリバビリンの併用は、インターフェロンの有無によらずジェノタイプ1〜6のHCVの第一選択肢(他の治療薬を排除しない)であり、同時に、第二選択肢以降としても使用できる、というものである<ref>{{Cite web|url=http://www.hcvguidelines.org/full-report/introduction|title=Recommendations for Testing, Managing, and Treating Hepatitis C|publisher={{仮リンク|AASLD|en|AASLD|label=AASLD}} and {{仮リンク|Infectious Diseases Society of America|en|Infectious Diseases Society of America|label=IDSA}}|accessdate=2 February 2014}}</ref>。 |
||
==禁忌== |
==禁忌== |
||
ソホスブビルは以下の患者には禁忌である<ref name=tenpu/>。 |
ソホスブビルは以下の患者には禁忌である<ref name=tenpu/>。 |
||
* 重度の腎機能障害(eGFR<30mL/分/1.73m<sup>2</sup>) |
* 重度の腎機能障害(eGFR<30mL/分/1.73m<sup>2</sup>)または透析を必要とする腎不全の患者 |
||
* [[カルバマゼピン]]、[[フェニトイン]]、[[リファンピシン]]を服用中の患者 |
* [[カルバマゼピン]]、[[フェニトイン]]、[[リファンピシン]]を服用中の患者 |
||
* [[セイヨウオトギリ]](セント・ジョーンズ・ワート)含有食品を摂取している患者 |
* [[セイヨウオトギリ]](セント・ジョーンズ・ワート)含有食品を摂取している患者 |
||
* 製剤成分に対し過敏症の既往歴の |
* 製剤成分に対し過敏症の既往歴のある患者 |
||
慎重投与 |
慎重投与 |
||
* B型肝炎ウイルス感染者 |
* B型肝炎ウイルス感染者または既往感染者では、B型肝炎ウイルスの再活性化が起こり得る。 |
||
==副作用== |
==副作用== |
||
添付文書に記載されている重大な副作用は、[[貧血]](11.4%)、[[高血圧]](1.4%)、脳血管障害(頻度不明)である。ソホスブビルの臨床試験はリバビリン |
添付文書に記載されている重大な副作用は、[[貧血]](11.4%)、[[高血圧]](1.4%)、脳血管障害(頻度不明)である。ソホスブビルの臨床試験はリバビリンなどとの併用で実施されていたので、副作用も併用時の副作用として理解すべきである。5%以上に発生する副作用として[[頭痛]]が記載されている<ref name=tenpu/>。 |
||
一般に見られる副作用は、頭痛の |
一般に見られる副作用は、頭痛のほか、倦怠感、嘔気、潮紅、易刺激性である。ほとんどの副作用は、インターフェロンを含むレジメンの方が含まないレジメンよりも多い。例として、頭痛、倦怠感はインターフェロンを含まないレジメンでは含むレジメンの半分程度であり、インフルエンザ様症状はインターフェロンを含まないレジメンで3〜6%、含むレジメンでは16〜18%である。また{{仮リンク|好中球減少|en|neutropenia}}はインターフェロンを含まないレジメンではほとんど起こらない<ref name=Sofosbuvir/><ref>Sofosbuvir {{Drugs.com|sfx|sofosbuvir}}</ref>。 |
||
===妊婦、産婦への投与=== |
===妊婦、産婦への投与=== |
||
ラット |
ラットおよびウサギではソホスブビルの胎児に対する作用は見られない<ref name=tenpu/>。米国FDAの[[胎児危険度分類|胎児危険度]]カテゴリーはB(妊婦に対する適切な、対照のある研究が存在しないもの。)である<ref name=Sofosbuvir>{{Cite web|title=Sofosbuvir Full Prescribing Information|url=https://www.gilead.com/~/media/Files/pdfs/medicines/liver-disease/sovaldi/sovaldi_pi.pdf|website=Www.Gilead.Com|publisher=Gilead|accessdate=28 October 2014}}</ref>。 |
||
ソホスブビル+リバビリン |
ソホスブビル+リバビリンまたはソホスブビル+リバビリン+インターフェロンのFDA胎児危険度カテゴリーはX(動物・人間による研究で明らかに胎児奇形を発生させる)である。リバビリンはラットおよびウサギで催奇形性作用が、ラットで胚・胎児致死作用が確認されている<ref name="MSD-Ribavirin">{{cite web|url=http://www.info.pmda.go.jp/go/pack/6250022M1021_1_35/|title=レベトールカプセル200mg 添付文書|accessdate=2016-11-05|date=2016-09|publisher=}}</ref>ので、妊婦およびその相手の男性の服用は避けるべきである<ref name="Roche - Ribavirin">{{Cite web|title=Copegus (Ribavirin, USP Tablets) Medication Guide|url=http://www.accessdata.fda.gov/drugsatfda_docs/label/2004/21511slr002_copegus_lbl.pdf|publisher=Roche|accessdate=28 October 2014}}</ref>。妊娠の可能性がある女性がソホスブビル・リバビリン・ペグインターフェロン併用療法を実施する際は、開始2ヶ月前から毎月、治療終了の6ヶ月後まで妊娠検査を実施する必要がある<ref name="Roche - Ribavirin"/>。 |
||
===授乳婦への投与=== |
===授乳婦への投与=== |
||
授乳婦がソホスブビルを服用した場合の児の副作用は明確でないが、主要代謝物であるGS-331007が乳汁中へ移行する |
授乳婦がソホスブビルを服用した場合の乳児の副作用は明確でないが、主要代謝物であるGS-331007が乳汁中へ移行することが確認されている<ref name=tenpu/>。リバビリンも乳汁中に移行する<ref name=MSD-Ribavirin/>。服用中は授乳しない様に勧められている<ref name="Sofosbuvir"/><ref name="Roche - Ribavirin"/>。 |
||
==相互作用== |
==相互作用== |
||
ソホスブビルは{{仮リンク|腸上皮|en|intestinal epithelium}}に |
ソホスブビルは{{仮リンク|腸上皮|en|intestinal epithelium}}において細胞内から消化管へと薬物などを移動させる[[P糖タンパク質|P糖蛋白質]]の基質である。したがって、リファンピシンや[[セント・ジョーンズ・ワート]]などのP糖蛋白質を誘導する物質は消化管からのソホスブビルの吸収を減少させる<ref name=tenpu/><ref name=Sofosbuvir/>。 |
||
加えて、抗痙攣薬、抗抗酸菌薬、HIVプロテアーゼ阻害剤({{仮リンク|チプラナビル|en|Tipranavir}})を併用すると、ソホスブビルの血中濃度を減少させると思われるので、併用は推奨されない。 |
加えて、抗痙攣薬、抗抗酸菌薬、HIVプロテアーゼ阻害剤({{仮リンク|チプラナビル|en|Tipranavir}})を併用すると、ソホスブビルの血中濃度を減少させると思われるので、併用は推奨されない。 |
||
ソホスブビルは多くの医薬品との併用が臨床試験で検討され、[[シクロスポリン]]、{{仮リンク|ダルナビル|en|darunavir}}/[[リトナビル]]、{{仮リンク|エファビレンツ|en|efavirenz}}、{{仮リンク|エムトリシタビン|en|emtricitabine}}、[[メサドン]]、{{仮リンク|ラルテグラビル|en|raltegravir}}、{{仮リンク|リルピビリン|en|rilpivirine}}、[[タクロリムス]]、[[テノホビル]] |
ソホスブビルは多くの医薬品との併用が臨床試験で検討され、[[シクロスポリン]]、{{仮リンク|ダルナビル|en|darunavir}}/[[リトナビル]]、{{仮リンク|エファビレンツ|en|efavirenz}}、{{仮リンク|エムトリシタビン|en|emtricitabine}}、[[メサドン]]、{{仮リンク|ラルテグラビル|en|raltegravir}}、{{仮リンク|リルピビリン|en|rilpivirine}}、[[タクロリムス]]、[[テノホビル]]などはソホスブビルの血中濃度に影響を与えないことが判っている<ref name=Sofosbuvir/><ref>Karageorgopoulos DE, El-Sherif O, Bhagani S, Khoo SH., Curr Opin Infect Dis. 2014 Feb;27(1):36-45. doi: 10.1097/QCO.0000000000000034. Review. Drug interactions between antiretrovirals and new or emerging direct-acting antivirals in HIV/hepatitis C virus confection</ref>。 |
||
===心臓への副作用=== |
===心臓への副作用=== |
||
2015年3月、ソホスブビルと[[アミオダロン]]、[[ダクラタスビル]]、{{仮リンク|シメプレビル|en|simeprevir}}を併用した患者9名に異常な[[徐脈]]を生じ、1名が[[心停止]]で死亡した |
2015年3月、ソホスブビルと[[アミオダロン]]、[[ダクラタスビル]]、{{仮リンク|シメプレビル|en|simeprevir}}を併用した患者9名に異常な[[徐脈]]を生じ、1名が[[心停止]]で死亡したことが明らかにされた。3名は[[心臓ペースメーカー]]を装着した。これを受けて米国では添付文書が改定されることになった<ref>West, Stephen. [http://www.bloomberg.com/news/articles/2015-03-21/gilead-warns-after-hepatitis-patient-on-heart-drug-dies "Gilead Warns After Hepatitis Patient on Heart Drug Dies"]. Published 21 March 2015.</ref><ref>{{Cite web|url = http://www.fda.gov/Drugs/DrugSafety/ucm439484.htm|title = FDA Drug Safety Communication|date = 24 March 2015|accessdate = 24 March 2015 |publisher = |last = |first = }}</ref>。 |
||
==臨床試験== |
==臨床試験== |
||
{{節stub}} |
{{節stub}} |
||
ソホスブビルについては多くの臨床試験が実施されている。その一つPROTON試験では、ジェノタイプ1に対するソホスブビル200mg+リバビリン+ペグインターフェロンの12週後のウイルス学的著効率(SVR12)は90%、ソホスブビル400mg+リバビリン+ペグインターフェロンのSVR12は91%、ジェノタイプ2 |
ソホスブビルについては多くの臨床試験が実施されている。その一つPROTON試験では、ジェノタイプ1に対するソホスブビル200mg+リバビリン+ペグインターフェロンの12週後のウイルス学的著効率(SVR12)は90%、ソホスブビル400mg+リバビリン+ペグインターフェロンのSVR12は91%、ジェノタイプ2または3に対するソホスブビル400mg+リバビリン+ペグインターフェロンのSVR12は92%であった<ref>{{cite journal |url=http://www.thelancet.com/journals/laninf/article/PIIS1473-3099%2813%2970033-1/fulltext |author=Eric Lawitz, Jay P Lalezari, Tarek Hassanein, et al. |title=Sofosbuvir in combination with peginterferon alfa-2a and ribavirin for non-cirrhotic, treatment-naive patients with genotypes 1, 2, and 3 hepatitis C infection: a randomised, double-blind, phase 2 trial |journal=The Lancet Infectious Diseases |volume=13 |issue=5 |pages=401-408 |doi=10.1016/S1473-3099(13)70033-1 |pmid=23499158 |date=2013-05 |accessdate=2015-05-15}}</ref>。 |
||
またELECTRON試験では、前治療のないジェノタイプ2または3のHCVに対してソホスブビル+リバビリン+ペグインターフェロンを投与した患者で24週後の著効率(SVR24)が100%(10/10)であった<ref>[http://hivandhepatitis.com/hepatitis-c/hepatitis-c-topics/hcv-treatment/3336-aasld-psi-7977-plus-ribavirin-can-cure-hepatitis-c-in-12-weeks-without-interferon AASLD: PSI-7977 plus Ribavirin Can Cure Hepatitis C in 12 Weeks without Interferon]. Highleyman, L. HIVandHepatitis.com. 8 November 2011.</ref><ref name="pmid23281974">{{Cite journal | author = Gane EJ, Stedman CA, Hyland RH, Ding X, Svarovskaia E, Symonds WT, Hindes RG, Berrey MM | title = Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C | journal = N. Engl. J. Med. | volume = 368 | issue = 1 | pages = 34–44 |date=January 2013 | pmid = 23281974 | doi = 10.1056/NEJMoa1208953 }}</ref>。ソホスブビル単剤では60%(6/10)であった。 |
|||
==作用機序== |
==作用機序== |
||
ソホスブビルは{{仮リンク|プロチド|en|protide|label=ProTide}}技術を利用して創薬された[[プロドラッグ]]である。肝細胞内で代謝され、活性代謝物 2'-デオキシ-2'-α-フルオロ-β-''C''-メチルウリジン-5'-三リン酸 になる。三リン酸体はウイルスのRNAポリメラーゼである[[非構造蛋白質5B|NS5B]]に |
ソホスブビルは{{仮リンク|プロチド|en|protide|label=ProTide}}技術を利用して創薬された[[プロドラッグ]]である。肝細胞内で代謝され、活性代謝物 2'-デオキシ-2'-α-フルオロ-β-''C''-メチルウリジン-5'-三リン酸 になる。三リン酸体はウイルスのRNAポリメラーゼである[[非構造蛋白質5B|NS5B]]によってRNA鎖内に取り込まれ、RNA合成を停止させる<ref>{{Cite journal |
||
| pmid = 24733478 |
| pmid = 24733478 |
||
| pmc = 4068585 |
| pmc = 4068585 |
||
| 146行目: | 146行目: | ||
| first6 = J |
| first6 = J |
||
| doi = 10.1128/AAC.02666-14 |
| doi = 10.1128/AAC.02666-14 |
||
}}</ref>。ソホスブビルに先立ち、様々なヌクレオシドアナログが合成されたが、HCVへの効果は不十分であった。その原因の一つは、三リン酸化の前の一リン酸化の過程が遅い |
}}</ref>。ソホスブビルに先立ち、様々なヌクレオシドアナログが合成されたが、HCVへの効果は不十分であった。その原因の一つは、三リン酸化の前の一リン酸化の過程が遅いことにあった。ソホスブビルでは{{仮リンク|プロチド|en|protide|label=ProTide}}法に基づき、予め一リン酸化された物質を医薬品として用いる事とした。さらに、薬物分子を感染細胞内に速やかに侵入させるためには負の電荷を打ち消す必要があったので置換基が付加された<ref name="pmid20801890">{{Cite journal | author = Murakami E, Tolstykh T, Bao H, Niu C, Steuer HM, Bao D, Chang W, Espiritu C, Bansal S, Lam AM, Otto MJ, Sofia MJ, Furman PA | title = Mechanism of activation of PSI-7851 and its diastereoisomer PSI-7977 | journal = J. Biol. Chem. | volume = 285 | issue = 45 | pages = 34337–47 |date=November 2010 | pmid = 20801890 | pmc = 2966047 | doi = 10.1074/jbc.M110.161802 }}</ref><ref>{{Cite web | url = http://hepaton.com/272/sofosbuvir | title = Sofosbuvir | author = Alejandro Soza | date = November 11, 2012 | publisher = Hepaton |accessdate=2015-05-15}}</ref><!--日付不明-->。NS5Bはウイルスの複製に不可欠の[[RNA依存性RNAポリメラーゼ]]である。 |
||
[[ファイル:Sofosbuvir prodrug chemistry.svg|thumb|center|upright=3.0]] |
[[ファイル:Sofosbuvir prodrug chemistry.svg|thumb|center|upright=3.0]] |
||
ソホスブビル |
ソホスブビルなどの直接作用型抗ウイルス薬は抵抗性形成を極めて生じ難い。C型肝炎の治療失敗の原因がウイルスの耐性獲得による処が大きい現状において、これは重要な利点である<ref>{{Cite journal |author=Chae HB, Park SM, Youn SJ |title=Direct-acting antivirals for the treatment of chronic hepatitis C: open issues and future perspectives |journal=ScientificWorldJournal |volume=2013 |issue= |pages=704912 |year=2013 |pmid=23844410 |pmc=3687480 |doi=10.1155/2013/704912 |url=}}</ref><ref>{{Cite journal |author=Wu S, Kanda T, Nakamoto S, Imazeki F, Yokosuka O |title=Hepatitis C virus protease inhibitor-resistance mutations: Our experience and review |journal=World J. Gastroenterol. |volume=19 |issue=47 |pages=8940–8948 |date=December 2013 |pmid=24379619 |pmc=3870547 |doi=10.3748/wjg.v19.i47.8940 |url=}}</ref>。 |
||
==承認状況== |
==承認状況== |
||
ソホスブビルの{{仮リンク|新薬承認申請|en|New Drug Application}}は米国では2013年4月に提出され、FDAから画期的治療薬の指定を受け、優先審査される事となった<ref>{{Cite web | url = http://www.drugs.com/nda/sofosbuvir_131025.html | title = FDA Advisory Committee Supports Approval of Gilead’s Sofosbuvir for Chronic Hepatitis C Infection | date = October 25, 2013 | publisher = ''Drugs.com'' |accessdate=2015-05-15}}</ref>。2013年12月、FDAはC型肝炎に対するソホスブビルの使用を承認した<ref name="urlFDA approves Sovaldi for chronic hepatitis C">{{Cite web | url = http://www.fda.gov/newsevents/newsroom/pressannouncements/ucm377888.htm | title = FDA approves Sovaldi for chronic hepatitis C | date = 2013-12-06| work = FDA New Release | publisher = U.S. Food and Drug Administration |accessdate=2015-05-15}}</ref>。 |
ソホスブビルの{{仮リンク|新薬承認申請|en|New Drug Application}}は米国では2013年4月に提出され、FDAから画期的治療薬の指定を受け、優先審査される事となった<ref>{{Cite web | url = http://www.drugs.com/nda/sofosbuvir_131025.html | title = FDA Advisory Committee Supports Approval of Gilead’s Sofosbuvir for Chronic Hepatitis C Infection | date = October 25, 2013 | publisher = ''Drugs.com'' |accessdate=2015-05-15}}</ref>。2013年12月、FDAはC型肝炎に対するソホスブビルの使用を承認した<ref name="urlFDA approves Sovaldi for chronic hepatitis C">{{Cite web | url = http://www.fda.gov/newsevents/newsroom/pressannouncements/ucm377888.htm | title = FDA approves Sovaldi for chronic hepatitis C | date = 2013-12-06| work = FDA New Release | publisher = U.S. Food and Drug Administration |accessdate=2015-05-15}}</ref>。 |
||
日本では、2014年6月に承認申請資料が提出され<ref>{{cite web |url=http://www.gilead.co.jp/~/media/Japan/PDFs/Press%20Releases/6-27-14/Rev_0627_Japan_GT2_NDA-1.pdf |title=ギリアド社、C型慢性肝炎に対するソホスブビル(Sofosbuvir)の新薬承認申請を日本の医薬品医療機器総合機構(PMDA)に提出 |publisher=ギリアド・サイエンシズ |date=2014-06-27 |accessdate=2015-05-14}}</ref>、2015年3月に承認された<ref>{{cite web |url=http://www.gilead.co.jp/~/media/Japan/PDFs/Press%20Releases/3-26-15/Japan_Sovaldi_Approval_final.pdf |title=ギリアド・サイエンシズ ジェノタイプ2型C型慢性肝炎治療薬ソバルディ |
日本では、2014年6月に承認申請資料が提出され<ref>{{cite web |url=http://www.gilead.co.jp/~/media/Japan/PDFs/Press%20Releases/6-27-14/Rev_0627_Japan_GT2_NDA-1.pdf |title=ギリアド社、C型慢性肝炎に対するソホスブビル(Sofosbuvir)の新薬承認申請を日本の医薬品医療機器総合機構(PMDA)に提出 |publisher=ギリアド・サイエンシズ |date=2014-06-27 |accessdate=2015-05-14}}</ref>、2015年3月に承認された<ref>{{cite web |url=http://www.gilead.co.jp/~/media/Japan/PDFs/Press%20Releases/3-26-15/Japan_Sovaldi_Approval_final.pdf |title=ギリアド・サイエンシズ ジェノタイプ2型C型慢性肝炎治療薬ソバルディ錠400mgの製造販売承認取得 |publisher=ギリアド・サイエンシズ |date=2015-03-26 |accessdate=2015-05-14}}</ref>。 |
||
欧州では、2013年4月に承認申請資料が提出され<ref>{{cite web |url=http://investors.gilead.com/phoenix.zhtml?c=69964&p=irol-newsArticle&ID=1822966 |title=European Medicines Agency Validates Gilead's Marketing Application for Sofosbuvir for the Treatment of Hepatitis C |publisher=Gilead |date=2013-05-21 |accessdate=2015-05-15}}</ref>、2013年11月に承認勧告された<ref>{{cite web |url=http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2013/11/news_detail_001970.jsp&mid=WC0b01ac058004d5c1 |title=European Medicines Agency recommends approval of sofosbuvir for the treatment of chronic hepatitis C |publisher=European Medicines Agency |date=2013-11-22 |accessdate=2015-05-15}}</ref>。 |
欧州では、2013年4月に承認申請資料が提出され<ref>{{cite web |url=http://investors.gilead.com/phoenix.zhtml?c=69964&p=irol-newsArticle&ID=1822966 |title=European Medicines Agency Validates Gilead's Marketing Application for Sofosbuvir for the Treatment of Hepatitis C |publisher=Gilead |date=2013-05-21 |accessdate=2015-05-15}}</ref>、2013年11月に承認勧告された<ref>{{cite web |url=http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2013/11/news_detail_001970.jsp&mid=WC0b01ac058004d5c1 |title=European Medicines Agency recommends approval of sofosbuvir for the treatment of chronic hepatitis C |publisher=European Medicines Agency |date=2013-11-22 |accessdate=2015-05-15}}</ref>。 |
||
薬価は1錠あたり米国で1000ドル、日本では42000円ほど<ref>{{Cite report|publisher=一般社団法人国際貿易投資研究所 |title= C型肝炎の特効薬・ソバルディの国別販売価格-新薬開発と必須医薬品の供給の共存を目指す- |date=2016-05-12 |url= http://www.iti.or.jp/flash278.htm}}</ref>。 |
|||
==研究== |
==研究== |
||
ソホスブビルと、[[ダクラタスビル]]や[[レジパスビル]] |
ソホスブビルと、[[ダクラタスビル]]や[[レジパスビル]]などのNS5A阻害薬との併用は、HCVに対するウイルス学的著効率が100%に達する場合がある。臨床試験の多くは94%〜97%であり、従来の治療法よりも充分に高い<ref name="urlAASLD 2012: Sofosbuvir and daclatasvir dual regimen cures most people with HCV genotypes 1, 2, or 3 - ELPA - European Liver Patients Association">{{Cite web | url = http://www.elpa-info.org/elpa-news---reader/items/aasld-2012-sofosbuvir-and-daclatasvir-dual-regimen-cures-most-people-with-hcv-genotypes-1-2-or-3.htm | title = AASLD 2012: Sofosbuvir and daclatasvir dual regimen cures most people with HCV genotypes 1, 2, or 3 | author = | date = 2012-11-21 | work = News | publisher = European Liver Patients Association |accessdate=2015-05-15}}</ref><ref>{{Cite journal|url = http://www.sciencedirect.com/science/article/pii/S0149291814008704|title = Simeprevir and Sofosbuvir for Treatment of Chronic Hepatitis C Infection|last = Childs-Kean|first = Lindsey|date = January 16, 2015|journal = Clinical Therapeutics|doi = 10.1016/j.clinthera.2014.12.012|pmid = 25601269|access-date =|volume=37|pages=243–67}}</ref><ref>{{Cite journal|url = http://aop.sagepub.com/content/49/3/343.long|title = Interferon-/Ribavirin-Free Regimen for Chronic Hepatitis C Virus Infection|last = Smith|first = Michael|date = December 16, 2014|journal = Annals of pharmacotherapy|doi = 10.1177/1060028014563952|pmid = 25515863|access-date =|volume=49|pages=343–50}}</ref>。 |
||
2013年に開催された第20回レトロウイルス |
2013年に開催された第20回レトロウイルスおよび日和見感染症学会(Conference on Retroviruses and Opportunistic Infections、CROI)で発表されたデータに拠ると、ソホスブビル+レジパスビル+リバビリンの3剤併用療法でジェノタイプ1のHCVに対する12週でのウイルス学的著効率(SVR12)は前治療無しおよび前治療無反応の患者のいずれでも100%であった<ref>[http://www.hivandhepatitis.com/hcv-treatment/experimental-hcv-drugs/4005-croi-2013-sofosbuvirledipasvirribavirin-combo-for-hcv-produces-100-sustained-response CROI 2013: Sofosbuvir + Ledipasvir + Ribavirin Combo for HCV Produces 100% Sustained Response]. Highleyman, L. HIVandHepatitis.com. 4 March 2013.</ref>。ソホスブビルとレジパスビルの合剤について±リバビリンの治験が実施された。 |
||
2014年10月、FDAはソホスブビル400mgとレジパスビル90mgの合剤(商品名 |
2014年10月、FDAはソホスブビル400mgとレジパスビル90mgの合剤(商品名ハーボニー)を承認した<ref>{{Cite web|url=http://www.gilead.com/news/press-releases/2014/10/us-food-and-drug-administration-approves-gileads-harvoni-ledipasvirsofosbuvir-the-first-oncedaily-single-tablet-regimen-for-the-treatment-of-genotype-1-chronic-hepatitis-c|title=U.S. Food and Drug Administration Approves Gilead’s Harvoni (Ledipasvir/Sofosbuvir), the First Once-Daily Single Tablet Regimen for the Treatment of Genotype 1 Chronic Hepatitis C |date=10 Oct 2014|accessdate=10 Oct 2014}}</ref>。その後日本でも2015年7月に厚生労働省がハーボニーの製造販売を承認した<ref>{{cite web |url=http://www.gilead.co.jp/~/media/japan/pdfs/press%20releases/7-3-2015/gilead_harvoni_japan_approval_final.pdf?la=ja-jp |title=ジェノタイプ1型C型慢性肝炎治療薬1日1回1錠経口投与「ハーボニー配合錠」製造販売承認取得 |publisher=ギリアド・サイエンシズ |date=2015-07-03 |accessdate=2015-07-22}}</ref>。 |
||
==その他== |
==その他== |
||
ソホスブビルが使える様になる以前は、C型肝炎の治療はインターフェロンを基本とした6〜12ヶ月の治療が一般的であり、治癒率は70%以下であった上、貧血、 |
ソホスブビルが使える様になる以前は、C型肝炎の治療はインターフェロンを基本とした6〜12ヶ月の治療が一般的であり、治癒率は70%以下であった上、貧血、うつ病、重症発疹、嘔気、下痢、疲労といった副作用が伴っていた。ソホスブビルの臨床開発が進むに連れて、医師は患者を“保留”し始めた<ref>{{Cite web |url=http://www.wsj.com/articles/SB10001424127887323293704578330712442353712 |title=Hepatitis C Dilemma: Treat Illness With Interferon Now or Wait? - WSJ |format= |work= |accessdate=2015-05-15}}</ref>。米国でのソバルディの上市後の立ち上がりは医薬品の歴史上最速であった<ref>{{Cite web |url=http://www.forbes.com/sites/matthewherper/2014/02/21/gileads-hepatitis-c-pill-takes-off-like-a-rocket/ |title=Gilead's Hepatitis C Pill Takes Off Like A Rocket - Forbes |format= |work= |accessdate=2015-05-15}}</ref>。最初の30週間に6万人以上の患者がソバルディを服用した。これは米国のC型肝炎患者の約5%に当たる<ref>{{Cite web |url=http://www.mercurynews.com/business/ci_26237037/gileads-sovaldi-prescribed-more-than-all-other-hepatitis |title=Gilead's Sovaldi prescribed more than all other hepatitis C drugs combined - San Jose Mercury News |format= |work= |accessdate=2015-05-15}}</ref><ref>{{Cite web |url=http://pi.vrtx.com/files/uspi_telaprevir.pdf |title=pi.vrtx.com |format= |work= |accessdate=2015-05-15}}</ref><ref>{{Cite web |url=http://www.medscape.com/viewarticle/817371 |title=FDA Approves 'Game Changer' Hepatitis C Drug Sofosbuvir |format= |work= |accessdate=2015-05-15}}</ref><ref>{{Cite web |url=http://www.fda.gov/ForConsumers/ConsumerUpdates/ucm405642.htm |title=Faster, Easier Cures for Hepatitis C |work= |accessdate=2015-05-15}}</ref>。 |
||
[[2017年]]1月、[[奈良県]]でレジパスビルとの配合剤(ハーボニー配合錠)の偽造品が流通していることが判明。厚生労働省は、都道府県や関係団体に文書で注意を呼び掛けた<ref>[http://www.yomiuri.co.jp/national/20170117-OYT1T50079.html |
[[2017年]]1月、[[奈良県]]でレジパスビルとの配合剤(ハーボニー配合錠)の偽造品が流通していることが判明。厚生労働省は、都道府県や関係団体に文書で注意を呼び掛けた<ref>[http://www.yomiuri.co.jp/national/20170117-OYT1T50079.html C型肝炎薬に偽造品、厚労省注意呼びかけ…奈良] 読売新聞オンライン(2017年01月17日)</ref>。 |
||
== |
==出典== |
||
{{Reflist|colwidth=30em}} |
{{Reflist|colwidth=30em}} |
||
| 180行目: | 182行目: | ||
[[Category:有機フッ素化合物]] |
[[Category:有機フッ素化合物]] |
||
[[Category:リン酸エステル]] |
[[Category:リン酸エステル]] |
||
[[Category:WHOエッセンシャルドラッグ]] |
|||
2018年5月2日 (水) 20:21時点における版
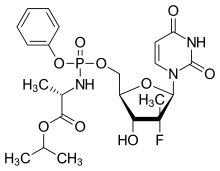 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Sovaldi,Hepcinat, Resof, Hepcvir, SoviHep |
| Drugs.com | entry |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 92% |
| 血漿タンパク結合 | 61–65% |
| 代謝 | Quickly activated to triphosphate |
| 半減期 | 0.4 hrs (sofosbuvir) 27 hrs (active metabolite GS-331007) |
| 排泄 | 80% feces, 14% urine (mostly as GS-331007) |
| データベースID | |
| CAS番号 | 1190307-88-0 |
| ATCコード | J05AX15 (WHO) |
| PubChem | CID: 45375808 |
| DrugBank | DB08934 |
| ChemSpider | 26286922 |
| UNII |
WJ6CA3ZU8B |
| KEGG | D10366 |
| ChEBI | CHEBI:85083en:Template:ebicite |
| ChEMBL | CHEMBL1259059 |
| 別名 | PSI-7977; GS-7977 |
| 化学的データ | |
| 化学式 | C22H29FN3O9P |
| 分子量 | 529.453 g/mol |
| |
| |
ソホスブビル(Sofosbuvir)はC型肝炎ウイルス(HCV)感染症の治療薬として使用されるヌクレオチドアナログの一つである。ウイルスのNS5Bポリメラーゼを阻害する。商品名ソバルディ。従来の治療に比べ、ソホスブビルを含むレジメンでの治療効果(ウイルス学的著効(SVR)達成率)は2〜4倍とされ、副作用も少ない[1][2][3]。従来は重篤な副作用を伴う事の多いインターフェロンの注射[4]が必須であったが、ソホスブビルを用いると多くの患者がペグインターフェロン(pegIFN)を用いる事なく治療に成功する[5]。開発コードPSI-7977、GS-7977。
ソホスブビルはHCVウイルスが自身のRNAを複製するために用いるRNAポリメラーゼを阻害する。米国ファーマセット社が発見し、米国ギリアド・サイエンシズ社が同社を買収[6]して開発した[7]。
2013年、米国FDAはHCVジェノタイプ2および3に対する経口薬治療法としてソホスブビル(SFV)とリバビリン(RBV)の併用を、未治療のHCVジェノタイプ1および4に対する3剤併用療法としてpegIFN+RBV+SFVを承認した[8]。2014年にはウイルス由来NS5A阻害薬レジパスビル(LDP)とSFVの併用療法が承認された[9]。また、日本においてもLDP/SFV配合剤(商品名ハーボニー配合錠)が承認され、HCVジェノタイプIに対するIFNフリーの経口薬として販売されている[10]。
LDP+SFVの併用療法は、ジェノタイプ1(日米ならびに欧州の多くの地域で最も頻度の高い型)について、前治療の有無または肝硬変の有無にかかわらず、インターフェロン未使用で高い治療率を誇る[11]。
WHO必須医薬品モデル・リストに収載されている[12]。
効能・効果
日本で承認されている効能・効果は以下のとおり。
- 単剤(ソバルディ):セログループ2(ジェノタイプ2)のC型慢性肝炎またはC型代償性肝硬変におけるウイルス血症の改善[13]
- LDP配合剤(ハーボニー) :セログループ1(ジェノタイプ1)のC型慢性肝炎またはC型代償性肝硬変におけるウイルス血症の改善[14]
米国では、ジェノタイプ1、2、3、4のC型肝炎に対してリバビリンとの併用またはリバビリンとペグインターフェロンとの併用で用いられる。あるいはジェノタイプ1に対してはNS5A阻害剤であるレジパスビルとの併用も認められている[11]。HIVとの重感染にも使用できる[15]。
2014年前半、米国肝臓学会議と米国感染症学会がC型肝炎の管理について共同声明を発表した。声明では、ソホスブビルとリバビリンの併用は、インターフェロンの有無によらずジェノタイプ1〜6のHCVの第一選択肢(他の治療薬を排除しない)であり、同時に、第二選択肢以降としても使用できる、というものである[16]。
禁忌
ソホスブビルは以下の患者には禁忌である[13]。
- 重度の腎機能障害(eGFR<30mL/分/1.73m2)または透析を必要とする腎不全の患者
- カルバマゼピン、フェニトイン、リファンピシンを服用中の患者
- セイヨウオトギリ(セント・ジョーンズ・ワート)含有食品を摂取している患者
- 製剤成分に対し過敏症の既往歴のある患者
慎重投与
- B型肝炎ウイルス感染者または既往感染者では、B型肝炎ウイルスの再活性化が起こり得る。
副作用
添付文書に記載されている重大な副作用は、貧血(11.4%)、高血圧(1.4%)、脳血管障害(頻度不明)である。ソホスブビルの臨床試験はリバビリンなどとの併用で実施されていたので、副作用も併用時の副作用として理解すべきである。5%以上に発生する副作用として頭痛が記載されている[13]。
一般に見られる副作用は、頭痛のほか、倦怠感、嘔気、潮紅、易刺激性である。ほとんどの副作用は、インターフェロンを含むレジメンの方が含まないレジメンよりも多い。例として、頭痛、倦怠感はインターフェロンを含まないレジメンでは含むレジメンの半分程度であり、インフルエンザ様症状はインターフェロンを含まないレジメンで3〜6%、含むレジメンでは16〜18%である。また好中球減少はインターフェロンを含まないレジメンではほとんど起こらない[15][17]。
妊婦、産婦への投与
ラットおよびウサギではソホスブビルの胎児に対する作用は見られない[13]。米国FDAの胎児危険度カテゴリーはB(妊婦に対する適切な、対照のある研究が存在しないもの。)である[15]。
ソホスブビル+リバビリンまたはソホスブビル+リバビリン+インターフェロンのFDA胎児危険度カテゴリーはX(動物・人間による研究で明らかに胎児奇形を発生させる)である。リバビリンはラットおよびウサギで催奇形性作用が、ラットで胚・胎児致死作用が確認されている[18]ので、妊婦およびその相手の男性の服用は避けるべきである[19]。妊娠の可能性がある女性がソホスブビル・リバビリン・ペグインターフェロン併用療法を実施する際は、開始2ヶ月前から毎月、治療終了の6ヶ月後まで妊娠検査を実施する必要がある[19]。
授乳婦への投与
授乳婦がソホスブビルを服用した場合の乳児の副作用は明確でないが、主要代謝物であるGS-331007が乳汁中へ移行することが確認されている[13]。リバビリンも乳汁中に移行する[18]。服用中は授乳しない様に勧められている[15][19]。
相互作用
ソホスブビルは腸上皮において細胞内から消化管へと薬物などを移動させるP糖蛋白質の基質である。したがって、リファンピシンやセント・ジョーンズ・ワートなどのP糖蛋白質を誘導する物質は消化管からのソホスブビルの吸収を減少させる[13][15]。
加えて、抗痙攣薬、抗抗酸菌薬、HIVプロテアーゼ阻害剤(チプラナビル)を併用すると、ソホスブビルの血中濃度を減少させると思われるので、併用は推奨されない。
ソホスブビルは多くの医薬品との併用が臨床試験で検討され、シクロスポリン、ダルナビル/リトナビル、エファビレンツ、エムトリシタビン、メサドン、ラルテグラビル、リルピビリン、タクロリムス、テノホビルなどはソホスブビルの血中濃度に影響を与えないことが判っている[15][20]。
心臓への副作用
2015年3月、ソホスブビルとアミオダロン、ダクラタスビル、シメプレビルを併用した患者9名に異常な徐脈を生じ、1名が心停止で死亡したことが明らかにされた。3名は心臓ペースメーカーを装着した。これを受けて米国では添付文書が改定されることになった[21][22]。
臨床試験
この節の加筆が望まれています。 |
ソホスブビルについては多くの臨床試験が実施されている。その一つPROTON試験では、ジェノタイプ1に対するソホスブビル200mg+リバビリン+ペグインターフェロンの12週後のウイルス学的著効率(SVR12)は90%、ソホスブビル400mg+リバビリン+ペグインターフェロンのSVR12は91%、ジェノタイプ2または3に対するソホスブビル400mg+リバビリン+ペグインターフェロンのSVR12は92%であった[23]。
またELECTRON試験では、前治療のないジェノタイプ2または3のHCVに対してソホスブビル+リバビリン+ペグインターフェロンを投与した患者で24週後の著効率(SVR24)が100%(10/10)であった[24][25]。ソホスブビル単剤では60%(6/10)であった。
作用機序
ソホスブビルはProTide技術を利用して創薬されたプロドラッグである。肝細胞内で代謝され、活性代謝物 2'-デオキシ-2'-α-フルオロ-β-C-メチルウリジン-5'-三リン酸 になる。三リン酸体はウイルスのRNAポリメラーゼであるNS5BによってRNA鎖内に取り込まれ、RNA合成を停止させる[26]。ソホスブビルに先立ち、様々なヌクレオシドアナログが合成されたが、HCVへの効果は不十分であった。その原因の一つは、三リン酸化の前の一リン酸化の過程が遅いことにあった。ソホスブビルではProTide法に基づき、予め一リン酸化された物質を医薬品として用いる事とした。さらに、薬物分子を感染細胞内に速やかに侵入させるためには負の電荷を打ち消す必要があったので置換基が付加された[27][28]。NS5Bはウイルスの複製に不可欠のRNA依存性RNAポリメラーゼである。

ソホスブビルなどの直接作用型抗ウイルス薬は抵抗性形成を極めて生じ難い。C型肝炎の治療失敗の原因がウイルスの耐性獲得による処が大きい現状において、これは重要な利点である[29][30]。
承認状況
ソホスブビルの新薬承認申請は米国では2013年4月に提出され、FDAから画期的治療薬の指定を受け、優先審査される事となった[31]。2013年12月、FDAはC型肝炎に対するソホスブビルの使用を承認した[32]。
日本では、2014年6月に承認申請資料が提出され[33]、2015年3月に承認された[34]。
欧州では、2013年4月に承認申請資料が提出され[35]、2013年11月に承認勧告された[36]。
薬価は1錠あたり米国で1000ドル、日本では42000円ほど[37]。
研究
ソホスブビルと、ダクラタスビルやレジパスビルなどのNS5A阻害薬との併用は、HCVに対するウイルス学的著効率が100%に達する場合がある。臨床試験の多くは94%〜97%であり、従来の治療法よりも充分に高い[38][39][40]。
2013年に開催された第20回レトロウイルスおよび日和見感染症学会(Conference on Retroviruses and Opportunistic Infections、CROI)で発表されたデータに拠ると、ソホスブビル+レジパスビル+リバビリンの3剤併用療法でジェノタイプ1のHCVに対する12週でのウイルス学的著効率(SVR12)は前治療無しおよび前治療無反応の患者のいずれでも100%であった[41]。ソホスブビルとレジパスビルの合剤について±リバビリンの治験が実施された。
2014年10月、FDAはソホスブビル400mgとレジパスビル90mgの合剤(商品名ハーボニー)を承認した[42]。その後日本でも2015年7月に厚生労働省がハーボニーの製造販売を承認した[43]。
その他
ソホスブビルが使える様になる以前は、C型肝炎の治療はインターフェロンを基本とした6〜12ヶ月の治療が一般的であり、治癒率は70%以下であった上、貧血、うつ病、重症発疹、嘔気、下痢、疲労といった副作用が伴っていた。ソホスブビルの臨床開発が進むに連れて、医師は患者を“保留”し始めた[44]。米国でのソバルディの上市後の立ち上がりは医薬品の歴史上最速であった[45]。最初の30週間に6万人以上の患者がソバルディを服用した。これは米国のC型肝炎患者の約5%に当たる[46][47][48][49]。
2017年1月、奈良県でレジパスビルとの配合剤(ハーボニー配合錠)の偽造品が流通していることが判明。厚生労働省は、都道府県や関係団体に文書で注意を呼び掛けた[50]。
出典
- ^ Berden FA, Kievit W, Baak LC, et al. (October 2014). “Dutch guidance for the treatment of chronic hepatitis C virus infection in a new therapeutic era”. Neth J Med 72 (8): 388–400. PMID 25387551.
- ^ Cholongitas E, Papatheodoridis GV (2014). “Sofosbuvir: a novel oral agent for chronic hepatitis C”. Ann Gastroenterol 27 (4): 331–337. PMC 4188929. PMID 25332066.
- ^ Tran TT (December 2012). “A review of standard and newer treatment strategies in hepatitis C”. Am J Manag Care 18 (14 Suppl): S340–9. PMID 23327540.
- ^ Calvaruso V, Mazza M, Almasio PL (May 2011). “Pegylated-interferon-α(2a) in clinical practice: how to manage patients suffering from side effects”. Expert Opin Drug Saf 10 (3): 429–35. doi:10.1517/14740338.2011.559161. PMID 21323500.
- ^ Yau AH, Yoshida EM (September 2014). “Hepatitis C drugs: the end of the pegylated interferon era and the emergence of all-oral interferon-free antiviral regimens: a concise review”. Can J Gastroenterol Hepatol 28 (8): 445–51. PMID 25229466.
- ^ “米ギリアド、ファーマセットを110億ドルで買収へ-肝炎治療薬取得”. Bloomberg (2011年11月22日). 2015年5月14日閲覧。
- ^ “PSI-7977”. Gilead Sciences. 2015年5月14日閲覧。
- ^ Tucker M (December 6, 2013). “FDA Approves 'Game Changer' Hepatitis C Drug Sofosbuvir”. Medscape. 2015年5月14日閲覧。
- ^ “FDA approves first combination pill to treat hepatitis C”. 2015年5月14日閲覧。
- ^ “ギリアド・サイエンシズ ジェノタイプ1型C型慢性肝炎治療薬「ハーボニー配合錠」を新発売”. 2015年9月6日閲覧。
- ^ a b “harvoni package insert” (pdf) (2015年3月). 2015年5月14日閲覧。
- ^ “www.who.int”. 2015年5月14日閲覧。
- ^ a b c d e f “ソバルディ錠400mg 添付文書” (2016年7月). 2016年7月31日閲覧。
- ^ “ハーボニー配合錠 添付文書” (2016年7月). 2016年7月31日閲覧。
- ^ a b c d e f “Sofosbuvir Full Prescribing Information”. Www.Gilead.Com. Gilead. 28 October 2014閲覧。
- ^ “Recommendations for Testing, Managing, and Treating Hepatitis C”. AASLD and IDSA. 2 February 2014閲覧。
- ^ Sofosbuvir 副作用(英語)
Side Effects - ^ a b “レベトールカプセル200mg 添付文書” (2016年9月). 2016年11月5日閲覧。
- ^ a b c “Copegus (Ribavirin, USP Tablets) Medication Guide”. Roche. 28 October 2014閲覧。
- ^ Karageorgopoulos DE, El-Sherif O, Bhagani S, Khoo SH., Curr Opin Infect Dis. 2014 Feb;27(1):36-45. doi: 10.1097/QCO.0000000000000034. Review. Drug interactions between antiretrovirals and new or emerging direct-acting antivirals in HIV/hepatitis C virus confection
- ^ West, Stephen. "Gilead Warns After Hepatitis Patient on Heart Drug Dies". Published 21 March 2015.
- ^ “FDA Drug Safety Communication” (24 March 2015). 24 March 2015閲覧。
- ^ Eric Lawitz, Jay P Lalezari, Tarek Hassanein, et al. (2013-05). “Sofosbuvir in combination with peginterferon alfa-2a and ribavirin for non-cirrhotic, treatment-naive patients with genotypes 1, 2, and 3 hepatitis C infection: a randomised, double-blind, phase 2 trial”. The Lancet Infectious Diseases 13 (5): 401-408. doi:10.1016/S1473-3099(13)70033-1. PMID 23499158 2015年5月15日閲覧。.
- ^ AASLD: PSI-7977 plus Ribavirin Can Cure Hepatitis C in 12 Weeks without Interferon. Highleyman, L. HIVandHepatitis.com. 8 November 2011.
- ^ Gane EJ, Stedman CA, Hyland RH, Ding X, Svarovskaia E, Symonds WT, Hindes RG, Berrey MM (January 2013). “Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C”. N. Engl. J. Med. 368 (1): 34–44. doi:10.1056/NEJMoa1208953. PMID 23281974.
- ^ Fung, A; Jin, Z; Dyatkina, N; Wang, G; Beigelman, L; Deval, J (2014). “Efficiency of incorporation and chain termination determines the inhibition potency of 2'-modified nucleotide analogs against hepatitis C virus polymerase”. Antimicrobial Agents and Chemotherapy 58 (7): 3636-45. doi:10.1128/AAC.02666-14. PMC 4068585. PMID 24733478.
- ^ Murakami E, Tolstykh T, Bao H, Niu C, Steuer HM, Bao D, Chang W, Espiritu C, Bansal S, Lam AM, Otto MJ, Sofia MJ, Furman PA (November 2010). “Mechanism of activation of PSI-7851 and its diastereoisomer PSI-7977”. J. Biol. Chem. 285 (45): 34337–47. doi:10.1074/jbc.M110.161802. PMC 2966047. PMID 20801890.
- ^ Alejandro Soza (November 11, 2012). “Sofosbuvir”. Hepaton. 2015年5月15日閲覧。
- ^ Chae HB, Park SM, Youn SJ (2013). “Direct-acting antivirals for the treatment of chronic hepatitis C: open issues and future perspectives”. ScientificWorldJournal 2013: 704912. doi:10.1155/2013/704912. PMC 3687480. PMID 23844410.
- ^ Wu S, Kanda T, Nakamoto S, Imazeki F, Yokosuka O (December 2013). “Hepatitis C virus protease inhibitor-resistance mutations: Our experience and review”. World J. Gastroenterol. 19 (47): 8940–8948. doi:10.3748/wjg.v19.i47.8940. PMC 3870547. PMID 24379619.
- ^ “FDA Advisory Committee Supports Approval of Gilead’s Sofosbuvir for Chronic Hepatitis C Infection”. Drugs.com (October 25, 2013). 2015年5月15日閲覧。
- ^ “FDA approves Sovaldi for chronic hepatitis C”. FDA New Release. U.S. Food and Drug Administration (2013年12月6日). 2015年5月15日閲覧。
- ^ “ギリアド社、C型慢性肝炎に対するソホスブビル(Sofosbuvir)の新薬承認申請を日本の医薬品医療機器総合機構(PMDA)に提出”. ギリアド・サイエンシズ (2014年6月27日). 2015年5月14日閲覧。
- ^ “ギリアド・サイエンシズ ジェノタイプ2型C型慢性肝炎治療薬ソバルディ錠400mgの製造販売承認取得”. ギリアド・サイエンシズ (2015年3月26日). 2015年5月14日閲覧。
- ^ “European Medicines Agency Validates Gilead's Marketing Application for Sofosbuvir for the Treatment of Hepatitis C”. Gilead (2013年5月21日). 2015年5月15日閲覧。
- ^ “European Medicines Agency recommends approval of sofosbuvir for the treatment of chronic hepatitis C”. European Medicines Agency (2013年11月22日). 2015年5月15日閲覧。
- ^ C型肝炎の特効薬・ソバルディの国別販売価格-新薬開発と必須医薬品の供給の共存を目指す- (Report). 一般社団法人国際貿易投資研究所. 12 May 2016.
- ^ “AASLD 2012: Sofosbuvir and daclatasvir dual regimen cures most people with HCV genotypes 1, 2, or 3”. News. European Liver Patients Association (2012年11月21日). 2015年5月15日閲覧。
- ^ Childs-Kean, Lindsey (January 16, 2015). “Simeprevir and Sofosbuvir for Treatment of Chronic Hepatitis C Infection”. Clinical Therapeutics 37: 243–67. doi:10.1016/j.clinthera.2014.12.012. PMID 25601269.
- ^ Smith, Michael (December 16, 2014). “Interferon-/Ribavirin-Free Regimen for Chronic Hepatitis C Virus Infection”. Annals of pharmacotherapy 49: 343–50. doi:10.1177/1060028014563952. PMID 25515863.
- ^ CROI 2013: Sofosbuvir + Ledipasvir + Ribavirin Combo for HCV Produces 100% Sustained Response. Highleyman, L. HIVandHepatitis.com. 4 March 2013.
- ^ “U.S. Food and Drug Administration Approves Gilead’s Harvoni (Ledipasvir/Sofosbuvir), the First Once-Daily Single Tablet Regimen for the Treatment of Genotype 1 Chronic Hepatitis C” (10 Oct 2014). 10 Oct 2014閲覧。
- ^ “ジェノタイプ1型C型慢性肝炎治療薬1日1回1錠経口投与「ハーボニー配合錠」製造販売承認取得”. ギリアド・サイエンシズ (2015年7月3日). 2015年7月22日閲覧。
- ^ “Hepatitis C Dilemma: Treat Illness With Interferon Now or Wait? - WSJ”. 2015年5月15日閲覧。
- ^ “Gilead's Hepatitis C Pill Takes Off Like A Rocket - Forbes”. 2015年5月15日閲覧。
- ^ “Gilead's Sovaldi prescribed more than all other hepatitis C drugs combined - San Jose Mercury News”. 2015年5月15日閲覧。
- ^ “pi.vrtx.com”. 2015年5月15日閲覧。
- ^ “FDA Approves 'Game Changer' Hepatitis C Drug Sofosbuvir”. 2015年5月15日閲覧。
- ^ “Faster, Easier Cures for Hepatitis C”. 2015年5月15日閲覧。
- ^ C型肝炎薬に偽造品、厚労省注意呼びかけ…奈良 読売新聞オンライン(2017年01月17日)
