「ニトロゲナーゼ」の版間の差分
MomijiRoBot (会話 | 投稿記録) m Bot: Removed Unicode 0x200e ∵Check Wikipedia #16 |
m cewbot: 修正ウィキ文法 38: HTMLの<i>タグの使用 |
||
| 16行目: | 16行目: | ||
:N<sub>2</sub> + 3[[水素|H<sub>2</sub>]] -> 2NH<sub>3</sub> ([[自由エネルギー|ΔG]] = -8 kcal/mol N<sub>2</sub>; 450 ℃、200 atm) |
:N<sub>2</sub> + 3[[水素|H<sub>2</sub>]] -> 2NH<sub>3</sub> ([[自由エネルギー|ΔG]] = -8 kcal/mol N<sub>2</sub>; 450 ℃、200 atm) |
||
上述の条件における反応は発エルゴン的だが、高温高圧条件下のみで行われる。一方、生物による窒素固定反応は基本的には標準状態(25 ℃、1 atm、pH 7.0)にて行われる。ニトロゲナーゼの担う標準状態におけるアンモニア生産反応は下記の式にて表される。 |
上述の条件における反応は発エルゴン的だが、高温高圧条件下のみで行われる。一方、生物による窒素固定反応は基本的には標準状態(25 ℃、1 atm、pH 7.0)にて行われる。ニトロゲナーゼの担う標準状態におけるアンモニア生産反応は下記の式にて表される。 |
||
:N<sub>2</sub> + 6[[水素イオン|H<sup>+</sup>]] + 6[[電子|e<sup>-</sup>]] + 12[[アデノシン三リン酸|ATP]] + 12H<sub>2</sub>O -> 2NH<sub>3</sub> + 12[[アデノシン二リン酸|ADP]] + 12[[リン酸|P<sub> |
:N<sub>2</sub> + 6[[水素イオン|H<sup>+</sup>]] + 6[[電子|e<sup>-</sup>]] + 12[[アデノシン三リン酸|ATP]] + 12H<sub>2</sub>O -> 2NH<sub>3</sub> + 12[[アデノシン二リン酸|ADP]] + 12[[リン酸|P<sub>''i''</sub>]] (ΔG’ = -136 kcal/mol N<sub>2</sub>)・・・反応式1<ref name=Biochemistry>田宮信雄、八木達彦(1991)コーン・スタンプ生化学 第5版</ref> |
||
水素に代わり、電子供与体([[フェレドキシン]]など)からの電子および高エネルギーリン酸化合物の加水分解のエネルギーを用いてアンモニア生産反応を行う。'''ニトロゲナーゼ系における反応は標準状態であるにもかかわらず発エルゴン的であり、その自由エネルギー変化は極めて大きい。''' |
水素に代わり、電子供与体([[フェレドキシン]]など)からの電子および高エネルギーリン酸化合物の加水分解のエネルギーを用いてアンモニア生産反応を行う。'''ニトロゲナーゼ系における反応は標準状態であるにもかかわらず発エルゴン的であり、その自由エネルギー変化は極めて大きい。''' |
||
===窒素固定化=== |
===窒素固定化=== |
||
ニトロゲナーゼの窒素固定反応は以下のように表される。大気中の窒素を還元し、アンモニアとして固定化する。アンモニアとして固定された窒素は他の細菌によって[[グルタミン酸]]塩や[[硝酸]]塩に変換され、植物が利用可能な形となる。 |
ニトロゲナーゼの窒素固定反応は以下のように表される。大気中の窒素を還元し、アンモニアとして固定化する。アンモニアとして固定された窒素は他の細菌によって[[グルタミン酸]]塩や[[硝酸]]塩に変換され、植物が利用可能な形となる。 |
||
: N<sub>2</sub> + 8H<sup>+</sup> + 8e<sup>-</sup> + 16 ATP → 2NH<sub>3</sub> + H<sub>2</sub> + 16ADP + 16P<sub> |
: N<sub>2</sub> + 8H<sup>+</sup> + 8e<sup>-</sup> + 16 ATP → 2NH<sub>3</sub> + H<sub>2</sub> + 16ADP + 16P<sub>''i''</sub>・・・反応式2 |
||
上述のアンモニア生産反応との相違点は、ニトロゲナーゼの反応特異性の低さによる。ニトロゲナーゼの代表的な副反応の一つとしてATPの加水分解と共役したプロトン還元活性(水素生産)があり、本活性は還元的ATPアーゼ活性と呼ばれている。 |
上述のアンモニア生産反応との相違点は、ニトロゲナーゼの反応特異性の低さによる。ニトロゲナーゼの代表的な副反応の一つとしてATPの加水分解と共役したプロトン還元活性(水素生産)があり、本活性は還元的ATPアーゼ活性と呼ばれている。 |
||
:2H<sup>+</sup> + 2e<sup>-</sup> + 4ATP + 4H<sub>2</sub>O -> H<sub>2</sub> + 4ADP + 4P<sub> |
:2H<sup>+</sup> + 2e<sup>-</sup> + 4ATP + 4H<sub>2</sub>O -> H<sub>2</sub> + 4ADP + 4P<sub>''i''</sub>・・・反応式3 |
||
この還元的ATPアーゼ活性と反応式1が合わさり、見かけのニトロゲナーゼ活性である反応式2の反応が得られる。なお、反応式2は至適条件における式であり、実際の生理状態においては20~30ATPが必要であるとされている。<ref name=Nitrogenases>R. H. Burris (1991) Nitrogenases, J. Biol. Chem., 266 (15), 9339-9342</ref> |
この還元的ATPアーゼ活性と反応式1が合わさり、見かけのニトロゲナーゼ活性である反応式2の反応が得られる。なお、反応式2は至適条件における式であり、実際の生理状態においては20~30ATPが必要であるとされている。<ref name=Nitrogenases>R. H. Burris (1991) Nitrogenases, J. Biol. Chem., 266 (15), 9339-9342</ref> |
||
===副反応=== |
===副反応=== |
||
| 36行目: | 36行目: | ||
上記の反応の中で窒素を生産する一酸化二窒素のみが[[競合阻害|拮抗阻害剤]]であり、他の基質は[[非競合阻害|非拮抗阻害剤]]となる。一酸化二窒素の還元によって生じた窒素は、そのまま通常の窒素固定化反応に用いられる。'''アセチレン還元反応はニトロゲナーゼの簡易測定法として有効であり、生じたエチレンをガスクロマトグラフィーによって分析することによってニトロゲナーゼ活性を検出することができる。'''<ref name=Nitrogenases/>また、根粒菌による窒素固定化について、窒素の[[安定同位体]]である<sup>15</sup>Nを蓄積する現象が知られているが、その理由については現在説明は得られていない。<ref>Rasmussen, L. J., Peters, G. K., and Burris, R. H. (1989) Phykos 28, 64-79</ref>, <ref>Yoneyama, T., Yamada, N., Kojima, H., and Yazaki, J. (1984) Plant Cell Physiol., 25, 1561-1565</ref> |
上記の反応の中で窒素を生産する一酸化二窒素のみが[[競合阻害|拮抗阻害剤]]であり、他の基質は[[非競合阻害|非拮抗阻害剤]]となる。一酸化二窒素の還元によって生じた窒素は、そのまま通常の窒素固定化反応に用いられる。'''アセチレン還元反応はニトロゲナーゼの簡易測定法として有効であり、生じたエチレンをガスクロマトグラフィーによって分析することによってニトロゲナーゼ活性を検出することができる。'''<ref name=Nitrogenases/>また、根粒菌による窒素固定化について、窒素の[[安定同位体]]である<sup>15</sup>Nを蓄積する現象が知られているが、その理由については現在説明は得られていない。<ref>Rasmussen, L. J., Peters, G. K., and Burris, R. H. (1989) Phykos 28, 64-79</ref>, <ref>Yoneyama, T., Yamada, N., Kojima, H., and Yazaki, J. (1984) Plant Cell Physiol., 25, 1561-1565</ref> |
||
===電子供与体=== |
===電子供与体=== |
||
ニトロゲナーゼ反応に用いられる電子は主要な代謝系([[発酵]]、[[ピルビン酸]]の酸化など)によって還元された[[電子伝達体]]によって供与される。[[嫌気性]]の[[グラム陽性菌]]である |
ニトロゲナーゼ反応に用いられる電子は主要な代謝系([[発酵]]、[[ピルビン酸]]の酸化など)によって還元された[[電子伝達体]]によって供与される。[[嫌気性]]の[[グラム陽性菌]]である''Clostridium pasteurianum''は[[フェレドキシン]]を電子供与体として用いている。<ref>L. E. Mortenson, (1964) Biochim. Biophys. Acta, 81, 473-478</ref>また、''Azotobacter vinelandii''のような共生的な窒素固定微生物は、フェレドキシンと比べて酸化還元電位の高い[[フラボドキシン]]を用いている。<ref>Shah, V. K., Stacey, G., and Brill, W. J. (1983) J. Biol. Chem. 258, 12064-12068</ref>また、根粒菌や''Thiocapsa roseopersicina''のような[[光合成細菌]]においては、還元的ATPアーゼ活性によって生じた水素を[[ヒドロゲナーゼ|uptake-ヒドロゲナーゼ]]によって再酸化し、電子供与体の再還元に用いている。<ref>B. Fodor, G. Rakhely, A. T. Kovacs and K. L. Kovacs (2001) Transposon mutagenesis in purple sulfur photosynthetic bacteria: identification of ''hyp''F, encoding a protein capable of processing [NiFe] hydrogenases in alpha, beta, and gamma subdivisions of the proteobacteria, Appl. Environ. Microbiol., 67, 2476-2483</ref> |
||
==分布== |
==分布== |
||
| 42行目: | 42行目: | ||
'''非共生的窒素固定生物''' |
'''非共生的窒素固定生物''' |
||
:#[[嫌気性細菌|絶対嫌気性細菌]]・・・ |
:#[[嫌気性細菌|絶対嫌気性細菌]]・・・''Clostridium'', ''Desulfovibrio'', ''Desulfotomaculum'' |
||
:#[[嫌気性細菌|通性嫌気性細菌]]・・・ |
:#[[嫌気性細菌|通性嫌気性細菌]]・・・''Klebisiella'', ''Bacillus'' |
||
:#[[好気性細菌]]・・・ |
:#[[好気性細菌]]・・・''Azotobacter'', ''Azomonas'', ''Beijerinckia'' |
||
:#光合成細菌・・・ |
:#光合成細菌・・・''Chromatium'', ''Rhodospirillum'', ''Rhodobacter'' |
||
:#シアノバクテリア・・・ |
:#シアノバクテリア・・・''Anabaena'', ''Nostoc'', ''Gloeocapsa'' |
||
'''共生的窒素固定細菌''' |
'''共生的窒素固定細菌''' |
||
*根粒菌( |
*根粒菌(''Rhizobium'') |
||
:#エンドウ根粒菌・・・ |
:#エンドウ根粒菌・・・''R. legminosarum''([[エンドウ]]、[[ソラマメ]]) |
||
:#サイトウ根粒菌・・・ |
:#サイトウ根粒菌・・・''R. phaseoli''([[インゲン]]) |
||
:#ダイズ根粒菌・・・ |
:#ダイズ根粒菌・・・''R. japonicum''([[ダイズ]]) |
||
:#クローバー根粒菌・・・ |
:#クローバー根粒菌・・・''R. trifolii''([[シャジクソウ属|クローバー]]) |
||
:#ルーピン根粒菌・・・ |
:#ルーピン根粒菌・・・''R. lupini''([[ルーピン]]) |
||
:#アルファルファ根粒菌・・・ |
:#アルファルファ根粒菌・・・''R. meliloti''([[ウマゴヤシ]]、[[シナガワハギ]]) |
||
:#カウピー根粒菌・・・ |
:#カウピー根粒菌・・・''“Cowpea rhizobia”''([[カウピー]]、[[ナンキンマメ]]、[[アズキ]]) |
||
* |
*''Frankia''・・・未分離([[ハンノキ]]、[[モクマオウ]]、[[グミ]]、[[カルフォルニアライラック]]) |
||
*シアノバクテリア・・・ |
*シアノバクテリア・・・''Anabaena''([[地衣類]]、[[アカウキクサ]]) |
||
一方で真核生物からはニトロゲナーゼ系を含む窒素固定系は見出されていない。<ref name=Maturation>Luis M. Rubio and Paul W. Ludden (2005) Maturation of Nitrogenase: a Biochemical Puzzle, J. Bacteriol., 187, 405-414</ref> |
一方で真核生物からはニトロゲナーゼ系を含む窒素固定系は見出されていない。<ref name=Maturation>Luis M. Rubio and Paul W. Ludden (2005) Maturation of Nitrogenase: a Biochemical Puzzle, J. Bacteriol., 187, 405-414</ref> |
||
==分類== |
==分類== |
||
ニトロゲナーゼは活性中心に含まれる金属の種類によって3つに分類される。'''主要なニトロゲナーゼ群は[[モリブデン]]を活性中心に有するモリブデン含有ニトロゲナーゼである。'''多くの窒素固定菌が本ニトロゲナーゼを有しており、自然界にて行われている窒素固定のほとんどは本酵素によるものと考えられている。<ref name=Maturation/>残る二つの群は[[バナジウム]]および[[鉄]]をそれぞれ活性中心に含んでおり、それぞれバナジウム含有(Vanadium containing)ニトロゲナーゼおよび鉄型(Fe-only)ニトロゲナーゼと呼ばれている。<ref>Bishop, P. E., D. M. L. Jarlenski, and D. R. Hetherington. 1980. Evidence for an alternative nitrogen fixation system in |
ニトロゲナーゼは活性中心に含まれる金属の種類によって3つに分類される。'''主要なニトロゲナーゼ群は[[モリブデン]]を活性中心に有するモリブデン含有ニトロゲナーゼである。'''多くの窒素固定菌が本ニトロゲナーゼを有しており、自然界にて行われている窒素固定のほとんどは本酵素によるものと考えられている。<ref name=Maturation/>残る二つの群は[[バナジウム]]および[[鉄]]をそれぞれ活性中心に含んでおり、それぞれバナジウム含有(Vanadium containing)ニトロゲナーゼおよび鉄型(Fe-only)ニトロゲナーゼと呼ばれている。<ref>Bishop, P. E., D. M. L. Jarlenski, and D. R. Hetherington. 1980. Evidence for an alternative nitrogen fixation system in ''Azotobacter vinelandii''. Proc. Natl. Acad. Sci. USA 77:7342-7346</ref>バナジウムおよび鉄を含んでいるニトロゲナーゼは、その全体構造を含めてモリブデン含有ニトロゲナーゼとほぼ同一である。しかしながらその分布は著しく偏っており、モリブデン型が主要なニトロゲナーゼであるのに対して、バナジウムおよび鉄型ニトロゲナーゼは代替ニトロゲナーゼ(Alternative nitrogenase)と呼ばれている。下記に分布の例を挙げる。 |
||
*モリブデン、バナジウムおよび鉄型ニトロゲナーゼの全てを有する・・・ |
*モリブデン、バナジウムおよび鉄型ニトロゲナーゼの全てを有する・・・''Azotobacter vinelandii''<ref>Bishop, P. E., R. Premakumar, D. R. Dean, M. R. Jacobson, J. R. Chisnell, T. M. Rizzo, and J. Kopczynski. 1986. Nitrogen fixation by ''Azotobacter vinelandii'' strains having deletions in structural genes for nitrogenase. Science 232:92-94</ref> |
||
*モリブデンおよび鉄型ニトロゲナーゼを有する・・・ |
*モリブデンおよび鉄型ニトロゲナーゼを有する・・・''Rhodobacter capsulatus''、''Rhodospirillum rubrum'' <ref>Davis, R., L. Lehman, R. Petrovich, V. K. Shah, G. P. Roberts, and P. W. Ludden. 1996. Purification and characterization of the alternative nitrogenase from the photosynthetic bacterium ''Rhodospirillum rubrum''. J. Bacteriol. 178, 1445-1450.</ref>, <ref>Schneider, K., A. Muller, U. Schramm, and W. Klipp. 1991. Demonstration of a molybdenum- and vanadium-independent nitrogenase in a nifHDKdeletion mutant of ''Rhodobacter capsulatus''. Eur. J. Biochem. 195:653-661.</ref> |
||
*モリブデンおよびバナジウム含有ニトロゲナーゼを有する・・・ |
*モリブデンおよびバナジウム含有ニトロゲナーゼを有する・・・''Anabaena variablis''<ref>Thiel, T. 1993. Characterization of genes for an alternative nitrogenase in the cyanobacterium ''Anabaena variabilis''. J. Bacteriol. 175:6276-6286</ref> |
||
*モリブデン含有ニトロゲナーゼのみを有する・・・ |
*モリブデン含有ニトロゲナーゼのみを有する・・・''Krebsiella pneumoniae''<ref>Arnold, W., A. Rump, W. Klipp, U. B. Priefer, and A. Puhler. 1988. Nucleotide sequence of a 24,206-base-pair DNA fragment carrying the entire nitrogen fixation gene cluster of ''Klebsiella pneumoniae''. J. Mol. Biol. 203: 715-738.</ref> |
||
上述のリストのとおり、'''全ての窒素固定菌はモリブデン含有ニトロゲナーゼを有しており、バナジウムおよび鉄型ニトロゲナーゼのみを有する窒素固定生物はいまだ見つかっていない。'''また既存のニトロゲナーゼとは全く異なる4つ目のグループが[[放線菌]] |
上述のリストのとおり、'''全ての窒素固定菌はモリブデン含有ニトロゲナーゼを有しており、バナジウムおよび鉄型ニトロゲナーゼのみを有する窒素固定生物はいまだ見つかっていない。'''また既存のニトロゲナーゼとは全く異なる4つ目のグループが[[放線菌]]''Streptomyces thoermoautotrophicus''から見つかっている。本酵素は[[モリブドプテリン]]を活性中心に有しており、サブユニット構成など上述のニトロゲナーゼと全く異なっている。<ref>Ribbe, M., D. Gadkari, and O. Meyer. 1997. N<sub>2</sub> fixation by ''Streptomyces thermoautotrophicus'' involves a molybdenum-dinitrogenase and a manganese-superoxide oxidoreductase that couple N<sub>2</sub> reduction to the oxidation of superoxide produced from O<sub>2</sub> by a molybdenum-CO dehydrogenase. J. Biol. Chem. 272:26627-26633</ref> |
||
==立体構造== |
==立体構造== |
||
'''ニトロゲナーゼは活性中心を有するニトロゲナーゼ二量体(Dinitrogenase、Mo-Feタンパク質、component I)およびニトロゲナーゼ二量体を還元するニトロゲナーゼ還元酵素(Dinitrogenase reductase、Feタンパク質、component II)からなる。'''機能単位はニトロゲナーゼ二量体およびニトロゲナーゼ還元酵素二量体のヘテロ四量体をとっているが、生体内における構造はさらにヘテロ四量体が2つ結合しヘテロ八量体構造にて機能している(最上部の『ニトロゲナーゼの構造』図表参照)。なお、本節では立体構造がよく知られているモリブデン含有ニトロゲナーゼのみについて概説する。<ref name=Maturation/> |
'''ニトロゲナーゼは活性中心を有するニトロゲナーゼ二量体(Dinitrogenase、Mo-Feタンパク質、component I)およびニトロゲナーゼ二量体を還元するニトロゲナーゼ還元酵素(Dinitrogenase reductase、Feタンパク質、component II)からなる。'''機能単位はニトロゲナーゼ二量体およびニトロゲナーゼ還元酵素二量体のヘテロ四量体をとっているが、生体内における構造はさらにヘテロ四量体が2つ結合しヘテロ八量体構造にて機能している(最上部の『ニトロゲナーゼの構造』図表参照)。なお、本節では立体構造がよく知られているモリブデン含有ニトロゲナーゼのみについて概説する。<ref name=Maturation/> |
||
| 74行目: | 74行目: | ||
</gallery> |
</gallery> |
||
===ニトロゲナーゼ二量体=== |
===ニトロゲナーゼ二量体=== |
||
ニトロゲナーゼ二量体の遺伝子は |
ニトロゲナーゼ二量体の遺伝子は''nifD''および''nifK''であり、それぞれαおよびβサブユニットをコードしている。αβ構造が機能単位だが、生体内においてはα<sub>2</sub>β<sub>2</sub>構造をとっており、分子量は220~240 kDa程度である。αβ構造内には、活性中心である鉄-モリブデン補因子(FeMo-co)および電子伝達を担うP-clusterが一つずつ配位している。FeMo-coは[Mo-3Fe-3S]および[4Fe-3S]クラスターが3つの硫黄リガンドによって結合し、[Mo-7Fe-6S]クラスター構造を有している。さらにモリブデンは[[ホモクエン酸]]のC2カルボニル基とヒドロキシル基に結合し、さらにαサブユニットの[[システイン]]と[[ヒスチジン]]に結合して安定した構造をとっている。一方、P-clusterは2つの[4Fe-3S]クラスターが1つの硫黄リガンドによって結合し、[8Fe-7S]クラスター構造をとっている。それぞれのクラスターの両端はαおよびβサブユニットのシステインに結合し、配位されている。したがって、P-clusterはαβサブユニット間に配置している。 |
||
<gallery> |
<gallery> |
||
File:Nitrogenase FeMoco.png|'''FeMo-co補因子''':黄色部が硫黄、灰色部が鉄。ただし、左端の灰色はモリブデン。PDB: 1M34 |
File:Nitrogenase FeMoco.png|'''FeMo-co補因子''':黄色部が硫黄、灰色部が鉄。ただし、左端の灰色はモリブデン。PDB: 1M34 |
||
| 80行目: | 80行目: | ||
</gallery> |
</gallery> |
||
===ニトロゲナーゼ還元酵素=== |
===ニトロゲナーゼ還元酵素=== |
||
ニトロゲナーゼ還元酵素の遺伝子は |
ニトロゲナーゼ還元酵素の遺伝子は''nifH''である。機能単位はホモ二量体であり、分子量は120 kDaである。ニトロゲナーゼ還元酵素内には1つの[4Fe-4S]クラスターおよび2つの[[マグネシウム|Mg]]-ATP結合部位を有している。[4Fe-4S]クラスターはホモ二量体それぞれのシステインによって配位され、P-cluster同様サブユニット間に配置している。一方、Mg-ATP結合部位については、ホモ二量体のサブユニットそれぞれに存在している。 |
||
==反応機構== |
==反応機構== |
||
[[File:Nitrogenase reaction.PNG|thumb|400px|ニトロゲナーゼの反応機構]] |
[[File:Nitrogenase reaction.PNG|thumb|400px|ニトロゲナーゼの反応機構]] |
||
[[1960年]]にCarnahanらによって |
[[1960年]]にCarnahanらによって''C. pasteurianum''無細胞標品による窒素固定反応に成功した。<ref name=Carnahan_1>Carnahan. J. E.. Mortenson. L. E.. Mower. H. F.. and Castle. J. E. (1960) Biochim. Biophys. Acta 38, 188-189</ref>, <ref name=Carnahan_2>Carnahan. J. E.. Mortenson. L. E.. Mower. H. F.. and Castle. J. E. (1960) Biochim. Biophys. Acta 44, 520-535</ref>その後、モリブデン含有ニトロゲナーゼの精製を経て、ニトロゲナーゼが二つのComponent(ニトロゲナーゼ二量体およびニトロゲナーゼ還元酵素)によって機能することが明らかになった。<ref>Mortenson, L. E. (1965) in Non-Heme Iron Proteins: Role in Energy Conversion (San Pietro, A., ed) pp. 243-259, Antioch Press, Yellow Springs OH</ref>その後の精力的な研究により、ニトロゲナーゼは下記の5成分の存在下にて窒素固定反応を行うことが示された。<ref>Winter, H. C., and Burris, R. H. (1968) J. Biol. Chem. 243,940-944</ref>, <ref>Orme-Johnson, W. H., Hamilton, W. D., Ljones, T., Tso, M.-Y. W., Burris, R. H., Shah, V. K., and Brill, W. J. (1972) Proc. Natl. Acad. Sci. U. S. A. 69, 3142-3145</ref>, <ref>Zumft, W. G., and Mortenson, L. E. (1975) Biochim. Biophys. Acta 416, 1-52</ref> |
||
#電子供与体(フェレドキシン、フラボドキシン) |
#電子供与体(フェレドキシン、フラボドキシン) |
||
#ニトロゲナーゼ還元酵素([4Fe-4S]クラスター) |
#ニトロゲナーゼ還元酵素([4Fe-4S]クラスター) |
||
| 103行目: | 103行目: | ||
#ニトロゲナーゼ還元酵素 + 2Mg<sup>2+</sup> + 2ATP -> ニトロゲナーゼ還元酵素-MgATP複合体(酸化型) |
#ニトロゲナーゼ還元酵素 + 2Mg<sup>2+</sup> + 2ATP -> ニトロゲナーゼ還元酵素-MgATP複合体(酸化型) |
||
#2ニトロゲナーゼ還元酵素-MgATP複合体(酸化型) + 2e<sup>-</sup> -> 2ニトロゲナーゼ還元酵素-MgATP複合体(還元型) |
#2ニトロゲナーゼ還元酵素-MgATP複合体(酸化型) + 2e<sup>-</sup> -> 2ニトロゲナーゼ還元酵素-MgATP複合体(還元型) |
||
#2ニトロゲナーゼ還元酵素-MgATP複合体(還元型) + 2ATP -> 2ニトロゲナーゼ還元酵素-MgADP複合体(酸化型) + 2ADP + 4P<sub> |
#2ニトロゲナーゼ還元酵素-MgATP複合体(還元型) + 2ATP -> 2ニトロゲナーゼ還元酵素-MgADP複合体(酸化型) + 2ADP + 4P<sub>''i''</sub> + 2e<sup>-</sup> |
||
#1[4Fe-4S]クラスター(酸化型) + 2e<sup>-</sup> -> 1[4Fe-4S]クラスター(還元型)+ 1P cluster(酸化型) -> 1[4Fe-4S]クラスター(酸化型) + 1P cluster(還元型) |
#1[4Fe-4S]クラスター(酸化型) + 2e<sup>-</sup> -> 1[4Fe-4S]クラスター(還元型)+ 1P cluster(酸化型) -> 1[4Fe-4S]クラスター(酸化型) + 1P cluster(還元型) |
||
#1P cluster(還元型) + 1FeMo-co(酸化型) -> 1P cluster(酸化型) + 1FeMo-co(還元型) |
#1P cluster(還元型) + 1FeMo-co(酸化型) -> 1P cluster(酸化型) + 1FeMo-co(還元型) |
||
| 109行目: | 109行目: | ||
#(1~5の2回目サイクル)1FeMo-co(還元型) + N<sub>2</sub>H<sub>2</sub> -> N<sub>2</sub>H<sub>4</sub> |
#(1~5の2回目サイクル)1FeMo-co(還元型) + N<sub>2</sub>H<sub>2</sub> -> N<sub>2</sub>H<sub>4</sub> |
||
#(1~5の3回目サイクル)1FeMo-co(還元型) + N<sub>2</sub>H<sub>4</sub> -> 2NH<sub>3</sub> |
#(1~5の3回目サイクル)1FeMo-co(還元型) + N<sub>2</sub>H<sub>4</sub> -> 2NH<sub>3</sub> |
||
#2H<sup>+</sup> + 2e<sup>-</sup> + 4ATP + 4H<sub>2</sub>O -> H<sub>2</sub> + 4ADP + 4P<sub> |
#2H<sup>+</sup> + 2e<sup>-</sup> + 4ATP + 4H<sub>2</sub>O -> H<sub>2</sub> + 4ADP + 4P<sub>''i''</sub> |
||
なお、FeMo-co活性中心における窒素固定反応スキームについてはいまだ決定打が出ていない。現在のところFeが触媒となる経路や、[Mo-3Fe-3S]および[4Fe-3S]のクラスターをつなぐ窒素原子が触媒となる経路、あるいはモリブデンが触媒部位となる経路など4つのスキームが提案されている。<ref>John W Peters and Robert K Szilagyi (2006) Exploring new frontiers of nitrogenase structure and mechanism. Current Opinion in Chemical Biology, 10:101-108</ref> |
なお、FeMo-co活性中心における窒素固定反応スキームについてはいまだ決定打が出ていない。現在のところFeが触媒となる経路や、[Mo-3Fe-3S]および[4Fe-3S]のクラスターをつなぐ窒素原子が触媒となる経路、あるいはモリブデンが触媒部位となる経路など4つのスキームが提案されている。<ref>John W Peters and Robert K Szilagyi (2006) Exploring new frontiers of nitrogenase structure and mechanism. Current Opinion in Chemical Biology, 10:101-108</ref> |
||
==関連遺伝子および機能== |
==関連遺伝子および機能== |
||
P clusterやFeMo-coといった複雑な金属クラスターは自発的に構築されず様々なタンパク質が構築に関与している。ニトロゲナーゼ構造遺伝子発現後にタンパク質内にクラスターが配位される発現後プロセッシングを経て活性を発揮するが、この一連の現象を成熟化(maturation)という。また、ニトロゲナーゼは発現に際して様々な調節を受けており、それらにかかわる遺伝子も多数存在する。 |
P clusterやFeMo-coといった複雑な金属クラスターは自発的に構築されず様々なタンパク質が構築に関与している。ニトロゲナーゼ構造遺伝子発現後にタンパク質内にクラスターが配位される発現後プロセッシングを経て活性を発揮するが、この一連の現象を成熟化(maturation)という。また、ニトロゲナーゼは発現に際して様々な調節を受けており、それらにかかわる遺伝子も多数存在する。''A. vinelandii''や''K. pneumoniae''のニトロゲナーゼ遺伝子の機能解析により、ニトロゲナーゼにかかわる遺伝子の全貌が明らかになってきている。<ref>Dos Santos, P. C., D. R. Dean, Y. Hu, and M. W. Ribbe. 2004. Formation and insertion of the nitrogenase iron-molybdenum cofactor. Chem. Rev. 104:1159-1173</ref>, <ref>Imperial, J., V. K. Shah, R. A. Ugalde, P. W. Ludden, and W. J. Brill. 1987. Iron-molybdenum cofactor synthesis in ''Azotobacter vinelandii'' Nif- mutants. J. Bacteriol. 169:1784-1786.</ref>, <ref>Roberts, G. P., MacNeil, T., MacNeil, D., andBrill, W. J. (1978) J. Bacteriol. 136, 267-279</ref>下記に、これまで明らかになったニトロゲナーゼ関連遺伝子群の名称および機能を列挙する。 |
||
* |
*''nifH''・・・ニトロゲナーゼ還元酵素 |
||
* |
*''nifD''・・・ニトロゲナーゼ二量体αサブユニット |
||
* |
*''nifK''・・・ニトロゲナーゼ二量体βサブユニット |
||
* |
*''nifT''・・・機能不明 |
||
* |
*''nifY''/''nafY''・・・ニトロゲナーゼ二量体の[[シャペロン]]。FeMo-coの挿入にかかわる。 |
||
* |
*''nifE''・・・FeMo-co構築 |
||
* |
*''nifN''・・・FeMo-co構築 |
||
* |
*''nifX''・・・FeMo-co構築 |
||
* |
*''nifU''・・・鉄硫黄クラスター骨格 |
||
* |
*''nifS''・・・鉄硫黄クラスターの不安定硫黄の運搬 |
||
* |
*''nifV''・・・ホモクエン酸合成酵素 |
||
* |
*''nifW''・・・FeMo-co安定化 |
||
* |
*''nifZ''・・・機能不明 |
||
* |
*''nifM''・・・ニトロゲナーゼ還元酵素の成熟化 |
||
* |
*''nifF''・・・フラボドキシン |
||
* |
*''nifL''・・・陰性調節因子 |
||
* |
*''nifA''・・・陽性調節因子 |
||
* |
*''nifB''・・・FeMo-co構築 |
||
* |
*''fdnN''・・・フェレドキシン |
||
* |
*''nifQ''・・・FeMo-co構築 |
||
* |
*''nifJ''・・・ピルビン酸:フラボドキシン(フェレドキシン)オキシドレダクターゼ |
||
なお、バナジウム含有および鉄型ニトロゲナーゼも、それぞれ |
なお、バナジウム含有および鉄型ニトロゲナーゼも、それぞれ''vnf''遺伝子群(Vanadium Nitrogen Fixation)および''anf''遺伝子群(Alternative Nitrogen Fixation)をそれぞれ有し、良く似た機構で発現にかかわっていると考えられている。<ref>Rangaraj, P., C. Ruttimann-Johnson, V. K. Shah, and P. W. Ludden. 2000. Biosynthesis of the iron-molybdenum and iron-vanadium cofactors of the nif- and vnf-encoded nitrogenases, p. 55-79. In E. W. Triplett (ed.), Prokaryotic nitrogen fixation: a model system for analysis of a biochemical process. Horizon Scientific Press, Wymondham, United Kingdom.</ref>また、幾つかの'nif'遺伝子はバナジウム含有および鉄型ニトロゲナーゼで共有されている。<ref>Kennedy, C., and D. Dean. 1992. The nifU, nifS and nifV gene products are required for activity of all three nitrogenases of ''Azotobacter vinelandii''. Mol. Gen. Genet. 231:494-498.</ref> |
||
==発現調節== |
==発現調節== |
||
まず、ニトロゲナーゼ系は大量のATPを要求するため、[[酸化的リン酸化]]あるいは[[光化学反応|光リン酸化]]がおこなわれる条件でのみ窒素固定反応が見られる。さらにニトロゲナーゼ活性は酵素発現量の調節およびADPの拮抗阻害によって行われる。ニトロゲナーゼは生産物であるアンモニアの存在によって発現量が低下する。アンモニア自体はニトロゲナーゼ反応の阻害物質にはならない。ADPの拮抗阻害について、[[リボシル化]]されたADPがニトロゲナーゼ還元酵素の強力な阻害剤となることが明らかになっている。<ref>Ludden, P. W., and Burns, R. H. (1976) Science 194,424-426</ref>ADPのリボシル化はニトロゲナーゼ還元酵素ADPリボシル転移酵素(DRAT: Dinitrogenase Reductase ADP-ribosyltransferase)がかかわっており、本酵素は暗条件(光リン酸化がおこなわれない条件)やアンモニウム塩の添加によって誘導される。リボシル化ADPによって阻害されたニトロゲナーゼ還元酵素はニトロゲナーゼ還元酵素活性化グリコヒドロキシラーゼ(DRAG: Dinitrogenase Reductase Activating Glycohydrolase)によって付活され、再活性化する。DRATおよびDRAGはともに精製され、性状解析がおこなわれている。<ref>Ludden, P. W., and Roberts, G. P. (1989) Curr. Top. Cell. Regul. 30,23-56</ref> |
まず、ニトロゲナーゼ系は大量のATPを要求するため、[[酸化的リン酸化]]あるいは[[光化学反応|光リン酸化]]がおこなわれる条件でのみ窒素固定反応が見られる。さらにニトロゲナーゼ活性は酵素発現量の調節およびADPの拮抗阻害によって行われる。ニトロゲナーゼは生産物であるアンモニアの存在によって発現量が低下する。アンモニア自体はニトロゲナーゼ反応の阻害物質にはならない。ADPの拮抗阻害について、[[リボシル化]]されたADPがニトロゲナーゼ還元酵素の強力な阻害剤となることが明らかになっている。<ref>Ludden, P. W., and Burns, R. H. (1976) Science 194,424-426</ref>ADPのリボシル化はニトロゲナーゼ還元酵素ADPリボシル転移酵素(DRAT: Dinitrogenase Reductase ADP-ribosyltransferase)がかかわっており、本酵素は暗条件(光リン酸化がおこなわれない条件)やアンモニウム塩の添加によって誘導される。リボシル化ADPによって阻害されたニトロゲナーゼ還元酵素はニトロゲナーゼ還元酵素活性化グリコヒドロキシラーゼ(DRAG: Dinitrogenase Reductase Activating Glycohydrolase)によって付活され、再活性化する。DRATおよびDRAGはともに精製され、性状解析がおこなわれている。<ref>Ludden, P. W., and Roberts, G. P. (1989) Curr. Top. Cell. Regul. 30,23-56</ref> |
||
| 140行目: | 140行目: | ||
窒素固定反応は古くから知られていたが、1960年のCarnahanの無細胞標品の抽出まで長らく生化学的性質が明らかではなかった。<ref name=Carnahan_1/>, <ref name=Carnahan_2/>'''Carnahanは酸素を極力除去すること、そして通常4 ℃で扱うタンパク質標品を20 ℃で扱うことによってニトロゲナーゼの活性を残存させることに成功した。'''ニトロゲナーゼ還元酵素およびニトロゲナーゼ二量体のいずれも酸素に対して不可逆失活する。ニトロゲナーゼ還元酵素の空気暴露に対する半減期(t<sub>1/2</sub>)は30秒、そしてニトロゲナーゼ二量体のt<sub>1/2</sub>は4分である。<ref name=Biochemistry/> |
窒素固定反応は古くから知られていたが、1960年のCarnahanの無細胞標品の抽出まで長らく生化学的性質が明らかではなかった。<ref name=Carnahan_1/>, <ref name=Carnahan_2/>'''Carnahanは酸素を極力除去すること、そして通常4 ℃で扱うタンパク質標品を20 ℃で扱うことによってニトロゲナーゼの活性を残存させることに成功した。'''ニトロゲナーゼ還元酵素およびニトロゲナーゼ二量体のいずれも酸素に対して不可逆失活する。ニトロゲナーゼ還元酵素の空気暴露に対する半減期(t<sub>1/2</sub>)は30秒、そしてニトロゲナーゼ二量体のt<sub>1/2</sub>は4分である。<ref name=Biochemistry/> |
||
上述のように、嫌気性菌以外にも通性嫌気性菌、好気性菌そして根粒菌がニトロゲナーゼ活性を有している。嫌気性菌については完全嫌気状態でなければ窒素固定反応は行わない。また通性嫌気性菌については酸素濃度が1キロ[[パスカル]]以下の条件でなければ窒素固定反応は同様に行われない。また、 |
上述のように、嫌気性菌以外にも通性嫌気性菌、好気性菌そして根粒菌がニトロゲナーゼ活性を有している。嫌気性菌については完全嫌気状態でなければ窒素固定反応は行わない。また通性嫌気性菌については酸素濃度が1キロ[[パスカル]]以下の条件でなければ窒素固定反応は同様に行われない。また、''A. vinelandii''のような好気性細菌については自らの高い[[酸素呼吸]]活性によって細胞周辺の酸素を極力除去し、なおかつニトロゲナーゼの立体構造の違いによって酸素の影響を回避している。<ref>Postgate, J. R. (1982) The Fundamentals of Nitrogen Fixation, Cambridge University Press, London</ref>, <ref name=Nitrogenases/> |
||
'''根粒菌については酸素に高い親和性を有する[[ヘモグロビン|レグヘモグロビン]]を根粒の周囲に配置することによってニトロゲナーゼ系から酸素を除去している。'''レグヘモグロビンにとりこまれた酸素はニトロゲナーゼ系に触れることなく、植物の根を経て吸収され、体内で酸化的リン酸化に用いられる。<ref name=Nitrogenases/> |
'''根粒菌については酸素に高い親和性を有する[[ヘモグロビン|レグヘモグロビン]]を根粒の周囲に配置することによってニトロゲナーゼ系から酸素を除去している。'''レグヘモグロビンにとりこまれた酸素はニトロゲナーゼ系に触れることなく、植物の根を経て吸収され、体内で酸化的リン酸化に用いられる。<ref name=Nitrogenases/> |
||
シアノバクテリアは[[光化学反応|光化学系]]のIとIIを同時に有し、[[光合成|酸素発生型光合成]]をおこなう。したがって、ニトロゲナーゼ系とは極めて相性が悪い。しかしながら |
シアノバクテリアは[[光化学反応|光化学系]]のIとIIを同時に有し、[[光合成|酸素発生型光合成]]をおこなう。したがって、ニトロゲナーゼ系とは極めて相性が悪い。しかしながら''Anabaena''属のような繊維状のシアノバクテリアは酸素を発生する光化学系IIを細胞から除去した[[ヘテロシスト]](異質細胞)にニトロゲナーゼを発現し、窒素固定反応を行っている。<ref name=PLANT/>しかしながら、繊維状の形態をとらない単細胞のシアノバクテリア(''Trichodesmium''属など)においてもニトロゲナーゼ系および窒素固定反応が確認されている。そうしたシアノバクテリアは昼間に光合成を行いATPを蓄積した後に、夜間窒素固定反応を行うといった方法をとっている。<ref name=Nitrogenases/>ただし、光合成と窒素固定を同時に行うシアノバクテリアも見つかっており、それらの機構についてはいまだ謎に包まれている。<ref>Bergmann, B., Gallon, J, R., Rai, A. N., and Stal, L. J., (1997) N2 fixation by non-heterocystous cyanobacteria. FEMS. Microbiol. Rev., 19, 139-185</ref> |
||
==参考文献== |
==参考文献== |
||
{{脚注ヘルプ}} |
{{脚注ヘルプ}} |
||
2016年11月15日 (火) 13:04時点における版
ニトロゲナーゼ (nitrogenase, EC 1.18.6.1) はリゾビウム (Rhizobium) 属(根粒菌)など窒素固定を行う細菌が持っている酵素。大気中の窒素をアンモニアに変換する反応を触媒する。全体構造は活性中心を有するニトロゲナーゼ二量体およびニトロゲナーゼ二量体に電子を供与するニトロゲナーゼ還元酵素からなる。極めて酸素に弱く、酸素に触れると数分間で不可逆的に失活する。そのため、本酵素を有する生物にはそれぞれ空気中の酸素からニトロゲナーゼを隔離する機構が見られる。
反応
窒素固定反応において最も特徴的なのが、窒素分子の強固な三重結合を解離し無機窒素化合物に変換する点にある。この三重結合は極めて安定であり、化学的に窒素からアンモニアを合成するハーバー・ボッシュ法の反応条件によっても裏付けられている。
上述の条件における反応は発エルゴン的だが、高温高圧条件下のみで行われる。一方、生物による窒素固定反応は基本的には標準状態(25 ℃、1 atm、pH 7.0)にて行われる。ニトロゲナーゼの担う標準状態におけるアンモニア生産反応は下記の式にて表される。
水素に代わり、電子供与体(フェレドキシンなど)からの電子および高エネルギーリン酸化合物の加水分解のエネルギーを用いてアンモニア生産反応を行う。ニトロゲナーゼ系における反応は標準状態であるにもかかわらず発エルゴン的であり、その自由エネルギー変化は極めて大きい。
窒素固定化
ニトロゲナーゼの窒素固定反応は以下のように表される。大気中の窒素を還元し、アンモニアとして固定化する。アンモニアとして固定された窒素は他の細菌によってグルタミン酸塩や硝酸塩に変換され、植物が利用可能な形となる。
- N2 + 8H+ + 8e- + 16 ATP → 2NH3 + H2 + 16ADP + 16Pi・・・反応式2
上述のアンモニア生産反応との相違点は、ニトロゲナーゼの反応特異性の低さによる。ニトロゲナーゼの代表的な副反応の一つとしてATPの加水分解と共役したプロトン還元活性(水素生産)があり、本活性は還元的ATPアーゼ活性と呼ばれている。
- 2H+ + 2e- + 4ATP + 4H2O -> H2 + 4ADP + 4Pi・・・反応式3
この還元的ATPアーゼ活性と反応式1が合わさり、見かけのニトロゲナーゼ活性である反応式2の反応が得られる。なお、反応式2は至適条件における式であり、実際の生理状態においては20~30ATPが必要であるとされている。[2]
副反応
還元的ATPアーゼ活性にも示されるようにニトロゲナーゼは反応特異性が低く、様々な窒素あるいは有機化合物を触媒できる。主要なものとして、一酸化二窒素、シアン、アセトニトリル、アジド、アセチレン、シクロプロペン、シアナミドそしてジアジリンなどがある。[3]
- N2O + 2H+ + 2e- -> N2 + H2O
- CN- + 7H+ + 6e- -> CH4 + NH3
- CH3NC + 6H+ + 6e- -> CH3NH2 + CH4
- N3- + 3H+ + 2e- -> N2 + NH3
- C2H2 + 2H+ + 2e- -> C2H4
- CH2CHCH + 2H+ + 2e- -> CH2CH2CH2
- H2N-CN + 6H+ + 6e- -> NH3 + CH3NH2
- CH2NN + 6H+ + 6e- -> CH3NH2 + NH3
上記の反応の中で窒素を生産する一酸化二窒素のみが拮抗阻害剤であり、他の基質は非拮抗阻害剤となる。一酸化二窒素の還元によって生じた窒素は、そのまま通常の窒素固定化反応に用いられる。アセチレン還元反応はニトロゲナーゼの簡易測定法として有効であり、生じたエチレンをガスクロマトグラフィーによって分析することによってニトロゲナーゼ活性を検出することができる。[2]また、根粒菌による窒素固定化について、窒素の安定同位体である15Nを蓄積する現象が知られているが、その理由については現在説明は得られていない。[4], [5]
電子供与体
ニトロゲナーゼ反応に用いられる電子は主要な代謝系(発酵、ピルビン酸の酸化など)によって還元された電子伝達体によって供与される。嫌気性のグラム陽性菌であるClostridium pasteurianumはフェレドキシンを電子供与体として用いている。[6]また、Azotobacter vinelandiiのような共生的な窒素固定微生物は、フェレドキシンと比べて酸化還元電位の高いフラボドキシンを用いている。[7]また、根粒菌やThiocapsa roseopersicinaのような光合成細菌においては、還元的ATPアーゼ活性によって生じた水素をuptake-ヒドロゲナーゼによって再酸化し、電子供与体の再還元に用いている。[8]
分布
ニトロゲナーゼは原核生物(細菌、古細菌)に広く分布しており、ゲノム解析や微生物生態学的アプローチからもその分布範囲は拡大の一途をたどっている。[9]しかしながら、窒素固定の研究の特に進んでいる微生物群については嫌気性細菌、シアノバクテリアそして根粒菌が主としてあげられる。また、その生活様態から共生的窒素固定生物と非共生的窒素固定生物に分類される。[10]
非共生的窒素固定生物
共生的窒素固定細菌
- 根粒菌(Rhizobium)
一方で真核生物からはニトロゲナーゼ系を含む窒素固定系は見出されていない。[11]
分類
ニトロゲナーゼは活性中心に含まれる金属の種類によって3つに分類される。主要なニトロゲナーゼ群はモリブデンを活性中心に有するモリブデン含有ニトロゲナーゼである。多くの窒素固定菌が本ニトロゲナーゼを有しており、自然界にて行われている窒素固定のほとんどは本酵素によるものと考えられている。[11]残る二つの群はバナジウムおよび鉄をそれぞれ活性中心に含んでおり、それぞれバナジウム含有(Vanadium containing)ニトロゲナーゼおよび鉄型(Fe-only)ニトロゲナーゼと呼ばれている。[12]バナジウムおよび鉄を含んでいるニトロゲナーゼは、その全体構造を含めてモリブデン含有ニトロゲナーゼとほぼ同一である。しかしながらその分布は著しく偏っており、モリブデン型が主要なニトロゲナーゼであるのに対して、バナジウムおよび鉄型ニトロゲナーゼは代替ニトロゲナーゼ(Alternative nitrogenase)と呼ばれている。下記に分布の例を挙げる。
- モリブデン、バナジウムおよび鉄型ニトロゲナーゼの全てを有する・・・Azotobacter vinelandii[13]
- モリブデンおよび鉄型ニトロゲナーゼを有する・・・Rhodobacter capsulatus、Rhodospirillum rubrum [14], [15]
- モリブデンおよびバナジウム含有ニトロゲナーゼを有する・・・Anabaena variablis[16]
- モリブデン含有ニトロゲナーゼのみを有する・・・Krebsiella pneumoniae[17]
上述のリストのとおり、全ての窒素固定菌はモリブデン含有ニトロゲナーゼを有しており、バナジウムおよび鉄型ニトロゲナーゼのみを有する窒素固定生物はいまだ見つかっていない。また既存のニトロゲナーゼとは全く異なる4つ目のグループが放線菌Streptomyces thoermoautotrophicusから見つかっている。本酵素はモリブドプテリンを活性中心に有しており、サブユニット構成など上述のニトロゲナーゼと全く異なっている。[18]
立体構造
ニトロゲナーゼは活性中心を有するニトロゲナーゼ二量体(Dinitrogenase、Mo-Feタンパク質、component I)およびニトロゲナーゼ二量体を還元するニトロゲナーゼ還元酵素(Dinitrogenase reductase、Feタンパク質、component II)からなる。機能単位はニトロゲナーゼ二量体およびニトロゲナーゼ還元酵素二量体のヘテロ四量体をとっているが、生体内における構造はさらにヘテロ四量体が2つ結合しヘテロ八量体構造にて機能している(最上部の『ニトロゲナーゼの構造』図表参照)。なお、本節では立体構造がよく知られているモリブデン含有ニトロゲナーゼのみについて概説する。[11]
-
ニトロゲナーゼ機能単位:ニトロゲナーゼ二量体(黄、青)およびニトロゲナーゼ還元酵素二量体構造(白、ピンク)。ポリペプチドを除去した図表が下部『ニトロゲナーゼの補因子』。PDB: 1M34
-
ニトロゲナーゼ二量体:αサブユニット(緑)およびβサブユニット(赤)の二量体構造。αサブユニット内にはFeMo-coおよびホモクエン酸が、両サブユニット間にはP-clusterが確認できる。PDB: 1M34
-
ニトロゲナーゼ還元酵素:ホモ二量体構造。白およびピンクポリペプチド内にはそれぞれMg-ATPが結合している。また両サブユニット間に[4Fe-4S]クラスターが確認できる。PDB: 1M34
ニトロゲナーゼ二量体
ニトロゲナーゼ二量体の遺伝子はnifDおよびnifKであり、それぞれαおよびβサブユニットをコードしている。αβ構造が機能単位だが、生体内においてはα2β2構造をとっており、分子量は220~240 kDa程度である。αβ構造内には、活性中心である鉄-モリブデン補因子(FeMo-co)および電子伝達を担うP-clusterが一つずつ配位している。FeMo-coは[Mo-3Fe-3S]および[4Fe-3S]クラスターが3つの硫黄リガンドによって結合し、[Mo-7Fe-6S]クラスター構造を有している。さらにモリブデンはホモクエン酸のC2カルボニル基とヒドロキシル基に結合し、さらにαサブユニットのシステインとヒスチジンに結合して安定した構造をとっている。一方、P-clusterは2つの[4Fe-3S]クラスターが1つの硫黄リガンドによって結合し、[8Fe-7S]クラスター構造をとっている。それぞれのクラスターの両端はαおよびβサブユニットのシステインに結合し、配位されている。したがって、P-clusterはαβサブユニット間に配置している。
-
FeMo-co補因子:黄色部が硫黄、灰色部が鉄。ただし、左端の灰色はモリブデン。PDB: 1M34
-
P-cluster:黄色部が硫黄、灰色部が鉄。PDB: 1M34
ニトロゲナーゼ還元酵素
ニトロゲナーゼ還元酵素の遺伝子はnifHである。機能単位はホモ二量体であり、分子量は120 kDaである。ニトロゲナーゼ還元酵素内には1つの[4Fe-4S]クラスターおよび2つのMg-ATP結合部位を有している。[4Fe-4S]クラスターはホモ二量体それぞれのシステインによって配位され、P-cluster同様サブユニット間に配置している。一方、Mg-ATP結合部位については、ホモ二量体のサブユニットそれぞれに存在している。
反応機構
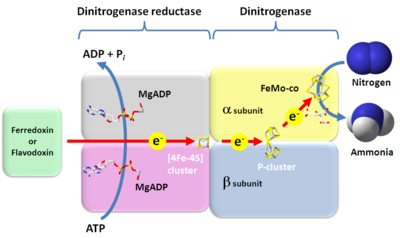
1960年にCarnahanらによってC. pasteurianum無細胞標品による窒素固定反応に成功した。[19], [20]その後、モリブデン含有ニトロゲナーゼの精製を経て、ニトロゲナーゼが二つのComponent(ニトロゲナーゼ二量体およびニトロゲナーゼ還元酵素)によって機能することが明らかになった。[21]その後の精力的な研究により、ニトロゲナーゼは下記の5成分の存在下にて窒素固定反応を行うことが示された。[22], [23], [24]
- 電子供与体(フェレドキシン、フラボドキシン)
- ニトロゲナーゼ還元酵素([4Fe-4S]クラスター)
- ATPおよび2価金属イオン(マグネシウム、カルシウムなど)
- ニトロゲナーゼ二量体(P-Cluster、FeMo-co)
- 電子受容体(窒素)
なお、上記の順序で電子伝達が行われる。以上5成分の窒素固定反応は下記の順序で行われる。
- ニトロゲナーゼ還元酵素にATPおよびマグネシウムが結合し、複合体をとる。この時ニトロゲナーゼ還元酵素の標準酸化還元電位は-400 mV付近まで低下する。
- 電子供与体からニトロゲナーゼ還元酵素-MgATP複合体に電子伝達がおこなわれ、本複合体が還元される。
- ニトロゲナーゼ還元酵素-MgATP複合体のATPが加水分解されより低電位の電子となる。結合しているATPはADPとなる。
- ニトロゲナーゼ還元酵素-MgADP複合体の[4Fe-4S]クラスターを通じて、ニトロゲナーゼ二量体のP-clusterに電子伝達がおこなわれる。
- ニトロゲナーゼ二量他のP-clusterからFeMo-coに電子伝達がおこなわれる。
- FeMo-coが窒素を2電子還元するとN2H2を生じる。
- FeMo-coがN2H2をさらに2電子還元するとN2H4が生じる。
- FeMo-coがN2H4をさらに2電子還元すると2アンモニアが生じる。
- 窒素の還元を行っている際、同時にプロトンも還元し、水素が発生する。
以上の反応の化学量論式は以下のとおりである。
- ニトロゲナーゼ還元酵素 + 2Mg2+ + 2ATP -> ニトロゲナーゼ還元酵素-MgATP複合体(酸化型)
- 2ニトロゲナーゼ還元酵素-MgATP複合体(酸化型) + 2e- -> 2ニトロゲナーゼ還元酵素-MgATP複合体(還元型)
- 2ニトロゲナーゼ還元酵素-MgATP複合体(還元型) + 2ATP -> 2ニトロゲナーゼ還元酵素-MgADP複合体(酸化型) + 2ADP + 4Pi + 2e-
- 1[4Fe-4S]クラスター(酸化型) + 2e- -> 1[4Fe-4S]クラスター(還元型)+ 1P cluster(酸化型) -> 1[4Fe-4S]クラスター(酸化型) + 1P cluster(還元型)
- 1P cluster(還元型) + 1FeMo-co(酸化型) -> 1P cluster(酸化型) + 1FeMo-co(還元型)
- 1FeMo-co(還元型) + N2 -> N2H2
- (1~5の2回目サイクル)1FeMo-co(還元型) + N2H2 -> N2H4
- (1~5の3回目サイクル)1FeMo-co(還元型) + N2H4 -> 2NH3
- 2H+ + 2e- + 4ATP + 4H2O -> H2 + 4ADP + 4Pi
なお、FeMo-co活性中心における窒素固定反応スキームについてはいまだ決定打が出ていない。現在のところFeが触媒となる経路や、[Mo-3Fe-3S]および[4Fe-3S]のクラスターをつなぐ窒素原子が触媒となる経路、あるいはモリブデンが触媒部位となる経路など4つのスキームが提案されている。[25]
関連遺伝子および機能
P clusterやFeMo-coといった複雑な金属クラスターは自発的に構築されず様々なタンパク質が構築に関与している。ニトロゲナーゼ構造遺伝子発現後にタンパク質内にクラスターが配位される発現後プロセッシングを経て活性を発揮するが、この一連の現象を成熟化(maturation)という。また、ニトロゲナーゼは発現に際して様々な調節を受けており、それらにかかわる遺伝子も多数存在する。A. vinelandiiやK. pneumoniaeのニトロゲナーゼ遺伝子の機能解析により、ニトロゲナーゼにかかわる遺伝子の全貌が明らかになってきている。[26], [27], [28]下記に、これまで明らかになったニトロゲナーゼ関連遺伝子群の名称および機能を列挙する。
- nifH・・・ニトロゲナーゼ還元酵素
- nifD・・・ニトロゲナーゼ二量体αサブユニット
- nifK・・・ニトロゲナーゼ二量体βサブユニット
- nifT・・・機能不明
- nifY/nafY・・・ニトロゲナーゼ二量体のシャペロン。FeMo-coの挿入にかかわる。
- nifE・・・FeMo-co構築
- nifN・・・FeMo-co構築
- nifX・・・FeMo-co構築
- nifU・・・鉄硫黄クラスター骨格
- nifS・・・鉄硫黄クラスターの不安定硫黄の運搬
- nifV・・・ホモクエン酸合成酵素
- nifW・・・FeMo-co安定化
- nifZ・・・機能不明
- nifM・・・ニトロゲナーゼ還元酵素の成熟化
- nifF・・・フラボドキシン
- nifL・・・陰性調節因子
- nifA・・・陽性調節因子
- nifB・・・FeMo-co構築
- fdnN・・・フェレドキシン
- nifQ・・・FeMo-co構築
- nifJ・・・ピルビン酸:フラボドキシン(フェレドキシン)オキシドレダクターゼ
なお、バナジウム含有および鉄型ニトロゲナーゼも、それぞれvnf遺伝子群(Vanadium Nitrogen Fixation)およびanf遺伝子群(Alternative Nitrogen Fixation)をそれぞれ有し、良く似た機構で発現にかかわっていると考えられている。[29]また、幾つかの'nif'遺伝子はバナジウム含有および鉄型ニトロゲナーゼで共有されている。[30]
発現調節
まず、ニトロゲナーゼ系は大量のATPを要求するため、酸化的リン酸化あるいは光リン酸化がおこなわれる条件でのみ窒素固定反応が見られる。さらにニトロゲナーゼ活性は酵素発現量の調節およびADPの拮抗阻害によって行われる。ニトロゲナーゼは生産物であるアンモニアの存在によって発現量が低下する。アンモニア自体はニトロゲナーゼ反応の阻害物質にはならない。ADPの拮抗阻害について、リボシル化されたADPがニトロゲナーゼ還元酵素の強力な阻害剤となることが明らかになっている。[31]ADPのリボシル化はニトロゲナーゼ還元酵素ADPリボシル転移酵素(DRAT: Dinitrogenase Reductase ADP-ribosyltransferase)がかかわっており、本酵素は暗条件(光リン酸化がおこなわれない条件)やアンモニウム塩の添加によって誘導される。リボシル化ADPによって阻害されたニトロゲナーゼ還元酵素はニトロゲナーゼ還元酵素活性化グリコヒドロキシラーゼ(DRAG: Dinitrogenase Reductase Activating Glycohydrolase)によって付活され、再活性化する。DRATおよびDRAGはともに精製され、性状解析がおこなわれている。[32]
酸素耐性機構
窒素固定反応は古くから知られていたが、1960年のCarnahanの無細胞標品の抽出まで長らく生化学的性質が明らかではなかった。[19], [20]Carnahanは酸素を極力除去すること、そして通常4 ℃で扱うタンパク質標品を20 ℃で扱うことによってニトロゲナーゼの活性を残存させることに成功した。ニトロゲナーゼ還元酵素およびニトロゲナーゼ二量体のいずれも酸素に対して不可逆失活する。ニトロゲナーゼ還元酵素の空気暴露に対する半減期(t1/2)は30秒、そしてニトロゲナーゼ二量体のt1/2は4分である。[1]
上述のように、嫌気性菌以外にも通性嫌気性菌、好気性菌そして根粒菌がニトロゲナーゼ活性を有している。嫌気性菌については完全嫌気状態でなければ窒素固定反応は行わない。また通性嫌気性菌については酸素濃度が1キロパスカル以下の条件でなければ窒素固定反応は同様に行われない。また、A. vinelandiiのような好気性細菌については自らの高い酸素呼吸活性によって細胞周辺の酸素を極力除去し、なおかつニトロゲナーゼの立体構造の違いによって酸素の影響を回避している。[33], [2]
根粒菌については酸素に高い親和性を有するレグヘモグロビンを根粒の周囲に配置することによってニトロゲナーゼ系から酸素を除去している。レグヘモグロビンにとりこまれた酸素はニトロゲナーゼ系に触れることなく、植物の根を経て吸収され、体内で酸化的リン酸化に用いられる。[2]
シアノバクテリアは光化学系のIとIIを同時に有し、酸素発生型光合成をおこなう。したがって、ニトロゲナーゼ系とは極めて相性が悪い。しかしながらAnabaena属のような繊維状のシアノバクテリアは酸素を発生する光化学系IIを細胞から除去したヘテロシスト(異質細胞)にニトロゲナーゼを発現し、窒素固定反応を行っている。[10]しかしながら、繊維状の形態をとらない単細胞のシアノバクテリア(Trichodesmium属など)においてもニトロゲナーゼ系および窒素固定反応が確認されている。そうしたシアノバクテリアは昼間に光合成を行いATPを蓄積した後に、夜間窒素固定反応を行うといった方法をとっている。[2]ただし、光合成と窒素固定を同時に行うシアノバクテリアも見つかっており、それらの機構についてはいまだ謎に包まれている。[34]
参考文献
- ^ a b 田宮信雄、八木達彦(1991)コーン・スタンプ生化学 第5版
- ^ a b c d e R. H. Burris (1991) Nitrogenases, J. Biol. Chem., 266 (15), 9339-9342
- ^ J. M. Rivera-Ortiz and R. H. Burris (1975) J. Bacteriol., 123, 537-545
- ^ Rasmussen, L. J., Peters, G. K., and Burris, R. H. (1989) Phykos 28, 64-79
- ^ Yoneyama, T., Yamada, N., Kojima, H., and Yazaki, J. (1984) Plant Cell Physiol., 25, 1561-1565
- ^ L. E. Mortenson, (1964) Biochim. Biophys. Acta, 81, 473-478
- ^ Shah, V. K., Stacey, G., and Brill, W. J. (1983) J. Biol. Chem. 258, 12064-12068
- ^ B. Fodor, G. Rakhely, A. T. Kovacs and K. L. Kovacs (2001) Transposon mutagenesis in purple sulfur photosynthetic bacteria: identification of hypF, encoding a protein capable of processing [NiFe] hydrogenases in alpha, beta, and gamma subdivisions of the proteobacteria, Appl. Environ. Microbiol., 67, 2476-2483
- ^ Young, J. P. W. 1992. Phylogenetic classification of nitrogen-fixing organisms, p. 43-86. In G. Stacey, R. H. Burris, and H. J. Evans (ed.), Biological nitrogen fixation. Chapman and Hall, New York, N.Y.
- ^ a b 桜井英博、柴岡弘郎、清水碩(1997)植物生理学入門、培風館
- ^ a b c Luis M. Rubio and Paul W. Ludden (2005) Maturation of Nitrogenase: a Biochemical Puzzle, J. Bacteriol., 187, 405-414
- ^ Bishop, P. E., D. M. L. Jarlenski, and D. R. Hetherington. 1980. Evidence for an alternative nitrogen fixation system in Azotobacter vinelandii. Proc. Natl. Acad. Sci. USA 77:7342-7346
- ^ Bishop, P. E., R. Premakumar, D. R. Dean, M. R. Jacobson, J. R. Chisnell, T. M. Rizzo, and J. Kopczynski. 1986. Nitrogen fixation by Azotobacter vinelandii strains having deletions in structural genes for nitrogenase. Science 232:92-94
- ^ Davis, R., L. Lehman, R. Petrovich, V. K. Shah, G. P. Roberts, and P. W. Ludden. 1996. Purification and characterization of the alternative nitrogenase from the photosynthetic bacterium Rhodospirillum rubrum. J. Bacteriol. 178, 1445-1450.
- ^ Schneider, K., A. Muller, U. Schramm, and W. Klipp. 1991. Demonstration of a molybdenum- and vanadium-independent nitrogenase in a nifHDKdeletion mutant of Rhodobacter capsulatus. Eur. J. Biochem. 195:653-661.
- ^ Thiel, T. 1993. Characterization of genes for an alternative nitrogenase in the cyanobacterium Anabaena variabilis. J. Bacteriol. 175:6276-6286
- ^ Arnold, W., A. Rump, W. Klipp, U. B. Priefer, and A. Puhler. 1988. Nucleotide sequence of a 24,206-base-pair DNA fragment carrying the entire nitrogen fixation gene cluster of Klebsiella pneumoniae. J. Mol. Biol. 203: 715-738.
- ^ Ribbe, M., D. Gadkari, and O. Meyer. 1997. N2 fixation by Streptomyces thermoautotrophicus involves a molybdenum-dinitrogenase and a manganese-superoxide oxidoreductase that couple N2 reduction to the oxidation of superoxide produced from O2 by a molybdenum-CO dehydrogenase. J. Biol. Chem. 272:26627-26633
- ^ a b Carnahan. J. E.. Mortenson. L. E.. Mower. H. F.. and Castle. J. E. (1960) Biochim. Biophys. Acta 38, 188-189
- ^ a b Carnahan. J. E.. Mortenson. L. E.. Mower. H. F.. and Castle. J. E. (1960) Biochim. Biophys. Acta 44, 520-535
- ^ Mortenson, L. E. (1965) in Non-Heme Iron Proteins: Role in Energy Conversion (San Pietro, A., ed) pp. 243-259, Antioch Press, Yellow Springs OH
- ^ Winter, H. C., and Burris, R. H. (1968) J. Biol. Chem. 243,940-944
- ^ Orme-Johnson, W. H., Hamilton, W. D., Ljones, T., Tso, M.-Y. W., Burris, R. H., Shah, V. K., and Brill, W. J. (1972) Proc. Natl. Acad. Sci. U. S. A. 69, 3142-3145
- ^ Zumft, W. G., and Mortenson, L. E. (1975) Biochim. Biophys. Acta 416, 1-52
- ^ John W Peters and Robert K Szilagyi (2006) Exploring new frontiers of nitrogenase structure and mechanism. Current Opinion in Chemical Biology, 10:101-108
- ^ Dos Santos, P. C., D. R. Dean, Y. Hu, and M. W. Ribbe. 2004. Formation and insertion of the nitrogenase iron-molybdenum cofactor. Chem. Rev. 104:1159-1173
- ^ Imperial, J., V. K. Shah, R. A. Ugalde, P. W. Ludden, and W. J. Brill. 1987. Iron-molybdenum cofactor synthesis in Azotobacter vinelandii Nif- mutants. J. Bacteriol. 169:1784-1786.
- ^ Roberts, G. P., MacNeil, T., MacNeil, D., andBrill, W. J. (1978) J. Bacteriol. 136, 267-279
- ^ Rangaraj, P., C. Ruttimann-Johnson, V. K. Shah, and P. W. Ludden. 2000. Biosynthesis of the iron-molybdenum and iron-vanadium cofactors of the nif- and vnf-encoded nitrogenases, p. 55-79. In E. W. Triplett (ed.), Prokaryotic nitrogen fixation: a model system for analysis of a biochemical process. Horizon Scientific Press, Wymondham, United Kingdom.
- ^ Kennedy, C., and D. Dean. 1992. The nifU, nifS and nifV gene products are required for activity of all three nitrogenases of Azotobacter vinelandii. Mol. Gen. Genet. 231:494-498.
- ^ Ludden, P. W., and Burns, R. H. (1976) Science 194,424-426
- ^ Ludden, P. W., and Roberts, G. P. (1989) Curr. Top. Cell. Regul. 30,23-56
- ^ Postgate, J. R. (1982) The Fundamentals of Nitrogen Fixation, Cambridge University Press, London
- ^ Bergmann, B., Gallon, J, R., Rai, A. N., and Stal, L. J., (1997) N2 fixation by non-heterocystous cyanobacteria. FEMS. Microbiol. Rev., 19, 139-185



![ニトロゲナーゼ還元酵素:ホモ二量体構造。白およびピンクポリペプチド内にはそれぞれMg-ATPが結合している。また両サブユニット間に[4Fe-4S]クラスターが確認できる。PDB: 1M34](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d3/Dinitrogenase_reductase.png/120px-Dinitrogenase_reductase.png)

