「周期表」の版間の差分
m r2.5.2) (ロボットによる 追加: hif:Periodic table |
Babi Hijau (会話 | 投稿記録) m Category付け忘れ |
||
| (同じ利用者による、間の1版が非表示) | |||
| 1行目: | 1行目: | ||
'''周期表'''(しゅうきひょう、{{Lang-en-short|periodic table}}) |
'''周期表'''(しゅうきひょう、{{Lang-en-short|periodic table}})は、[[物質]]を構成する基本[[単位]]である[[元素]]を、それぞれが持つ[[物理]]的または[[化学]]的[[性質]]が似かよったもの同士が並ぶように決められた規則([[周期律]])に従って配列した[[表]]である。これは原則的に、左上から[[原子番号]]の順に並ぶよう作成されている<ref name=Yone>{{Cite book|和書|author=米沢富美子|year=2006年|title=人物で語る物理入門(下)|chapter=第11章 原子核物理学を築いた女性たち、元素周期表|pages=112-116|publisher=[[岩波新書]]|edition=第1刷|isbn=4-00-430981-6}}</ref>。周期表上で元素はその原子の[[電子配置]]に従って並べられ、似た性質の元素が規則的に出現する<ref>{{Citation | ref = none | title = 物理化学キーノート | last1 = Whittaker | first1 = G. Allan | last2 = Mount | first2 = A. R. | last3 = Heal | first3 = M. R | editor = 中村 亘男 訳 | publisher = シュプリンガー・フェアラーク東京 | year = 2002 | publication-date = 2002-12 | isbn = 4431709568 | page = 208}}</ref>。 |
||
[[File:Дмитрий Иванович Менделеев 2.jpg|thumb|right|200px|ドミトリ・メンデレーエフ]] |
|||
同様の主旨を元に作成された先駆的な表も存在するが、一般に周期表は1869年に[[ロシア]]の[[化学者]][[ドミトリ・メンデレーエフ]]によって提案された<ref>{{Citation | ref = none | title = 地球環境化学入門 | last = Andrews | first = Julian E. | last2 = Brimblecombe | first2 = Peter | last3 = Jickells | first3 = Tim D. | last4 = Liss | first4 = Peter. S. | last5 = Reid | first5 = Brian J. | author6 = 渡辺 正 訳 | publisher = シュプリンガー・ジャパン | year = 2005 | isbn = 9784431711117 | pages = 16}}</ref>、[[原子量]]順に並べた元素がある周回で傾向が近似した性質を示す周期的な特徴を例証した表に始まると見なされている。この表の形式は、新元素の発見や理論構築など元素に対する知見が積み重なるとともに改良され、現在では各元素のふるまいを説明する洗練された表となっている<ref>{{cite web|url=http://www.iupac.org/didac/Didac%20Eng/Didac01/Content/S01.htm |title= The periodic table of the elements|publisher= IUPAC |language=英語|accessdate=2011-01-04}}</ref>。 |
|||
元素の性質を簡潔かつ完成度が高く示した周期表は「化学のバイブル」とも呼ばれる<ref>[[#竹内1996|竹内 (1996)、pp.78-79]]</ref>。現在、周期表は化学のあらゆる分野にて、[[反応]]の分類や体系化および比較を行うための枠組みを与えるものとして、汎用的に用いられている。そして、化学だけでなく物理学、[[生物学]]、[[化学工学]]を中心に[[工学]]全体に、多くの法則を示す表として用いられる。現在の周期表には、118の元素が含まれている。 |
|||
== 周期表 == |
== 周期表 == |
||
{{周期表}} |
{{周期表}} |
||
周期表は、原子番号が最も小さい「1」すなわち[[原子]]内の[[原子核|核]]に含まれる[[陽子]]の数が1個である[[水素]]から始まり、右側に原子番号の順番に応じて大きな元素を1個一マスずつに[[原子記号]]を示しながら並べる。そして周期律に沿って改行され、2段目、3段目と順次追加されてゆく。そのため、左から右へ、また上から下へ行くにつれて原子番号が大きな元素が並ぶ<ref name=Yone />。 |
|||
== 周期律を発見した人々 == |
|||
[[1860年]]のカールスルーエ会議で、[[スタニズラオ・カニッツァーロ]]が[[アルカリ土類]](2族)の[[原子量]]が従来考えられていた原子量の2倍とするのが正しいことを示した。正しい原子量の序列は多くの研究者に周期表の着想を与えるものであった。[[1862年]]、[[フランス]]の[[鉱物学|鉱物学者]][[ベギエ・ド・シャンクルトワ]]は24個の[[元素]]を原子量順に並べて[[円柱]]の周りにまくと似た性質の元素が上下に並ぶことを示した。[[イギリス]]の[[ジョン・ニューランズ]]も既知の元素を原子価順にならべると8つごとに似た性質が現れることに気づいた<ref>{{Citation | ref = none | title = 元素を知る事典 : 先端材料への入門 | author1 = 村上雅人 編著 | author2 = 阿部泰之 ら | place = 東京 | publisher = 海鳴社 | year = 2004 | publication-date = 2004-11 | isbn = 487525220X | page = 240}}</ref>(当時希ガスは未発見)。[[1868年]]、[[ドイツ]]の[[ロータル・マイヤー]]も16列にわけた周期表を考えたが公表前にメンデレーエフの表が発表された<ref>{{Citation | ref = none | title = タングステンおじさん: 化学と過ごした私の少年時代 | author-link = オリバー・サックス | first = Oliver W | last = Sacks | author2 = 斉藤隆央 訳 | publisher = 早川書房 | year = 2003 | isbn = 9784152085177}}</ref>。 |
|||
しかし、周期表は四角(長方形)ではなく中央に谷間があるおおまかな凹型をしている<ref name=Okawa44 />。これは、周期表が示す元素の近似的性質が必ずしも同じ原子番号の[[整数]][[倍]]で現れないという現象を反映しているためである。周期律において右端にある原子番号2の[[ヘリウム]]と近い性質を持つ元素の仲間([[族]]という)では、次に現れるものは原子番号10の[[ネオン]]であり、その次は[[アルゴン]](元素番号18)となる。ここまでは原子番号数の差分はいずれも8だが、続く仲間は[[クリプトン]](同36)、[[キセノン]](同54)と、増分は18に増える。上に示された一般的なレイアウトの周期表では、この18で一巡し希ガスで改行する法則を採り、縦方向でまとまる元素の族を1-18族という名称で設定する。このため、ヘリウムやネオンがある行では途中に空白が生じ、結果として周期表は凹型となる。 |
|||
== 脚注 == |
|||
{{Reflist}} |
|||
ところが、ネオンに始まる族([[希ガス]])においてキセノンの下に続く元素は[[ラドン]](同86)であり、差分は32に増える。これを1元素一マスを使い表示した[[拡張周期表]]という形式もあるが、一般的なレイアウトでは原子番号57から71までを[[ランタノイド]]、89から103までを[[アクチノイド]]として纏めて切り離し、欄外に表示する<ref name=Yone />。結果、この周期表は縦18並び、横7段、欄外2行の枠組みで構成される。この形式は[[スイス]]の[[アルフレッド・ベルナー]]が1905年に提唱したもので、現在でも国際的な[[標準]]となっている<ref name=New30>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.30-31、周期表は140年もの間、重要な役割をになってきた]]</ref>。 |
|||
[[Image:Electron shell 112 ununbium.png|right|thumb|150px|コペルニシウム(暫定名称:ウンウンビウム)。2010年2月に正式名称が決定した新元素。]] |
|||
2010年現在、周期表には118個の元素が表示されている。このうち、正式な元素名がつけられたものは112個である。この112番目の元素[[コペルニシウム]]は[[国際純正・応用化学連合]](International Union of Pure and Applied Chemistry, IUPAC)が2010年2月に正式名称として認定したものであるが、元素の発見は1996年に[[ドイツ]]の研究グループが合成に成功したことに遡る。これよりも原子番号が大きな元素は、113番目を[[日本]]の[[理化学研究所]](2004年)<ref name=Yone />、114‐116および118番目を[[アメリカ合衆国]]と[[ロシア]]の研究チーム(1998年、2000年、2003年および2003年)がそれぞれ合成に成功したと報告しており、再現性の追試験などが待たれる状態にある。なお、117番目の元素は未だ合成したという報告が無い<ref name=New70>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.70-74、周期表の元素が112個にふえた]]</ref>。元素の数がどこまで増えるかははっきりしないが、研究者の中には173番目まで存在しうるという説もある<ref name=New70 />。 |
|||
== 元素の特徴をつくりだす電子 == |
|||
{{Main|周期律|電子配置}} |
|||
メンデレーエフが各元素を特徴から並べた時には、未だ原子の構造ははっきりとわかっていなかった。どのような理論でこれら元素の特徴がもたらされるかは、20世紀になって原子の構造を示す[[原子論]]と[[電子配置]]を取り扱う[[量子力学]]理論が確立され、原子には陽子数(原子番号)と同じ数の[[電子]]が陽子核のまわりに[[電子殻]]と呼ばれる層を形成して存在すること、この殻は複数あり、電子は基本的に内側から順番に埋まってゆくことが判明した。そして、最も外側の殻([[最外殻]]にある電子([[価電子]])は[[化学反応]]など変化においてやりとりがしやすく<ref name=Okawa44 />、このためその個数が元素の性質を決める要因だということが分かった<ref name=New34>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.34-35、メンデレーエフの正しさは、原子構造で証明された]]</ref>。 |
|||
<div style="float:right; margin:5px;"> |
|||
{| class="wikitable" align=center |
|||
|- style="background:#CCCCCC" |
|||
| 電子殻(亜殻)||K||L||M(3s+3p)||M(3d)||N(4S) |
|||
|- |
|||
| style="background:#DDDDDD"| 元素|| || || || || |
|||
|- |
|||
| style="background:#DDDDDD"| K・[[カリウム]] ||2||8||8||0||1 |
|||
|- |
|||
| style="background:#DDDDDD"| Ca・[[カルシウム]] ||2||8||8||0||2 |
|||
|- |
|||
| style="background:#DDDDDD"| Sc ・[[スカンジウム]]||2||8||8||1||2 |
|||
|- |
|||
| style="background:#DDDDDD"| Ti・[[チタン]] ||2||8||8||2 ||2 |
|||
|- |
|||
| style="background:#DDDDDD"| V・[[バナジウム]] ||2||8||8|| 3||2 |
|||
|- |
|||
| style="background:#DDDDDD"| Cr ・[[クロム]]||2||8||8||5||1 |
|||
|- |
|||
| style="background:#DDDDDD"|Mn・[[マンガン]] ||2||8||8||5 ||2 |
|||
|- |
|||
| style="background:#DDDDDD"| Fe・[[鉄]] ||2||8||8||6||2 |
|||
|- |
|||
| style="background:#DDDDDD"| Co・[[コバルト]] ||2||8||8||7||2 |
|||
|- |
|||
| style="background:#DDDDDD"| Ni・[[ニッケル]] ||2||8||8||8||2 |
|||
|- |
|||
| style="background:#DDDDDD"| Cu・[[銅]] ||2||8||8||10||1 |
|||
|- |
|||
| style="background:#DDDDDD"| Zn・[[亜鉛]] ||2||8||8||10||2 |
|||
|}</div> |
|||
ところが単純に電子殻を内側から埋めてゆく法則は[[アルゴン]](原子番号18)までにしか当てはまらない。現在のところ電子殻が複数定められており、内側からK・L・M・N・O・P・Qと名称が続いてつけられている<ref name=Take76>[[#竹内1996|竹内 (1996)、pp.76-83、5.1周期表]]</ref>。それぞれには収まる電子の最大数が決まっており、K殻=2個、L=8、M=18、N=32、O=32,である。さらにこれは、構成原理[[:en:Aufbau principle|(en)]]に基づく[[エネルギー準位]]によって電子が順に埋まる電子軌道([[亜殻]]、subshells) に分けられる。K殻は2個の電子が入る1s軌道、L殻は2個の電子が入る2s軌道と6個の電子が入る2p軌道、以下、M殻(3s軌道=2個、3p軌道=6個、3d軌道=10個)、N殻(4s=2、4p=6、4d=10、4f=14)、O殻(5s=2、5p=6、5d=10、5f=14)、P殻(6s=2、6p=6…)、Q殻(7s=2、…)となっている。このうち第4周期において、4s軌道は3d軌道よりも先に電子が満たされる傾向がある<ref name=Take76 />。そのため[[カリウム]](同19)から[[ニッケル]](同28)まではM殻に空席がある状態でN殻の4s軌道に電子が配置され、これが最外殻として元素の性質を形作る。そして、周期表のへこんだ中央部にあるこの元素群は表の横方向で近似した傾向を備え、これらに該当する3-11族は[[遷移元素]]と呼ばれ、このような特性は第4周期以降の長周期と呼ばれる部分で現れる<ref name=Take76 />。まだ電子の存在が解明されていなかったメンデレーエフは、この元素の一群をどう解釈すべきかで非常に頭を痛めたという<ref name=New36>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.36-37、メンデレーエフを最後まで悩ませた元素の一群]]</ref>。このような現象が起こる理由について、現在ではM殻内ので電子同士が負電荷で反発するために起こると説明されている<ref name=Okawa44>[[#大川2002|大川 (2002)、pp.44-48、1.7周期表と電子配置]]</ref>。 |
|||
== 分類 == |
|||
=== 族 === |
|||
{{Main|元素の族}} |
|||
周期表において元素が表示された位置関係は、その化学的特性を予想することを可能とする。列に沿って左右を見比べるよりも、縦に並んだマスを比較する方に留意して見るべきである。 |
|||
[[元素の族|族]](group またはfamily)は、周期表における縦方向の集合である。この族は元素を分類する上で最も重要な方法と考えられている。いくつかの族に当る各元素の特性は非常に似かよっており、原子量が多くなる方向で明らかな傾向が見られる。この族には名称がつけられているが、それらは [[アルカリ金属]] (alkali metals)、[[アルカリ土類金属]] (alkaline earth metals)、[[ハロゲン]] (halogen)、[[第15族元素|ニクトゲン]] (pnictogens)、[[第16族元素|カルコゲン]] (chalcogens)、[[希ガス]] (noble gases)と、統一性があまり無い。[[第14族元素]]など周期表におけるその他の族は垂直方向での近似性があまり見られず、基本的に族の数字で表されることが多い。 |
|||
現代の[[量子力学]]理論が要請する原子の構造は、族が持つ傾向で説明され、それは特性ごとに分ける上で最も重要な要素に影響を与える原子価殻において電子配置が同一である原子は同じ族に含まれる。同じ族の元素グループには、[[原子半径]]、[[イオン化エネルギー]]そして[[電気陰性度]]のパターンにも近似性が見られる。上から下に行くにつれ、全体のエネルギー値が高くなるため、原子価電子は原子核から遠くなってゆき、元素の原子半径は大きくなる。原子全体が電子を捕まえる力は強くなるため、下に行くほどイオン化エネルギーは小さくなり、同様に原子核と原子価電子の距離が長くなるにつれ電気陰性度も低くなる<ref name=Take83>[[#竹内1996|竹内 (1996)、pp.83-91、5.2単体の性質の周期性]]</ref>。 |
|||
=== 周期 === |
|||
{{Main|元素の周期}} |
|||
[[元素の周期|周期]](period)は、周期表のおける横方向の集合である。基本的に各元素の特性に族で示される程の似かよった所は無いが、例外的な箇所もある。これは、[[遷移金属]]と、特に[[ランタノイド]]や[[アクチノイド]]において、水平方向で近似性を持つ特徴が相当する。この周期は、最外電子殻が内側から何番目であるかを表している<ref name=Okawa44 />。 |
|||
[[Image:Ionization energies.svg|right|thumb|300px|原子番号(横軸)と[[イオン化エネルギー]](縦軸)のグラフ。それぞれの周期においてアルカリ金属で最も低く、希ガスで最も高くなる<ref name=Take83 />。]] |
|||
同じ周期にある元素は原子半径、イオン化エネルギー、[[電子親和力]]、電気陰性度のパターンで似た傾向を示す。左から右に行くにつれ、一般に原子半径は小さくなる。これは、元素に含まれる陽子の数は段々と増えるため、それに応じて電子が原子核にひきつけられるためである。これに伴ってイオン化エネルギーは大きくなり、希ガスで最大となる<ref name=Take83 />。原子半径が小さくなると全体を捉える力が強まり、電子を引き剥がすために必要なエネルギーが大きくなる。電気陰性度も同じく核による電子の牽引力が増すため大きくなる。電子親和力の周期内による変化傾向はわずかである。周期表左側にある金属元素は一般に、希ガスを除いて右側の非金属元素よりも電子親和力は低い<ref name=Take83 />。 |
|||
=== ブロック === |
|||
[[File:Periodic Table structure.svg|right|thumb|300px|この図は、周期表における[[元素のブロック]]を示す。]] |
|||
{{Main|元素のブロック}} |
|||
最外殻電子が元素の特徴に大きな影響を与える点を考慮して周期表を領域で分ける分類もあり、これは[[元素のブロック|ブロック]] (periodic table block または単に block) と呼ばれ、「最後の電子」が存在する亜殻の位置に応じて名称がつけられる。[[Sブロック元素|sブロック元素]]はアルカリ金属とアルカリ土類金属のふたつの族に[[水素]]と[[ヘリウム]]が加わるブロックである。[[Pブロック元素|pブロック元素]]は残り6つの族(13 – 18族元素)が該当し、[[半金属]]はここに含まれる。[[Dブロック元素|dブロック元素]]は3-12族元素に当る遷移金属を包括する。通常、周期表の欄外に置かれるランタノイドとアクチノイドは[[Fブロック元素|fブロック元素]]となる。 |
|||
=== その他 === |
|||
元素は他の集合でも分類され、周期表の縦横またはブロックでも示しにくい場合がある。[[金属]]・[[半金属]]元素と[[非金属]]元素の区分は暗示的にしか表現されない階段状の斜め線で区別されている。その線の右側が非金属元素、左側が金属元素であり、間に半金属が挟まれている。金属が持つ典型的特徴である電子を放出しやすい性質は、周期表の左下で強くなる<ref name=Okawa52>[[#大川2002|大川 (2002)、pp.52-55、1.9イオン]]</ref>。 |
|||
また、単体が常温常圧下で取る[[物質の状態]]([[固体]]・[[液体]]・[[気体]])もブロックでは表しにくい。全体の傾向は水素と右上のヘリウム付近(窒素から左、塩素から左および希ガス)が気体であり、例外的に液体の相となる[[臭素]]と[[水銀]]を除いた元素は固体である。このような分類は、マスや文字色などそれぞれの周期表で工夫をこらした表現で示される場合もある<ref name=New30 />。 |
|||
== 歴史 == |
|||
[[ファイル:Chancourtois elements.png|right|thumb|125px|[[ベギエ・ド・シャンクルトワ]]の「地のらせん」概略図。]] |
|||
=== 先駆的な周期律の考察 === |
|||
18世紀後半から19世紀前半にかけて化学の発展に伴い元素が数多く発見され、1789年に[[アントワーヌ・ラヴォアジエ]]が作成したリストでは33個の元素が記載された。1930年までにその数は55種まで増え、それとともに化学者の中には漠然とした不安が持ち上がっていた。元素は一体何種類あるのか、そしてこの増えるばかりの元素には何かしらの法則性が隠されていないのだろうかという疑念である<ref name=Asi155>[[#アシモフ1967|アシモフ (1967)、第8章 周期表、pp.155-161、乱雑に並んだ元素]]</ref>。1829年、ドイツの[[ヨハン・デーベライナー]]は1826年に発見された[[臭素]]の色や反応における性質、そして原子量が[[塩素]]および[[ヨウ素]]の中間にありことに気づいた。彼は他にも同様の組み合わせが無いか研究したところ、[[カルシウム]]‐[[ストロンチウム]]‐[[バリウム]]と[[硫黄]]‐[[セレン]]‐[[テルル]]にも同じような性質の近似性があることを見つけた。デーベライナーはこの組み合わせを[[三つ組元素]]と名付けた<ref name=Asi155 /><ref name=New26>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.26-27、元素の周期性に気づいた先人たち]]</ref>。しかし、当時知られた元素のうちこれに当てはまるものは1/6に過ぎず、多くの化学者は単なる偶然と片付けた。当時、原子量と分子量、そして[[化学当量]]は明確に区別されておらず、混同も多かった<ref name=Asi155 />。 |
|||
1862年に[[フランス]]の[[鉱物学者]][[ベギエ・ド・シャンクルトワ]]が「地のらせん」という説を発表し、円筒状の紙に元素を螺旋型に並べると垂直方向に性質が近似した元素が並ぶと唱えた<ref name=Asi161>[[#アシモフ1967|アシモフ (1967)、第8章 周期表、pp.161-170、元素の体系化]]</ref>。しかし彼は[[数学]]における[[錬金術]]的な「数秘学」という方法でこれを説明し、的確な図を添付しなかったために他の科学者には理解されなかった。1864年、[[イギリス]]の[[ジョン・ニューランズ]]が当時知られていた元素を並べると、最初(水素)と8番目(フッ素)の性質が似ており、以下2番目(リチウム)と9番目(ナトリウム)も同じ傾向があり、これは7番目([[酸素]])と14番目(硫黄)まで同様に見られることを、音楽の音階になぞらえて「[[オクターブの法則]]」と名付けて発表した<ref name=Asi161 /><ref>{{Citation | ref = none | title = 元素を知る事典 : 先端材料への入門 | author1 = 村上雅人 編著 | author2 = 阿部泰之 ら | place = 東京 | publisher = 海鳴社 | year = 2004 | publication-date = 2004-11 | isbn = 487525220X | page = 240}}</ref><ref>{{cite journal | title = On the Law of Octaves | author = Newlands, John A. R. | journal = Chemical News | volume = 12 | page = 83 | date = 1865-08-18 | url = http://web.lemoyne.edu/~giunta/EA/NEWLANDSann.HTML#newlands4}}</ref>。ただしこれはさらに大きな元素には当てはまらなかったために賛同を得られず<ref name=New26 />かえって「では元素記号のアルファベット順に並べたらどうなる」と嘲笑の的になった<ref>{{cite book|last=Bryson|first=Bill|title=A Short History of Nearly Everything|publisher=Black Swan|year=2004|location=London|pages=141–142|isbn=9780552151740}}</ref>。1864年、ドイツの[[ロータル・マイヤー]]は既知49種類の元素を原子容(原子体積)に着目し<ref name=Asi161 />16列にわけた周期表を考案した。これは電子価が同じ元素が近似した性質を持つことを表していた<ref>{{Citation | ref = none | title = タングステンおじさん: 化学と過ごした私の少年時代 | author-link = オリバー・サックス | first = Oliver W | last = Sacks | author2 = 斉藤隆央 訳 | publisher = 早川書房 | year = 2003 | isbn = 9784152085177}}</ref><ref>Ball, p. 101</ref>。 |
|||
=== メンデレーエフの周期表 === |
|||
[[File:Mendeleev's 1869 periodic table.png|left|thumb|200px|メンデレーエフが1869年に、最初に作成した周期表]] |
|||
ドイツの[[アウグスト・ケクレ]]は、原子量や分子量などの概念が固まっていないことを問題視し、1860年に[[カールスルーエ]]で「元素の質量測定」を命題とした史上初の国際化学者会議を開催した<ref name=Asi155 />。この会議に出席したロシアの[[教師]]であり化学者であったメンデレーエフはそこで[[イタリア]]の[[スタニズラオ・カニッツァーロ]]が主張する原子量を重視すべきという主張<ref name=Asi155 />に影響を受けた<ref name=New46>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.46-47、周期表を生み出したメンデレーエフの生涯]]</ref>。 |
|||
帰国後メンデレーエフは[[ペテルブルク大学]]の教授となった1869年に、化学の[[教科書]]を執筆していた際<ref name=New46 />、当時63個まで発見数が増えていた元素を説明する方法に悩んでいた。彼は好きなカードゲームから発案し、元素名を書き込んだカードを何度も原子量順に並べ替えることを繰り返す内にひとつの表を作り上げた。それは原子価を重視し、かつ適切に当てはまる元素が無い箇所は「エカホウ素」「エカアルミニウム」「エカケイ素」(「エカ」はラテン語で「1」の意味)など仮の名をつけた空白とする工夫を施したものだった<ref name=Asi161 />。この表は1870年にドイツの科学雑誌で発表された<ref name=New28>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.28-29、カードゲームでひらめいた!周期表の誕生物語]]</ref>。 |
|||
[[File:Mendelejevs periodiska system 1871.png|right|thumb|300px|メンデレーエフの第二周期表。1871年。表の上部には水素化物と酸化物があるように、彼は化合物を重視してこの表を作成した<ref name=Saito35 />。]] |
|||
当初この表に価値を認める学者はほとんどいなかった<ref name=New28 />。しかし、マイヤーはこれに注目し、原子容の考え方を加えた論文を発表した。彼は原子量順の原子容を調べたところ、リチウム・ナトリウム・カリウムと並ぶアルカリ金属族に該当する元素は原子容が前後と飛びぬけて高いことを示した<ref name=Saito35>[[#斉藤1982|斉藤 (1982)、2章 元素の種類と周期律、pp.35-39、2.1.4.メンデレーエフとマイヤー]]</ref>。メンデレーエフはマイヤーの論文も参照し、改良を加えた周期表(第二周期表)を作成した。これにはローマ数字ⅠからⅧで縦の分類が施され、うちⅠ-Ⅶが基本的に1-2族および13-17族に対応し、Ⅷには遷移元素群を入れ、また希ガスは反映されていなかった。それぞれには2種類の亜族を設け、表の左右に振り分けて区分した<ref name=Saito35 />。 |
|||
=== 認められた周期表 === |
|||
メンデレーエフの周期表はすぐに認められたわけではなかった。しかし1875年に[[フランス]]の[[ポール・ボアボードラン]]が新元素[[ガリウム]]を発見し、これが「エカアルミニウム」と一致することが判明すると周期表が注目を浴びるようになった<ref name=Asi170>[[#アシモフ1967|アシモフ (1967)、第8章 周期表、pp.170-175、空所を埋める]]</ref>。その後も1879年の[[スカンジウム]](「エカホウ素」)、1886年の[[ゲルマニウム]](「エカケイ素」)がメンデレーエフの表にある空白を埋めるものだということが判明し、彼の周期表の正しさが証明された<ref name=New28 /><ref name=Asi170 />。これに伴って「オクターブの法則」のジョン・ニューランズも再評価され、1887年にイギリス化学学会から賞を授与された<ref>[[#竹内1996|竹内 (1996)、pp.97]]</ref>。 |
|||
逆のケースもあった。1794年に[[スウェーデン]]の小村[[イッテルビー]]で発見された鉱物群から多くの新元素が見つかっていたが、1907年までにその数は14種までになった。これらはいずれも近似した性質を持ち[[希土類元素]]と呼ばれたが、メンデレーエフの周期表を元にすると、いずれの族にも納まらない<ref name=Asi175>[[#アシモフ1967|アシモフ (1967)、第8章 周期表、pp.175-182、新しい元素の群]]</ref>。この問題は常に意識されていたが、1920年以降にランタノイドが概念化され決着を見た<ref name=Saito40>[[#斉藤1982|斉藤 (1982)、2章 元素の種類と周期律、pp.40-41、2.1.5.周期表の完成]]</ref>。 |
|||
=== 希ガスを反映 === |
|||
メンデレーエフは化合物のでき方、すなわち原子価を重視して周期表を作成した。ここに、1894年に[[ジョン・ウィリアム・ストラット]](レイリー卿)と[[ウィリアム・ラムゼー]]が発見した新元素[[アルゴン]]が立ちはだかった。「怠け者」を意味する化合物を作らないアルゴンをどのように周期表の中に組み込むべきかが悩まれた。しかし1898年までに同様な性質を持つヘリウム・ネオン・クリプトン・キセノンが相次いで発見され、これらも周期表の族の一種だと考えられるようになった<ref name=Saito47>[[#斉藤1982|斉藤 (1982)、2章 元素の種類と周期律、pp.47-51、2.2.3.アルゴンと希ガス]]</ref>。 |
|||
これら元素は[[希ガス]]と呼ばれたが、原子価を示すとゼロとなる。原子量で考えるとアルゴンはカリウムとカルシウムの間に入るべきだが、原子価で見るとイオウ‐塩素‐カリウム‐カルシウムが2‐1‐1‐2となる点を重視して塩素とカリウムの間に入れると2‐1‐0‐1‐2となったため、希ガスは周期表の右端に置かれるようになった<ref name=Asi175 />。 |
|||
=== 原子モデル構築 === |
|||
周期表で示される元素の性質を作り出す構造は、1913年に[[ニールス・ボーア]]が提唱した[[ボーアの原子模型]]で理論説明が成された<ref name=Take76 />。彼の理論によって、元素は電子配置によって性質が左右し、その軌道が周期表の周期と対応していることが説明された<ref name=Take76 />。 |
|||
== 色々な周期表 == |
|||
=== 周期表に表示される情報 === |
|||
周期表の各マスには、最低限元素記号と原子番号が記される。大きな周期表においては、これに加えさまざまな情報が追記されたものもある。日本ならば[[日本語]]の名称というように作成地域の[[言語]]における元素名、原子量や価電子数、さらに拡張的なものでは電子配置や利用例なども加えられることがある。 |
|||
原子量について、元素の多くは[[同位元素]]を持つ。これらの原子量は一定ではないため、表記する際には慣例的に[[半減期]]が最も長い同位体を[[括弧]]つきで示す<ref>{{cite web|url=http://www.ptable.com/ |title= Dynamic periodic table |publisher= ptable.com |language=英語|accessdate=2011-01-04}}</ref>。なお、原子量には絶対質量と相対質量があり、後者は質量数12の炭素(<sup>12</sup>C)を基準「12」と置いて設定される。これには物理学会と化学学会の紆余曲折があり、1820年頃に酸素を基準に置いていたところ、1890年代に3つの同位体の存在が判明し、物理では厳密に<sup>16</sup>Oを基準と定めたが化学では従来通り3同位体が混ざった状態を基準としていた。これらの統一は1960年に検討がなされたが、<sup>16</sup>Oを基準に置くと化学での数字が0.027%も変化するため、ずれが0.0043%に収まり、また同位体の存在数が比較的少ない<sup>12</sup>Cを新しい基準に採用した<ref name=Ne648>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.64-65、元素の基準はなぜ水素から炭素になったのか]]</ref>。 |
|||
=== 水素の位置 === |
|||
現在一般的な周期表では、水素は最も左上の場所にある。しかしこれは適切ではないのではという意見が過去IUPACの雑誌にて提唱された。現状では水素は、最外殻に一つの電子を持つ1族の位置にあるが、[[リチウム]]以下でこの属はアルカリ金属を指しており、金属ではない水素がここにある矛盾が指摘された。また、電子殻(この場合亜殻の1p軌道)が満たされる状態からひとつ電子が少ないと捉えると、[[フッ素]]以下の17属([[ハロゲン]])の仲間と考えることも可能であり、実際に水素はハロゲン的な性質を併せ持つ。IUPACは水素の位置を左上端に置くとする見解を示しているが、[[アメリカ化学会]]などはこれらを考慮し、水素を第1周期の中央部分に置いた周期表を掲載した書籍を発行している<ref name=New42>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.42-43、水素の位置で新提案!周期表の並び方が変わる?]]</ref>。 |
|||
また、ヘリウムも最外殻の電子数が二つであることを重視して2族の[[ベリリウム]]上部に置くべきという主張もある。しかしヘリウムは希ガスの性質を持つため、右端に置く現状が最適という考えが一般的である<ref name=New42 />。 |
|||
=== 立体周期表 === |
|||
平面的な周期表では1族と18族が大きく断絶しているように見えるが、本来この2つの族は原子番号が隣り合っている通り、連続して示されるべきものである。一般的な周期表は、いわばらせん状に連なるべきものを無理に平面で表示している。[[京都大学]]教授の前野悦輝は円筒の上に示す[[エレメンタッチ]]を考案し、立体的な周期表を示した<ref name=New44>[[#ニュートン別2010|ニュートン別冊 (2010)、pp.44-45、さまざまなタイプの周期表が考案されている]]</ref>。 |
|||
欄外に置かれたランタノイドとアクチノイドを取り込んだ立体周期表を、化学者ポール・ジゲールが提案した。平面状の周期表を立てた棒に貼り付け、ランタノイドとアクチノイドの部分を直角に差し込んだもので、将来119番目以降の元素が発見された際に設ける必要が生じる欄外も取り込むことができる<ref name=New44 />。 |
|||
[[カナダ]]の化学者フェルナンド・デュフォーは、柱に取り付けた複数の透明なプレート上に各原子を配列し、プレートで同一の周期を示しながら、族を上から見下ろした際に元素の表示が重なって見えることで周期律を表す立体周期表を提案した。これは、柱を中心にそれぞれの方向に近似する性質を持つ元素の集団が見通せ、それが規則的に増加する周期それぞれの性質を把握しやすい形となっている<ref name=New44 />。 |
|||
=== 様々な周期表 === |
|||
<gallery> |
|||
File:Elementspiral.svg|スパイラル周期表(テーオドール・ベンファイ、1960年<ref>{{cite web|url= http://www.glencoe.com/sec/science/chemistry/mc/pow/chapter06.shtml |title=Problem of the Week |publisher= Chemistry|language=英語|accessdate=2011-01-04}}</ref>) |
|||
File:Circular form of periodic table.svg|円形 |
|||
File:TROPE 777x777 AB 082009.png|リング型 |
|||
File:Mendeleev flower.jpg|花型 |
|||
File:Periodic system Pyramid format.svg|ピラミッド型 |
|||
File:Periodic system Stowe format.svg|ストウ型 |
|||
File:Periodic system Zmaczynski&Bayley.svg|"Zmaczynski & Bayley" 型 |
|||
File:Adomah_Wiki.JPG|ADOMAH 型、2006年<ref>{{cite web|url=http://www.perfectperiodictable.com/ |title=Reriodic Law can be understood in terms of the Tetrahedral Sphere Packing |publisher= perfectperiodictable.com |language=英語|accessdate=2011-01-04}}</ref> |
|||
</gallery> |
|||
== 関連項目 == |
== 関連項目 == |
||
{{Commons|Periodic table}} |
{{Commons|Periodic table}} |
||
* [[元素]] |
|||
* [[元素の周期]] |
|||
* [[元素の族]] |
|||
* [[拡張周期表]] |
|||
* [[エレメンタッチ]](立体周期表) |
|||
* [[化学元素発見の年表]] |
* [[化学元素発見の年表]] |
||
* [[核図表]] |
* [[核図表]] |
||
== |
== 参考文献 == |
||
* {{Cite book|和書|author=編集長:水谷仁|year=2010年|title=[[ニュートン (雑誌)|ニュートン]]別冊周期表第2版|publisher=[[ニュートンプレス]]|location=[[東京都]]|isbn=978-4-315-51876-4|ref=ニュートン別2010}} |
|||
* [http://www.mext.go.jp/a_menu/kagaku/week/shuki.htm 文部科学省:一家に1枚周期表] |
|||
*{{cite book|和書|title=化学入門コース 化学の基礎|author=竹内敬人|publisher=岩波書店|edition=第1刷|year=1996年|isbn=4-00-007981-6|ref=竹内1996}} |
|||
* [http://www.chemsoc.org/viselements/pages/periodic_table.html 英国王立化学会:ヴィジュアル周期表] |
|||
*{{cite book|和書|title=化学の歴史|author=[[アイザック・アシモフ]]|translator=玉虫文一、竹内敬人 |publisher=[[ちくま学芸文庫]]|edition=第1刷|oridate=1967年|year=2010年|isbn=978-4-480-09282-3|ref=アシモフ1967}} |
|||
*{{cite book|和書|title=高校化学とっておき勉強法|author=大川貴史|publisher=[[講談社]]|edition=第1刷| year=2002年|isbn=4-06-257356-3|ref=大川2002}} |
|||
*{{cite book|和書|title=元素の話|author=斉藤一夫|publisher=[[培風館]]|edition=初版第12刷| oriyear=1982年|year=1996年|isbn=4-563-02014-1|ref=斉藤1982}} |
|||
*{{cite book|title=The Periodic Kingdom|author=Atkins, P. W.|publisher=HarperCollins Publishers, Inc.|year=1995|isbn=0-465-07265-8}} |
|||
*{{cite book|title=The Ingredients: A Guided Tour of the Elements|author=Ball, Philip|publisher=Oxford University Press|year=2002|isbn=0-19-284100-9}} |
|||
*{{cite book|author=Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E.|title=Chemistry: The Central Science|year=2005|publisher=Prentice Hall|edition=10th|isbn=0-13-109686-9}} |
|||
*{{cite book|author=Pullman, Bernard|title=The Atom in the History of Human Thought|publisher=Oxford University Press|year=1998|isbn=0-19-515040-6|others=Translated by Axel Reisinger}} |
|||
== 脚注 == |
|||
{{Link FA|lmo}} |
|||
=== 注釈 === |
|||
{{脚注ヘルプ}} |
|||
<div class= "references-small"> |
|||
<references group="注"/> |
|||
</div> |
|||
=== 脚注 === |
|||
{{Reflist|2}} |
|||
=== 脚注2 === |
|||
本脚注は、出典・脚注内で提示されている「出典」を示しています。 |
|||
{{Reflist|group="2-"}} |
|||
== 外部リンク == |
|||
*{{ja icon}}[http://www.mext.go.jp/a_menu/kagaku/week/shuki.htm 文部科学省:一家に1枚周期表] |
|||
*{{en icon}}[http://www.chemsoc.org/viselements/pages/periodic_table.html 英国王立化学会:ヴィジュアル周期表] |
|||
*{{en icon}}[http://www.meta-synthesis.com/webbook/35_pt/pt_database.php 様々な周期表] |
|||
{{DEFAULTSORT:しゆうきひよう}} |
{{DEFAULTSORT:しゆうきひよう}} |
||
[[Category:元素]] |
[[Category:元素]] |
||
[[Category:周期表|*]] |
[[Category:周期表|*]] |
||
{{Link FL|no}} |
|||
[[af:Periodieke tabel]] |
[[af:Periodieke tabel]] |
||
[[als:Periodensystem]] |
[[als:Periodensystem]] |
||
[[am:የንጥረ ነገሮች ሠንጠረዥ]] |
[[am:የንጥረ ነገሮች ሠንጠረዥ]] |
||
[[ar:جدول دوري]] |
|||
[[an:Tabla periodica d'os elementos]] |
[[an:Tabla periodica d'os elementos]] |
||
[[ar:جدول دوري]] |
|||
[[arz:جدول دورى]] |
|||
[[ast:Tabla periódica]] |
[[ast:Tabla periódica]] |
||
[[az:Kimyəvi elementlərin dövri cədvəli]] |
[[az:Kimyəvi elementlərin dövri cədvəli]] |
||
[[bn:পর্যায় সারণী]] |
|||
[[bar:Periodnsystem]] |
|||
[[zh-min-nan:Chiu-kî-piáu]] |
|||
[[bat-smg:Periuodėnė elementu lentalė]] |
|||
[[be:Перыядычная сістэма элементаў]] |
[[be:Перыядычная сістэма элементаў]] |
||
[[be-x-old:Пэрыядычная сыстэма хімічных элемэнтаў]] |
[[be-x-old:Пэрыядычная сыстэма хімічных элемэнтаў]] |
||
[[bar:Periodensystem]] |
|||
[[bs:Periodni sistem elemenata]] |
|||
[[br:Taolenn beriodek an elfennoù]] |
|||
[[bg:Периодична система]] |
[[bg:Периодична система]] |
||
[[bn:পর্যায় সারণী]] |
|||
[[bpy:পর্যায় সারণী]] |
|||
[[br:Taolenn beriodek an elfennoù]] |
|||
[[bs:Periodni sistem elemenata]] |
|||
[[ca:Taula periòdica]] |
[[ca:Taula periòdica]] |
||
[[cv:Элементсен периодикăллă системи]] |
|||
[[ceb:Talaang peryodiko]] |
[[ceb:Talaang peryodiko]] |
||
[[cs:Periodická tabulka]] |
[[cs:Periodická tabulka]] |
||
[[cv:Элементсен периодикăллă системи]] |
|||
[[cy:Tabl cyfnodol]] |
[[cy:Tabl cyfnodol]] |
||
[[da:Periodiske system]] |
[[da:Periodiske system]] |
||
[[de:Periodensystem]] |
[[de:Periodensystem]] |
||
[[et:Keemiliste elementide perioodilisussüsteem]] |
|||
[[el:Περιοδικός πίνακας των χημικών στοιχείων]] |
[[el:Περιοδικός πίνακας των χημικών στοιχείων]] |
||
[[en:Periodic table]] |
[[en:Periodic table]] |
||
[[es:Tabla periódica de los elementos]] |
|||
[[eo:Perioda tabelo]] |
[[eo:Perioda tabelo]] |
||
[[es:Tabla periódica de los elementos]] |
|||
[[et:Keemiliste elementide perioodilisussüsteem]] |
|||
[[eu:Taula periodikoa]] |
[[eu:Taula periodikoa]] |
||
[[fa:جدول تناوبی (استاندارد)]] |
[[fa:جدول تناوبی (استاندارد)]] |
||
[[fi:Jaksollinen järjestelmä]] |
|||
[[fiu-vro:Mendelejevi tapõl]] |
|||
[[fo:Skeiðbundna skipanin]] |
[[fo:Skeiðbundna skipanin]] |
||
[[fr:Tableau périodique des éléments]] |
[[fr:Tableau périodique des éléments]] |
||
[[fy:Periodyk systeem fan de eleminten]] |
|||
[[frr:Perioodisch tabäle]] |
|||
[[fur:Tabele periodiche]] |
[[fur:Tabele periodiche]] |
||
[[fy:Periodyk systeem fan de eleminten]] |
|||
[[ga:Tábla peiriadach]] |
[[ga:Tábla peiriadach]] |
||
[[gv:Taabyl reiltagh ny bunstooghyn]] |
|||
[[gan:元素週期表]] |
|||
[[gl:Táboa periódica dos elementos]] |
[[gl:Táboa periódica dos elementos]] |
||
[[gan:元素週期表]] |
|||
[[gu:આવર્ત કોષ્ટક]] |
[[gu:આવર્ત કોષ્ટક]] |
||
[[gv:Taabyl reiltagh ny bunstooghyn]] |
|||
[[hak:Ngièn-su Tsû-khì-péu]] |
[[hak:Ngièn-su Tsû-khì-péu]] |
||
[[ko:주기율표]] |
|||
[[he:הטבלה המחזורית]] |
|||
[[hy:Պարբերական աղյուսակ]] |
|||
[[hi:आवर्त सारणी]] |
[[hi:आवर्त सारणी]] |
||
[[hif:Periodic table]] |
|||
[[hr:Periodni sustav elemenata]] |
[[hr:Periodni sustav elemenata]] |
||
[[ht:Tablo klasifikasyon peryodik eleman]] |
|||
[[hu:Periódusos rendszer]] |
|||
[[hy:Պարբերական աղյուսակ]] |
|||
[[ia:Tabella periodic del elementos]] |
|||
[[id:Tabel periodik]] |
|||
[[io:Periodala tabelo dil elementaro]] |
[[io:Periodala tabelo dil elementaro]] |
||
[[bpy:পর্যায় সারণী]] |
|||
[[id:Tabel periodik]] |
|||
[[ia:Tabella periodic del elementos]] |
|||
[[os:Элементты периодон системæ]] |
|||
[[is:Lotukerfið]] |
[[is:Lotukerfið]] |
||
[[it:Tavola periodica degli elementi]] |
[[it:Tavola periodica degli elementi]] |
||
[[he:הטבלה המחזורית]] |
|||
[[jbo:dikni selratni cartu]] |
|||
[[jv:Daftar unsur miturut lambang]] |
[[jv:Daftar unsur miturut lambang]] |
||
[[ka:ქიმიურ ელემენტთა პერიოდული სისტემა]] |
|||
[[kn:ಆವರ್ತ ಕೋಷ್ಟಕ]] |
[[kn:ಆವರ್ತ ಕೋಷ್ಟಕ]] |
||
[[ka:ქიმიურ ელემენტთა პერიოდული სისტემა]] |
|||
[[ko:주기율표]] |
|||
[[sw:Mfumo radidia]] |
|||
[[koi:Периоддэз сьӧрті химия ӧтувторрезлӧн тэчас]] |
[[koi:Периоддэз сьӧрті химия ӧтувторрезлӧн тэчас]] |
||
[[ksh:Periodesystem fun de schėmische Ellemänte]] |
|||
[[ku:Sîstema vedorî ya elementan]] |
|||
[[kv:Химия элементъяслӧн период системаныс]] |
[[kv:Химия элементъяслӧн период системаныс]] |
||
[[ht:Tablo klasifikasyon peryodik eleman]] |
|||
[[ku:Sîstema vedorî ya elementan]] |
|||
[[la:Systema Periodicum]] |
[[la:Systema Periodicum]] |
||
[[lv:Ķīmisko elementu periodiskā tabula]] |
|||
[[lb:Periodesystem vun den Elementer]] |
[[lb:Periodesystem vun den Elementer]] |
||
[[lt:Periodinė elementų lentelė]] |
|||
[[li:Periodiek systeem vaan elemente]] |
[[li:Periodiek systeem vaan elemente]] |
||
[[lmo:Taula periodica]] |
|||
[[ln:Etánda ya bileko]] |
[[ln:Etánda ya bileko]] |
||
[[lmo:Taula periodica]] |
|||
[[lt:Periodinė elementų lentelė]] |
|||
[[hu:Periódusos rendszer]] |
|||
[[lv:Ķīmisko elementu periodiskā tabula]] |
|||
[[mhr:Химий тӱҥлык-влакын периодик радамлыкше]] |
|||
[[mi:Ripanga pūmotu]] |
|||
[[mk:Периоден систем на елементите]] |
[[mk:Периоден систем на елементите]] |
||
[[ml:ആവർത്തനപ്പട്ടിക]] |
[[ml:ആവർത്തനപ്പട്ടിക]] |
||
[[mt:Tavla perjodika]] |
|||
[[mn:Үелэх систем]] |
|||
[[mi:Ripanga pūmotu]] |
|||
[[mr:आवर्त सारणी]] |
[[mr:आवर्त सारणी]] |
||
[[arz:جدول دورى]] |
|||
[[ms:Jadual berkala]] |
[[ms:Jadual berkala]] |
||
[[mn:Үелэх систем]] |
|||
[[mt:Tavla perjodika]] |
|||
[[my:ဒြပ်စင်အလှည့်ကျဇယား]] |
[[my:ဒြပ်စင်အလှည့်ကျဇယား]] |
||
[[nah:Tlapēuhcāyōtl nemachiyōtīlpāntli]] |
[[nah:Tlapēuhcāyōtl nemachiyōtīlpāntli]] |
||
[[nds:Periodensystem]] |
|||
[[nl:Periodiek systeem]] |
[[nl:Periodiek systeem]] |
||
[[frr:Perioodisch tabäle]] |
|||
[[nn:Periodesystemet]] |
|||
[[no:Periodesystemet]] |
[[no:Periodesystemet]] |
||
[[nn:Periodesystemet]] |
|||
[[oc:Taula periodica]] |
[[oc:Taula periodica]] |
||
[[mhr:Химий тӱҥлык-влакын периодик радамлыкше]] |
|||
[[os:Элементты периодон системæ]] |
|||
[[uz:Unsurlarning davriy jadvali]] |
|||
[[pa:ਪੀਰੀਆਡਿਕ ਟੇਬਲ]] |
[[pa:ਪੀਰੀਆਡਿਕ ਟੇਬਲ]] |
||
[[pnb:پیریاڈک ٹیبل]] |
|||
[[pap:Mesa periodiko]] |
[[pap:Mesa periodiko]] |
||
[[nds:Periodensystem]] |
|||
[[pl:Układ okresowy pierwiastków]] |
[[pl:Układ okresowy pierwiastków]] |
||
[[pnb:پیریاڈک ٹیبل]] |
|||
[[pnt:Περιοδικόν Πινάκιν]] |
[[pnt:Περιοδικόν Πινάκιν]] |
||
[[pt:Tabela periódica]] |
[[pt:Tabela periódica]] |
||
[[ksh:Periodesystem fun de schėmische Ellemänte]] |
|||
[[qu:Qallawap ñiqi rakirinkuna]] |
|||
[[ro:Tabelul periodic al elementelor]] |
[[ro:Tabelul periodic al elementelor]] |
||
[[qu:Qallawap ñiqi rakirinkuna]] |
|||
[[roa-tara:Tavele Periodiche]] |
|||
[[ru:Периодическая система химических элементов]] |
[[ru:Периодическая система химических элементов]] |
||
[[sah:Периодтаах таабыл]] |
[[sah:Периодтаах таабыл]] |
||
[[sco:Periodic Cairt]] |
[[sco:Periodic Cairt]] |
||
[[stq:Periodiske Tabelle]] |
|||
[[sh:Periodni sistem elemenata]] |
|||
[[st:Tafole ya periodiki]] |
|||
[[simple:Periodic table]] |
[[simple:Periodic table]] |
||
[[sk:Periodická tabuľka]] |
[[sk:Periodická tabuľka]] |
||
[[sl:Periodni sistem elementov]] |
[[sl:Periodni sistem elementov]] |
||
[[so:Kaltanka Curiyayaasha]] |
[[so:Kaltanka Curiyayaasha]] |
||
[[sr:Периодни систем елемената]] |
|||
[[srn:Periodiki sistemi]] |
[[srn:Periodiki sistemi]] |
||
[[sr:Периодни систем елемената]] |
|||
[[st:Tafole ya periodiki]] |
|||
[[sh:Periodni sistem elemenata]] |
|||
[[stq:Periodiske Tabelle]] |
|||
[[su:Tabél periodik]] |
[[su:Tabél periodik]] |
||
[[fi:Jaksollinen järjestelmä]] |
|||
[[sv:Periodiska systemet]] |
[[sv:Periodiska systemet]] |
||
[[ |
[[tl:Talaang peryodiko]] |
||
[[ta:தனிம அட்டவணை]] |
[[ta:தனிம அட்டவணை]] |
||
[[roa-tara:Tavele Periodiche]] |
|||
[[tg:Ҷадвали даврии элементҳои химиявӣ]] |
|||
[[tt:Менделеевның периодик таблицасы]] |
|||
[[th:ตารางธาตุ]] |
[[th:ตารางธาตุ]] |
||
[[tg:Ҷадвали даврии элементҳои химиявӣ]] |
|||
[[tl:Talaang peryodiko]] |
|||
[[tpi:Tebol bilong ol elemen]] |
|||
[[tr:Periyodik tablo]] |
[[tr:Periyodik tablo]] |
||
[[tt:Менделеевның периодик таблицасы]] |
|||
[[ug:ئېلېمېنتلارنىڭ دەۋرىي جەەدۋىلى]] |
|||
[[uk:Періодична система елементів]] |
[[uk:Періодична система елементів]] |
||
[[ur:دوری جدول]] |
[[ur:دوری جدول]] |
||
[[ug:ئېلېمېنتلارنىڭ دەۋرىي جەەدۋىلى]] |
|||
[[uz:Unsurlarning davriy jadvali]] |
|||
[[vec:Tabeła periòdica]] |
[[vec:Tabeła periòdica]] |
||
[[vi:Bảng tuần hoàn]] |
[[vi:Bảng tuần hoàn]] |
||
[[fiu-vro:Mendelejevi tapõl]] |
|||
[[wa:Tåvlea periodike des elemints]] |
|||
[[vls:Periodiek système]] |
[[vls:Periodiek système]] |
||
[[wa:Tåvlea periodike des elemints]] |
|||
[[war:Tabla Peryodika han mga Elemento]] |
[[war:Tabla Peryodika han mga Elemento]] |
||
[[wuu:元素周期表]] |
[[wuu:元素周期表]] |
||
[[yi:פעריאדישע טאבעלע]] |
[[yi:פעריאדישע טאבעלע]] |
||
[[yo:Tábìlì ìgbà]] |
[[yo:Tábìlì ìgbà]] |
||
[[zh-yue:元素週期表]] |
|||
[[bat-smg:Periuodėnė elementu lentalė]] |
|||
[[zh:元素周期表]] |
[[zh:元素周期表]] |
||
[[zh-min-nan:Chiu-kî-piáu]] |
|||
[[zh-yue:元素週期表]] |
|||
2011年1月4日 (火) 13:58時点における版
周期表(しゅうきひょう、英: periodic table)は、物質を構成する基本単位である元素を、それぞれが持つ物理的または化学的性質が似かよったもの同士が並ぶように決められた規則(周期律)に従って配列した表である。これは原則的に、左上から原子番号の順に並ぶよう作成されている[1]。周期表上で元素はその原子の電子配置に従って並べられ、似た性質の元素が規則的に出現する[2]。

同様の主旨を元に作成された先駆的な表も存在するが、一般に周期表は1869年にロシアの化学者ドミトリ・メンデレーエフによって提案された[3]、原子量順に並べた元素がある周回で傾向が近似した性質を示す周期的な特徴を例証した表に始まると見なされている。この表の形式は、新元素の発見や理論構築など元素に対する知見が積み重なるとともに改良され、現在では各元素のふるまいを説明する洗練された表となっている[4]。
元素の性質を簡潔かつ完成度が高く示した周期表は「化学のバイブル」とも呼ばれる[5]。現在、周期表は化学のあらゆる分野にて、反応の分類や体系化および比較を行うための枠組みを与えるものとして、汎用的に用いられている。そして、化学だけでなく物理学、生物学、化学工学を中心に工学全体に、多くの法則を示す表として用いられる。現在の周期表には、118の元素が含まれている。
周期表
| 18 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 |
1 |
0 n | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 |
1 H |
2 | 13 | 14 | 15 | 16 | 17 | 2 He | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 |
3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 |
11 Na |
12 Mg |
3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |||||||||||||||||||||||||||||||||||||||||
| 4 |
19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |||||||||||||||||||||||||||||||||||||||||
| 5 |
37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |||||||||||||||||||||||||||||||||||||||||
| 6 |
55 Cs |
56 Ba |
*1 | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |||||||||||||||||||||||||||||||||||||||||
| 7 |
87 Fr |
88 Ra |
*2 | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |||||||||||||||||||||||||||||||||||||||||
| 8 |
119 Uue |
120 Ubn |
*3 | 154 Upq |
155 Upp |
156 Uph |
157 Ups |
158 Upo |
159 Upe |
160 Uhn |
161 Uhu |
162 Uhb |
163 Uht |
164 Uhq |
165 Uhp |
166 Uhh |
167 Uhs |
168 Uho | |||||||||||||||||||||||||||||||||||||||||
| 9 |
169 Uhe |
170 Usn |
*5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 |
*1 ランタノイド: | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||||||||||||||||||||||||||||||||||||||||
| 7 |
*2 アクチノイド: | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||||||||||||||||||||||||||||||||||||||||
| 8 |
*4 超アクチノイド: | 139 Ute |
140 Uqn |
141 Uqu |
142 Uqb |
143 Uqt |
144 Uqq |
145 Uqp |
146 Uqh |
147 Uqs |
148 Uqo |
149 Uqe |
150 Upn |
151 Upu |
152 Upb |
153 Upt | |||||||||||||||||||||||||||||||||||||||||||
| 8 |
*3 超アクチノイド: | 121 Ubu |
122 Ubb |
123 Ubt |
124 Ubq |
125 Ubp |
126 Ubh |
127 Ubs |
128 Ubo |
129 Ube |
130 Utn |
131 Utu |
132 Utb |
133 Utt |
134 Utq |
135 Utp |
136 Uth |
137 Uts |
138 Uto |
*4 | |||||||||||||||||||||||||||||||||||||||
| 9 |
*5 超アクチノイド: | 171 Usu |
172 Usb |
173 Ust |
[t 1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
脚注
周期表は、原子番号が最も小さい「1」すなわち原子内の核に含まれる陽子の数が1個である水素から始まり、右側に原子番号の順番に応じて大きな元素を1個一マスずつに原子記号を示しながら並べる。そして周期律に沿って改行され、2段目、3段目と順次追加されてゆく。そのため、左から右へ、また上から下へ行くにつれて原子番号が大きな元素が並ぶ[1]。
しかし、周期表は四角(長方形)ではなく中央に谷間があるおおまかな凹型をしている[6]。これは、周期表が示す元素の近似的性質が必ずしも同じ原子番号の整数倍で現れないという現象を反映しているためである。周期律において右端にある原子番号2のヘリウムと近い性質を持つ元素の仲間(族という)では、次に現れるものは原子番号10のネオンであり、その次はアルゴン(元素番号18)となる。ここまでは原子番号数の差分はいずれも8だが、続く仲間はクリプトン(同36)、キセノン(同54)と、増分は18に増える。上に示された一般的なレイアウトの周期表では、この18で一巡し希ガスで改行する法則を採り、縦方向でまとまる元素の族を1-18族という名称で設定する。このため、ヘリウムやネオンがある行では途中に空白が生じ、結果として周期表は凹型となる。
ところが、ネオンに始まる族(希ガス)においてキセノンの下に続く元素はラドン(同86)であり、差分は32に増える。これを1元素一マスを使い表示した拡張周期表という形式もあるが、一般的なレイアウトでは原子番号57から71までをランタノイド、89から103までをアクチノイドとして纏めて切り離し、欄外に表示する[1]。結果、この周期表は縦18並び、横7段、欄外2行の枠組みで構成される。この形式はスイスのアルフレッド・ベルナーが1905年に提唱したもので、現在でも国際的な標準となっている[7]。

2010年現在、周期表には118個の元素が表示されている。このうち、正式な元素名がつけられたものは112個である。この112番目の元素コペルニシウムは国際純正・応用化学連合(International Union of Pure and Applied Chemistry, IUPAC)が2010年2月に正式名称として認定したものであるが、元素の発見は1996年にドイツの研究グループが合成に成功したことに遡る。これよりも原子番号が大きな元素は、113番目を日本の理化学研究所(2004年)[1]、114‐116および118番目をアメリカ合衆国とロシアの研究チーム(1998年、2000年、2003年および2003年)がそれぞれ合成に成功したと報告しており、再現性の追試験などが待たれる状態にある。なお、117番目の元素は未だ合成したという報告が無い[8]。元素の数がどこまで増えるかははっきりしないが、研究者の中には173番目まで存在しうるという説もある[8]。
元素の特徴をつくりだす電子
メンデレーエフが各元素を特徴から並べた時には、未だ原子の構造ははっきりとわかっていなかった。どのような理論でこれら元素の特徴がもたらされるかは、20世紀になって原子の構造を示す原子論と電子配置を取り扱う量子力学理論が確立され、原子には陽子数(原子番号)と同じ数の電子が陽子核のまわりに電子殻と呼ばれる層を形成して存在すること、この殻は複数あり、電子は基本的に内側から順番に埋まってゆくことが判明した。そして、最も外側の殻(最外殻にある電子(価電子)は化学反応など変化においてやりとりがしやすく[6]、このためその個数が元素の性質を決める要因だということが分かった[9]。
| 電子殻(亜殻) | K | L | M(3s+3p) | M(3d) | N(4S) |
| 元素 | |||||
| K・カリウム | 2 | 8 | 8 | 0 | 1 |
| Ca・カルシウム | 2 | 8 | 8 | 0 | 2 |
| Sc ・スカンジウム | 2 | 8 | 8 | 1 | 2 |
| Ti・チタン | 2 | 8 | 8 | 2 | 2 |
| V・バナジウム | 2 | 8 | 8 | 3 | 2 |
| Cr ・クロム | 2 | 8 | 8 | 5 | 1 |
| Mn・マンガン | 2 | 8 | 8 | 5 | 2 |
| Fe・鉄 | 2 | 8 | 8 | 6 | 2 |
| Co・コバルト | 2 | 8 | 8 | 7 | 2 |
| Ni・ニッケル | 2 | 8 | 8 | 8 | 2 |
| Cu・銅 | 2 | 8 | 8 | 10 | 1 |
| Zn・亜鉛 | 2 | 8 | 8 | 10 | 2 |
ところが単純に電子殻を内側から埋めてゆく法則はアルゴン(原子番号18)までにしか当てはまらない。現在のところ電子殻が複数定められており、内側からK・L・M・N・O・P・Qと名称が続いてつけられている[10]。それぞれには収まる電子の最大数が決まっており、K殻=2個、L=8、M=18、N=32、O=32,である。さらにこれは、構成原理(en)に基づくエネルギー準位によって電子が順に埋まる電子軌道(亜殻、subshells) に分けられる。K殻は2個の電子が入る1s軌道、L殻は2個の電子が入る2s軌道と6個の電子が入る2p軌道、以下、M殻(3s軌道=2個、3p軌道=6個、3d軌道=10個)、N殻(4s=2、4p=6、4d=10、4f=14)、O殻(5s=2、5p=6、5d=10、5f=14)、P殻(6s=2、6p=6…)、Q殻(7s=2、…)となっている。このうち第4周期において、4s軌道は3d軌道よりも先に電子が満たされる傾向がある[10]。そのためカリウム(同19)からニッケル(同28)まではM殻に空席がある状態でN殻の4s軌道に電子が配置され、これが最外殻として元素の性質を形作る。そして、周期表のへこんだ中央部にあるこの元素群は表の横方向で近似した傾向を備え、これらに該当する3-11族は遷移元素と呼ばれ、このような特性は第4周期以降の長周期と呼ばれる部分で現れる[10]。まだ電子の存在が解明されていなかったメンデレーエフは、この元素の一群をどう解釈すべきかで非常に頭を痛めたという[11]。このような現象が起こる理由について、現在ではM殻内ので電子同士が負電荷で反発するために起こると説明されている[6]。
分類
族
周期表において元素が表示された位置関係は、その化学的特性を予想することを可能とする。列に沿って左右を見比べるよりも、縦に並んだマスを比較する方に留意して見るべきである。
族(group またはfamily)は、周期表における縦方向の集合である。この族は元素を分類する上で最も重要な方法と考えられている。いくつかの族に当る各元素の特性は非常に似かよっており、原子量が多くなる方向で明らかな傾向が見られる。この族には名称がつけられているが、それらは アルカリ金属 (alkali metals)、アルカリ土類金属 (alkaline earth metals)、ハロゲン (halogen)、ニクトゲン (pnictogens)、カルコゲン (chalcogens)、希ガス (noble gases)と、統一性があまり無い。第14族元素など周期表におけるその他の族は垂直方向での近似性があまり見られず、基本的に族の数字で表されることが多い。
現代の量子力学理論が要請する原子の構造は、族が持つ傾向で説明され、それは特性ごとに分ける上で最も重要な要素に影響を与える原子価殻において電子配置が同一である原子は同じ族に含まれる。同じ族の元素グループには、原子半径、イオン化エネルギーそして電気陰性度のパターンにも近似性が見られる。上から下に行くにつれ、全体のエネルギー値が高くなるため、原子価電子は原子核から遠くなってゆき、元素の原子半径は大きくなる。原子全体が電子を捕まえる力は強くなるため、下に行くほどイオン化エネルギーは小さくなり、同様に原子核と原子価電子の距離が長くなるにつれ電気陰性度も低くなる[12]。
周期
周期(period)は、周期表のおける横方向の集合である。基本的に各元素の特性に族で示される程の似かよった所は無いが、例外的な箇所もある。これは、遷移金属と、特にランタノイドやアクチノイドにおいて、水平方向で近似性を持つ特徴が相当する。この周期は、最外電子殻が内側から何番目であるかを表している[6]。
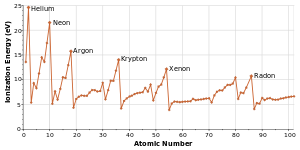
同じ周期にある元素は原子半径、イオン化エネルギー、電子親和力、電気陰性度のパターンで似た傾向を示す。左から右に行くにつれ、一般に原子半径は小さくなる。これは、元素に含まれる陽子の数は段々と増えるため、それに応じて電子が原子核にひきつけられるためである。これに伴ってイオン化エネルギーは大きくなり、希ガスで最大となる[12]。原子半径が小さくなると全体を捉える力が強まり、電子を引き剥がすために必要なエネルギーが大きくなる。電気陰性度も同じく核による電子の牽引力が増すため大きくなる。電子親和力の周期内による変化傾向はわずかである。周期表左側にある金属元素は一般に、希ガスを除いて右側の非金属元素よりも電子親和力は低い[12]。
ブロック

最外殻電子が元素の特徴に大きな影響を与える点を考慮して周期表を領域で分ける分類もあり、これはブロック (periodic table block または単に block) と呼ばれ、「最後の電子」が存在する亜殻の位置に応じて名称がつけられる。sブロック元素はアルカリ金属とアルカリ土類金属のふたつの族に水素とヘリウムが加わるブロックである。pブロック元素は残り6つの族(13 – 18族元素)が該当し、半金属はここに含まれる。dブロック元素は3-12族元素に当る遷移金属を包括する。通常、周期表の欄外に置かれるランタノイドとアクチノイドはfブロック元素となる。
その他
元素は他の集合でも分類され、周期表の縦横またはブロックでも示しにくい場合がある。金属・半金属元素と非金属元素の区分は暗示的にしか表現されない階段状の斜め線で区別されている。その線の右側が非金属元素、左側が金属元素であり、間に半金属が挟まれている。金属が持つ典型的特徴である電子を放出しやすい性質は、周期表の左下で強くなる[13]。
また、単体が常温常圧下で取る物質の状態(固体・液体・気体)もブロックでは表しにくい。全体の傾向は水素と右上のヘリウム付近(窒素から左、塩素から左および希ガス)が気体であり、例外的に液体の相となる臭素と水銀を除いた元素は固体である。このような分類は、マスや文字色などそれぞれの周期表で工夫をこらした表現で示される場合もある[7]。
歴史

先駆的な周期律の考察
18世紀後半から19世紀前半にかけて化学の発展に伴い元素が数多く発見され、1789年にアントワーヌ・ラヴォアジエが作成したリストでは33個の元素が記載された。1930年までにその数は55種まで増え、それとともに化学者の中には漠然とした不安が持ち上がっていた。元素は一体何種類あるのか、そしてこの増えるばかりの元素には何かしらの法則性が隠されていないのだろうかという疑念である[14]。1829年、ドイツのヨハン・デーベライナーは1826年に発見された臭素の色や反応における性質、そして原子量が塩素およびヨウ素の中間にありことに気づいた。彼は他にも同様の組み合わせが無いか研究したところ、カルシウム‐ストロンチウム‐バリウムと硫黄‐セレン‐テルルにも同じような性質の近似性があることを見つけた。デーベライナーはこの組み合わせを三つ組元素と名付けた[14][15]。しかし、当時知られた元素のうちこれに当てはまるものは1/6に過ぎず、多くの化学者は単なる偶然と片付けた。当時、原子量と分子量、そして化学当量は明確に区別されておらず、混同も多かった[14]。
1862年にフランスの鉱物学者ベギエ・ド・シャンクルトワが「地のらせん」という説を発表し、円筒状の紙に元素を螺旋型に並べると垂直方向に性質が近似した元素が並ぶと唱えた[16]。しかし彼は数学における錬金術的な「数秘学」という方法でこれを説明し、的確な図を添付しなかったために他の科学者には理解されなかった。1864年、イギリスのジョン・ニューランズが当時知られていた元素を並べると、最初(水素)と8番目(フッ素)の性質が似ており、以下2番目(リチウム)と9番目(ナトリウム)も同じ傾向があり、これは7番目(酸素)と14番目(硫黄)まで同様に見られることを、音楽の音階になぞらえて「オクターブの法則」と名付けて発表した[16][17][18]。ただしこれはさらに大きな元素には当てはまらなかったために賛同を得られず[15]かえって「では元素記号のアルファベット順に並べたらどうなる」と嘲笑の的になった[19]。1864年、ドイツのロータル・マイヤーは既知49種類の元素を原子容(原子体積)に着目し[16]16列にわけた周期表を考案した。これは電子価が同じ元素が近似した性質を持つことを表していた[20][21]。
メンデレーエフの周期表

ドイツのアウグスト・ケクレは、原子量や分子量などの概念が固まっていないことを問題視し、1860年にカールスルーエで「元素の質量測定」を命題とした史上初の国際化学者会議を開催した[14]。この会議に出席したロシアの教師であり化学者であったメンデレーエフはそこでイタリアのスタニズラオ・カニッツァーロが主張する原子量を重視すべきという主張[14]に影響を受けた[22]。
帰国後メンデレーエフはペテルブルク大学の教授となった1869年に、化学の教科書を執筆していた際[22]、当時63個まで発見数が増えていた元素を説明する方法に悩んでいた。彼は好きなカードゲームから発案し、元素名を書き込んだカードを何度も原子量順に並べ替えることを繰り返す内にひとつの表を作り上げた。それは原子価を重視し、かつ適切に当てはまる元素が無い箇所は「エカホウ素」「エカアルミニウム」「エカケイ素」(「エカ」はラテン語で「1」の意味)など仮の名をつけた空白とする工夫を施したものだった[16]。この表は1870年にドイツの科学雑誌で発表された[23]。

当初この表に価値を認める学者はほとんどいなかった[23]。しかし、マイヤーはこれに注目し、原子容の考え方を加えた論文を発表した。彼は原子量順の原子容を調べたところ、リチウム・ナトリウム・カリウムと並ぶアルカリ金属族に該当する元素は原子容が前後と飛びぬけて高いことを示した[24]。メンデレーエフはマイヤーの論文も参照し、改良を加えた周期表(第二周期表)を作成した。これにはローマ数字ⅠからⅧで縦の分類が施され、うちⅠ-Ⅶが基本的に1-2族および13-17族に対応し、Ⅷには遷移元素群を入れ、また希ガスは反映されていなかった。それぞれには2種類の亜族を設け、表の左右に振り分けて区分した[24]。
認められた周期表
メンデレーエフの周期表はすぐに認められたわけではなかった。しかし1875年にフランスのポール・ボアボードランが新元素ガリウムを発見し、これが「エカアルミニウム」と一致することが判明すると周期表が注目を浴びるようになった[25]。その後も1879年のスカンジウム(「エカホウ素」)、1886年のゲルマニウム(「エカケイ素」)がメンデレーエフの表にある空白を埋めるものだということが判明し、彼の周期表の正しさが証明された[23][25]。これに伴って「オクターブの法則」のジョン・ニューランズも再評価され、1887年にイギリス化学学会から賞を授与された[26]。
逆のケースもあった。1794年にスウェーデンの小村イッテルビーで発見された鉱物群から多くの新元素が見つかっていたが、1907年までにその数は14種までになった。これらはいずれも近似した性質を持ち希土類元素と呼ばれたが、メンデレーエフの周期表を元にすると、いずれの族にも納まらない[27]。この問題は常に意識されていたが、1920年以降にランタノイドが概念化され決着を見た[28]。
希ガスを反映
メンデレーエフは化合物のでき方、すなわち原子価を重視して周期表を作成した。ここに、1894年にジョン・ウィリアム・ストラット(レイリー卿)とウィリアム・ラムゼーが発見した新元素アルゴンが立ちはだかった。「怠け者」を意味する化合物を作らないアルゴンをどのように周期表の中に組み込むべきかが悩まれた。しかし1898年までに同様な性質を持つヘリウム・ネオン・クリプトン・キセノンが相次いで発見され、これらも周期表の族の一種だと考えられるようになった[29]。
これら元素は希ガスと呼ばれたが、原子価を示すとゼロとなる。原子量で考えるとアルゴンはカリウムとカルシウムの間に入るべきだが、原子価で見るとイオウ‐塩素‐カリウム‐カルシウムが2‐1‐1‐2となる点を重視して塩素とカリウムの間に入れると2‐1‐0‐1‐2となったため、希ガスは周期表の右端に置かれるようになった[27]。
原子モデル構築
周期表で示される元素の性質を作り出す構造は、1913年にニールス・ボーアが提唱したボーアの原子模型で理論説明が成された[10]。彼の理論によって、元素は電子配置によって性質が左右し、その軌道が周期表の周期と対応していることが説明された[10]。
色々な周期表
周期表に表示される情報
周期表の各マスには、最低限元素記号と原子番号が記される。大きな周期表においては、これに加えさまざまな情報が追記されたものもある。日本ならば日本語の名称というように作成地域の言語における元素名、原子量や価電子数、さらに拡張的なものでは電子配置や利用例なども加えられることがある。
原子量について、元素の多くは同位元素を持つ。これらの原子量は一定ではないため、表記する際には慣例的に半減期が最も長い同位体を括弧つきで示す[30]。なお、原子量には絶対質量と相対質量があり、後者は質量数12の炭素(12C)を基準「12」と置いて設定される。これには物理学会と化学学会の紆余曲折があり、1820年頃に酸素を基準に置いていたところ、1890年代に3つの同位体の存在が判明し、物理では厳密に16Oを基準と定めたが化学では従来通り3同位体が混ざった状態を基準としていた。これらの統一は1960年に検討がなされたが、16Oを基準に置くと化学での数字が0.027%も変化するため、ずれが0.0043%に収まり、また同位体の存在数が比較的少ない12Cを新しい基準に採用した[31]。
水素の位置
現在一般的な周期表では、水素は最も左上の場所にある。しかしこれは適切ではないのではという意見が過去IUPACの雑誌にて提唱された。現状では水素は、最外殻に一つの電子を持つ1族の位置にあるが、リチウム以下でこの属はアルカリ金属を指しており、金属ではない水素がここにある矛盾が指摘された。また、電子殻(この場合亜殻の1p軌道)が満たされる状態からひとつ電子が少ないと捉えると、フッ素以下の17属(ハロゲン)の仲間と考えることも可能であり、実際に水素はハロゲン的な性質を併せ持つ。IUPACは水素の位置を左上端に置くとする見解を示しているが、アメリカ化学会などはこれらを考慮し、水素を第1周期の中央部分に置いた周期表を掲載した書籍を発行している[32]。
また、ヘリウムも最外殻の電子数が二つであることを重視して2族のベリリウム上部に置くべきという主張もある。しかしヘリウムは希ガスの性質を持つため、右端に置く現状が最適という考えが一般的である[32]。
立体周期表
平面的な周期表では1族と18族が大きく断絶しているように見えるが、本来この2つの族は原子番号が隣り合っている通り、連続して示されるべきものである。一般的な周期表は、いわばらせん状に連なるべきものを無理に平面で表示している。京都大学教授の前野悦輝は円筒の上に示すエレメンタッチを考案し、立体的な周期表を示した[33]。
欄外に置かれたランタノイドとアクチノイドを取り込んだ立体周期表を、化学者ポール・ジゲールが提案した。平面状の周期表を立てた棒に貼り付け、ランタノイドとアクチノイドの部分を直角に差し込んだもので、将来119番目以降の元素が発見された際に設ける必要が生じる欄外も取り込むことができる[33]。
カナダの化学者フェルナンド・デュフォーは、柱に取り付けた複数の透明なプレート上に各原子を配列し、プレートで同一の周期を示しながら、族を上から見下ろした際に元素の表示が重なって見えることで周期律を表す立体周期表を提案した。これは、柱を中心にそれぞれの方向に近似する性質を持つ元素の集団が見通せ、それが規則的に増加する周期それぞれの性質を把握しやすい形となっている[33]。
様々な周期表
関連項目
参考文献
- 編集長:水谷仁『ニュートン別冊周期表第2版』ニュートンプレス、東京都、2010。ISBN 978-4-315-51876-4。
- 竹内敬人『化学入門コース 化学の基礎』(第1刷)岩波書店、1996。ISBN 4-00-007981-6。
- アイザック・アシモフ 著、玉虫文一、竹内敬人 訳『化学の歴史』(第1刷)ちくま学芸文庫、2010。ISBN 978-4-480-09282-3。
- 大川貴史『高校化学とっておき勉強法』(第1刷)講談社、2002。ISBN 4-06-257356-3。
- 斉藤一夫『元素の話』(初版第12刷)培風館、1996。ISBN 4-563-02014-1。
- Atkins, P. W. (1995). The Periodic Kingdom. HarperCollins Publishers, Inc.. ISBN 0-465-07265-8
- Ball, Philip (2002). The Ingredients: A Guided Tour of the Elements. Oxford University Press. ISBN 0-19-284100-9
- Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E. (2005). Chemistry: The Central Science (10th ed.). Prentice Hall. ISBN 0-13-109686-9
- Pullman, Bernard (1998). The Atom in the History of Human Thought. Translated by Axel Reisinger. Oxford University Press. ISBN 0-19-515040-6
脚注
注釈
脚注
- ^ a b c d 米沢富美子「第11章 原子核物理学を築いた女性たち、元素周期表」『人物で語る物理入門(下)』(第1刷)岩波新書、2006、112-116頁。ISBN 4-00-430981-6。
- ^ Whittaker, G. Allan; Mount, A. R.; Heal, M. R (2002), 中村 亘男 訳, ed., 物理化学キーノート, シュプリンガー・フェアラーク東京, 2002-12, p. 208, ISBN 4431709568
- ^ Andrews, Julian E.; Brimblecombe, Peter; Jickells, Tim D.; Liss, Peter. S.; Reid, Brian J.; 渡辺 正 訳 (2005), 地球環境化学入門, シュプリンガー・ジャパン, pp. 16, ISBN 9784431711117
- ^ “The periodic table of the elements” (英語). IUPAC. 2011年1月4日閲覧。
- ^ 竹内 (1996)、pp.78-79
- ^ a b c d 大川 (2002)、pp.44-48、1.7周期表と電子配置
- ^ a b ニュートン別冊 (2010)、pp.30-31、周期表は140年もの間、重要な役割をになってきた
- ^ a b ニュートン別冊 (2010)、pp.70-74、周期表の元素が112個にふえた
- ^ ニュートン別冊 (2010)、pp.34-35、メンデレーエフの正しさは、原子構造で証明された
- ^ a b c d e 竹内 (1996)、pp.76-83、5.1周期表
- ^ ニュートン別冊 (2010)、pp.36-37、メンデレーエフを最後まで悩ませた元素の一群
- ^ a b c d 竹内 (1996)、pp.83-91、5.2単体の性質の周期性
- ^ 大川 (2002)、pp.52-55、1.9イオン
- ^ a b c d e アシモフ (1967)、第8章 周期表、pp.155-161、乱雑に並んだ元素
- ^ a b ニュートン別冊 (2010)、pp.26-27、元素の周期性に気づいた先人たち
- ^ a b c d アシモフ (1967)、第8章 周期表、pp.161-170、元素の体系化
- ^ 村上雅人 編著; 阿部泰之 ら (2004), 元素を知る事典 : 先端材料への入門, 東京: 海鳴社 (2004-11発行), p. 240, ISBN 487525220X
- ^ Newlands, John A. R. (1865-08-18). “On the Law of Octaves”. Chemical News 12: 83.
- ^ Bryson, Bill (2004). A Short History of Nearly Everything. London: Black Swan. pp. 141–142. ISBN 9780552151740
- ^ Sacks, Oliver W; 斉藤隆央 訳 (2003), タングステンおじさん: 化学と過ごした私の少年時代, 早川書房, ISBN 9784152085177
- ^ Ball, p. 101
- ^ a b ニュートン別冊 (2010)、pp.46-47、周期表を生み出したメンデレーエフの生涯
- ^ a b c ニュートン別冊 (2010)、pp.28-29、カードゲームでひらめいた!周期表の誕生物語
- ^ a b c 斉藤 (1982)、2章 元素の種類と周期律、pp.35-39、2.1.4.メンデレーエフとマイヤー
- ^ a b アシモフ (1967)、第8章 周期表、pp.170-175、空所を埋める
- ^ 竹内 (1996)、pp.97
- ^ a b アシモフ (1967)、第8章 周期表、pp.175-182、新しい元素の群
- ^ 斉藤 (1982)、2章 元素の種類と周期律、pp.40-41、2.1.5.周期表の完成
- ^ 斉藤 (1982)、2章 元素の種類と周期律、pp.47-51、2.2.3.アルゴンと希ガス
- ^ “Dynamic periodic table” (英語). ptable.com. 2011年1月4日閲覧。
- ^ ニュートン別冊 (2010)、pp.64-65、元素の基準はなぜ水素から炭素になったのか
- ^ a b ニュートン別冊 (2010)、pp.42-43、水素の位置で新提案!周期表の並び方が変わる?
- ^ a b c ニュートン別冊 (2010)、pp.44-45、さまざまなタイプの周期表が考案されている
- ^ “Problem of the Week” (英語). Chemistry. 2011年1月4日閲覧。
- ^ “Reriodic Law can be understood in terms of the Tetrahedral Sphere Packing” (英語). perfectperiodictable.com. 2011年1月4日閲覧。
脚注2
本脚注は、出典・脚注内で提示されている「出典」を示しています。

![スパイラル周期表(テーオドール・ベンファイ、1960年[34])](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8e/Elementspiral.svg/120px-Elementspiral.svg.png)






![ADOMAH 型、2006年[35]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/42/Adomah_Wiki.JPG/90px-Adomah_Wiki.JPG)