「チラコイド」の版間の差分
Smilesworth (会話 | 投稿記録) m →内腔性タンパク質: リンクの追加 |
|||
| (18人の利用者による、間の24版が非表示) | |||
| 1行目: | 1行目: | ||
[[ファイル:Thylakoid.png|thumb|250px|チラコイド(緑)は、葉緑体の中にある。]] |
|||
#REDIRECT[[葉緑体]] |
|||
'''チラコイド'''(Thylakoid)は、[[葉緑体]]や[[シアノバクテリア]]中で[[膜]]に結合した区画である。[[光合成]]の[[光化学反応]]が起こる場所である。チラコイドという言葉は、「[[嚢]]」を表す[[ギリシャ語]]の {{lang|gr|θύλακος}} (''thylakos'')に由来する。チラコイドは、[[ルーメン (解剖学)|ルーメン]]の周りを取り巻くチラコイド膜から構成される。緑色植物の葉緑体のチラコイドは円盤状で、積み重なって[[グラナ]]と呼ばれる構造をなしている。グラナは[[ストロマ]]とつながり、単一機能を持つ構造を作っている。 |
|||
==チラコイドの構造== |
|||
[[ファイル:Granum.svg|thumb|250px|チラコイドの構造]] |
|||
[[ファイル:chloroplast in leaf of Anemone sp TEM 85000x.png|thumb|250px|right|グラナの[[透過型電子顕微鏡]]写真]] |
|||
チラコイドは膜と結合した構造で、葉緑体のストロマに埋め込まれている。 |
|||
===膜=== |
|||
チラコイド膜は、直接埋め込まれた[[光合成色素]]内で光化学反応が起こる場所である。1nm幅の暗いバンドと明るいバンドが交互に重なった模様として見える<ref> "Photosynthesis" McGraw Hill Encyclopedia of Science and Technology, 10th ed. 2007. Vol. 13 p. 469 </ref>。チラコイドの[[脂質二重層]]は、[[原核生物]]の膜や葉緑体内膜と同じ性質を持っている。例えば、チラコイド膜やシアノバクテリア、その他の[[光合成細菌]]の膜では[[酸性脂質]]が見られ、光合成の機能的統合に関わっている<ref name="Sato">{{cite journal |author=Sato N |title=Roles of the acidic lipids sulfoquinovosyl diacylglycerol and phosphatidylglycerol in photosynthesis: their specificity and evolution |journal=J Plant Res |volume=117 |pages=495–505 |year=2004 |pmid=15538651 |doi=10.1007/s10265-004-0183-1 |issue=6}}</ref>。[[高等植物]]のチラコイド膜は、主に[[リン脂質]]と<ref>"photosynthesis."Encyclopædia Britannica. 2008. Encyclopædia Britannica 2006 Ultimate Reference Suite DVD 9 Apr. 2008 </ref>[[ガラクト脂質]]が非対称に配列して構成されている<ref name="Spraque">{{cite journal |author=Spraque SG |title=Structural and functional organization of galactolipids on thylakoid membrane organization |journal=J Bioenerg Biomembr |volume=19 |pages=691–703 |year=1987 |pmid=3320041 |doi=10.1007/BF00762303 |issue=6}}</ref>。チラコイド膜の[[脂質]]は、[[小胞体]]と[[色素体]]包膜の内膜の脂質前駆体を交換する複雑な経路で合成され、内膜から[[小嚢]]を通ってチラコイドに輸送される<ref name="Benning">{{cite journal |title=Non-vesicular and vesicular lipid trafficking involving plastids |journal=Curr Opin Plant Biol |volume=9 |pages=241–7 |year=2006 |pmid=16603410 |doi=10.1016/j.pbi.2006.03.012 |author=Benning C, Xu C, Awai K |issue=3}}</ref>。 |
|||
===ルーメン=== |
|||
チラコイドルーメンは、チラコイド膜に結合した区画である。光合成過程での[[光リン酸化]]に不可欠な役割を果たす。光化学反応の際には、チラコイド膜を通過してルーメン内に[[水素イオン|プロトン]]が輸送され、pH4まで酸性化される。 |
|||
===グラナ=== |
|||
グラナは、チラコイドの円盤が重なった構造である。葉緑体は1つ当たり10個から100個のグラナを持つ。グラナは、[[ラメラ]]と呼ばれる細長く伸びたチラコイドによって結ばれている。グラナを構成するチラコイドとストロマ内のチラコイドは、[[タンパク質]]組成によって区別できる。グラナは、葉緑体が体積に対して大きい表面積を持つのに貢献している。またチラコイドの[[電子断層撮影]]の解釈によって、グラナの構造について2つのモデルが作られている。どちらも、ラメラはグラナの円盤の重なりと平行に交差すると仮定しているが、グラナの重なりの軸と垂直に交差しているか、それとも右巻きのらせんを描いているかについて、論争がある<ref name="Mustardy">{{cite journal |title=The three-dimensional network of the thylakoid membranes in plants: quasihelical model of the granum-stroma assembly | journal=Plant Cell |volume=20 |pages=2552–2557 |year=2008 |author=Garab, Mustardy, L., Buttle, K., Steinbach, G., G. |doi=10.1105/tpc.108.059147 |pmid=18952780 |last3=Steinbach |first3=G |last4=Garab |first4=G |issue=10 |pmc=2590735}} </ref>。 |
|||
==チラコイドの形成== |
|||
葉緑体は、植物が地面から[[発芽]]する際に色素体から発展してできる。チラコイドの形成には[[光]]が必要である。[[胚]]の段階で光が当たらないと、色素体は、プロラメラ体と呼ばれる半結晶の膜構造を持つ[[エチオプラスト]]になる。光に曝露されると、プロラメラ体はチラコイドになる。光の量が不十分だとチラコイドの形成に失敗し、葉緑体ができずに植物は死んでしまう。 |
|||
チラコイドの形成には、vesicle-inducing protein in plastids 1 (VIPP1)と呼ばれるタンパク質の働きが必要である。このタンパク質を欠くと植物は生きることができず、VIPP1の発現量を減らすと光合成の能力が落ち、成長は遅く、色は薄くなる。VIPP1はチラコイド膜の形成に必要だと考えられているが、チラコイド膜上のタンパク質複合体には含まれていない<ref>{{cite journal |title=Vipp1 is required for basic thylakoid membrane formation but not for the assembly of thylakoid protein complexes |journal=Plant Physiol Biochem |volume=45 |issue=2 |pages=119–28 |year=2007 |pmid=17346982 |doi=10.1016/j.plaphy.2007.01.005 |author=Aseeva E, Ossenbühl F, Sippel C, Cho WK, Stein B, Eichacker LA, Meurer J, Wanner G, Westhoff P, Soll J, Vothknecht UC.}}</ref>。このタンパク質は、シアノバクテリア<ref>{{cite journal |title=Vipp1 deletion mutant of Synechocystis: a connection between bacterial phage shock and thylakoid biogenesis? |journal=Proc Natl Acad Sci USA |volume=98 |issue=7 |pages=4243–8 |year=2001 |pmid=11274448 |doi=10.1073/pnas.061501198 |author=Westphal S, Heins L, Soll J, Vothknecht U}}</ref>、[[クラミドモナス]]のような[[緑藻]]<ref>{{cite journal |title=The chloroplast HSP70B-CDJ2-CGE1 chaperones catalyse assembly and disassembly of VIPP1 oligomers in Chlamydomonas |journal=Plant J |volume=Epub ahead of print |issue= 2|pages= 265–77|year=2007 |pmid=17355436 |author=Liu C, Willmund, FGolecki J, Cacace S, Markert C, Heß B, Schroda M |last=Schroda |first=M |doi=10.1111/j.1365-313X.2007.03047.x}}</ref>、[[シロイヌナズナ]]のような高等植物<ref>{{cite journal |title=VIPP1, a nuclear gene of Arabidopsis thaliana essential for thylakoid membrane formation |journal=Proc Natl Acad Sci USA |volume=98 |issue=7 |pages=4238–42 |year=2001 |pmid=11274447 |doi=10.1073/pnas.061500998 |author=Kroll D, =Meierhoff K, Bechtold N, Kinoshita M, Westphal S, Vothknecht U, Soll J, Westhoff P }}</ref>を含むチラコイドを持つ全ての生物で保存されている。 |
|||
==チラコイドの単離と分画== |
|||
チラコイドは、[[重力遠心法]]と[[分画遠心法]]を組み合わせることによって<ref name="Peltier2002">{{cite journal |title=Central functions of the lumenal and peripheral thylakoid proteome of Arabidopsis determined by and a sex tool experimentation and genome-wide prediction |journal=Plant Cell |volume=14 |issue=1 |pages=211–36 |year=2002 |pmid=11826309 |doi=10.1105/tpc.010304 |author=Peltier JB, Emanuelsson O, Kalume DE, Ytterberg J, Friso G, Rudella A, Liberles DA, Söderberg L, Roepstorff P, von Heijne G, van Wijk KJ.}}</ref>、[[植物細胞]]から単離される。機械[[せん断力]]が働くと、ルーメン分画が流出してしまい、チラコイドの単離は上手くいかない。表在性膜や内在性膜は、膜画分の残渣から抽出される。[[炭酸ナトリウム]]による処理により表在性膜タンパク質を分離し、[[界面活性剤]]や[[有機溶媒]]による処理により内在性膜タンパク質を可溶化することができる。 |
|||
==チラコイドタンパク質== |
|||
チラコイドは、内腔タンパク質の他に、多くの表在性及び内在性膜タンパク質を持つ。チラコイド画分の[[プロテオーム解析]]の研究により、チラコイドのタンパク質組成がより詳細に理解された<ref name="Wijk">{{cite journal |author=van Wijk K |title=Plastid proteomics |journal=Plant Physiol Biochem |volume=42 |issue=12 |pages=963–77 |year=2004 |pmid=15707834 |doi=10.1016/j.plaphy.2004.10.015}}</ref>。これらのデータは、いくつかのオンラインのタンパク質データベースで入手することができる<ref name="Friso">{{cite journal |title=In-depth analysis of the thylakoid membrane proteome of Arabidopsis thaliana chloroplasts: new proteins, new functions, and a plastid proteome database |journal=Plant Cell |volume=16 |issue=2 |pages=478–99 |year=2004 |pmid=14729914 |doi=10.1105/tpc.017814 |author=Friso G,Giacomelli L,Ytterberg A,Peltier J,Rudella A, Sun Q, Wijk K}}- [http://ppdb.tc.cornell.edu/ The Plastid Proteome Database]</ref><ref name="Kleffmann">{{cite journal |title=plprot: a comprehensive proteome database for different plastid types |journal=Plant Cell Physiol |volume=47 |issue=3 |pages=432–6 |year=2006 |pmid=16418230 |doi=10.1093/pcp/pcj005 |author=Kleffmann T,Hirsch-Hoffmann M, Gruissem W, Baginsky S}} – [http://www.plprot.ethz.ch/ Plastid Protein Database]</ref>。 |
|||
これらの研究によると、チラコイドのタンパク質は少なくとも335種類から構成される。そのうち、89種類は内腔性、116種類は内在性、62種類はストロマ側の表在性、68種類はルーメン側の表在性である。さらに、コンピュータを用いた方法により、存在量の少ない内腔性のタンパク質が予測された<ref name="Peltier2002"/><ref name="Peltier2000"> {{cite journal |title=Proteomics of the chloroplast: systematic identification and targeting analysis of lumenal and peripheral thylakoid proteins |journal=Plant Cell |volume=12 |issue=3 |pages=319–41 |year=2000 |pmid=10715320 |doi=10.1105/tpc.12.3.319 |author=Peltier J, Friso G, Kalume D, Roepstorff P,Nilsson F, Adamska I, van Wijk K}}</ref>。機能別に見ると、42%が光合成に関わるもの、11%が[[フォールディング]]の際のタンパク質標的に関わるもの、9%が[[酸化ストレス]]への応答に関わるもの、8%が[[翻訳 (生物学)|翻訳]]に関わるものであった<ref name="Friso"/>。 |
|||
===内在性タンパク質=== |
|||
チラコイド膜には、光合成の際の光受容や光化学反応において重要な役割を果たす内在性タンパク質が存在する。主要なタンパク質複合体には、次の4つがある。 |
|||
*[[光化学系Iタンパク質複合体]] |
|||
*[[光化学系IIタンパク質複合体]] |
|||
*[[シトクロムb6f複合体]] |
|||
*[[ATP合成酵素]] |
|||
光化学系IIタンパク質複合体は、主にグラナのチラコイドに、光化学系Iタンパク質複合体は主にストロマのチラコイドやグラナの外層に存在する。シトクロムb6f複合体はチラコイド膜に平均的に広がっている。チラコイド膜上で2つの[[光化学系]]の存在する位置が離れているため、[[電子]]の運搬が必要である。このためには、[[プラストキノン]]や[[プラストシアニン]]が稼働型電子運搬体となって電子を運ぶ。プラストキノンは光化学系IIタンパク質複合体からシトクロムb6f複合体まで、プラストシアニンはシトクロムb6f複合体から光化学系Iタンパク質複合体まで電子を運搬する。 |
|||
またこれらのタンパク質は、光エネルギーによって電子伝達系を動かしてチラコイド膜を挟んで[[電気化学的勾配]]を作り出し、[[酸化還元反応]]の最終産物である[[ニコチンアミドアデニンジヌクレオチドリン酸]](NADPH)を作り出す。ATP合成酵素は電気化学的勾配を用いて、光リン酸化により[[アデノシン三リン酸]](ATP)を作り出す。 |
|||
====光化学系==== |
|||
{{main|光化学系}} |
|||
これらの光化学系は、光で稼働する酸化還元中心で、それぞれが葉緑体及び[[カロテノイド]]や[[フィコビリンタンパク質]]等のその他の光合成色素を用いて様々な周波数の光を受容する[[アンテナ複合体]]から構成されている。アンテナ複合体はそれぞれ250個から400個の色素分子を持ち、これらが吸収するエネルギーはそれぞれの光化学系中心が持つ特殊な[[クロロフィル]]aに共鳴輸送される。反応中心の2つのクロロフィルa分子のどちらかが光を吸収すると、電子が励起して電子受容分子に転移する。光化学系Iは、700nmまでの波長の光を吸収するP700と呼ばれる1対のクロロフィルaを持つ。光化学系IIは、680nmの波長の光を最も良く吸収するP680と呼ばれるクロロフィルを持つ(これらの波長は、深紅色である)。Pは色素(pigment)という言葉を縮めたものであり、数字はそれぞれの反応中心のクロロフィル分子が吸収する波長のピークをnm単位で表した値である。 |
|||
====シトクロムb6f複合体==== |
|||
シトクロムb6f複合体は、チラコイドの電子伝達系の一部であり、1対のプロトンがルーメンの中に取り込まれる。エネルギー的には2つの光化学系の間に位置づけられ、光化学系II-プラストキノンから光化学系I-プラストシアニンに電子を転移する。 |
|||
====ATP合成酵素==== |
|||
{{main|ATP合成酵素}} |
|||
チラコイドのATP合成酵素は、[[ミトコンドリア]]の[[ATPアーゼ]]と類似したF<sub>1</sub>F<sub>0</sub>-ATP合成酵素である。ストロマに突き出たチラコイド膜のCF-1部位に埋め込まれている。そのため、ATP合成は光合成の[[暗反応]]がおこるチラコイドのストロマ側で行われる。 |
|||
===内腔性タンパク質=== |
|||
電子伝達タンパク質のプラストシアニンはルーメン内に存在し、シトクロムb6f複合体から光化学系Iに電子を輸送する。プラストキノンは[[脂溶性]]でチラコイド膜内を移動するのに対し、プラストシアニンはチラコイドルーメン内を移動する。 |
|||
ルーメンには、光化学系IIのルーメン側とともに[[水]]を酸化する[[酸素発生複合体]]も存在する。 |
|||
内腔性タンパク質は、ターゲットシグナルに基づき、コンピュータで予測することができる。シロイヌナズナでは、Tatシグナルを処理する最も大きいグループでは、19%がタンパク質プロセシング(タンパク質分解やフォールディング)に、18%が光合成に、11%が[[代謝]]に、7%が酸化還元の運搬や防御に関与するものだった<ref name="Peltier2002"/>。 |
|||
===チラコイドタンパク質の発現=== |
|||
葉緑体は、多数のチラコイドタンパク質をコードする独自の[[ゲノム]]を持つ。しかし、シアノバクテリアからの色素体の進化の過程で、葉緑体ゲノムから[[細胞核]]への広範の遺伝子転移が生じた。これにより、チラコイドの4つの主要なタンパク質複合体が、部分ごとに葉緑体と細胞核の両方でコードされることになった。植物は、[[化学量論]]的に適切な量を発現し、タンパク質複合体を組み立てるため、2つの別々の器官にコードされる異なるサブユニットの発現を共同制御する様々な機構を発展させてきた。例えば、光合成装置の一部をコードする細胞核ゲノムの転写は、光によって制御される。チラコイドタンパク質複合体の合成、維持、分解は、チラコイド膜のRedox感受性[[キナーゼ]]による[[リン酸化]]によって制御される<ref name="Vener">{{cite journal |title=Protein phosphorylation and redox sensing in chloroplast thylakoids |journal=Curr Opin Plant Biol |volume=1 |issue=3 |pages=217–23 |year=1998 |pmid=10066592 |doi=10.1016/S1369-5266(98)80107-6 |author=Vener AV, Ohad I, Andersson B}}</ref>。葉緑体にコードされるタンパク質の[[転写 (生物学)|転写]]速度は、[[エピスタシス]]によって制御される<ref name="Choquet">{{cite journal |title=Assembly-controlled regulation of chloroplast gene translation |journal=Biochem Soc Trans |volume=29 |issue=Pt 4 |pages=421–6 |year=2001 |pmid=11498001 |doi=10.1042/BST0290421 |author=Choquet Y, Wostrikoff K, Rimbault B, Zito F, Girard-Bascou J, Drapier D ,Wollman F}}</ref>。この機構の中には、過剰のタンパク質が葉緑体[[伝令RNA|mRNA]]の5'非転写領域に結合することによるネガティブ[[フィードバック]]も含まれる<ref name="Minai">{{cite journal |title=Chloroplast biogenesis of photosystem II cores involves a series of assembly-controlled steps that regulate translation |journal=Plant Cell |volume=18 |issue=1 |pages=159–75 |year=2006 |pmid=16339851 |doi=10.1105/tpc.105.037705 |author=Minai L ,Wostrikoff K, Wollman F, Choquet Y}}</ref>。葉緑体には、光化学系Iと光化学系IIのバランスも重要である。チラコイド膜の電子を運搬するプラストキノンの酸化還元状態は、光化学系の反応中心のタンパク質をコードする葉緑体遺伝子の転写に直接影響し、電子伝達系のバランスを調節する<ref name="Allen">{{cite journal |title=Balancing the two photosystems: photosynthetic electron transfer governs transcription of reaction centre genes in chloroplasts |journal=Philos Trans R Soc Lond B Biol Sci |volume=355 |issue=1402 |pages=1351–9 |year=2000 |pmid=11127990 |doi=10.1098/rstb.2000.0697 |author=Allen J, Pfannschmidt}}</ref>。 |
|||
==チラコイドの機能== |
|||
[[ファイル:Thylakoid membrane 3.svg|thumb|300px|チラコイド膜における光化学系反応]] |
|||
チラコイドは光合成の光化学反応が行われる場所である。これには、光による水の酸化と酸素の生成、プロトンと電子の勾配形成等が含まれる。 |
|||
===水の光分解=== |
|||
{{main|光分解}} |
|||
光合成の第一段階では、光により水を酸化し、電子伝達系に電子を供給するとともにプロトン勾配を形成する。水の開裂反応はチラコイド膜のルーメン側で行われ、光化学系によって捕獲された光のエネルギーが用いられる。この水の酸化反応によって、[[細胞呼吸]]に不可欠な酸素が廃棄物として生成される。生成された酸素分子は、大気中に放出される。 |
|||
===電子伝達系=== |
|||
{{main|電子伝達系}} |
|||
光合成では、以下の2種類の方法で電子伝達が行われる。 |
|||
*'''非循環的電子伝達'''または'''非循環的光リン酸化反応'''には、両方の光化学系が関与し、NADPH + H+とATPを生成する。 |
|||
*'''循環的電子伝達'''または'''循環的光リン酸化反応'''には、光化学系Iのみが関与し、ATPのみを生成する。 |
|||
*光化学系Iは、光エネルギーを用いてNADP+をNADPH + H+に還元する。非循環的電子伝達にも循環的電子伝達にも関与する。循環的電子伝達では、励起電子が電子伝達系に伝わり、葉緑体に戻る。 |
|||
*光化学系IIは、光エネルギーを用いて水分子を酸化し、電子、プロトン、酸素分子を生成する。循環的電子伝達のみに関与する。この系では電子は保存されず、水分子の酸化により継続的に供給され、NADP+のNADPHへの還元に消費される。 |
|||
===化学浸透=== |
|||
{{main|化学浸透}} |
|||
チラコイド膜と光化学系の主要な役割は、[[化学浸透]]圧を形成することである。電子伝達系での輸送は、電子のエネルギーを用いてストロマからラメラにプロトンを[[能動輸送]]する。光合成の際には、ルーメンはpH4程度の酸性、ストロマはpH8程度の塩基性である。これは、チラコイド膜を挟んでプロトンの濃度が約1万倍も違うことを意味している。 |
|||
====プロトン勾配の原因==== |
|||
ルーメンのプロトンの供給源には、主に以下の3つがある。 |
|||
*ルーメン内での光化学系II複合体による、水の酸素、電子、プロトンへの光分解 |
|||
*非循環的電子伝達の際の光化学系IIからプラストキノンへの電子の輸送により、ストロマのプロトンが2つ消費される。これは、ルーメン内で還元されたプラストキノンがシトクロムb6f複合体によって酸化される際に解放される。 |
|||
*循環的電子伝達の際の[[フェレドキシン]]によるプラストキノンの還元によっても、ストロマからルーメンに2つのプロトンが輸送される。 |
|||
ストロマ内で[[NADPレダクターゼ]]によりNADP+からNADPHを生成する際にもプロトン勾配が発生する。 |
|||
====ATP生成==== |
|||
葉緑体内でのATP生成の分子機構は、ミトコンドリア内での機構と類似しており、プロトン駆動力が用いられる。しかし、葉緑体ではATP合成に必要なポテンシャルエネルギーをプロトン駆動力の[[化学ポテンシャル]]により大きく依存している。プロトン駆動力はプロトン勾配によるプロトンの化学ポテンシャルと膜を挟んだ[[電位]]の総和である。電荷の分離による[[膜電位]]がかなり大きいミトコンドリア内膜と比べ、チラコイド膜では電位勾配はほとんどない。これを埋め合わせるために、ミトコンドリア内膜のプロトン勾配が10倍程度であるのに対して、チラコイド膜のプロトン勾配は1万倍にも達する。結果としてのルーメンとストロマの間の電気化学的勾配は、[[ATPシンターゼ]]を用いたATP合成に十分なものとなっている。プロトンがATPシンターゼのチャネルを通って勾配に沿って元に戻ると、ADP + Piが結合してATPが生成する。このような機構で光化学反応はプロトン勾配を通じ、ATP合成と協調している。 |
|||
==シアノバクテリアのチラコイド膜== |
|||
[[ファイル:Synechocystis.svg|thumb|250px|シアノバクテリア(''Synechocystis'')に含まれるチラコイド(緑)]] |
|||
シアノバクテリアは、高度に分化した膜系を持つ光合成[[原核生物]]である。シアノバクテリアは内部にチラコイド膜を持ち、そこでは光合成と呼吸の電子伝達が行われる。別の膜系の存在もあり、シアノバクテリアは[[細菌]]の中でも独特の細胞となっている。シアノバクテリアは、膜の再構成、新しい膜脂質の合成、正しい膜へのタンパク質のターゲッティングが可能なはずである。細菌外膜、[[原形質膜]]、チラコイド膜は、シアノバクテリア細胞の中でそれぞれが特殊な役割を果たす。膜系の組織、機能、タンパク質構成等を調べることは、シアノバクテリア[[細胞生物学]]の大きな課題として残っている<ref name=Herrero>{{cite book | author = Herrero A and Flores E (editor). | title = The Cyanobacteria: Molecular Biology, Genomics and Evolution | edition = 1st | publisher = Caister Academic Press | year = 2008 | url=http://www.horizonpress.com/cyan | isbn = 1904455158}}</ref>。 |
|||
==関連項目== |
|||
*[[アーサー・メイヤー]] |
|||
*[[化学浸透]] |
|||
*[[電気化学ポテンシャル]] |
|||
*[[細胞内共生]] |
|||
*[[酸素発生]] |
|||
*[[光合成]] |
|||
==出典== |
|||
{{reflist|2}} |
|||
===参照テキスト=== |
|||
*{{cite book | author=Heller, H. Craig; Orians, Gordan H.; Purves, William K.; & Sadava, David | title=LIFE: The Science of Biology | edition=7th | publisher=Sinauer Associates, Inc. | year=2004 | isbn=0-7167-9856-5}} |
|||
*{{cite book | last = Raven | first = Peter H. | coauthors = Ray F. Evert, Susan E. Eichhorn | title = Biology of Plants | edition = 7th | publisher = W.H. Freeman and Company Publishers | date = 2005 | location = New York | pages = 115–127 | isbn = 0-7167-1007-2}} |
|||
*{{cite book | author = Herrero A and Flores E (editors). | title = The Cyanobacteria: Molecular Biology, Genomics and Evolution | edition = 1st | publisher = Caister Academic Press | year = 2008 | url=http://www.horizonpress.com/cyan | isbn = 978-1-904455-15-8 }} |
|||
{{Good article}} |
|||
{{デフォルトソート:ちらこいと}} |
|||
[[Category:光合成]] |
|||
[[Category:細胞小器官]] |
|||
2024年1月4日 (木) 12:35時点における最新版

チラコイド(Thylakoid)は、葉緑体やシアノバクテリア中で膜に結合した区画である。光合成の光化学反応が起こる場所である。チラコイドという言葉は、「嚢」を表すギリシャ語の θύλακος (thylakos)に由来する。チラコイドは、ルーメンの周りを取り巻くチラコイド膜から構成される。緑色植物の葉緑体のチラコイドは円盤状で、積み重なってグラナと呼ばれる構造をなしている。グラナはストロマとつながり、単一機能を持つ構造を作っている。
チラコイドの構造
[編集]

チラコイドは膜と結合した構造で、葉緑体のストロマに埋め込まれている。
膜
[編集]チラコイド膜は、直接埋め込まれた光合成色素内で光化学反応が起こる場所である。1nm幅の暗いバンドと明るいバンドが交互に重なった模様として見える[1]。チラコイドの脂質二重層は、原核生物の膜や葉緑体内膜と同じ性質を持っている。例えば、チラコイド膜やシアノバクテリア、その他の光合成細菌の膜では酸性脂質が見られ、光合成の機能的統合に関わっている[2]。高等植物のチラコイド膜は、主にリン脂質と[3]ガラクト脂質が非対称に配列して構成されている[4]。チラコイド膜の脂質は、小胞体と色素体包膜の内膜の脂質前駆体を交換する複雑な経路で合成され、内膜から小嚢を通ってチラコイドに輸送される[5]。
ルーメン
[編集]チラコイドルーメンは、チラコイド膜に結合した区画である。光合成過程での光リン酸化に不可欠な役割を果たす。光化学反応の際には、チラコイド膜を通過してルーメン内にプロトンが輸送され、pH4まで酸性化される。
グラナ
[編集]グラナは、チラコイドの円盤が重なった構造である。葉緑体は1つ当たり10個から100個のグラナを持つ。グラナは、ラメラと呼ばれる細長く伸びたチラコイドによって結ばれている。グラナを構成するチラコイドとストロマ内のチラコイドは、タンパク質組成によって区別できる。グラナは、葉緑体が体積に対して大きい表面積を持つのに貢献している。またチラコイドの電子断層撮影の解釈によって、グラナの構造について2つのモデルが作られている。どちらも、ラメラはグラナの円盤の重なりと平行に交差すると仮定しているが、グラナの重なりの軸と垂直に交差しているか、それとも右巻きのらせんを描いているかについて、論争がある[6]。
チラコイドの形成
[編集]葉緑体は、植物が地面から発芽する際に色素体から発展してできる。チラコイドの形成には光が必要である。胚の段階で光が当たらないと、色素体は、プロラメラ体と呼ばれる半結晶の膜構造を持つエチオプラストになる。光に曝露されると、プロラメラ体はチラコイドになる。光の量が不十分だとチラコイドの形成に失敗し、葉緑体ができずに植物は死んでしまう。
チラコイドの形成には、vesicle-inducing protein in plastids 1 (VIPP1)と呼ばれるタンパク質の働きが必要である。このタンパク質を欠くと植物は生きることができず、VIPP1の発現量を減らすと光合成の能力が落ち、成長は遅く、色は薄くなる。VIPP1はチラコイド膜の形成に必要だと考えられているが、チラコイド膜上のタンパク質複合体には含まれていない[7]。このタンパク質は、シアノバクテリア[8]、クラミドモナスのような緑藻[9]、シロイヌナズナのような高等植物[10]を含むチラコイドを持つ全ての生物で保存されている。
チラコイドの単離と分画
[編集]チラコイドは、重力遠心法と分画遠心法を組み合わせることによって[11]、植物細胞から単離される。機械せん断力が働くと、ルーメン分画が流出してしまい、チラコイドの単離は上手くいかない。表在性膜や内在性膜は、膜画分の残渣から抽出される。炭酸ナトリウムによる処理により表在性膜タンパク質を分離し、界面活性剤や有機溶媒による処理により内在性膜タンパク質を可溶化することができる。
チラコイドタンパク質
[編集]チラコイドは、内腔タンパク質の他に、多くの表在性及び内在性膜タンパク質を持つ。チラコイド画分のプロテオーム解析の研究により、チラコイドのタンパク質組成がより詳細に理解された[12]。これらのデータは、いくつかのオンラインのタンパク質データベースで入手することができる[13][14]。
これらの研究によると、チラコイドのタンパク質は少なくとも335種類から構成される。そのうち、89種類は内腔性、116種類は内在性、62種類はストロマ側の表在性、68種類はルーメン側の表在性である。さらに、コンピュータを用いた方法により、存在量の少ない内腔性のタンパク質が予測された[11][15]。機能別に見ると、42%が光合成に関わるもの、11%がフォールディングの際のタンパク質標的に関わるもの、9%が酸化ストレスへの応答に関わるもの、8%が翻訳に関わるものであった[13]。
内在性タンパク質
[編集]チラコイド膜には、光合成の際の光受容や光化学反応において重要な役割を果たす内在性タンパク質が存在する。主要なタンパク質複合体には、次の4つがある。
光化学系IIタンパク質複合体は、主にグラナのチラコイドに、光化学系Iタンパク質複合体は主にストロマのチラコイドやグラナの外層に存在する。シトクロムb6f複合体はチラコイド膜に平均的に広がっている。チラコイド膜上で2つの光化学系の存在する位置が離れているため、電子の運搬が必要である。このためには、プラストキノンやプラストシアニンが稼働型電子運搬体となって電子を運ぶ。プラストキノンは光化学系IIタンパク質複合体からシトクロムb6f複合体まで、プラストシアニンはシトクロムb6f複合体から光化学系Iタンパク質複合体まで電子を運搬する。
またこれらのタンパク質は、光エネルギーによって電子伝達系を動かしてチラコイド膜を挟んで電気化学的勾配を作り出し、酸化還元反応の最終産物であるニコチンアミドアデニンジヌクレオチドリン酸(NADPH)を作り出す。ATP合成酵素は電気化学的勾配を用いて、光リン酸化によりアデノシン三リン酸(ATP)を作り出す。
光化学系
[編集]これらの光化学系は、光で稼働する酸化還元中心で、それぞれが葉緑体及びカロテノイドやフィコビリンタンパク質等のその他の光合成色素を用いて様々な周波数の光を受容するアンテナ複合体から構成されている。アンテナ複合体はそれぞれ250個から400個の色素分子を持ち、これらが吸収するエネルギーはそれぞれの光化学系中心が持つ特殊なクロロフィルaに共鳴輸送される。反応中心の2つのクロロフィルa分子のどちらかが光を吸収すると、電子が励起して電子受容分子に転移する。光化学系Iは、700nmまでの波長の光を吸収するP700と呼ばれる1対のクロロフィルaを持つ。光化学系IIは、680nmの波長の光を最も良く吸収するP680と呼ばれるクロロフィルを持つ(これらの波長は、深紅色である)。Pは色素(pigment)という言葉を縮めたものであり、数字はそれぞれの反応中心のクロロフィル分子が吸収する波長のピークをnm単位で表した値である。
シトクロムb6f複合体
[編集]シトクロムb6f複合体は、チラコイドの電子伝達系の一部であり、1対のプロトンがルーメンの中に取り込まれる。エネルギー的には2つの光化学系の間に位置づけられ、光化学系II-プラストキノンから光化学系I-プラストシアニンに電子を転移する。
ATP合成酵素
[編集]チラコイドのATP合成酵素は、ミトコンドリアのATPアーゼと類似したF1F0-ATP合成酵素である。ストロマに突き出たチラコイド膜のCF-1部位に埋め込まれている。そのため、ATP合成は光合成の暗反応がおこるチラコイドのストロマ側で行われる。
内腔性タンパク質
[編集]電子伝達タンパク質のプラストシアニンはルーメン内に存在し、シトクロムb6f複合体から光化学系Iに電子を輸送する。プラストキノンは脂溶性でチラコイド膜内を移動するのに対し、プラストシアニンはチラコイドルーメン内を移動する。
ルーメンには、光化学系IIのルーメン側とともに水を酸化する酸素発生複合体も存在する。
内腔性タンパク質は、ターゲットシグナルに基づき、コンピュータで予測することができる。シロイヌナズナでは、Tatシグナルを処理する最も大きいグループでは、19%がタンパク質プロセシング(タンパク質分解やフォールディング)に、18%が光合成に、11%が代謝に、7%が酸化還元の運搬や防御に関与するものだった[11]。
チラコイドタンパク質の発現
[編集]葉緑体は、多数のチラコイドタンパク質をコードする独自のゲノムを持つ。しかし、シアノバクテリアからの色素体の進化の過程で、葉緑体ゲノムから細胞核への広範の遺伝子転移が生じた。これにより、チラコイドの4つの主要なタンパク質複合体が、部分ごとに葉緑体と細胞核の両方でコードされることになった。植物は、化学量論的に適切な量を発現し、タンパク質複合体を組み立てるため、2つの別々の器官にコードされる異なるサブユニットの発現を共同制御する様々な機構を発展させてきた。例えば、光合成装置の一部をコードする細胞核ゲノムの転写は、光によって制御される。チラコイドタンパク質複合体の合成、維持、分解は、チラコイド膜のRedox感受性キナーゼによるリン酸化によって制御される[16]。葉緑体にコードされるタンパク質の転写速度は、エピスタシスによって制御される[17]。この機構の中には、過剰のタンパク質が葉緑体mRNAの5'非転写領域に結合することによるネガティブフィードバックも含まれる[18]。葉緑体には、光化学系Iと光化学系IIのバランスも重要である。チラコイド膜の電子を運搬するプラストキノンの酸化還元状態は、光化学系の反応中心のタンパク質をコードする葉緑体遺伝子の転写に直接影響し、電子伝達系のバランスを調節する[19]。
チラコイドの機能
[編集]
チラコイドは光合成の光化学反応が行われる場所である。これには、光による水の酸化と酸素の生成、プロトンと電子の勾配形成等が含まれる。
水の光分解
[編集]光合成の第一段階では、光により水を酸化し、電子伝達系に電子を供給するとともにプロトン勾配を形成する。水の開裂反応はチラコイド膜のルーメン側で行われ、光化学系によって捕獲された光のエネルギーが用いられる。この水の酸化反応によって、細胞呼吸に不可欠な酸素が廃棄物として生成される。生成された酸素分子は、大気中に放出される。
電子伝達系
[編集]光合成では、以下の2種類の方法で電子伝達が行われる。
- 非循環的電子伝達または非循環的光リン酸化反応には、両方の光化学系が関与し、NADPH + H+とATPを生成する。
- 循環的電子伝達または循環的光リン酸化反応には、光化学系Iのみが関与し、ATPのみを生成する。
- 光化学系Iは、光エネルギーを用いてNADP+をNADPH + H+に還元する。非循環的電子伝達にも循環的電子伝達にも関与する。循環的電子伝達では、励起電子が電子伝達系に伝わり、葉緑体に戻る。
- 光化学系IIは、光エネルギーを用いて水分子を酸化し、電子、プロトン、酸素分子を生成する。循環的電子伝達のみに関与する。この系では電子は保存されず、水分子の酸化により継続的に供給され、NADP+のNADPHへの還元に消費される。
化学浸透
[編集]チラコイド膜と光化学系の主要な役割は、化学浸透圧を形成することである。電子伝達系での輸送は、電子のエネルギーを用いてストロマからラメラにプロトンを能動輸送する。光合成の際には、ルーメンはpH4程度の酸性、ストロマはpH8程度の塩基性である。これは、チラコイド膜を挟んでプロトンの濃度が約1万倍も違うことを意味している。
プロトン勾配の原因
[編集]ルーメンのプロトンの供給源には、主に以下の3つがある。
- ルーメン内での光化学系II複合体による、水の酸素、電子、プロトンへの光分解
- 非循環的電子伝達の際の光化学系IIからプラストキノンへの電子の輸送により、ストロマのプロトンが2つ消費される。これは、ルーメン内で還元されたプラストキノンがシトクロムb6f複合体によって酸化される際に解放される。
- 循環的電子伝達の際のフェレドキシンによるプラストキノンの還元によっても、ストロマからルーメンに2つのプロトンが輸送される。
ストロマ内でNADPレダクターゼによりNADP+からNADPHを生成する際にもプロトン勾配が発生する。
ATP生成
[編集]葉緑体内でのATP生成の分子機構は、ミトコンドリア内での機構と類似しており、プロトン駆動力が用いられる。しかし、葉緑体ではATP合成に必要なポテンシャルエネルギーをプロトン駆動力の化学ポテンシャルにより大きく依存している。プロトン駆動力はプロトン勾配によるプロトンの化学ポテンシャルと膜を挟んだ電位の総和である。電荷の分離による膜電位がかなり大きいミトコンドリア内膜と比べ、チラコイド膜では電位勾配はほとんどない。これを埋め合わせるために、ミトコンドリア内膜のプロトン勾配が10倍程度であるのに対して、チラコイド膜のプロトン勾配は1万倍にも達する。結果としてのルーメンとストロマの間の電気化学的勾配は、ATPシンターゼを用いたATP合成に十分なものとなっている。プロトンがATPシンターゼのチャネルを通って勾配に沿って元に戻ると、ADP + Piが結合してATPが生成する。このような機構で光化学反応はプロトン勾配を通じ、ATP合成と協調している。
シアノバクテリアのチラコイド膜
[編集]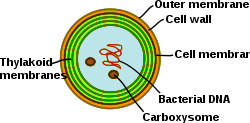
シアノバクテリアは、高度に分化した膜系を持つ光合成原核生物である。シアノバクテリアは内部にチラコイド膜を持ち、そこでは光合成と呼吸の電子伝達が行われる。別の膜系の存在もあり、シアノバクテリアは細菌の中でも独特の細胞となっている。シアノバクテリアは、膜の再構成、新しい膜脂質の合成、正しい膜へのタンパク質のターゲッティングが可能なはずである。細菌外膜、原形質膜、チラコイド膜は、シアノバクテリア細胞の中でそれぞれが特殊な役割を果たす。膜系の組織、機能、タンパク質構成等を調べることは、シアノバクテリア細胞生物学の大きな課題として残っている[20]。
関連項目
[編集]出典
[編集]- ^ "Photosynthesis" McGraw Hill Encyclopedia of Science and Technology, 10th ed. 2007. Vol. 13 p. 469
- ^ Sato N (2004). “Roles of the acidic lipids sulfoquinovosyl diacylglycerol and phosphatidylglycerol in photosynthesis: their specificity and evolution”. J Plant Res 117 (6): 495–505. doi:10.1007/s10265-004-0183-1. PMID 15538651.
- ^ "photosynthesis."Encyclopædia Britannica. 2008. Encyclopædia Britannica 2006 Ultimate Reference Suite DVD 9 Apr. 2008
- ^ Spraque SG (1987). “Structural and functional organization of galactolipids on thylakoid membrane organization”. J Bioenerg Biomembr 19 (6): 691–703. doi:10.1007/BF00762303. PMID 3320041.
- ^ Benning C, Xu C, Awai K (2006). “Non-vesicular and vesicular lipid trafficking involving plastids”. Curr Opin Plant Biol 9 (3): 241–7. doi:10.1016/j.pbi.2006.03.012. PMID 16603410.
- ^ Garab, Mustardy, L., Buttle, K., Steinbach, G., G. (2008). “The three-dimensional network of the thylakoid membranes in plants: quasihelical model of the granum-stroma assembly”. Plant Cell 20 (10): 2552–2557. doi:10.1105/tpc.108.059147. PMC 2590735. PMID 18952780.
- ^ Aseeva E, Ossenbühl F, Sippel C, Cho WK, Stein B, Eichacker LA, Meurer J, Wanner G, Westhoff P, Soll J, Vothknecht UC. (2007). “Vipp1 is required for basic thylakoid membrane formation but not for the assembly of thylakoid protein complexes”. Plant Physiol Biochem 45 (2): 119–28. doi:10.1016/j.plaphy.2007.01.005. PMID 17346982.
- ^ Westphal S, Heins L, Soll J, Vothknecht U (2001). “Vipp1 deletion mutant of Synechocystis: a connection between bacterial phage shock and thylakoid biogenesis?”. Proc Natl Acad Sci USA 98 (7): 4243–8. doi:10.1073/pnas.061501198. PMID 11274448.
- ^ Schroda, M (2007). “The chloroplast HSP70B-CDJ2-CGE1 chaperones catalyse assembly and disassembly of VIPP1 oligomers in Chlamydomonas”. Plant J Epub ahead of print (2): 265–77. doi:10.1111/j.1365-313X.2007.03047.x. PMID 17355436.
- ^ Kroll D, =Meierhoff K, Bechtold N, Kinoshita M, Westphal S, Vothknecht U, Soll J, Westhoff P (2001). “VIPP1, a nuclear gene of Arabidopsis thaliana essential for thylakoid membrane formation”. Proc Natl Acad Sci USA 98 (7): 4238–42. doi:10.1073/pnas.061500998. PMID 11274447.
- ^ a b c Peltier JB, Emanuelsson O, Kalume DE, Ytterberg J, Friso G, Rudella A, Liberles DA, Söderberg L, Roepstorff P, von Heijne G, van Wijk KJ. (2002). “Central functions of the lumenal and peripheral thylakoid proteome of Arabidopsis determined by and a sex tool experimentation and genome-wide prediction”. Plant Cell 14 (1): 211–36. doi:10.1105/tpc.010304. PMID 11826309.
- ^ van Wijk K (2004). “Plastid proteomics”. Plant Physiol Biochem 42 (12): 963–77. doi:10.1016/j.plaphy.2004.10.015. PMID 15707834.
- ^ a b Friso G,Giacomelli L,Ytterberg A,Peltier J,Rudella A, Sun Q, Wijk K (2004). “In-depth analysis of the thylakoid membrane proteome of Arabidopsis thaliana chloroplasts: new proteins, new functions, and a plastid proteome database”. Plant Cell 16 (2): 478–99. doi:10.1105/tpc.017814. PMID 14729914.- The Plastid Proteome Database
- ^ Kleffmann T,Hirsch-Hoffmann M, Gruissem W, Baginsky S (2006). “plprot: a comprehensive proteome database for different plastid types”. Plant Cell Physiol 47 (3): 432–6. doi:10.1093/pcp/pcj005. PMID 16418230. – Plastid Protein Database
- ^ Peltier J, Friso G, Kalume D, Roepstorff P,Nilsson F, Adamska I, van Wijk K (2000). “Proteomics of the chloroplast: systematic identification and targeting analysis of lumenal and peripheral thylakoid proteins”. Plant Cell 12 (3): 319–41. doi:10.1105/tpc.12.3.319. PMID 10715320.
- ^ Vener AV, Ohad I, Andersson B (1998). “Protein phosphorylation and redox sensing in chloroplast thylakoids”. Curr Opin Plant Biol 1 (3): 217–23. doi:10.1016/S1369-5266(98)80107-6. PMID 10066592.
- ^ Choquet Y, Wostrikoff K, Rimbault B, Zito F, Girard-Bascou J, Drapier D ,Wollman F (2001). “Assembly-controlled regulation of chloroplast gene translation”. Biochem Soc Trans 29 (Pt 4): 421–6. doi:10.1042/BST0290421. PMID 11498001.
- ^ Minai L ,Wostrikoff K, Wollman F, Choquet Y (2006). “Chloroplast biogenesis of photosystem II cores involves a series of assembly-controlled steps that regulate translation”. Plant Cell 18 (1): 159–75. doi:10.1105/tpc.105.037705. PMID 16339851.
- ^ Allen J, Pfannschmidt (2000). “Balancing the two photosystems: photosynthetic electron transfer governs transcription of reaction centre genes in chloroplasts”. Philos Trans R Soc Lond B Biol Sci 355 (1402): 1351–9. doi:10.1098/rstb.2000.0697. PMID 11127990.
- ^ Herrero A and Flores E (editor). (2008). The Cyanobacteria: Molecular Biology, Genomics and Evolution (1st ed.). Caister Academic Press. ISBN 1904455158
参照テキスト
[編集]- Heller, H. Craig; Orians, Gordan H.; Purves, William K.; & Sadava, David (2004). LIFE: The Science of Biology (7th ed.). Sinauer Associates, Inc.. ISBN 0-7167-9856-5
- Raven, Peter H.; Ray F. Evert, Susan E. Eichhorn (2005). Biology of Plants (7th ed.). New York: W.H. Freeman and Company Publishers. pp. 115–127. ISBN 0-7167-1007-2
- Herrero A and Flores E (editors). (2008). The Cyanobacteria: Molecular Biology, Genomics and Evolution (1st ed.). Caister Academic Press. ISBN 978-1-904455-15-8
