シクロドデカヘキサエン
| シクロドデカヘキサエン | |
|---|---|
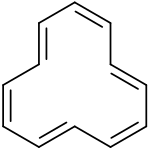 Tri-trans isomer of cyclododecahexaene
| |
1,3,5,7,9,11-Cyclododecahexaene | |
別称 [12]annulene | |
| 識別情報 | |
| CAS登録番号 | 3227-77-8 |
| PubChem | 53438306 |
| |
| |
| 特性 | |
| 化学式 | C12H12 |
| モル質量 | 156.22 g mol−1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
シクロドデカヘキサエン(Cyclododecahexaene)または[12]アヌレン([12]annulene)は、化学式C12H12のアヌレンの1つであり、その芳香族性に関して興味が持たれている[1]。
シクロドデカヘキサエンは平面ではないため、反芳香族性であるが、一方、14電子のジアニオンは、ヒュッケル則により芳香族性を持ち、より安定である。
in silico実験では、tri-trans異性体が最も安定であり、次に1,7-ditrans異性体とall cis異性体(+1 kcal/mol)、1,5-ditrans異性体(+5 kcal/mol)と続く。
sym-tri-trans配置を持つ最初のアヌレンは、1970年に三環式前駆体から低温での光分解により合成された。化合物を加熱すると、二環式の[6,4,0]異性体に再配置する。化合物を低温で還元すると、ジアニオンをプロトン核磁気共鳴で分析することが可能となり、内部のプロトンがテトラメチルシランに対して- 4.5 ppmで共鳴し、反磁性環電流の証拠となる[2]。
研究では、1,7-ditrans異性体は、低温のテトラヒドロフラン中、ヘキサブロモシクロドデカンとカリウム tert-ブトキシドの脱ハロゲン化水素で生成した。この化合物の金属セシウムによる低温還元では、最初にラジカルアニオンを生じ、後にジアニオンになる。この化合物の内部プロトンの化学シフトは、+0.2 ppmで、tri-trans異性体よりもずっと小さい。
ラジカルイオン溶液を室温まで加熱すると、脱水素し、ヘプタレンのラジカルアニオンを形成する。
出典
[編集]- ^ Kiesewetter, Matthew K.; Gard, Matthew N.; Reiter, Richard C.; Stevenson, Cheryl D. (2006). “Reactions Involving Di-trans-[12]Annulenes”. Journal of the American Chemical Society 128 (49): 15618?15624. doi:10.1021/ja062846u. PMID 17147369.
- ^ Oth, J. F. M.; Schroder, G. (1971). “Annulenes. Part XII. The dianion of [12annulene”] (英語). J. Chem. Soc. B 0: 904?907. doi:10.1039/j29710000904. ISSN 0045-6470.

![[12]annulene synthesis](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4a/12-annulene.svg/500px-12-annulene.svg.png)
![[12]annulene synthesis](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/12annulene2006.png/400px-12annulene2006.png)